Respiratorni distres sindrom u novorođenčadi. Glavni klinički sindromi u bolestima respiratornog sistema
Zavod za propedeutiku unutrašnjih bolesti
Metodološki razvoj
Za samostalan rad studenata treće godine
Tema: „Osnovno klinički sindromi za respiratorne bolesti"
Stavropol
Glavni klinički sindromi u bolestima
respiratornih organa
Sindrom – ovo je skup simptoma ujedinjenih jednim razvojnim mehanizmom (patogenezom)
Razlikuju se sljedeći plućni sindromi:
1. Sindrom normalnog plućnog tkiva
2. Sindrom fokalnog zbijanja plućnog tkiva
3. Sindrom lobarnog zbijanja plućnog tkiva
4. Sindrom šupljine u plućnom tkivu
5. Sindrom opstruktivne atelektaze
6. Sindrom kompresijske atelektaze
7. Sindrom nakupljanja tečnosti pleuralna šupljina
8. Sindrom akumulacije vazduha u pleuralnoj šupljini
9. Višak vazduha u plućima sindrom
10. Sindrom suženja bronha sa viskoznim eksudatom
11. Sindrom bronhoopstrukcije
12. Sindrom fibrotoraksa ili privez
13. Sindrom respiratorna insuficijencija
Skup simptoma za određeni plućni sindrom otkriva se kada se koriste glavni (opći pregled, pregled prsa, palpacija, perkusija, auskultacija) i dodatne (rendgenski snimak grudnog koša, analiza krvi i sputuma) metode istraživanja.
Sindrom normalnog plućnog tkiva
^
Pritužbe: ne
Pregled grudnog koša: grudni koš je pravilnog oblika, obe polovine grudnog koša su simetrične i podjednako učestvuju u činu disanja. Broj respiratornih pokreta je 16-18 u minuti. Disanje je ritmično, tip disanja je mješovit.
Palpacija
Percussion: Jasan plućni zvuk se detektuje na cijeloj površini plućnog tkiva.
Auskultacija: vezikularno disanje se čuje cijelom površinom plućnog tkiva, nema štetnih respiratornih zvukova.
rendgenski snimak: plućno tkivo je providno.
Pregled krvi i sputuma: Bez promjene.
^
Sindrom žarišnog zbijanja plućnog tkiva

Ovaj sindrom karakterizira stvaranje malih žarišta zbijanja okruženih normalnim plućnim tkivom.
^ Javlja se kada:
A) fokalna pneumonija (bronhopneumonija), alveole su ispunjene inflamatornom tečnošću i fibrinom.
B) infarkt pluća (alveole se pune krvlju)
B) pneumoskleroza, karnifikacija (razrast plućnog tkiva sa vezivnim ili tumorskim tkivom)
patomorfologija: Tkivo pluća je zbijeno, ali sadrži malo zraka.
^ Pritužbe: kratak dah, kašalj.
Opšti pregled : Bez promjene.
Pregled grudnog koša: nešto zaostajanja “bolesne” polovine grudnog koša pri disanju.
Palpacija: grudni koš bezbolan, elastičan. Vokalni tremor je pojačan velikim pneumonijskim žarištem koji se nalazi površno.
Percussion
Auskultacija: bronhovezikularno disanje, vlažno fino - i
Srednje pjenušavo zvučno piskanje, lokalizirano u određenom području. Bronhofonija je pojačana.
rendgenski snimak: žarišta upalne infiltracije pluća
Tkiva se izmjenjuju s područjima normalnog plućnog tkiva; plućni uzorak u "zahvaćenom segmentu" može biti poboljšan.
^ Test krvi : umjerena leukocitoza, ubrzana ESR.
Ispitivanje sputuma: sluzni sputum, može biti prošaran krvlju, ne sadrži veliki broj leukociti, eritrociti.
^
Sindrom lobarnog zbijanja plućnog tkiva
P  Kod ovog sindroma, za razliku od sindroma fokalnog zbijanja plućnog tkiva, u proces je uključen cijeli režanj pluća.
Kod ovog sindroma, za razliku od sindroma fokalnog zbijanja plućnog tkiva, u proces je uključen cijeli režanj pluća.
^
Javlja se kada:
A) lobarna pneumonija(pleuropneumonija), alveole su ispunjene inflamatornom tečnošću i fibrinom.
b) pneumoskleroza, karnifikacija (izrastanje plućnog režnja vezivnim i tumorskim tkivom).
Fizikalni nalazi kod lobarne pneumonije:
Patomorfologija: plućno tkivo je zbijeno, ali sadrži određenu količinu vazduha (stadijum I-III), plućno tkivo je gusto i bez vazduha (faza II).
^ Pritužbe: bol u grudima, otežano disanje, kašalj.
Opšti pregled: akrocijanoza nasolabijalnog trougla, herpetički osip na usnama, nosu.
Pregled grudnog koša: zaostajanje “bolesne” polovine grudnog koša pri disanju.
Palpacija: bol u zahvaćenoj polovini grudnog koša, vokalni tremor je blago pojačan (I-III stadijum), značajno pojačan (II stadijum).
Percussion: prigušenost udaraljki sa bubnjićima u stadijumima I-III, tupost u stadijumu II (gusta pluća bez vazduha).
Auskultacija: oslabljeno vezikularno disanje sa bronhijalnom nijansom u stadijumima I-III, bronhijalno u stadijumu II. Inicijalna krepitacija (crepitatio indux) u stadijumu I, krepitacija rezolucije (crepitatio redux) u stadijumu III.
Bronhofonija je blago ili značajno pojačana. Može doći do trljanja pleure.
rendgenski snimak: homogeno tamnjenje plućnog tkiva, prekrivajući segment ili režanj pluća.
^ Test krvi : leukocitoza, ubrzana ESR.
Ispitivanje sputuma: mukopurulentni ispljuvak, pomešan sa krvlju („zarđao“), sadrži mnogo leukocita, eritrocita
^
Sindrom plućne šupljine
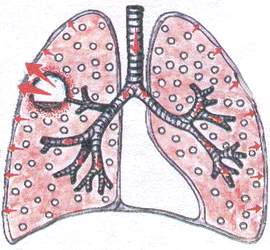
Da bi se karijes dijagnosticirao metodom fizičkog pregleda, mora ispunjavati sljedeće uslove:
Prečnik šupljine mora biti najmanje 4 cm.
šupljina mora biti povezana sa bronhom.
šupljina mora biti "prazna".
šupljina je “stara”, sa gustim ivicama.
šupljina mora biti locirana površno.
Ovaj sindrom se javlja kada:
a) apsces pluća
b) bronhiektazije
D) sa kolapsom plućnog tkiva
Pritužbe: kašalj sa gnojnim sputumom u velikim količinama, češće usta puna, septička temperatura sa jakim noćnim znojenjem (karakteristično za apsces pluća, bronhiektazije), kašalj sa krvavim sputumom ili prošaran krvlju (kod kavernozne tuberkuloze, kolapsa plućnog tkiva).
^ Opći pregled: akrocijanoza, difuzna cijanoza, promjene na terminalnim falangama (“ Štapići za bubnjeve", "naočare za sat").
Pregled grudnog koša: zaostajanje “bolesne” polovine grudnog koša pri disanju, tahipnena.
Palpacija: ponekad su grudi bolne, drhtanje glasa pojačano.
Percussion: tup timpanijski zvuk, sa velikom šupljinom koja se nalazi na periferiji - timpanijski zvuk sa metalnom nijansom.
auskultacija: bronhijalno ili amforično disanje, vlažno zvučno zviždanje srednjeg i velikog mjehura. Bronhofonija je pojačana.
rendgenski snimak: Na pozadini zamračenja, uočava se čišćenje plućnog tkiva s horizontalnim nivoom tekućine.
^ Test krvi : hiperleukocitoza, značajno ubrzana ESR, moguća anemija.
Ispitivanje sputuma: sputum je gnojan, može biti pomiješan s krvlju, sadrži veliki broj leukocita, može sadržavati crvena krvna zrnca, elastična vlakna.
^
Sindrom opstruktivne atelektaze
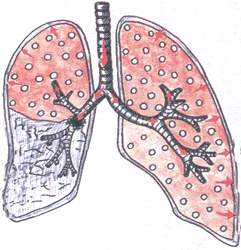
Kod ovog sindroma, kolaps plućnog tkiva se opaža kao rezultat djelomične ili potpune blokade velikog bronha tumorom, povećanim limfnim čvorovima ili stranim tijelom.
Patomorfologija: kada je bronh potpuno blokiran, vazduh ne ulazi u pluća, plućno tkivo je gusto. Uz djelomičnu blokadu bronha, plućno tkivo je zbijeno, ali sadrži malu količinu zraka.
^ Pritužbe: jaka kratkoća daha, kašalj, bol u grudima.
Opšti pregled: bljedilo kože, umjerena cijanoza.
Pregled grudnog koša: kod produžene blokade dolazi do povlačenja “bolesne” polovine grudnog koša (kolapsirano plućno tkivo zauzima manje prostora), tahipneja, zaostajanje “bolesne” polovine pri dubokom disanju.
Palpacija: određena rigidnost zahvaćene polovine grudnog koša. Drhtanje glasa je oslabljeno djelomičnim začepljenjem bronha, naglo oslabljeno ili uopće ne uz potpunu blokadu aferentnog bronha (nema uslova za prolaz zraka).
Percussion: kod nepotpune blokade bronha javlja se tup timpanijski zvuk, kod potpunog začepljenja - apsolutno tup zvuk.
Auskultacija: disanje je oslabljeno, vezikularno ili se uopšte ne čuje. Bronhofonija je naglo oslabljena ili se uopće ne opaža.
rendgenski snimak: homogena sjena u području atelektaze. Srce i velika plovila povučen na "bolesnu" stranu.
Pregled krvi i sputuma: Neće biti značajnijih promjena.
^
Sindrom kompresijske atelektaze
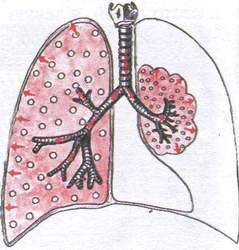
Ovaj sindrom se uočava kada je plućno tkivo komprimirano izvana tekućinom (hidrotoraks) ili zrakom (pneumotoraks).
Patomorfologija: plućno tkivo je zbijeno, ali sadrži određenu količinu vazduha, jer veza sa bronhom nije prekinuta i vazduh nastavlja da struji u pluća.
^ Pritužbe: kratak dah, kašalj, bol u grudima.
Opšti pregled: cijanoza, promjene na terminalnim falangama (“bubanj štapići”).
Pregled grudnog koša: izbočenje “bolesne” polovine grudnog koša zbog nakupljanja tečnosti ili vazduha u pleuralnoj šupljini, tahipneja, zaostajanje “bolesne” polovine pri disanju.
Palpacija: rigidnost “zahvaćene” polovine grudnog koša, vokalni tremor je blago pojačan.
udaraljke: tupost sa bubnim nijansama.
Auskultacija: oslabljeno vezikularno disanje sa bronhijalnom bojom ili bronhijalno (stvoreni su uslovi za to provodljivost - plućna tkanina je debela).
rendgenski snimak: u području atelektaze postoji homogena sjena povezana sa bronhom.
^ Pregled krvi i sputuma : Neće biti značajnijih promjena.
Sindrom nakupljanja tečnosti u pleuralnoj šupljini
(hidrotoraks)
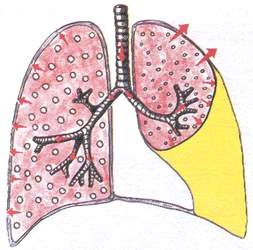
Ovaj sindrom karakterizira nakupljanje neupalne tekućine (transudata) - u slučaju srčane insuficijencije ili nakupljanja upalne tekućine (eksudativni pleuris) ili nakupljanje krvi (u slučaju ozljede grudnog koša, hemoragijske dijateze).
Pritužbe: at eksudativni pleuritis(bol u grudima, otežano disanje, kašalj, groznica), sa zatajenjem srca (bol u srcu, palpitacije, bol u desnom hipohondrijumu, otok).
^ Opći pregled
Pregled grudnog koša: izbočenje “bolesne” polovine grudnog koša (stepen ispupčenja zavisi od količine tečnosti), tahipneja, zaostajanje “bolesne” polovine pri disanju.
palpacija: na zahvaćenoj strani grudi su bolne i krute. Drhtanje glasa je naglo oslabljeno ili izostaje, ovisno o količini tekućine u pleuralnoj šupljini.
Percussion: često tup (femoralni) zvuk. Tokom stagnacije, nivo tečnosti je nizak i horizontalan sa obe strane. Kod eksudativnog pleuritisa, nivo tekućine može biti visok, tupost je određena kosom linijom Damoiseaua na jednoj strani.
Auskultacija: disanje je naglo oslabljeno ili izostaje, u zavisnosti od količine tečnosti u pleuralnoj šupljini. Sa zdrave strane čuje se pojačano vezikularno disanje. Može doći do trljanja pleure.
Bronhofonija je naglo oslabljena ili odsutna.
rendgenski snimak: homogeno zatamnjenje u zahvaćenom dijelu plućnog polja, pomicanje medijastinalnih organa, često u suprotnoj strani, kod tumorskog pleuritisa, medijastinalni organi se povlače prema „bolesnoj“ strani.
^ Pregled krvi i sputuma : sa eksudativnim pleuritisom - leukocitoza, ubrzana ESR.
Sindrom akumulacije zraka u pleuralnoj šupljini
(pneumotoraks)

Javlja se kada bronhi komuniciraju sa pleuralnom šupljinom (subpleuralna lokacija tuberkulozne šupljine, apsces), sa traumom grudnog koša, spontanim pneumotoraksom ili sa veštačkim uvođenjem vazduha u pleuralnu šupljinu sa terapeutske svrhe pacijenata sa kavernoznom tuberkulozom.
^ Pritužbe
Opšti pregled: bleda koža, cijanoza.
Pregled grudnog koša: izbočenje “bolesne” polovine grudnog koša, u kojoj se nakupio vazduh, zaglađivanje međurebarnih prostora, tahipneja, zaostajanje “bolesne” polovine pri disanju.
palpacija: bol, ukočenost zahvaćene polovine grudnog koša. Drhtanje glasa je naglo oslabljeno ili ga nema.
Percussion: glasan timpanični zvuk ponekad sa metalnim sjena.
auskultacija: disanje je oslabljeno, vezikularno ili se ne čuje. Bronhofonija je naglo oslabljena ili odsutna.
rendgenski snimak: svijetlo plućno polje bez plućne šare, a bliže korijenu nalazi se sjena kolapsiranog pluća.
^ Pregled krvi i sputuma : Neće biti značajnijih promjena.
Sindrom viška zraka u plućima (emfizem)
Ovaj sindrom se opaža kada je faza izdisaja otežana (smanjenje lumena bronhija zbog njihovog grča ili punjenja eksudatom, smanjenje elastičnosti plućnog tkiva), širenje pluća, povećanje sadržaja zraka u njima, ali ekskurzija disanja oni se smanjuju.
Patomorfologija: povećana prozračnost plućnog tkiva.
Pritužbe: kratak dah, kašalj.
^ Opći pregled: natečenost lica, cijanoza, otok vratnih vena.
Pregled grudnog koša: sanduk u obliku bureta,
Interkostalni prostori su prošireni, sub- i supraklavikularne jame su glatke ili ispupčene, pokreti disanja grudni koš je smanjen u volumenu, tahipneja.
palpacija: grudi su krute. Drhtanje glasa je oslabljeno.
udaraljke: Po cijeloj dužini plućnog tkiva se detektira kutijasti zvuk, donje granice pluća su spuštene, a ekskurzija donjih granica pluća je ograničena.
auskultacija: ujednačeno oslabljeno vezikularno disanje, suvi i vlažni hripavi.
rendgenski snimak: povećana transparentnost plućnih polja, slabljenje plućnog uzorka, niska lokacija i mala pokretljivost dijafragme.
Pregled krvi i sputuma: Neće biti značajnijih promjena.
^
Sindrom suženja bronha sa viskoznim eksudatom
E  ovaj sindrom je najtipičniji za akutne ili hronični bronhitis, kod kojih dolazi do upale bronhijalne sluznice i punjenja lumena bronha viskoznim sekretom.
ovaj sindrom je najtipičniji za akutne ili hronični bronhitis, kod kojih dolazi do upale bronhijalne sluznice i punjenja lumena bronha viskoznim sekretom.
^ Žalbe: kašalj, možda bol u grudima.
Opšti pregled: akrocijanoza, bleda koža.
Pregled grudnog koša: bitnih promjena neće biti.
Palpacija: grudni koš bezbolan, elastičan. Tremor glasa se izvodi dobro, podjednako sa obe strane.
Percussion: Jasan plućni zvuk se otkriva na cijeloj površini plućnog tkiva.
Auskultacija: teško disanje, suvo zviždanje različite visine i boje.
rendgenski snimak: jačanje plućnog uzorka.
^ Test krvi: umjerena leukocitoza, ubrzana ESR.
Pregled sputuma: Sputum je sluzav, mukopurulantan i sadrži mali broj leukocita.
^
Sindrom bronhoopstrukcije
D  Ovaj sindrom karakterizira kršenje bronhijalna opstrukcija zbog bronhospazma, upale i otoka sluzokože malokalibarskih bronha (hronični opstruktivni bronhitis, bronhijalna astma).
Ovaj sindrom karakterizira kršenje bronhijalna opstrukcija zbog bronhospazma, upale i otoka sluzokože malokalibarskih bronha (hronični opstruktivni bronhitis, bronhijalna astma).
^ Pritužbe: kašalj, kratak dah.
Opšti pregled: cijanoza, „bubanj“ (promene na terminalnim falangama).
Pregled grudnog koša: tahipneja, sa produženom bronhijalnom opstrukcijom - grudi su bačvastog oblika, respiratorni pokreti su smanjeni u volumenu.
Palpacija: grudni koš donekle ukočen, vokalni tremor je oslabljen.
Percussion: blago prigušenost zvuka udaraljki sa kutijastom nijansom.
Auskultacija: disanje je oštro ili oslabljeno vezikularno sa masom razbacanih suhih, au donjim dijelovima vlažno, fino, neglasno zviždanje.
rendgenski snimak: povećana transparentnost plućnog tkiva, niska pozicija kupole dijafragme i ograničenje njene pokretljivosti.
^ Test krvi : leukocitoza, ubrzana ESR, može biti eozinofilija, limfocitoza.
Ispitivanje sputuma: sputum je sluzav, mukopurulantan, sadrži mali broj leukocita i eozinofila.
^
Sindrom fibrotoraksa ili privez
P  Kod ovog sindroma uočava se zamjena plućnog tkiva vezivno tkivo, zbog dugotrajnog upalnog procesa različite etiologije.
Kod ovog sindroma uočava se zamjena plućnog tkiva vezivno tkivo, zbog dugotrajnog upalnog procesa različite etiologije.
^ Pritužbe: kratak dah, bol u grudima.
Opšti pregled: bleda koža, cijanoza.
Pregled grudnog koša: povlačenje “bolesne” polovine grudnog koša, tahipneja, zaostajanje “bolesne” polovine tokom dubokog disanja.
Percussion: prigušenost udaraljki.
Auskultacija: disanje je oslabljeno, vezikularno ili se ne čuje. Šum trenja pleure. Bronhofonija je naglo oslabljena ili odsutna.
rendgenski snimak: u predjelu fibrotoraksa postoji homogena sjena.
Pregled krvi i sputuma: Neće biti značajnijih promjena.
^
Respiratorni distres sindrom
Respiratorna insuficijencija (DN) je stanje organizma u kojem se održava normalno sastav gasa krvi ili se to postiže intenzivnijim radom uređaja spoljašnje disanje i srca, što dovodi do smanjenja funkcionalnost tijelo.
Normalna izmjena plinova u plućima je moguća uz jasan odnos između tri komponente.
1) ventilacija
2) difuzija gasova kroz alveolarno-kapilarnu membranu
3) perfuzija kapilarne krvi u plućima
Uzroci DN mogu biti bilo koji patološki procesi u organizmu ili nepovoljni faktori okruženje, koji utiču na barem jednu od ovih komponenti.
Postoje dvije grupe DN:
sa dominantnim oštećenjem plućnih mehanizama
sa dominantnim uključivanjem ekstrapulmonalnih mehanizama
Opstrukcija majora respiratornog trakta
Mala opstrukcija disajnih puteva
Smanjenje plućnog tkiva
Poremećaj restrikcije alveolarnog tkiva
Poremećaj plućnog krvotoka
Kršenje omjera ventilacije i perfuzije
Zadebljanje alveolarno-kapilarne membrane
1. Kršenje centralne regulacije disanja
2. Oštećenje respiratornih mišića
3. Oštećenje grudnog koša
Ovisno o uzrocima i mehanizmu DN, razlikuju se tri vrste kršenja ventilacijske funkcije pluća:
-opstruktivno
-restriktivno
-mješoviti
Za opstruktivni tip (Sl. 1) karakterizira otežano prolaz zraka kroz bronhije zbog upale bronha, bronhospazma, suženja ili kompresije dušnika i velikih bronha. Od faza disanja pretežno je zahvaćen izdisaj.
U spirografskoj studiji uočeno je smanjenje maksimalne plućne ventilacije (MVL) i volumena forsiranog izdisaja u 1 s. (FVC) uz blagi pad vitalni kapacitet pluća (VC).
 Fig.1
Fig.1
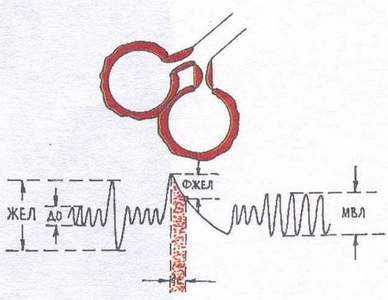
Restriktivni tip (Sl. 2) poremećaji ventilacije se uočavaju kada je mogućnost širenja i kolapsa pluća ograničena (hidrotoraks, pneumotoraks, pneumoskleroza, kifoskolioza, masivne pleuralne adhezije, okoštavanje obalnih hrskavica, ograničena pokretljivost rebara). Od faza disanja, dominantno je zahvaćen udisanje. Spirografska studija pokazuje smanjenje VC i MVL.
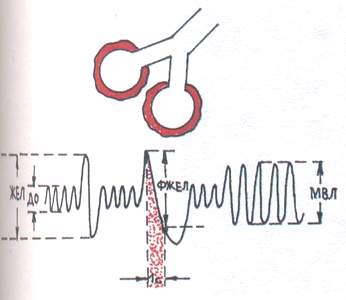 Fig.2
Fig.2
Mješoviti tip (Sl. 3) javlja se kod dugotrajnih plućnih i srčanih bolesti i kombinuje znakove 2 vrste ventilacijskog oštećenja (opstruktivnog i restriktivnog), često uz dominaciju jednog od njih.
^
Fig.3
Postoje tri stepena DN
1 tbsp.otežano disanje se javlja kada je ranije bilo dostupno fizička aktivnost cijanoza je odsutna, zamor je brz, pomoćni respiratorni mišići nisu uključeni u disanje.
2st. otežano disanje javlja se pri uobičajenom naporu, cijanoza je blago izražena, umor je izražen, a tokom vježbanja pomoćni mišići su uključeni u disanje.
3st. otežano disanje u mirovanju, cijanoza, umor je izražen, pomoćni mišići su stalno uključeni u disanje.
Prisustvo DN i njegov stepen se ocjenjuju po težini istih kliničkih znakova kao što su otežano disanje, tahikardija, cijanoza i promjene u plimne zapremine i kontejnere. Podaci iz metoda fizikalnog pregleda ovisit će o osnovnoj bolesti s kojom je povezan razvoj respiratorne insuficijencije.
N.A.Mukhin, V.S.Moiseev. Propedeutika unutrašnjih bolesti. – M., 2002
A.V. Strutynsky “Osnove semiotike bolesti” unutrašnje organe" - Moskva -. MED-press-inform.- 2007.
Kontrolna pitanja
Koje glavne plućne sindrome poznajete?
Karakteristike auskultacije u stadijumu I, III i II lobarne pneumonije?
Za koje bolesti je najtipičniji sindrom fokalnog zbijanja plućnog tkiva?
Kako će se to promijeniti opšta analiza krv i sputum u slučaju karijesnog sindroma u plućnom tkivu?
Koja se šupljina u plućnom tkivu otkriva fizikalnim metodama pregleda?
Zašto je kod opstruktivne atelektaze disanje vezikularno oslabljeno ili se uopće ne čuje?
Koji je perkusioni zvuk najkarakterističniji za sindrom bronhijalne opstrukcije?
Kako se vokalni tremor mijenja sa sindromom lobarne kondenzacije?
Zašto je “zahvaćena” polovina grudnog koša rigidna kod sindroma kompresijske atelektaze?
Koje pritužbe ima pacijent sa hidrotoraks sindromom?
Šta znači grudni koš i za koje je bolesti tipičan?
Koji je mehanizam razvoja sindroma plućnog emfizema?
Koje promjene na rendgenskom snimku se uočavaju kod eksudativnog pleuritisa i kongestivnog zatajenja srca?
Šta održava normalnu izmjenu plinova u plućima?
Koje su tri vrste disfunkcije plućne ventilacije?
Termini sindrom respiratorni poremećaji(SRETAN ROĐENDAN), respiratornog distres sindroma(RDS) i bolest hijalinskih membrana (HMD) su sinonimi u stranoj literaturi. Na primjer, u najpopularnijim neonatološkim priručnicima u Sjedinjenim Državama, termini se koriste za opisivanje istog stanja (bolesti): u 7. izdanju Averys Diseases of the Newborn (1998) - bolest hijaline membrane, au 7. izdanju Neonatal -Perinatalna medicina (Ed. A.A.Fanaroff i R.J.Martin, 2002) - respiratorni distres sindrom. Preferiramo koncept respiratornog distres sindroma.
Učestalost razvoja SDR u prosjeku zavisi od stepena nedonoščadi novorođenčeta i iznosi u prosjeku 82-88% za rođenje djeteta u periodu gestacije kraćem od 27 sedmica, 78-80% - u periodu od 27-28 nedelja, 70% - u periodu od 29 -30 nedelja, 50-55% - za period od 3 1 - 3 2 nedelje, 20-22% - u periodu od 33-34 nedelje, 5 - 1 0% - za period od 35-36 sedmica. i manje od 1 - 2% - u gestacijskoj dobi od 37 sedmica. i više.
HDM (tip I SDR, RDS) i njegove posljedice uzrok su 30-50% neonatalnih smrti.
Etiologija. Uzročni faktori razvoj B GM su:
nedostatak stvaranja i oslobađanja surfaktanta;
nedostatak kvaliteta surfaktanta;
inhibicija i uništavanje surfaktanta;
nezrelost strukture plućnog tkiva. Sve ove procese olakšavaju:
nedonoščad;
intrauterine infekcije;
perinatalna hipoksija, asfiksija i plućna ishemija i acidoza uzrokovana njima;
retinopatija nedonoščadi;
Lokalni, plućni:
sindromi curenja zraka;
plućni edem;
upala pluća;
krvarenja u plućima;
bronhopulmonalna displazija;
Poremećaji povezani sa nepravilan položaj ili začepljenje respiratornih cijevi, oštećenje larinksa i traheje (suženje subglotičnog prostora, edem, stenoza, erozija, granulom).
Zbrinjavanje pacijenata sa GBM-om zahtijeva od neonatologa da kombinuje duboko poznavanje fiziologije vezane za uzrast, algoritama intenzivne njege i ovladavanje umijećem stalne analize dinamike kliničkih simptoma, simpatija, empatija prema djetetu. Potrebno je stalno praćenje osnovnih vitalnih parametara i, kao povratna informacija, brzo prilagođavanje parametara mehaničke ventilacije i infuzije. terapija lijekovima. Čini se da je kod mnoge djece s HBM težina stanja nakon prvog dana života posljedica ne toliko početne težine plućne bolesti koliko njihovog oštećenja (sa sekundarnim nedostatkom surfaktanta) s neadekvatnim (ne varira ovisno o djetetov odgovor) parametri mehaničke ventilacije, prekomjerna ili nedovoljna infuzija, terapija lijekovima, hlađenje.
Dijagnoza se postavlja na osnovu kliničke slike i rendgenskog snimka grudnog koša.
Radiološki, HBM karakterizira trijada simptoma koji se pojavljuju u prvih 6 sati života:
difuzna simetrična žarišta smanjene transparentnosti (simptom brušenog stakla bez ili sa znakovima retikularnih pluća);
zračni bronhogram;
smanjena pneumatizacija perifernih plućnih polja.
Ove raširene promjene bolje se razlikuju u donjim dijelovima pluća i na vrhovima. Osim toga, vidljivo je smanjenje volumena pluća, različite težine kardiomegalije (povećanje kardiotorakalnog indeksa), nodozno-retikularne promjene (razni autori ih opisuju kao retikularne, mozaične, zrnate, perle, itd., ali su i dalje prisutne češće se tumači kao difuzna atelektaza).
Za edematozno-hemoragični sindrom tipično je smanjenje veličine plućnih polja i zamagljena rendgenska slika, koja se klinički često kombinira s oslobađanjem pjenaste tekućine s krvlju iz usta.
Ako se navedeni znaci HD ne otkriju na rendgenskim snimcima 3 sata nakon rođenja, dijagnoza HD je sumnjiva. Radiografske karakteristike SDR-a su nespecifične (npr. slične su onima kod streptokokne B pneumonije), ali rendgenski snimci grudnog koša su i dalje neophodni da bi se isključila druga stanja koja ponekad zahtijevaju operaciju. Rendgenski znaci HD nestaju nakon nekoliko sati ili 1 do 3 dana, ovisno o težini bolesti, prirodi terapije, posebno da li je korišten egzogeni surfaktant ili ne.
R. J. Rodrigues et al. (2002) naglašavaju da se čak iu većini neonatalnih centara u Sjedinjenim Državama pri postavljanju dijagnoze SDR-a oslanjaju samo na kliničke i radiološke podatke, iako je, naravno, za ispravnu dijagnozu SDR-a važno dobiti dokaz o nedostatku surfaktanta. Stoga se danas ponekad koristi termin respiratorna insuficijencija nedonoščadi, kada je za liječenje prijevremeno rođene bebe potrebna mehanička ventilacija i dodatni kisik, ali nema tipične znakove SRETAN ROĐENDAN.
Prenatalna dijagnoza se zasniva na činjenici da fetalna plućna tečnost iz disajnih puteva ulazi u amnionsku tečnost, a njen fosfolipidni sastav se može koristiti za procenu zrelosti fetalnih pluća. Amnionska tečnost se dobija ili amniocentezom ili prikupljanjem tečnosti iz porođajnog kanala majke. Ako nivoi lecitina i sfingomijelina, zasićenog fosfatidilholina u amnionska tečnost, prelaze 5 mg/l ili fosfatidilglicerol - 3 µmol/l, SDR se razvija vrlo rijetko (manje od 1% slučajeva). Ako je omjer lecitin/sfingo-mijelin (L/S) veći od 2,0, vjerovatnoća SDR je 2%, ako je manja od 2,0, ali veća od 1,0, - 50%, a ako je manja od 1,0, -75%. Kada kasni intrauterini razvoj L/C omjer ne odražava uvijek ispravno funkcionalnu zrelost fetalnih pluća, te se stoga u ovim slučajevima preporučuje da se vodite prema gore navedenim apsolutnim razinama zasićenih fosfatidilholina i fosfatidilglicerola, kao i surfaktantnih proteina A. neki neonatalni centri, za procjenu zrelosti fetalnih pluća, pribjegavaju proučavanju tromboplastične aktivnosti plodove vode i brojanju narančastih stanica, ali to nije općenito prihvaćeno.
Pjenasti test je najjednostavniji test zrelosti pluća. Za izradu testa koristi se amnionska tekućina ili 1 ml želudačnog sadržaja dobivenog polietilenskim kateterom u prvom satu života. Test se izvodi na sledeći način: dodati 0,5 ml apsolutnog etanola (95%) u 0,5 ml amnionske tečnosti ili želudačnog sadržaja. Staklena epruveta (prečnika 1 cm) se snažno mućka 15 s, nakon 15 minuta se procenjuje rezultat ispitivanja približavanjem epruvete crnom papiru. Test je pozitivan ako se na površini nalazi jedan ili dvostruki prsten mjehurića. Test je negativan ako nema mjehurića, a slabo pozitivan ako ima pojedinačnih malih mjehurića oko meniskusa koji ispunjavaju 1/3 obima ili manje. Kada pozitivan test vjerovatnoća HMD-a je oko 4%, slabo pozitivna - 20%, negativna - 60%.
Obim pregleda (monitoringa) kod dece sa RDS:
Kontinuirano praćenje otkucaja srca i krvnog pritiska.
Transkutana oksihemoglobinometrija, ili još bolje, transkutano određivanje Pao2 i Paco2 u arterijske krvi. Vrlo je opasno oslanjati se samo na podatke pulsnog oksimetra, jer dobro odražava težinu hipoksemije, ali ne reagira na hiperoksiju, pa čak i na donjoj granici norme, Raoh oksihemoglobin je 100%. Opasnost od hiperoksije je velika: s njom je povezano kronično oštećenje pluća i očiju kod novorođenčadi.
Optimalno je odrediti Pao2 i Paco2 u krvi dobijenoj kateterizacijom umbilikalne, radijalne ili tibijalne arterije i iz centralne vene, uz analizu arteriovenske razlike u napetosti kiseonika, tj. potrošnja kiseonika tkiva.
Svaka 3 - 4 sata potrebno je izmjeriti i zabilježiti u kartoteku za posmatranje abdominalnu temperaturu kože, krvni pritisak, diurezu, CBS, glikemijski nivo i koncentraciju kiseonika u udahnutom vazduhu (Fio2).
Tokom akutne faze, SDR se obavlja svakodnevno ili svaki drugi dan:
rendgenski snimak grudnog koša;
određivanje indikatora hematokrita;
klinički test krvi;
kultura krvi i trahealnog sadržaja;
određivanje nivoa azota uree, kalijuma, natrijuma, kalcijuma i magnezijuma u serumu, ukupni proteini i albumin;
poželjno je odrediti volumen cirkulirajuće krvi, brzinu cerebralnog krvotoka i osmolarnost krvi;
koagulogram sa određivanjem fibrinogena i produkata razgradnje fibrina (prema indikacijama);
određivanje nivoa natrijuma u krvi na početku - 2 - 4 puta dnevno, jer postoji veliki rizik od hipernatremije usled dehidracije.
Diferencijalna dijagnoza se provodi sa respiratornim poremećajima kako plućnog (pneumonija, malformacije pluća itd.) tako i neplućnog porijekla (sekundarni respiratorni poremećaji - intrakranijalna porođajna povreda glave ili kičmena moždina, urođene srčane mane, dijafragmatska hernija, policitemija, metabolički poremećaji i sl.). Diferencijalna dijagnoza sa upalom pluća je navedeno u nastavku.
Choanalna ageneza uzrokuje nemogućnost disanja na nos i pojavu cijanoze i poremećaja disanja nakon normalnog prvog udisaja. Tipičan je obilan sluzavi iscjedak koji puni nos. Malformacija postaje očita kada nije moguće provući kateter ili sondu kroz nos u nazofarinks. Liječenje je hirurško, ali se dišni put odmah uvodi u usta.
Traheoezofagealne fistule klinički se manifestuju gušenjem, napadima cijanoze, kašljanjem i pojavom zviždanja u plućima tokom ili neposredno nakon hranjenja. Studija kontrasta jednjak (sa kontrastnim sredstvom rastvorljivim u vodi) i bronhoskopija će potvrditi dijagnozu.
Dijafragmatska kila se otkriva pri rođenju ili ubrzo nakon nje povećanjem teški poremećaj disanje. Tipični su mali navikularni abdomen i uvučeni prednji trbušni zid pri rođenju. Prilikom pregleda skreće se pažnja na asinhrone pokrete desne i lijeve polovice grudnog koša i pomicanje vršnog otkucaja srca, češće udesno (pošto se lijevostrana dijafragmalna hernija javlja 5-10 puta češće nego desna). -strane), oštro skraćivanje perkusionog tona u donjem dijelu pluća i izostanak zvukova disanja ovdje, iznenadna cijanoza kada je dijete smješteno na zdravu stranu. Od odlučujućeg dijagnostičkog značaja je radiografija grudnog koša, koja pokazuje prisustvo u grudnom košu za njega neuobičajenih struktura (crijeva, jetra itd.). Liječenje je hirurško.
Kod djece sa porođajnom traumom mozga i kičmene moždine, uz poremećaje disanja, javljaju se i znaci oštećenja centralnog nervnog sistema. U pravovremenoj dijagnostici moždane patologije pomažu i pomoćne studije: neurosonografija, radiografija kralježnice, lumbalna punkcija itd.
Urođene srčane mane plavog tipa i sindrom perzistentne fetalne cirkulacije ponekad je teško razlikovati od DFS. Međutim, u prvim satima života djeca sa SDD često imaju normalnu boju kože. Kada se koristi 100% kiseonik za disanje u trajanju od 10-15 minuta, posebno uz konstantan pozitivan pritisak u disajnim putevima, Raoh se povećava kod dece sa SDR, ponekad čak i iznad 100 Torr, dok se to ne dešava kod srčanih mana plavog tipa. Naravno, bitni su i podaci. klinički pregled, auskultaciju, procjenu na Silvermanovoj skali, kao i dodatne studije (rendgenski snimak grudnog koša, EKG, rezultati ehokardiografije).
Pneumonije uzrokovane streptokokom B i drugim streptokokom (peptost-reptokoki, enterokoki) daju kliničku sliku koja se praktično ne razlikuje od BGM, jer uzrokuju inhibiciju surfaktanta, a time i njegov nedostatak. Dijagnostička vrijednost u ovom slučaju ima identifikaciju drugih infektivnih žarišta (itd.), rezultate kliničkih pretraga krvi, hemokulture i trahealnog sadržaja.
Tretman. Temperaturna zaštita. Njega je prvenstveno usmjerena na sprječavanje hlađenja, jer pomaže da se smanji ili čak zaustavi (pri tjelesnoj temperaturi 35°C i niže) sinteza surfaktanta i povećanje metabolička acidoza, razvoj napada apneje. Odmah po rođenju beba se umotava u sterilnu zagrijanu pelenu, plodna voda se pažljivim upijanjem uklanja sa kože i stavlja pod zračeći izvor toplote, a zatim u inkubator (temperatura u inkubatoru zavisi od telesne težine pri rođenju; jer detalje, vidi Poglavlje VIII). Svakih 1-2 sata detetu se meri telesna temperatura, a ako je ispod 36°C, temperatura vazduha u inkubatoru se povećava za 1-2°C, a ako je iznad 37°C, onda se smanjuje (obično ne bi trebalo da bude niža od 32°C). Više detalja u poglavlju VIII.
Treba imati na umu da dijete koje leži ispod izvora topline na stolu za reanimaciju troši 5-10% više energije na održavanje tjelesne temperature nego dijete u inkubatoru. Stoga je preporučljivo prijevremeno rođene bebe sa vrlo malom tjelesnom težinom, čak i u inkubatoru, smjestiti u plastičnu komoru kako bi se smanjio gubitak topline konvekcijom, kao i neprimjetan gubitak vode. Sva djeca moraju staviti kapu na glavu, jer je gubitak topline i vode iz glave veoma veliki.
Važno je spriječiti temperaturne fluktuacije spoljašnje okruženje; Prilikom pregleda djeteta u inkubatoru, minimizirajte traumatske efekte - bol, itd.
Pregled kod ljekara treba da bude što kraći, a posebno je važno, ako dijete treba da se okrene, poduprijeti glavu, smanjujući pasivne pokrete u vratnoj kičmi.
Održavanje prohodnosti disajnih puteva. Prilikom rođenja djeteta u asfiksiji, prisustvo mekonija u amnionskoj tekućini u obliku supa od graška Potrebna je intubacija traheje i nežno, ali snažno usisavanje sadržaja disajnih puteva. Usisavanje se ponavlja akutna faza bolesti u više navrata, vođeni kliničkom slikom i auskultacijskim podacima, ali imajući na umu da trahealni toalet uzrokuje prolaznu, ali značajnu hipoksemiju, bradikardiju i hipertenziju, značajnu promjenu intenziteta cerebralnog krvotoka, što može izazvati intrakranijalne hemoragije, paraventrikularne lezije.
Položaj djeteta sa SDD na stolu ili u inkubatoru treba biti sa blago ispruženom glavom (položaj za kijanje). Da biste to učinili, ispod gornjeg dijela grudnog koša postavite jastuk debljine 3-4 cm.Periodično mijenjanje položaja djeteta (blago okretanje na jednu stranu, na stomaku i sl.) stimuliše drenažu dušnika. Na kraju akutnog perioda pribjegavaju vibracijskoj masaži, fizioterapiji i aerosol terapiji.
Infuziona terapija i prehrana. Djeca sa SDD se u pravilu ne hrane enteralno prva dva do tri dana života zbog rizika od kardiopulmonalnih komplikacija i regurgitacije. Međutim, od prvih sati života dijete ne smije biti gladno ili žedno. Osim toga, izuzetno je važno spriječiti razvoj hipoglikemije. Stoga, već 30-40 minuta nakon rođenja, počinje planirana infuzijska terapija. Volumen primijenjene tekućine prvog dana života iznosi 50-60 ml/kg sa daljim povećanjem od 20 ml/kg za svaki sljedeći dan (7. dana oko 140-150 ml/kg). Posebno pažljivo je potrebno davati tekućinu i povećavati njen dnevni volumen u slučaju oligurije kod djeteta. Kada se pojavi diureza (više od 2 mi/kg/h), volumen tekućine se snažnije povećava (do 40 ml/kg dnevno). Tokom faze oligurije, višak tečnosti može pomoći u održavanju otvorenog ductus arteriosus, plućni edem može biti faktor povećan rizik kasniji razvoj BPD-a. Obnavljanje diureze je vjesnik početka faze oporavka.
Prvog dana života transfuzirana tečnost je 5-10% rastvor glukoze, od drugog dana joj se dodaju natrijum i hlor u količini od 2-3 mol/kg/dan. i kalijum, kalcijum 2 mol/kg/dan. Sastav rastvora za infuziju se prilagođava u zavisnosti od monograma krvi, održavajući nivo natremije unutar 135-145 mmol/l plazme. Za prevenciju tromboze katetera i regionalne žile, posebno kod djece na potpunoj parenteralnoj ishrani, infuziranim otopinama se dodaje heparin u dozi od 0,2-0,5 jedinica na 1 ml transfuzirane tekućine.
Općenito, kao što je poznato, volumen i karakter infuziona terapija određuje se u zavisnosti od:
dinamika tjelesne težine;
dinamika ADC i intenzitet cerebralnog krvotoka;
stanje kardiovaskularnog sistema, posebno stanje periferne cirkulacije;
CBS i jonogram krvnog seruma;
uvjeti njege, posebno adekvatnost temperaturne zaštite, metode mehaničke ventilacije ili IVL.
Uzimajući u obzir sve ove parametre i korekciju jačine zvuka - složeni zadaci, za koje je potrebno i znanje i veština lekara, jer se do sada novorođenčad ne leči koliko negova.
Donatorsko hranjenje, majčino mleko ili mješavinu prilagođenu nedonoščadi počinje kada se stanje poboljša i otežano disanje se smanji na 60 u minuti, izostanak produžene apneje, regurgitacije, nakon kontrolne primjene destilirane vode unutra. Vrsta hranjenja (jednokratna ili kontinuirana želučana ili transpilorna sonda, bočica) ovisi o dostupnosti refleks sisanja, ozbiljnost stanja. Proračun količine mlijeka - vidi poglavlje VI, gdje možete pročitati i način parenteralne prehrane ako stanje pacijenta ne dozvoljava početak enteralne prehrane.
Normalizacija sastava gasova u krvi postiže se obogaćivanjem udahnutog vazduha kiseonikom, razne opcije stvaranje povećanog pritiska u disajnim putevima tokom spontanog disanja (spontano disanje sa konstantnim pozitivnim pritiskom u disajnim putevima) kroz nazalne kanile (pCPAP - nazalni kontinuirani pozitivni pritisak u disajnim putevima) pri konstantnom visok krvni pritisak i mehaničku ventilaciju.
Ako nema znakova SDR, prevremeno rođena beba se stavlja u inkubator, gdje je sadržaj kisika u zraku oko 40 - 45%. Ako u roku od 4 sata arterijski krvni pritisak (ili kada se odredi kožnim senzorom) ostane iznad 8 kPa (60 torr = mmHg), tada se koncentracija kiseonika smanjuje za 5% na sat na nivo od 30 - 35%. Kada je Pa o 2 manji od 6,6 7 kPa (5 0 torr = mm Hg), koncentracija kisika u udahnutom zraku se povećava do maksimuma postavljanjem poklopca u inkubator preko djetetove glave. Ako to ne dovede do normalizacije krvnog Pao2, tada se pokreće SDPPD (optimalno kroz nazalne kanile).
Ostale indikacije za pokretanje SDP-a su:
uporni nedostatak daha i zvukovi pri izdisanju;
Silverman postiže 5 ili više poena (čak i sa normalna boja koža);
negativan pjenasti test sa amnionskom tekućinom ili sadržajem želuca dobijenim odmah nakon rođenja, odsustvo fosfatidil glicerola u njima.
Najčešća metoda koja se trenutno koristi je pCPAP; Martinova metoda (Martin bag) se koristi mnogo rjeđe. Torbica se pjenastom trakom pričvršćuje za vrat djeteta kako bi mali prst doktora mogao slobodno prodrijeti između vrećice i vrata. Ekspiratorni ekspiratorni pritisak sa CPAP-om je obično u rasponu od 4-6 cm vode. Art. (tj. cijev kroz koju izlazi zrak iz vreće je uronjena do ove dubine), rijetko se mora povećati u slučaju jake krutosti pluća na 10 cm vode. Art. Ako je rigidnost pluća niska, tada višak pritiska tijekom izdisaja dovodi do poremećaja odljeva krvi iz mozga, smanjenja njenog dotoka do srca i doprinosi razvoju zatajenja srca i cerebralnog edema.
SDPPD počinje dovodom vlažnog kisika zagrijanog na 32-34°C, a zatim se pod kontrolom kliničkog efekta i PaO2 u krvi postepeno smanjuje njegova koncentracija u inhaliranoj smjesi, čime se postiže PaO2 u arterijskoj krvi od 6,67-10,67 kPa. (50-80 torr = mm Hg), a arterializirana krv iz pete više od 8 kPa smatra se potencijalno toksičnom, što zahtijeva smanjenje koncentracije kisika u udahnutom zraku.
Ako je dijete izrazito nemirno, što je posebno često kod pCPAP-a, propisuje se natrijum hidroksibutirat ili seduksen, ali ne i fenobarbital, koji selektivno potiskuje ekspiratorne strukture respiratornog centra smještenog u produženoj moždini.
Indikacije za mehaničku ventilaciju su:
Nemogućnost postizanja normalizacije krvnog Pao2 na pozadini pCPAP-a, Silverman skor više od 5 bodova, koji se ne smanjuje na pozadini pCPAP-a;
Pao2 je ispod 8,00 kPa (60 mm Hg) sa Fio2>0,7 (F1O2 je udio kiseonika u udisanoj mešavini kiseonika i vazduha), ali ako je porođajna težina manja od 1250 g, onda sa Fio2>0,4;
Paco2 je veći od 8,79 kPa (65 mm Hg), a sa tjelesnom težinom manjom od 1250 g - Paco2>8,00 kPa (60 mm Hg) i pH<7,25;
Metodologija izvođenje mehaničke ventilacije- vidi pogl. XXVI.
Ekstrakorporalna membranska oksigenacija koristi se u inostranstvu za liječenje djece s izuzetno teškim SDR-om kada je neefikasna tradicionalne metode Mehanička ventilacija kod djece sa teškim srčanim manama. Zbog nedostatka odgovarajuće opreme u Rusiji, u ovom udžbeniku ne opisujemo njene metode.
Opasnosti terapije kiseonikom:
suhi i hladni kiseonik oštećuje pluća, potiče spazam arteriola, plućnu hipertenziju, acidozu i inhibiciju sinteze surfaktanata. Zagrevanje kiseonika na 32-34°C je obavezno (sa mehaničkom ventilacijom - do 36-37C), kao i njegovo ovlaživanje. U nedostatku posebnih ovlaživača, kisik se prolazi kroz bobrov teglu (visina vodenog stupca je najmanje 15 cm). Prekomjerno vlaženje (100% relativna vlažnost zraka duže od 2 sata) dovodi do pregrijavanja djeteta, preopterećenja vodom i doprinosi plućnom edemu. toksični efekat Manjak kiseonika je stvaran kada je Pao2 u arterijskoj krvi veći od 10,67 kPa, traje nekoliko sati, što dovodi do oštećenja očiju, pluća i centralnog nervnog sistema. Održavanje PPOV. Potrebno je samo korigovati patološku acidozu (pH manji od 7,25 i BE više od minus 10 mmol/l), i to tek nakon uspostavljanja mehaničke ventilacije ili IVL.Ako je patologija pluća dovela do tako značajnog oštećenja KBS-a, tada ovo je direktna indikacija za mehaničku ventilaciju ili IVL. Količina natrijum bikarbonata u mmol (tj. broj ml 8,4% rastvora) χ (BE vrijednost - 5) χ tjelesna težina (kg) χ 0,4. Odgovarajuća količina natrijum bikarbonata se daje kap po kap u obliku 4,2% rastvora tokom 1 sata.Važno je imati na umu da alkaloza izaziva intrakranijalne hemoragije i respiratorni zastoj kod prevremeno rođene dece.
Borba protiv anemije i hipovolemije, hipotenzije. U akutnoj fazi bolesti potrebno je održavati vrijednost hematokrita od najmanje 0,4, jer je anemija faktor koji održava hipoksiju tkiva, što znači nedostatak surfaktanta, oticanje tkiva i sl. Transfuzira se masa crvenih krvnih zrnaca. Za tešku anemiju i težak tok Direktna transfuzija krvi je indikovanija za SDR, jer svježa crvena krvna zrnca sadrže više 2,3-difosfoglicerata, koji smanjuje hipoksiju tkiva. Osim toga, svježa krv je indikovanija za korekciju poremećaja hemostaze kod dekompenziranog DIC sindroma, a ujedno je i imunoprotektor infekcija. U isto vrijeme, zamjenske transfuzije krvi za SDR su sada napuštene, jer to doprinosi povećanju učestalosti i težine retinopatije nedonoščadi. U 2. sedmici života i kasnije, indikacija za transfuziju crvenih krvnih zrnaca je hematokrit ispod 0,3. Trenutno su indikacije za transfuziju pune krvi oštro ograničene zbog opasnosti od infekcija (ne samo hepatitisa B i C, HIV-a, već i citomegalovirusa, jer 6-12% darivatelja ima citomegalovirus u krvi), izosenzibilizacije.
Hipovolemija (pozitivan simptom bijela mrlja- 3 s ili više), posebno kod djece sa anemijom, preporučljivo je korigirati transfuzijom izotonični rastvor natrijum hlorid, ali možete transfuzirati i svježe smrznutu plazmu ili 10% otopinu albumina. Količina transfuziranog lijeka je 10-15 ml/kg tjelesne težine. Sipati polako u mlazu (1-2 ml/kg/min).
Ako se, nakon korekcije anemije i hipovolemije, arterijski krvni pritisak nizak (maksimalni pritisak ispod 45 torr, tj. mm Hg), tada počinju davati mikro-mlaz dopamina (početna doza 5 mcg/kg/min sa daljim povećanjem prema indikacijama na 10-15-20 mcg/kg/min) (za detalje videti Poglavlje XIX).
Nadoknada nedostatka surfaktanta. Od prvih radova T. Fujiwara et al. 1980. godine, kako bi se nadomjestio nedostatak surfaktanta kod vrlo prijevremeno rođene djece, ustanovljen je pozitivan efekat takvu terapiju.
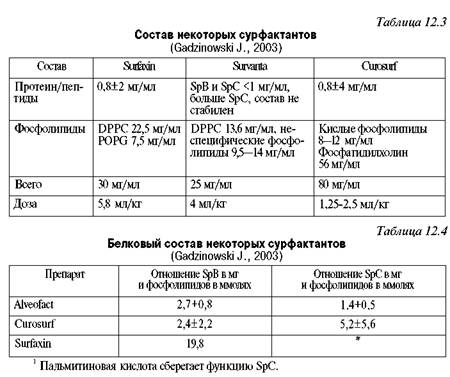
Trenutno koriste i prirodne surfaktante dobijene iz pluća goveda (domaći BL-surfaktant, razvijen u Sankt Peterburgu od strane prof. O.A. Rosenberga, strani - Survanta, Alveofact, Infrasurf), svinja (Curosurf), i sintetičke (ALEK, Exosurf , Surfaxin, "Sfenticute". Najefikasniji prirodni surfaktanti sadrže pored fosfolipida i surfaktant protein B (tabele 12.3, 12.4). Treba naglasiti da lek Surfaxin, koji je u SAD razvio laboratorija Discovery, sadrži kombinaciju fosfolipida (dipalmitilfosfatidilholin - DPPC, palmitil oleil fosfatidilglicerol - POPG, palmitinska kiselina - P A) i rekombinantnog, sintetičkog peptida koji se sastoji od fragmenata aminokiselina lizina (K) i leucina (LKLLCLL) u sekvenci recombinant KLLKLLKLL peptid ima svojstva surfaktant proteina B. Enticute sadrži rekombinantni surfaktant protein C.
Brojne randomizirane studije su pokazale da egzogeni surfaktant potiče:
povećanje plućne usklađenosti i funkcionalnog rezidualnog kapaciteta, čime se smanjuje rad respiratornih mišića;
smanjenje tokom mehaničke ventilacije Fio2 (udio kiseonika u udahnutom vazduhu), PIP (vršni inspiratorni pritisak), MAP (srednji pritisak u disajnim putevima), PEEP (pozitivni krajnji ekspiratorni pritisak), poboljšanje indeksa oksigenacije alveolokapilarnog gradijenta kiseonika;
smanjenje mortaliteta u SDR-u (njegova profilaktička upotreba je posebno efikasna kod djece s periodom trudnoće kraćim od 30 sedmica kada se kombinira
uz antenatalnu primjenu kortikosteroida), sindrom aspiracije mekonija, SDR odraslog tipa;
skraćivanje vremena mehaničke ventilacije i smanjenje učestalosti neželjenih efekata mehaničke ventilacije (sindromi curenja vazduha i sl.);
smanjenje incidencije MDD, IVH, retinopatije;
Ne inhibira sintezu endogenog surfaktanta.
Treba napomenuti da su prirodni surfaktanti efikasniji od sintetičkih, ali mogu biti antigeni; osim toga, oni su manje stabilni u sastavu, zahtijevaju strože uslove skladištenja i imaju ograničeniji rok trajanja i potencijalno mogu sadržavati prionske agense.
Imamo iskustva sa upotrebom lekova Curosurf i Exosurf u Dečjoj bolnici br. 1 (Sankt Peterburg). Oba lijeka su imala gore navedene efekte. Međutim, nakon uvođenja Curosurfa, Fio2, PIP, MAP bi se mogli smanjiti za otprilike 30% nakon 3-3,5 sata, dok nakon uvođenja Exosurf-a - tek nakon 6 sati. Nakon primjene Curosurfa, uočeno je smanjenje plućnog vaskularnog otpora, smanjenje postopterećenja desne komore i povećanje predopterećenja lijeve komore. Istovremeno je došlo do smanjenja alveolarno-kapilarne razlike u napetosti kiseonika i poboljšanja indeksa oksigenacije. Nažalost, randomizirano komparativne studije Domaći BL surfaktant se ne koristi, a nemamo iskustva u njegovoj upotrebi, ali znamo od naših kolega da je mnogo manje efikasan za teške SDR od Curosurfa.
Prema profesoru J. Gadzinowskom (2003), u multicentričnim evropskim komparativnim randomiziranim studijama (u njima učestvuju i neonatolozi iz Sankt Peterburga, ali studija je dvostruko slijepa i još ne znamo svoje rezultate) profilaktička upotreba Surfaxin, Exosurf i S u r v a n t a kod djece s porođajnom težinom manjom od 1 2 5 0 g, prvi lijek je bio učinkovitiji, što, po njegovom mišljenju, može biti posljedica ranijeg poboljšanja oksigenacije (već nakon nekoliko minuta, dok se nakon upotrebe drugih surfaktantnih preparata to primjećuje nakon 3-6 sati), dugotrajniji učinak zbog otpornosti sintetičkog lijeka Surfaxin na inhibiciju komponenti seruma i oksidansa.
Nuspojave i komplikacije terapije surfaktantima su uglavnom jatrogeni. U nedostatku adekvatnog praćenja i varijacije parametara mehaničke ventilacije, može doći do razvoja barotraume i plućne volutraume, sindroma curenja zraka, plućne hemoragije, hiperoksije, a time i retinopatije nedonoščadi, plućne hemoragije, IVH. Možda jedino što su primijetili mnogi istraživači u gotovo svim centrima je povećanje učestalosti funkcioniranja ductus arteriosus i napada apneje nakon upotrebe egzogenog surfaktanta. Učestalost funkcionalnog ductus arteriosus kod djece liječene Curosurf-om u našim opservacijama iznosila je 7,6%.
Najefikasnija profilaktička primjena surfaktanta je pri rođenju ili u prvih 15-30 minuta života. Doza namijenjena za primjenu se prethodno zagrije (unutar 1 sata do 37°C) i ulije kroz endotrahealnu cijev u traheju u 4 doze u trajanju od 1 0 - 1 5 minuta ili mikromlazom pomoću infuzera preko 2 0 - 3 0 minuta, sa sledećim m infuzija menja položaj deteta. Ako je potrebno, infuzije se ponavljaju nakon 12 sati.Nisu zabilježene ozbiljne nuspojave. Smatra se izuzetno važnim što je ranije moguće prekinuti mehaničku ventilaciju i prebaciti dijete na p SRA R. Kao rezultat ove generalno preventivne terapije, učestalost i težina SDR su značajno smanjene. Terapija površinski aktivnim tvarima već razvijenih SDR-a ili pneumonije mnogo je manje učinkovita od preventivnog liječenja. Istovremeno, izuzetno je važno prije davanja bilo kojeg surfaktanta stabilizirati stanje djeteta i, ako je moguće, ispraviti osnovne vitalne parametre. Nakon primjene lijeka potrebno je pažljivo praćenje, uključujući: parametre mehaničke ventilacije, Fio2, vizuelnu analizu učešća pomoćnih mišića u činu disanja, transkutanu analizu saturacije (Brog), puls, ADC, CBS, grudni koš radiografija prije i 3-6 sati nakon primjene. Opet, potrebno je fleksibilno varirati parametre I V L i F 1 0 2, izbjegavajući barotraumu i volumatsku traumu pluća, te hiperoksiju. S p o 2 se mora održavati u rasponu od 9 0 - 9 4%, što sprečava hiperoksiju. Preporučljivo je ne usisavati sadržaj traheje 3 do 6 sati nakon primjene surfaktanta.
Zatvaranje otvorenog ductus arteriosus se smatra medicinskim kod djece sa SDR prema ehokardiografiji i dopler studijama 4.-5. dana života. Taktike za upotrebu indometacina ili brufena opisane su u poglavlju XIX.
Antibiotska terapija. Kada se postavi dijagnoza SDR, čak i ako se sumnja, ampicilin se propisuje u kombinaciji s jednim od aminoglikozida (obično gentamicinom). To je zbog, s jedne strane, činjenice da se streptokokna B infekcija manifestira oštećenjem pluća, koje se ne razlikuje (čak i često radiološki) od SDR-a, as druge strane, prevođenjem pacijenta na mehaničku ventilaciju, što je često praćeno infekcijom. Međutim, 3 dana nakon dobijanja rezultata hemokulture i kliničkih analiza krvi tokom vremena, potrebno je odlučiti o prisutnosti infekcije i, ako je nema, prekinuti uzimanje antibiotika.
Vitaminoterapija. Nije potvrđeno mišljenje da profilaktička primjena vitamina E smanjuje učestalost bronhopulmonalne displazije. Pa ipak, indikovana je primjena vitamina E intramuskularno u dozi od 10 mg/kg dnevno kada se koristi mješavina kisika i zraka s Fio2 većim od 0,4, jer to smanjuje učestalost i težinu retinopatije nedonoščadi. Kurs 7 - 10 injekcija. Vitamin A, koji se daje enteralno po 2000 jedinica svaki drugi dan, treba dati svoj djeci prije enteralne ishrane, jer se time smanjuje incidenca nekrotizirajućeg enterokolitisa i bronhopulmonalne displazije.
Diuretici. Iako primjena furosemida povećava diurezu i poboljšava stanje pluća, ona povećava učestalost otvorenog duktus arteriozusa, kalcifikacija u bubrezima i diselektrolitimije, pa se stoga ne može smatrati rutinskom. Furosemid se propisuje samo za plućni edem i edematozni sindrom.
Glukokortikoidi. Odustalo se od planirane primjene glukokortikoida i njihovih derivata (najčešće se koristio deksametazon jer ima maksimalno tkivno djelovanje) za stimulaciju sinteze surfaktanta kod sve djece sa SDD. To je zbog uvoda u terapiju i sekundarna prevencija SDR preparata surfaktanata, unapređenje metoda respiratorne podrške, mehaničke ventilacije, kao i nuspojave terapija glukokortikoidima, od kojih su glavni, čak i uz kratak kurs,: hiperglikemija, arterijska hipertenzija, gastrointestinalno krvarenje, nekrotizirajuće entero i druge infekcije. Glukokortikoidi se propisuju pacijentima sa SDR koji, prema kliničkim i laboratorijskim podacima, imaju insuficijenciju nadbubrežne žlijezde.
Mnogi neonatolozi u inostranstvu su došli do zaključka da primena deksametazona za postintubacioni edematozni laringitis ili traheitis sa teškom stenozom ima pozitivan efekat. Neonatalni formular (BMJ, 2000) preporučuje davanje 4 doze od 200 mcg u intervalima od 8 sati, s tim da se prva doza daje 4 sata prije ekstubacije kod djece s edemom ili traumom larinksa.
Hormoni štitnjače za liječenje djece sa SDD počeli su se aktivno koristiti u nekim neonatalnim klinikama, na osnovu učestalog otkrivanja nizak nivo hormoni štitnjače kod veoma prevremeno rođene dece sa GBM. Međutim, ne postoje općeprihvaćeni podaci zasnovani na rezultatima randomiziranih studija koji neosporno dokazuju korist takvog recepta, te se stoga radi o ispitivačkoj terapiji. Intra-amnionska upotreba L-tiroksina kod visokorizičnih trudnica je opravdanija prevremeni porod, ali ni ovdje nema općeprihvaćenih shema i općeprihvaćenih rezultata.
Riboksin i inozitol, koji se propisuju intragastrično svakih 6 sati u dozi od 40 mg/kg od kraja prvog do 10. dana života, prema M. Hallman al. (1986-1989), smanjuju ozbiljnost SDR, povećavaju sintezu surfaktanta i smanjuju incidencu bronhopulmonalne displazije. Međutim, ova metoda, kao i planirana primjena plazminogena prijevremeno rođenoj novorođenčadi, je istraživačka metoda za liječenje djece sa SDD.
Prognoza SDR-a ovisi o njegovoj težini i prisutnosti prateća patologija, komplikacije terapije. Stopa mortaliteta djece s porođajnom težinom većom od 1 0 0 0 g uz racionalno upravljanje ne prelazi 5 - 1 0 %. U prvoj godini života djeca koja su oboljela od SDR često obolijevaju od upale pluća, a povećana je i incidencija sepse. Encefalopatija (posthipoksična) je jedno od karakterističnih pratećih stanja (ili komplikacija) kod djece sa SDD, a kod neke djece jasno se identifikuju tek u predškolskom i školskog uzrasta u obliku minimalne moždane disfunkcije, poremećaja ponašanja i poteškoća u učenju. S tim u vezi, u sistemu rehabilitacionih mera za decu sa SDD, potrebno je predvideti ranu primenu (od 3. - 4. dana) lekova koji poboljšavaju trofizam mozga (gliatilin 1 0 - 1 5 mg/kg/dan, nootropil 50 mg/kg intravenozno ili oralno 2-3 puta dnevno), nadzor neurologa.
Prevencija. Antenatalna hormonska terapija. Primjena intramuskularno ili oralno majci u slučaju opasnosti od prijevremenog porođaja u gestacijskoj dobi 2 4 - 3 4
betametazon u dozi od 12 mg (2 puta sa razmakom od 24 sata) ili
Deksametazon 6 mg 4 puta sa intervalom od 12 sati.
Optimalno je da period između završetka hormonske terapije i porođaja bude više od 24 sata.Učinak takvog recepta traje 10 dana, a ako ne dođe do porođaja, jednokratna primjena deksametazona u dozi od 6- Indicirano je 12 mg.
Antenatalni tok kortikosteroida dovodi ne samo do smanjenja učestalosti i težine DR, već i smanjuje rizik od razvoja sindroma otvorenog ductus arteriosus, intraventrikularnih krvarenja, periventrikularne leukomalacije, nekrotizirajućeg enterokolitisa, trajanja i troškova njege vrlo prevremeno rođenog novorođenčeta. .
Dugoročne studije praćenja pokazale su da je tok prenatalnog hormonska terapija ne povećava frekvenciju zarazne bolesti kod novorođenčadi, ne utječe na kasniji fizički i psihomotorni razvoj (uključujući brzinu povećanja obima glave), kao ni na rast pluća, ne uzrokuje disfunkciju nadbubrežnih žlijezda, vida ili sluha.
Trenutno, testiranje za praktična primjena sheme za uvođenje trijodtironina u amnionsku tekućinu, a optimalno - tirotropin-oslobađajući hormon (TRH). TRH preparati eksperimentalno i pod ograničenim uslovima kliničkim ispitivanjima pokazalo se da je veoma efikasan u prevenciji SDR. Međutim, dvije velike multicentrične studije provedene u SAD-u nisu pokazale nikakvu korist od kombinacije. profilaktička upotreba kortikosteroidi za trudnice u kombinaciji sa hormonima štitnjače i/ili TRH (Ballard R.A. et al., 1998).
Odgađanje porođaja je korisno, jer ako bezvodni interval traje duže od 2 dana, SDR se obično ne razvija, iako se kod takve djece češće uočavaju sepsa i vjerovatno intrakranijalna krvarenja.
Nadomjesna terapija egzogenim surfaktantima u prvih 30 minuta života (vidi gore) je vrlo učinkovita metoda prevencije teškog SDR-a.
Pojmovi “respiratorni distres sindrom” (RDS), “respiratorni distres sindrom” (RDS) i “bolest hijalinskih membrana” (HMD) su sinonimi u stranoj literaturi. Na primjer, u najpopularnijim neonatološkim priručnicima u Sjedinjenim Državama termini se koriste za opisivanje istog stanja (bolesti): u 7. izdanju Averyjeve bolesti novorođenčeta (1998.) - bolest hijaline membrane, au 7. izdanju knjige Neonatalno-perinatalna medicina (Ed. A.A.Fanaroff i R.J.Martin, 2002) - sindrom respiratornog distresa Mi preferiramo termin „sindrom respiratornog distresa“.
Učestalost razvoja SDR u prosjeku zavisi od stepena nedonoščadi novorođenčeta i iznosi u prosjeku 82-88% za rođenje djeteta u periodu gestacije kraćem od 27 sedmica, 78-80% - u periodu od 27-28 nedelja, 70% - u periodu od 29 -30 nedelja, 50-55% - u periodu od 31-32 nedelje, 20-22% - u periodu od 33-34 nedelje, 5-10% - u periodu od 35-36 nedelja. i manje od 1-2% - u gestacijskoj dobi od 37 sedmica. i više.
HDM (tip I SDR, RDS) i njegove posljedice uzrok su 30-50% neonatalnih smrti.
Etiologija. Uzročni faktori za razvoj HD su:
nedostatak stvaranja i oslobađanja surfaktanta;
nedostatak kvaliteta surfaktanta;
inhibicija i uništavanje surfaktanta; "
nezrelost strukture plućnog tkiva.
Sve ove procese olakšavaju:
nedonoščad;
intrauterine infekcije;
perinatalna hipoksija, asfiksija i plućna ishemija uzrokovana njima
i acidoza;
dijabetes majke;
akutni gubitak krvi tokom porođaja.
Osim toga, incidencija HD je povećana kod djece sa:
intraventrikularne hemoragije i općenito periventrikularne lezije koje su se javile prije i za vrijeme porođaja;
prolazna hipofunkcija štitne žlijezde i nadbubrežne žlijezde;
hipovolemija;
hiperoksija;
hlađenje (kako tokom opšteg hlađenja, tako i prilikom udisanja nezagrejane mešavine kiseonika i vazduha);
rođen uz pomoć carski rez;
kod drugog blizanca blizanaca.
Akutni perinatalni stres, posebno produženje porođaja, može smanjiti učestalost i/ili težinu BGM-a. Time postaje jasno zašto je faktor rizika za razvoj HD elektivni carski rez, a povećanje trajanja anhidrovanog intervala smanjuje rizik od HD.
Patogeneza. Vodeća karika u patogenezi SDRI tipa (HD) je kvantitativni nedostatak i kvalitativni defekt surfaktanta.
Surfaktant je surfaktant koji sintetiziraju alveolociti tipa II (koji pokrivaju oko 3% površine alveola) i bronhiolarne ćelije bez dlake (Clara ćelije). Sastoji se od 90% lipida, od kojih su 80% fosfolipidi: fosfatidilholin (lecitin) - 70% (45-50% - oksidirani, zasićeni i 20-25% - nezasićeni), fosfatidilglicerol - 6% i ostali fosfolipi -6%; 8% - neutralni lipidi. 8-10% suhe težine surfaktanta čine proteini: proteini A, B, C, D.
Surfaktant ima sljedeće glavne funkcije:
sprečava kolaps alveola tokom izdisaja;
štiti alveolarni epitel od oštećenja i potiče mukocilijarno čišćenje;
ima baktericidno djelovanje protiv gram-pozitivnih mikroba i stimulira reakciju makrofaga u plućima;
učestvuje u regulaciji mikrocirkulacije u plućima i propusnosti zidova alveola, sprečava nastanak plućnog edema.
Važnu ulogu u obavljanju ovih funkcija surfaktanata igraju proteini, od kojih su A (SpA) i D (SpD) - hidrofilni - uključeni u zaštitne mehanizme djetetovog organizma (ne nalaze se u životinjskim plućnim surfaktantima), te proteini B (SpB) i C (SpC) - hidrofobni - smanjuju površinsku napetost alveola stimulacijom apsorpcije fosfolipida na površini vazdušne barijere i pospješuju ravnomjernu raspodjelu surfaktanta na površini alveola (sadržanog u dobivenim surfaktantima iz životinjskih pluća). Geni koji određuju sintezu surfaktantnih proteina SpA i SpD nalaze se na 10. hromozomu, SpB na 2. i SpC na 8. hromozomu. SpA se pojavljuje u ljudskoj amnionskoj tečnosti u 19. nedelji gestacije, a SpB u 31.; u budućnosti njihov nivo se stalno povećava.
Štaviše, prema modernim konceptima, najvažniji među ovim proteinima je surfaktant protein B, jer je njegov nasledni ili urođeni nedostatak smrtonosan za ljude (de Mello D.E. et al., 1994; Nogee L.M., 1995; Chetcuti PAJ., Ball R.J., 1995). Nedostatak SpB nasljeđuje se aitosomno recesivno i manifestira se kod donošene novorođenčadi sa kliničkom slikom tipične SDD nedonoščadi sa dugotrajnom potrebom za mehaničkom ventilacijom. Nadomjesna terapija životinjskim surfaktantima ima samo prolazan učinak. Mogući tretman je transplantacija pluća.
Sintezu surfaktantnih proteina stimulišu glukokortikoidi, tiroidni hormoni, estrogeni, adrenalin i norepinefrin, a inhibiraju je insulin.
Surfaktant počinje da se proizvodi u fetusu od 20-24 nedelje intrauterinog razvoja alveolarnim ćelijama tipa II. Akumulira se u njima u obliku osmiofilnih granula koje migriraju na površinu alveola, gdje u hipofazi formira tanak film. Posebno intenzivno oslobađanje surfaktanta dolazi u vrijeme rođenja, što doprinosi procesu primarne ekspanzije pluća. Poluživot surfaktanta je 10-20 sati.
Postoje dva puta za sintezu glavne fosfolipidne komponente – fosfatidilholina (lecitin): 1) metilacija fosfatidiletanolamina (kefalina) pomoću metiltransferaze (izvor metil grupe je metionin); 2) sinteza iz citidin difosfat holina u prisustvu fosfoholin transferaze, koja reaguje sa digliceridom. Utvrđeno je da se do 33-35. sedmice intrauterinog razvoja sinteza surfaktanta uglavnom odvija metilacijom etanolamina, a kasnije fosfatidilholin transferazom.
Prvi put sinteze surfaktanta lako se iscrpljuje pod utjecajem hipoksije, acidoze i hipotermije. Stoga se vjeruje da surfaktantni sistem u potpunosti sazrijeva do 35-36. sedmice intrauterinog razvoja. Kod djeteta rođenog prije ovog perioda raspoložive rezerve surfaktanta osiguravaju početak disanja i formiranje funkcionalnog rezidualnog kapaciteta pluća, ali zbog zaostajanja u sintezi surfaktanta od brzine njegovog raspada dolazi do manjka ove tvari. , što dovodi do kolapsa alveola pri izdisaju, naglog povećanja rada respiratornih mišića, jer zbog nestabilnog funkcionalnog rezidualnog kapaciteta pluća i njihove povećane „ukočenosti“, napori potrebni za svako naredno naduvavanje pluća treba da budu ista kao kod prvog udisaja. Osim toga, zbog kolapsa alveola, ne dolazi do kontinuirane izmjene plinova u plućima, što izaziva razvoj hipoksemije i hiperkapnije.
Pojasnimo da, zajedno sa fosfatidilkolinom za normalno funkcionisanje surfaktant, njegove ostale komponente su također važne, posebno fosfatidilglicerol i fosfatidilinozitol. Na primjer, u ispiranjima iz pluća djece umrle od SDR i rođenih od majki sa dijabetesom, količina lecitina i sfingomijelina i odnos između njih su normalni, ali postoji manjak fosfatidil glutena. S druge strane, kod veoma nedonoščadi sa niskim nivoom lecitina u amnionskoj tečnosti, ali normalnim sadržajem fosfatidilglicerola, SDR se ne razvija. U SDR-u, osim nestanka fosfatidilglicerola iz surfaktanta, smanjuje se količina zasićenog fosfatidilholina u njemu i povećava sadržaj fosfatidilserina i sfingomijelina.
Smanjite sintezu surfaktanta:
„povrede od hladnoće, uključujući upotrebu nezagrejane mešavine kiseonika i vazduha tokom mehaničke ventilacije;
patološka acidoza;
hipovolemija;
policitemija;
hipoksemija;
hiperoksija;
barotrauma i volutrauma pluća;
infekcije, i ante-, intra- i postnatalne. Navedeni faktori oštećuju alveole, aktiviraju sintezu proinflamatornih citokina, sistem komplementa i hemokina (anafilotoksini, bradikinin i dr.), što dovodi do povećane permeabilnosti endotela i alveolarnog edema.
Inaktivaciju surfaktanta i njegovo uništavanje pospješuju:
infekcije (posebno gram-negativne, mikoplazma);
proteini plazme koji su "procurili" u alveole;
patološka acidoza;
višak oksidansa, peroksidnih spojeva, proinflamatornih citokina.
Važan predisponirajući faktor za razvoj SDR je nezrelost pluća kod fetusa koja su se razvila u nepovoljnim uslovima. Histološki, nezrelost pluća se očituje širokim slojevima intersticijalnog tkiva u acinusima, smanjenjem broja alveolarnih kanala i alveola, nepotpunom diferencijacijom acinusa i labavim prilijeganjem kapilara u alveole. U plućima djece umrle od SDR-a mogu se istovremeno pojaviti atelektaze, hijaline membrane i edematozno-hemoragijske promjene na različitim područjima.
Hijalinske membrane sastoje se od fibrinskog matriksa i staničnih ostataka - krajnjeg proizvoda fragmenata krvnih stanica i oštećenog epitela. Period poboljšanja SDR-a karakterizira regeneracija zidova alveola, alveolocita, uključujući pneumocite tipa II i, kao rezultat, povećanje sinteze surfaktanta. Hijalinske membrane same po sebi ne uzrokuju razvoj atelektaze. Kod neke djece, klinički i patomorfološki (u slučaju smrti), izrazito su dominantne manifestacije bolesti hijaline membrane, odnosno primarne atelektaze i edematozno-hemoragični sindrom. Stoga je pojam “sindrom respiratornog distresa” vjerovatno sada popularniji u inostranstvu od “bolesti hijalinskih membrana”.
Provocirajući faktori za ispoljavanje nedostatka surfaktanta u obliku BHM su:
aspiracija amnionske tečnosti mekonijumom (deca od majki koje su patile od dugotrajne - više od 4 nedelje - gestoze);
edematozno-hemoragični plućni sindrom (povećani faktori rizika su perinatalna hipoksija, posebno mješovitog porijekla, zatajenje srca, nedostatak prokoagulanata čija sinteza ovisi o vitaminu K, fibrinogenu, kvantitativnom i kvalitativnom defektu trombocitne komponente hemostaze);
nedostatak plazminogena, a time i niska aktivnost fibrinolize;
nedovoljna aktivnost antiproteaza (oc-antitripsin i ag-makroglobulin, antitrombin III, itd.);
dekompenzirani DIC sindrom.
Pacijenti sa SDR razvijaju:
smanjena usklađenost, plućna usklađenost i funkcionalni rezidualni kapacitet;
smanjenje minutne plućne ventilacije i iskorištenja (transporta) kisika u plućima;
pojačan rad disanja;
teška hipoksemija i hipoksija; hiperkapnija;
mješovita (respiratorno-metabolička) acidoza;
smanjena sinteza fosfolipida i surfaktantnih proteina;
izgovoreno plućna hipertenzija i sistemska hipotenzija;
smanjen efektivni plućni protok krvi;
hipovolemija, poremećaji mikrocirkulacije, periferni edemi, tj. fenomeni šoka;
kompenzirana ili dekompenzirana difuzna intravaskularna koagulacija (kompenzirani ili dekompenzirani DIC sindrom);
metabolički poremećaji (hipoproteinemija, sklonost hipoglikemiji, hipokalcemija, ali hiperkalijemija, itd.);
mišićna hipotenzija;
poremećaji funkcionalnog stanja mozga prvenstveno zbog HIE;
disfunkcija miokarda sa zatajenjem srca (uglavnom tipa desne komore sa šantovima zdesna nalijevo);
temperaturna nestabilnost sa tendencijom hlađenja, posebno zbog njihove karakteristične prolazne hipotiroksinemije;
loša bubrežna i periferna perfuzija sa oligurijom, edemom;
funkcionalna opstrukcija crijeva (dijagram 12.1).
Klinička slika. Prvi znak razvoja tipa I SDR (DMS)
je otežano disanje (više od 60 udisaja u minuti), koji se u slučaju bolesti hijalinske membrane i edematozno-hemoragičnog sindroma obično manifestira u prvom satu nakon rođenja, a kod primarne atelektaze - u prvim minutama života. Pojava kratkoće daha 3 sata nakon rođenja i kasnije nije tipična za BGM. Boja djetetove kože kada se pojavi kratak dah je normalna. Razlog zbog kojeg se otežano disanje u SDR javlja na pozadini ružičaste kože je veći afinitet fetalnog hemoglobina za kisik. Hipoksemijom se smatra smanjenje Pao2 u krvi na 8,67 kPa (65 torr, ili mm Hg). Cijanoza se kod novorođenčadi javlja pri nivou Pao2 u krvi od 4,27-5,87 kPa (32-44 mm Hg), a kod odraslih - 5,6-6,93 kPa (42-52 mm Hg). Slijedom toga, kod blage hipoksemije, boja kože novorođenčeta može biti ružičasta, ali zbog iritacije vaskularnih hemoreceptora dijete već razvija otežano disanje.
Sljedeći simptom su zvukovi izdisaja koji se nazivaju "grublji izdisaj". Ekspiratorni šumovi su uzrokovani činjenicom da se u početnim fazama SDR-a razvija grč glotisa pri izdisaju kao kompenzacijski mehanizam (disanje tipa dahta), koji pomaže povećanju funkcionalnog rezidualnog kapaciteta pluća i sprječava kolaps pluća. alveole. Uz naglo opuštanje epiglotisa, prolaz zraka pod povećanim pritiskom u respiratornom traktu ispod glasnica uzrokuje ekspiratornu buku.
Recesija grudnog koša tokom inspiracije (povlačenje xiphoid process sternum, epigastrična regija, interkostalni prostori, supraklavikularne jame) je treći znak SDR u smislu vremena pojavljivanja.
(l
I
ja i
Šema 12.1. Patogeneza respiratornog distres sindroma: IUI - intrauterine infekcije; DIC - diseminirana intravaskularna koagulacija. Istovremeno ili nešto kasnije, napetost krila nosa, napadi apneje, cijanoza (perioralna, a kasnije akrocijanoza ili generalizovana) na pozadini bljedila kože, oticanje obraza ("trubačko" disanje), rigidni srčani ritam, paradoksalno disanje (povlačenje prednjeg trbušni zid na inspiraciji), pjena na ustima (kod polovine pacijenata), oticanje šaka i stopala. Tipičan je ravni sanduk (u obliku kutije šibica).
Auskultacijom u prvim satima života, preko pluća se čuje oštro oslabljeno disanje, zatim, na pozadini mehaničke ventilacije, čuju se obični, normalni respiratorni zvuci, a tek kasnije se javljaju visoki suhi hripovi pri udisanju i izdisanju, krepitacija i fini mjehurasti hripavi.
Tipični uobičajeni simptomi su:
temperaturna nestabilnost sa tendencijom hipotermije;
letargija, nedostatak pokreta, znaci depresije centralnog nervnog sistema do adinamije, letargija pa čak i kome (zapamtite mogućnost hipoglikemije, hiperamonemije!);
periferni edem potkožnog tkiva;
hiporefleksija i hipotonija mišića;
hipovolemija i arterijska hipotenzija;
oligurija;
regurgitacija, nadimanje, pa čak i znakovi crijevne opstrukcije;
veliki gubici početne tjelesne težine;
Donji ekstremiteti su često u “žabljem položaju” (kao kod ozljede lumbalnog dijela kičme).
Često se bolesnom djetetu dijagnosticira intraventrikularna hemoragija (IVH), obično stepena I-II, ili ultrazvučni znaci periventrikularne leukomalacije (PVL). Kod određenog djeteta ponekad je teško odlučiti šta je primarno – oštećenje pluća (SDR) ili mozga (IVH, PVL). Kako SDR napreduje, unatoč intenzivnoj terapiji, razvijaju se znaci šoka i dekompenziranog DIC-a, uključujući krvarenje s mjesta injekcije, plućno krvarenje itd.
Silverman je predložio skalu za procjenu težine respiratornih poremećaja kod novorođenčadi (Tabela 12.1).
Svaki simptom u koloni “I faza” boduje se 1 bod, u koloni “Stadijum II” - 2 boda. Posebnost skale je da ne uzima u obzir znakove respiratorne insuficijencije kao što su otežano disanje i cijanoza, jer pojava ovih simptoma kod novorođenčeta može biti posljedica i neplućnih uzroka respiratornih poremećaja. Prema Silvermanu, sa ukupnim rezultatom od 10 bodova, novorođenče ima izuzetno tešku SDR, 6-9 bodova - tešku, 5 bodova - umjerene težine, ispod 5 - početni SDR.
Auskultatorni i perkusioni podaci u početnom periodu SDR-a nisu demonstrativni, ali kasnije, na pozadini oslabljenog disanja, pojavljuju se raštrkani crepitirajući i tihi fino-mjehurasti hripi.
Kardiovaskularni poremećaji su vrlo tipični za SDR. U početku se razvija tahikardija i prigušeni srčani tonovi. Daljnje promjene određene su težinom plućne hipertenzije i hemoreološkim poremećajima. Silverman Scale Stage 0 Stage I Stage II Gornji dio grudni koš (sa djetetom pozicioniranim na leđima) i prednji trbušni zid sinhrono učestvuju u činu disanja Nedostatak sinhronije ili minimalno spuštanje gornjeg dijela grudnog koša kada se prednji trbušni zid podiže za vrijeme inspiracije Primetna depresija gornjeg dijela grudnog koša pri podizanju prednjeg trbušnog zida na inspiraciji Nema povlačenja interkostalnih rebara na udisanje pluća retrakcija međurebarnih prostora tokom inspiracije Primetno povlačenje međurebarnih prostora tokom inspiracije Nedostatak retrakcije mesnog nastavka grudne kosti tokom udisaja Lagana retrakcija meksifoidnog nastavka grudne kosti tokom udisaja Primetna retrakcija meksifoidnog nastavka grudne kosti tokom udisaja Absence pomeranje brade tokom disanja Spuštanje brade pri udisanju, zatvorena usta Spuštanje brade pri udisanju, otvorena usta Nema buke pri izdisanju. Čuju se šumovi pri izdisanju („ekspiratorno gunđanje”) tokom auskultacije grudnog koša Čuju se šumovi pri izdisaju („ekspiratorno gunđanje”) kada se fonendoskop prinese ustima ili čak i bez fonendoskopa Plućna hipertenzija dovodi do perzistiranja fetalnih šantova i šantiranja zdesna nalijevo ductus arteriosus i foramen ovale.
Zbog povećane vaskularne permeabilnosti, uočava se hipovolemija, zgušnjavanje krvi i povećanje hematokritnog broja i koncentracije hemoglobina. Kada su kompenzatorni mehanizmi iscrpljeni, krvni pritisak se smanjuje i razvija se 3. stadijum šoka.
Još jedna komplikacija SDR-a može biti šant lijevo-desno (kroz otvoreni ductus arteriosus), što je posljedica prebrze ekspanzije pluća nakon rođenja ili mehaničke ventilacije. Tipično, takva djeca pokazuju znakove hipoksije i zagušenja u plućima krajem prve - početkom druge sedmice života povećava se pulsni pritisak, čuje se sistolno-dijastolni šum na krvnim žilama.
Diferencijalna dijagnoza sindroma perzistentne fetalne cirkulacije i otvorenog duktusa arteriozusa prikazana je u tabeli 12.2.
Raslojavanje sekundarne infekcije predstavlja ozbiljnu opasnost za djecu sa SDD; upala pluća se razvija kod 40-50% pacijenata.
Trenutni SDR. Kod SDR-a umjerene težine i njegovog nekomplikovanog toka, maksimalna ozbiljnost stanja se uočava prvog dana života, a zatim intenzitet povlačenja grudne kosti, retrakcije međurebarnih prostora, kao i napadi apneje, otekline. , a oligurija se postepeno smanjuje. Povećavaju se diureza, mišićni tonus i spontana motorička aktivnost, poboljšava se neurološki status, a smanjuje se potreba za kisikom i mehaničkom ventilacijom. Ako bolest nije komplikovana intraventrikularnim krvarenjem, periventrikularnom leukomalacijom, intersticijskim emfizemom i drugim vrstama „propuštanja zraka“, perzistentna plućna
Tabela 12.2
Diferencijalni dijagnostički znaci sekundarnih sindroma uzrokovanih funkcionalnim ductus arteriosus Znak Sindrom perzistentne fetalne cirkulacije (desno-lijevi šant) Sindrom otvorenog ductus arteriosus (lijevo-desni šant) Asfiksija i aspiracija tokom porođaja Tipično Nije tipično Mehanička ventilacija u prvim satima života Svibanj biti Tipična atelektaza pluća Tipična Rijetko Ponavljajuća apneja na kraju prve - početkom druge sedmice života Može biti tipična Generalizirana cijanoza U prvim danima života sa nijansom trešnje Krajem prve - u drugoj sedmici života, sa mramornom nijansom Diferencirana cijanoza (uglavnom nogu) Tipično Nije tipično Reakcija na disanje 100% kiseonika Poboljšanje se, po pravilu, ne primećuje, Pao2 ostaje ispod 9,33 kPa Poboljšanje, Pao postaje veći od 10,67 kPa u kapilari krv iz ruku, Pao je 1,33 kPa, a pH je 0,02 viši nego u krvi noge Tipično nekarakteristično Obilje hripanja pri udisanju, ružičasta pjena Nije tipično, ali se može javiti u prvim danima života Tipično za kraj prvog sedmica života i stariji Puls Slab i mali Veliki i brz, galopirajući Krvni pritisak Povećan ili snižen Pojačan puls sa niskim dijastolnim Granica srca Umjereno proširena, pretežno udesno Proširena, pretežno lijevo, Herhartova pruga Veličine jetre Obično ne naglo povećana naglo povećana RTG organa grudnog koša Atelektaza, pneumonija, nodozno-retikularna mreža, srce prošireno prvenstveno udesno, konture njegove neravnine, osiromašenje plućne cirkulacije. U III stadijumu - plućni edem U početku se povećava dotok krvi u pluća, oticanje centralnog, a zatim perifernog polja pluća. Srce je uvećano pretežno lijevo i prema gore.Šum u predelu srca često izostaje ili je sistolni u drugom interkostalnom prostoru lijevo od grudne kosti.Tipični su elektrokardiografski znaci preopterećenja desnog dijela srca. Tipičan je sistolni i dijastolni šum, sistolni šum može biti prisutan ili odsutan.
Na EKG-u se prvo javlja preopterećenje lijevog, zatim desnog dijela srca
Tabela 12.2 (nastavak)
Znak Sindrom perzistentne fetalne cirkulacije (desno-lijevi šant) Sindrom duktus arteriozusa (lijevo-desni šant) Ultrazvučni pregled srca (indeks: lijevi atrijum - aorta) Manje od 1,0 Više od 1,3 Klinički učinak liječenja Srčani glikozidi Može doći do pogoršanja hemodinamike Pozitivan tolazolin (u venu glave) Poboljšanje Pogoršanje Indometacin Nema promjena Poboljšanje Droperidol Nešto poboljšanja Pojačana buka
hipertenzije, tada se do sredine prve nedelje života dete prvo prebacuje na IVL (nazalne kanile), a zatim samostalno diše, hrani se enteralno,
Ali.
Kod djece s porođajnom težinom manjom od 1500 g, SDR se obično javlja sa dolje navedenim komplikacijama (jedna ili više), a zatim se mehanička ventilacija odgađa, ponekad i po nekoliko sedmica. Tipične komplikacije kod djece sa SDD. Sistem:
dekompenzovana teška acidoza, šok mešovitog porekla, dekompenzovani DIC sindrom;
intraventrikularna krvarenja;
otvoreni ductus arteriosus;
sindrom perzistentne fetalne cirkulacije;
sindrom otvorenog ductus arteriosus;
prolazna hiperamonemija;
hipoglikemija;
nekrotizirajući enterokolitis;
retinopatija nedonoščadi;
zatajenje bubrega. Lokalni, plućni:
sindromi curenja zraka;
plućni edem;
upala pluća;
krvarenja u plućima;
bronhopulmonalna displazija;
poremećaji povezani s nepravilnim položajem ili blokadom respiratornih cijevi, lezije larinksa i traheje (suženje subglotičnog prostora, edem, stenoza, erozija, granulom).
Zbrinjavanje pacijenata sa GBM zahtijeva od neonatologa da spoji duboko poznavanje starosne fiziologije, algoritama intenzivne njege i ovladavanje umijećem stalne analize dinamike kliničkih simptoma, simpatije i empatije prema djetetu. Neophodno je stalno praćenje osnovnih vitalnih parametara i, kao povratna informacija, brzo prilagođavanje parametara mehaničke ventilacije i terapije infuzijom i lijekovima. Čini se da je kod mnoge djece s HBM težina stanja nakon prvog dana života posljedica ne toliko početne težine plućne bolesti koliko njihovog oštećenja (sa sekundarnim nedostatkom surfaktanta) s neadekvatnim (ne varira ovisno o “reakcija” djeteta) parametri mehaničke ventilacije, prekomjerna ili nedovoljna infuzija, terapija lijekovima, hlađenje.
Dijagnoza se postavlja na osnovu kliničke slike i rendgenskog snimka grudnog koša.
Radiološki, HBM karakterizira trijada simptoma koji se pojavljuju u prvih 6 sati života:
difuzna simetrična žarišta smanjene transparentnosti (simptom brušenog stakla bez ili sa znakovima „retikularnih pluća”);
zračni bronhogram;
smanjena pneumatizacija perifernih plućnih polja.
Ove raširene promjene bolje se razlikuju u donjim dijelovima pluća i na vrhovima. Osim toga, vidljivo je smanjenje volumena pluća, različite težine kardiomegalije (povećanje kardiotorakalnog indeksa), nodozno-retikularne promjene (razni autori ih opisuju kao retikularne, mozaične, zrnate, perle, itd., ali su i dalje prisutne češće se tumači kao difuzna atelektaza).
Za edematozno-hemoragični sindrom tipično je smanjenje veličine plućnih polja i „zamućena“ rendgenska slika, koja se klinički često kombinira s oslobađanjem pjenaste tekućine s krvlju iz usta.
Ako se navedeni znaci HD ne otkriju na rendgenskim snimcima 3 sata nakon rođenja, dijagnoza HD je sumnjiva. Radiografske karakteristike SDR-a su nespecifične (npr. slične su onima kod streptokokne B pneumonije), ali rendgenski snimci grudnog koša su i dalje neophodni da bi se isključila druga stanja koja ponekad zahtijevaju operaciju. Rendgenski znaci HD nestaju nakon nekoliko sati ili 1-3 dana, ovisno o težini bolesti, prirodi terapije, posebno da li je korišten egzogeni surfaktant ili ne.
RJ Rodrigues et al. (2002) naglašavaju da se čak iu većini neonatalnih centara u Sjedinjenim Državama pri postavljanju dijagnoze SDR-a oslanjaju samo na kliničke i radiološke podatke, iako je, naravno, za ispravnu dijagnozu SDR-a važno dobiti dokaz o nedostatku surfaktanta. Stoga se danas ponekad koristi termin „respiratorna insuficijencija nedonoščadi“, kada je za liječenje prijevremeno rođene bebe potrebna mehanička ventilacija i dodatni kisik, ali rendgenski snimak grudnog koša ne pokazuje tipične znakove RDD.
Prenatalna dijagnoza se zasniva na činjenici da fetalna plućna tečnost iz disajnih puteva ulazi u amnionsku tečnost, a njen fosfolipidni sastav se može koristiti za procenu zrelosti fetalnih pluća. Amnionska tečnost se dobija ili amniocentezom ili prikupljanjem tečnosti iz porođajnog kanala majke. Ako nivoi lecitina i sfingomijelina, zasićenog fosfatidilholina u amnionskoj tekućini prelaze 5 mg/l ili fosfatidilglicerola - 3 µmol/l, SDR se razvija vrlo rijetko (manje od 1% slučajeva). Ako je omjer lecitin/sfingomijelin (L/S) veći od 2,0, vjerovatnoća SDR je 2%, ako je manji od 2,0 ali veći od 1,0 iznosi 50%, a ako je manji od 1,0 je -75%. U slučajevima intrauterinog zastoja u rastu, odnos L/C ne odražava uvijek ispravno funkcionalnu zrelost fetalnih pluća, te se stoga u tim slučajevima preporučuje rukovođenje gore navedenim apsolutnim nivoima zasićenih fosfatidilholina i fosfatidilglicerola, kao što su kao i surfaktantni proteini A. U nekim neonatalnim centrima, studije se koriste za procjenu zrelosti fetalnih pluća tromboplastične aktivnosti amnionske tekućine i brojanje „narandžastih ćelija“, ali to nije općenito prihvaćeno.
„Test pene“ je najjednostavniji test zrelosti pluća. Za izradu testa koristi se amnionska tekućina ili 1 ml želudačnog sadržaja dobivenog polietilenskim kateterom u prvom satu života. Test se izvodi na sledeći način: 0,5 ml apsolutnog etanola (95%) se dodaje u 0,5 ml amnionske tečnosti ili želudačnog sadržaja. Staklena epruveta (prečnika 1 cm) se snažno mućka 15 s, nakon 15 minuta se procenjuje rezultat ispitivanja približavanjem epruvete crnom papiru. Test je pozitivan ako se na površini nalazi jedan ili dvostruki prsten mjehurića. Test je negativan ako nema mjehurića, a slabo pozitivan ako ima pojedinačnih malih mjehurića oko meniskusa koji ispunjavaju 1/3 obima ili manje. U slučaju pozitivnog testa, vjerovatnoća HDM je oko 4%, slabo pozitivan - 20%, negativan - 60%.
Obim pregleda (monitoringa) kod dece sa RDS:
Kontinuirano praćenje otkucaja srca i krvnog pritiska.
Transkutana oksihemoglobinometrija, ili još bolje, transkutano određivanje Pao2 i Paco2 u arterijskoj krvi. Vrlo je opasno oslanjati se samo na podatke pulsnog oksimetra, jer on dobro odražava težinu hipoksemije, ali ne reagira na hiperoksiju, pa čak i na donjoj granici normale Raoh oksihemoglobin je 100%. Opasnost od hiperoksije je velika: s njom je povezano kronično oštećenje pluća i očiju kod novorođenčadi.
Optimalno je odrediti Pao2 i Paco2 u krvi dobijenoj kateterizacijom umbilikalne, radijalne ili tibijalne arterije i iz centralne vene, uz analizu arteriovenske razlike u napetosti kiseonika, tj. potrošnja kiseonika tkiva.
Svaka 3-4 sata potrebno je izmjeriti i zabilježiti u kartoteku za posmatranje abdominalnu temperaturu kože, krvni pritisak, diurezu, CBS, glikemijski nivo i koncentraciju kiseonika u udahnutom vazduhu (Fio2).
Tokom akutne faze, SDR se obavlja svakodnevno ili svaki drugi dan:
rendgenski snimak grudnog koša;
određivanje indikatora hematokrita;
EKG;
klinički test krvi;
kultura krvi i trahealnog sadržaja;
određivanje nivoa azota uree, kalija, natrijuma, kalcija i magnezija, ukupnih proteina i albumina u serumu krvi;
poželjno je odrediti volumen cirkulirajuće krvi, brzinu cerebralnog krvotoka i osmolarnost krvi;
koagulogram sa određivanjem fibrinogena i produkata razgradnje fibrina (prema indikacijama);
određivanje nivoa natrijuma u krvi na početku - 2-4 puta dnevno, jer postoji veliki rizik od hipernatremije usled dehidracije.
Diferencijalna dijagnoza se provodi sa respiratornim poremećajima plućnog (pneumonija, malformacije pluća itd.) i neplućnog porijekla (sekundarni respiratorni poremećaji - intrakranijalna porođajna ozljeda mozga ili kičmene moždine, urođene srčane mane, dijafragmatska kila, policitemija, metabolički poremećaji poremećaji i sl.). Diferencijalna dijagnoza s pneumonijom je navedena u nastavku.
Choanalna ageneza uzrokuje nemogućnost disanja na nos i pojavu cijanoze i poremećaja disanja nakon normalnog prvog udisaja. Tipičan je obilan sluzavi iscjedak koji puni nos. Malformacija postaje očita kada nije moguće provući kateter ili sondu kroz nos u nazofarinks. Liječenje je hirurško, ali se zračni kanal odmah ubacuje u usta.
Traheoezofagealne fistule klinički se manifestuju gušenjem, napadima cijanoze, kašljanjem i pojavom zviždanja u plućima tokom ili neposredno nakon hranjenja. Kontrastna studija jednjaka (sa kontrastnim sredstvom rastvorljivim u vodi) i bronhoskopija će potvrditi dijagnozu.
Dijafragmatska kila se otkriva pri rođenju ili ubrzo nakon sve težeg poremećaja disanja. Tipični su mali navikularni abdomen i uvučeni prednji trbušni zid pri rođenju. Prilikom pregleda skreće se pažnja na asinhrone pokrete desne i lijeve polovice grudnog koša i pomicanje vršnog otkucaja srca, češće udesno (pošto se lijevostrana dijafragmalna hernija javlja 5-10 puta češće nego desna). -bočne), oštro skraćivanje perkusionog tona u donjem dijelu pluća i izostanak disajnih zvukova, iznenadna cijanoza kada se dijete nalazi na zdravoj strani. Od odlučujućeg dijagnostičkog značaja je radiografija grudnog koša, koja pokazuje prisustvo u grudnom košu za njega neuobičajenih struktura (crijeva, jetra itd.). Liječenje je hirurško.
Kod djece sa porođajnom traumom mozga i kičmene moždine, uz poremećaje disanja, javljaju se i znaci oštećenja centralnog nervnog sistema. U pravovremenoj dijagnostici moždane patologije pomažu i pomoćne studije: neurosonografija, radiografija kralježnice, lumbalna punkcija itd.
Urođene srčane mane plavog tipa i sindrom perzistentne fetalne cirkulacije ponekad je teško razlikovati od DFS. Međutim, u prvim satima života djeca sa SDD često imaju normalnu boju kože. Kada se koristi 100% kiseonik za disanje u trajanju od 10-15 minuta, posebno uz konstantan pozitivan pritisak u disajnim putevima, Raoh se povećava kod dece sa SDR, ponekad čak i iznad 100 Torr, dok se to ne dešava kod srčanih mana plavog tipa. Naravno, bitni su i podaci kliničkog pregleda, auskultacije, procjene na Silvermanovoj skali, kao i dodatne studije (rendgenski snimak grudnog koša, EKG, rezultati ehokardiografije).
Pneumonije uzrokovane streptokokom B i drugim streptokokom (peptost-reptokoki, enterokoki) daju kliničku sliku koja se praktično ne razlikuje od BGM, jer uzrokuju inhibiciju surfaktanta, a time i njegov nedostatak. Dijagnostički značaj u ovom slučaju je identifikacija drugih infektivnih žarišta (meningitis i sl.), rezultati kliničkih analiza krvi, hemokulture i trahealnog sadržaja.
Tretman. Temperaturna zaštita. Njega je prvenstveno usmjerena na sprječavanje hlađenja, jer pomaže u smanjenju ili čak zaustavljanju (pri tjelesnoj temperaturi od 35°C i niže) sinteze surfaktanta i povećanju metaboličke acidoze, razvoju napada apneje. Odmah po rođenju beba se umotava u sterilnu zagrijanu pelenu, plodna voda se pažljivim upijanjem uklanja sa kože i stavlja pod zračeći izvor toplote, a zatim u inkubator (temperatura u inkubatoru zavisi od telesne težine pri rođenju; jer detalje, vidi Poglavlje VIII). Svakih 1-2 sata detetu se meri telesna temperatura, a ako je ispod 36°C, tada se temperatura vazduha u inkubatoru povećava za 1-2°C, a ako je iznad 37°C, onda se smanjuje (obično ne bi trebalo da bude niža od 32°C). Više detalja u poglavlju VIII.
Treba imati na umu da dijete koje leži ispod izvora topline na stolu za reanimaciju troši 5-10% više energije na održavanje tjelesne temperature nego dijete u inkubatoru. Stoga je preporučljivo prijevremeno rođene bebe sa vrlo malom tjelesnom težinom, čak i u inkubatoru, smjestiti u plastičnu komoru kako bi se smanjio gubitak topline konvekcijom, kao i neprimjetan gubitak vode. Sva djeca moraju staviti kapu na glavu, jer je gubitak topline i vode iz glave veoma veliki.
Važno je spriječiti fluktuacije u temperaturi okoline; Prilikom pregleda djeteta u inkubatoru, minimizirajte traumatske efekte - bol, itd.
Pregled kod ljekara treba da bude što kraći, a posebno je važno, ako dijete treba da se okrene, poduprijeti glavu, smanjujući pasivne pokrete u vratnoj kičmi.
Održavanje prohodnosti disajnih puteva. Kada se dijete rodi u asfiksiji, prisustvo mekonija u amnionskoj tekućini u obliku „supe od graška“ zahtijeva intubaciju dušnika i nježno, ali snažno usisavanje sadržaja respiratornog trakta. Usisavanje se ponavlja više puta u akutnoj fazi bolesti, vodeći se kliničkom slikom i auskultacijskim podacima, ali imajući u vidu da trahealni toalet izaziva prolaznu, ali značajnu hipoksemiju, bradikardiju i hipertenziju, značajnu promjenu intenziteta moždanog krvotoka, što može izazivaju intrakranijalne hemoragije, paraventrikularne lezije.
Položaj djeteta sa SDD na stolu ili u inkubatoru treba da bude sa blago ispruženom glavom („položaj za kijanje“). Da biste to učinili, ispod gornjeg dijela grudnog koša postavite jastuk debljine 3-4 cm.Periodično mijenjanje položaja djeteta (blago okretanje na jednu stranu, na stomaku i sl.) stimuliše drenažu dušnika. Na kraju akutnog perioda pribjegavaju vibracijskoj masaži, fizioterapiji i aerosol terapiji.
Infuziona terapija i prehrana. Djeca sa SDD se u pravilu ne hrane enteralno prva dva do tri dana života zbog rizika od kardiopulmonalnih komplikacija i regurgitacije. Međutim, od prvih sati života dijete ne smije biti gladno ili žedno. Osim toga, izuzetno je važno spriječiti razvoj hipoglikemije. Stoga, već 30-40 minuta nakon rođenja, počinje planirana infuzijska terapija. Volumen primijenjene tekućine prvog dana života iznosi 50-60 ml/kg sa daljim povećanjem od 20 ml/kg za svaki sljedeći dan (7. dana oko 140-150 ml/kg). Potrebno je posebno pažljivo davati tečnost i povećati njen dnevni volumen u slučaju oligurije kod djeteta. Kada se pojavi diureza (više od 2 mi/kg/h), volumen tekućine se snažnije povećava (do 40 ml/kg dnevno). Tokom faze oligurije, višak tekućine može doprinijeti održavanju otvorenog duktus arteriozusa, plućnog edema i biti faktor u povećanom riziku od naknadnog razvoja BPD-a. Obnavljanje diureze je vjesnik početka faze oporavka.
Prvog dana života transfuzirana tečnost je 5-10% rastvor glukoze, a od drugog dana joj se dodaju natrijum i hlor u količini od 2-3 mol/kg/dan. i kalijum, kalcijum 2 mol/kg/dan. Sastav rastvora za infuziju se prilagođava u zavisnosti od monograma krvi, održavajući nivo natremije unutar 135-145 mmol/l plazme. Za prevenciju tromboze katetera i regionalne žile, posebno kod djece na potpunoj parenteralnoj ishrani, infuziranim otopinama se dodaje heparin u dozi od 0,2-0,5 jedinica po 1 ml transfuzirane tekućine.
Općenito, kao što je poznato, volumen i priroda infuzijske terapije određuju se ovisno o:
OCC;
diureza;
dinamika tjelesne težine;
dinamika ADC i intenzitet cerebralnog krvotoka;
stanje kardiovaskularnog sistema, posebno stanje periferne cirkulacije;
CBS i jonogram krvnog seruma;
uvjeti njege, posebno adekvatnost temperaturne zaštite, metode mehaničke ventilacije ili IVL.
Uzimanje u obzir svih ovih parametara i korekcija volumena su složeni zadaci koji zahtijevaju i znanje i vještinu ljekara, jer se do sada novorođenčad ne liječi koliko njeguje.
Hranjenje donorskim, majčinim mlijekom ili adaptiranim adaptiranim mlijekom za prijevremeno rođene bebe počinje kada se stanje poboljša i otežano disanje se smanji na 60 u minuti, izostanak produžene apneje, regurgitacije, nakon kontrolne primjene destilirane vode. Vrsta hranjenja (jednokratna ili stalna gastrična ili transpilorna sonda, iz bočice) zavisi od prisustva refleksa sisanja i težine stanja. Proračun količine mlijeka - vidi poglavlje VI, gdje možete pročitati i način parenteralne prehrane ako stanje pacijenta ne dozvoljava početak enteralne prehrane.
Normalizacija gasnog sastava krvi postiže se obogaćivanjem udahnutog vazduha kiseonikom, raznim opcijama za stvaranje povišenog pritiska u disajnim putevima pri spontanom disanju (spontano disanje sa konstantnim pozitivnim pritiskom u disajnim putevima) kroz nazalne kanile (sCPAP - nazalni kontinuirani pozitivan pritisak u disajnim putevima).pritisak u disajnim putevima) sa konstantno povišenim pritiskom i mehaničkom ventilacijom.
Ako nema znakova SDR, prevremeno rođena beba se stavlja u inkubator, gdje je sadržaj kisika u zraku oko 40-45%. Ako u roku od 4 sata Rao arterijske krvi (ili kada se odredi kožnim senzorom) ostane iznad 8 kPa (60 torr = mmHg), tada se koncentracija kisika smanjuje za 5% na sat na razinu od 30-35%. Kada je Pao2 manji od 6,67 kPa (50 torr = mmHg), koncentracija kisika u udahnutom zraku se povećava do maksimuma postavljanjem poklopca u inkubator preko djetetove glave. Ako to ne dovede do normalizacije krvnog Pao2, tada se pokreće SDPPD (optimalno kroz nazalne kanile).
Ostale indikacije za pokretanje SDP-a su:
uporni nedostatak daha i zvukovi pri izdisanju;
Silverman postiže 5 poena ili više (čak i sa normalnom bojom kože);
negativan “pjenasti test” sa amnionskom tekućinom ili sadržajem želuca dobijenim neposredno nakon rođenja, odsustvo fosfatidilglicerola u njima.
Najčešća metoda koja se trenutno koristi je pCPAP; Martinova metoda (Martin bag) se koristi mnogo rjeđe. Torbica se pjenastom trakom pričvršćuje za vrat djeteta kako bi mali prst doktora mogao slobodno prodrijeti između vrećice i vrata. Ekspiratorni ekspiratorni pritisak sa CPAP-om je obično u rasponu od 4-6 cm vode. Art. (tj. cijev kroz koju izlazi zrak iz vreće je uronjena do ove dubine), rijetko se mora povećati u slučaju jake krutosti pluća na 10 cm vode. Art. Ako je rigidnost pluća niska, tada višak pritiska tijekom izdisaja dovodi do poremećaja odljeva krvi iz mozga, smanjenja njenog dotoka do srca i doprinosi razvoju zatajenja srca i cerebralnog edema.
SDPPD počinje dovodom vlažnog kisika zagrijanog na 32-34°C, a zatim se pod kontrolom kliničkog efekta i PaO2 u krvi postepeno smanjuje njegova koncentracija u inhaliranoj smjesi, čime se postiže PaO2 u arterijskoj krvi od 6,67-10,67 kPa. (50-80 torr = mm Hg), a arterijalizirana krv iz pete više od 8 kPa smatra se potencijalno toksičnom, što zahtijeva smanjenje koncentracije kisika u udahnutom zraku.
Ako je dijete izrazito nemirno, što se posebno često opaža u prisustvu pCPAP-a, propisuje se natrijum hidroksibutirat ili seduksen, ali ne i fenobarbital, koji selektivno potiskuje ekspiratorne strukture respiratornog centra smještenog u produženoj moždini.
Indikacije za mehaničku ventilaciju su:
nemogućnost postizanja normalizacije krvnog Pao2 na pozadini pCPAP-a, Silverman skor više od 5 bodova, koji se ne smanjuje na pozadini pCPAP-a;
Pao2 je ispod 8,00 kPa (60 mm Hg) sa Fio2>0,7 (F1O2 je udio kiseonika u udisanoj mešavini kiseonika i vazduha), ali ako je porođajna težina manja od 1250 g, onda sa Fio2>0,4;
Paco2 je veći od 8,79 kPa (65 mm Hg), a sa tjelesnom težinom manjom od 1250 g - Paco2>8,00 kPa (60 mm Hg) i pH pH Za način izvođenja mehaničke ventilacije vidi poglavlje. XXVI.
Ekstrakorporalna membranska oksigenacija koristi se u inozemstvu za liječenje djece s izrazito teškim SDR-om kada su tradicionalne metode mehaničke ventilacije neefikasne i kod djece s teškim srčanim manama. Zbog nedostatka odgovarajuće opreme u Rusiji, u ovom udžbeniku ne opisujemo njene metode.
Opasnosti terapije kiseonikom:
suhi i hladni kiseonik oštećuje pluća, potiče spazam arteriola, plućnu hipertenziju, acidozu i inhibiciju sinteze surfaktanata. Grijanje
kiseonik do 32-34°C je obavezan (sa mehaničkom ventilacijom - do 36-37°C), kao i njegovo ovlaživanje. U nedostatku posebnih ovlaživača, kisik se prolazi kroz bobrov teglu (visina vodenog stupca je najmanje 15 cm). Prekomjerna vlaga (100% relativna vlažnost duže od 2 sata) dovodi do pregrijavanja djeteta, preopterećenja vodom i doprinosi plućnom edemu; Opasnost od toksičnosti kiseonika je realna kada je Pao2 u arterijskoj krvi veći od 10,67 kPa, u trajanju od nekoliko sati, što dovodi do oštećenja očiju, pluća i centralnog nervnog sistema.
Održavanje PPOV. Potrebno je samo korigovati patološku acidozu (pH manji od 7,25 i BE više od minus 10 mmol/l), i to tek nakon uspostavljanja mehaničke ventilacije ili IVL. Ako je patologija pluća dovela do tako značajnog oštećenja CBS-a, onda je to direktna indikacija za mehaničku ventilaciju ili IVL. Količina natrijum bikarbonata u mmol (tj. broj ml 8,4% rastvora) x (BE vrijednost - 5) x tjelesna težina (kg) x 0,4. Odgovarajuća količina natrijum bikarbonata se daje kap po kap u obliku 4,2% rastvora tokom 1 sata.Važno je imati na umu da alkaloza izaziva intrakranijalne hemoragije i respiratorni zastoj kod prevremeno rođene dece.
Borba protiv anemije i hipovolemije, hipotenzije. U akutnoj fazi bolesti potrebno je održavati vrijednost hematokrita od najmanje 0,4, jer je anemija faktor koji održava hipoksiju tkiva, što znači nedostatak surfaktanta, oticanje tkiva i sl. Transfuzira se masa crvenih krvnih zrnaca. Kod teške anemije i teškog SDR-a, direktna transfuzija krvi je indikovanija, jer svježa crvena krvna zrnca sadrže više 2,3-difosfoglicerata, koji smanjuje hipoksiju tkiva. Osim toga, svježa krv je indikovanija za korekciju poremećaja hemostaze kod dekompenziranog DIC sindroma, a ujedno je i imunoprotektor infekcija. U isto vrijeme, zamjenske transfuzije krvi za SDR su sada napuštene, jer to doprinosi povećanju učestalosti i težine retinopatije nedonoščadi. U 2. sedmici života i kasnije, indikacija za transfuziju crvenih krvnih zrnaca je hematokrit ispod 0,3. Trenutno su indikacije za transfuziju pune krvi oštro ograničene zbog opasnosti od infekcija (ne samo hepatitisa B i C, HIV-a, već i citomegalovirusa, jer 6-12% darivatelja ima citomegalovirus u krvi), izosenzibilizacije.
Hipovolemiju (pozitivan “simptom bijele mrlje” – 3 s ili više), posebno kod djece s anemijom, najpoželjnije je ispraviti transfuzijom izotonične otopine natrijum hlorida, ali možete transfuzirati i svježe smrznutu plazmu ili 10% otopinu albumina. Količina transfuziranog lijeka je 10-15 ml/kg tjelesne težine. Sipati polako u mlazu (1-2 ml/kg/min).
Ako je nakon korekcije anemije i hipovolemije arterijski krvni pritisak nizak (maksimalni pritisak ispod 45 torr, tj. mm Hg), tada se dopamin daje mikro-mlazom (početna doza 5 mcg/kg/min uz dalje povećanje prema indikacijama) do 10-15-20 mcg/kg/min) (za detalje pogledajte Poglavlje XIX).
Nadoknada nedostatka surfaktanta. Od prvih radova T. Fujiwara et al. 1980. godine, da bi se nadomjestio nedostatak surfaktanta kod vrlo prijevremeno rođene djece, ustanovljen je pozitivan učinak takve terapije.
Trenutno koriste kako prirodne surfaktante dobijene iz pluća goveda (domaći BL-surfaktant, razvijen u Sankt Peterburgu od prof. OARozenberga, strani - Survanta, Alveofact, Infrasurf), svinja (Curosurf), tako i sintetičke (ALEK, Exosurf , Surfaxin, "Sfenticute". Najefikasniji prirodni surfaktanti sadrže pored fosfolipida i surfaktant protein B (tabele 12.3, 12.4). Treba naglasiti da lek Surfaxin, koji je u SAD razvio laboratorija Discovery, sadrži kombinaciju fosfolipida (dipalmitilfosfatidilholin - DPPC, palmitil oleil fosfatidilglicerol - POPG, palmitinska kiselina - PA) i rekombinantnog, sintetičkog peptida koji se sastoji od fragmenata aminokiselina lizina (K) i leucina u rekombinantnoj sekvenci KLLLLKLLK (LKLLKLL) peptid ima svojstva surfaktanta proteina B Lijek \enticute sadrži rekombinantni surfaktant protein C.
Brojne randomizirane studije su pokazale da egzogeni surfaktant potiče:
povećanje plućne usklađenosti i funkcionalnog rezidualnog kapaciteta, čime se smanjuje rad respiratornih mišića;
smanjenje tokom mehaničke ventilacije Fio2 (udio kiseonika u udahnutom vazduhu), PIP (vršni inspiratorni pritisak), MAP (srednji pritisak u disajnim putevima), PEEP (pozitivni krajnji ekspiratorni pritisak), poboljšanje indeksa oksigenacije alveolokapilarnog gradijenta kiseonika;
smanjenje mortaliteta u SDR-u (njegova profilaktička upotreba je posebno efikasna kod djece s periodom trudnoće kraćim od 30 sedmica kada se kombinira
Tabela 12.3
Sastav nekih tenzida
(Gadzinowski J., 2003) Sastav Surfaxin Survanta Curosurf proteina/peptida 0,8+2 mg/ml SpB i SpC Tabela 12.4
Proteinski sastav nekih surfaktanata
(Gadzinowski J., 2003.)
Odnos SpB u mg i fosfolipida u mmol Odnos SpC u mg i fosfolipida u mmol Alveofact 2,7+0,8 1,4+0,5 Curosurf 2,4+2,2 5,2+5,6 Surfaxin 19, 8 * 1 SpC palmitinska kiselina čuva funkciju
uz antenatalnu primjenu kortikosteroida), sindrom aspiracije mekonija, SDR odraslog tipa;
skraćivanje vremena mehaničke ventilacije i smanjenje učestalosti neželjenih efekata mehaničke ventilacije (sindromi curenja vazduha i sl.);
smanjenje incidencije MDD, IVH, retinopatije;
ne inhibira sintezu endogenog surfaktanta.
Treba napomenuti da su prirodni surfaktanti efikasniji od sintetičkih, ali mogu biti antigeni; osim toga, oni su manje stabilni u sastavu, zahtijevaju strože uslove skladištenja i imaju ograničeniji rok trajanja i potencijalno mogu sadržavati prionske agense.
Imamo iskustva sa upotrebom lekova Curosurf i Exosurf u Dečjoj bolnici br. 1 (Sankt Peterburg). Oba lijeka su imala gore navedene efekte. Međutim, nakon uvođenja Curosurfa, Fio2, PIP, MAP bi se mogli smanjiti za otprilike 30% nakon 3-3,5 sata, dok nakon uvođenja Exosurf-a - tek nakon 6 sati. Nakon primjene Curosurfa, uočeno je smanjenje plućnog vaskularnog otpora, smanjenje postopterećenja desne komore i povećanje predopterećenja lijeve komore. Istovremeno je došlo do smanjenja alveolarno-kapilarne razlike u napetosti kiseonika i poboljšanja indeksa oksigenacije. Nažalost, ne postoje randomizirane uporedne studije upotrebe domaćeg BL surfaktanta, a nemamo ni iskustva u njegovoj primjeni, ali od naših kolega znamo da je mnogo manje efikasan u teškim SDR od Curosurfa.
Prema profesoru J. Gadzinowskom (2003), u multicentričnim evropskim komparativnim randomiziranim studijama (u njima učestvuju i neonatolozi iz Sankt Peterburga, ali je studija dvostruko slijepa i još ne znamo svoje rezultate) profilaktičke upotrebe Surfaxin, Exosurf i Survanta kod djece s porođajnom težinom manjom od 1250 g, prvi lijek je bio učinkovitiji, što, po njegovom mišljenju, može biti posljedica ranijeg poboljšanja oksigenacije (u roku od nekoliko minuta, dok je nakon upotrebe kod ostalih surfaktantnih lijekova to se primjećuje nakon 3-6 sati), dugotrajniji učinak zbog otpornosti sintetičkog lijeka Surfaxin na inhibiciju komponenti seruma i oksidansa.
Nuspojave i komplikacije terapije surfaktantima su uglavnom jatrogeni. U nedostatku adekvatnog praćenja i varijacije parametara mehaničke ventilacije, može doći do razvoja barotraume i plućne volutraume, sindroma curenja zraka, plućne hemoragije, hiperoksije, a time i retinopatije nedonoščadi, plućne hemoragije, IVH. Možda jedino što su primijetili mnogi istraživači u gotovo svim centrima je povećanje učestalosti funkcioniranja ductus arteriosus i napada apneje nakon upotrebe egzogenog surfaktanta. Učestalost funkcionalnog ductus arteriosus kod djece liječene Curosurf-om u našim opservacijama iznosila je 7,6%.
Najefikasnija profilaktička primjena surfaktanta je pri rođenju ili u prvih 15-30 minuta života. Doza namijenjena za primjenu se prethodno zagrije (unutar 1 sat do 37°C) i infundira kroz endotrahealnu cijev u traheju u 4 doze u trajanju od 10-15 minuta ili mikro-mlazom pomoću infuzera 20-30 minuta, uz sledeća infuzija menja se položaj deteta. Ako je potrebno, infuzije se ponavljaju nakon 12 sati.Nisu zabilježene ozbiljne nuspojave. Smatra se izuzetno važnim prekinuti mehaničku ventilaciju što je prije moguće i prebaciti dijete na pCPAP. Kao rezultat ove općenito preventivne terapije, učestalost i težina SDR-a su značajno smanjene.
Terapija površinski aktivnim tvarima već razvijenih SDR-a ili pneumonije mnogo je manje učinkovita od preventivnog liječenja. Istovremeno, izuzetno je važno prije davanja bilo kojeg surfaktanta stabilizirati stanje djeteta i, ako je moguće, ispraviti osnovne vitalne parametre. Nakon primjene lijeka potrebno je pažljivo praćenje, uključujući: parametre mehaničke ventilacije, Fio2, vizuelnu analizu učešća pomoćnih mišića u činu disanja, transkutanu analizu saturacije (Brog), puls, ADC, CBS, grudni koš radiografija prije i 3-6 sati nakon primjene. Opet, potrebno je fleksibilno varirati parametre mehaničke ventilacije i F102, izbjegavajući barotraumu i volutraumu pluća, te hiperoksiju. Spo2 treba održavati između 90-94% kako bi se spriječila hiperoksija. Savjetuje se da se sadržaj traheje ne usisava 3-6 sati nakon primjene surfaktanta.
Zatvaranje otvorenog ductus arteriosus se smatra medicinskim kod djece sa SDR prema ehokardiografiji i Dopler studijama 4-5. dana života. Taktike za upotrebu indometacina ili brufena opisane su u poglavlju XIX.
Antibiotska terapija. Kada se postavi dijagnoza SDR, čak i ako se sumnja, ampicilin se propisuje u kombinaciji s jednim od aminoglikozida (obično gentamicinom). To je zbog, s jedne strane, činjenice da se streptokokna B infekcija manifestira oštećenjem pluća, koje se ne razlikuje (čak i često radiološki) od SDR-a, as druge strane, prevođenjem pacijenta na mehaničku ventilaciju, što je često praćeno infekcijom. Međutim, 3 dana nakon dobijanja rezultata hemokulture i kliničkih analiza krvi tokom vremena, potrebno je odlučiti o prisutnosti infekcije i, ako je nema, prekinuti uzimanje antibiotika.
Vitaminoterapija. Nije potvrđeno mišljenje da profilaktička primjena vitamina E smanjuje učestalost bronhopulmonalne displazije. Pa ipak, indikovana je primjena vitamina E intramuskularno u dozi od 10 mg/kg dnevno kada se koristi mješavina kisika i zraka s Fio2 većim od 0,4, jer to smanjuje učestalost i težinu retinopatije nedonoščadi. Kurs od 7-10 injekcija. Vitamin A, koji se daje enteralno po 2000 jedinica svaki drugi dan, treba dati svoj djeci prije ulaska u enteralnu ishranu, jer se time smanjuje incidenca nekrotizirajućeg enterokolitisa i bronhopulmonalne displazije.
Diuretici. Iako primjena furosemida povećava diurezu i poboljšava stanje pluća, ona povećava učestalost otvorenog duktus arteriozusa, kalcifikacija u bubrezima i diselektrolitimije, pa se stoga ne može smatrati rutinskom. Furosemid se propisuje samo za plućni edem i edematozni sindrom.
Glukokortikoidi. Odustalo se od planirane primjene glukokortikoida i njihovih derivata (najčešće se koristio deksametazon jer ima maksimalno tkivno djelovanje) za stimulaciju sinteze surfaktanta kod sve djece sa SDD. To je zbog uvođenja surfaktantnih preparata u terapiju i sekundarne prevencije SDR-a, poboljšanja metoda respiratorne podrške, mehaničke ventilacije, kao i nuspojava glukokortikoidne terapije, od kojih je glavni, čak i uz kratak kurs, su: hiperglikemija, arterijska hipertenzija, gastrointestinalna krvarenja, nekrotizirajući enterokolitis i druge infekcije. Glukokortikoidi se propisuju pacijentima sa SDR koji, prema kliničkim i laboratorijskim podacima, imaju insuficijenciju nadbubrežne žlijezde.
Mnogi neonatolozi u inostranstvu su došli do zaključka da primena deksametazona za postintubacioni edematozni laringitis ili traheitis sa teškom stenozom ima pozitivan efekat. Neonatalni formular (BMJ, 2000) preporučuje davanje 4 doze od 200 mcg u intervalima od 8 sati, s tim da se prva doza daje 4 sata prije ekstubacije kod djece s edemom ili traumom larinksa.
Hormoni štitnjače za liječenje djece sa SDD počeli su se aktivno koristiti u nekim neonatalnim klinikama, na osnovu učestalog otkrivanja niskog nivoa hormona štitnjače kod vrlo prevremeno rođene djece sa GBM. Međutim, ne postoje općeprihvaćeni podaci zasnovani na rezultatima randomiziranih studija koji neosporno dokazuju korist takvog recepta, te se stoga radi o ispitivačkoj terapiji. Intraamnionska primjena L-tiroksina za trudnice s visokim rizikom od prijevremenog porođaja je opravdanija, ali čak i ovdje ne postoje općeprihvaćene sheme i općeprihvaćeni rezultati.
Riboksin i inozitol, koji se propisuju intragastrično svakih 6 sati u dozi od 40 mg/kg od kraja prvog do 10. dana života, prema M. Hallman et al. (1986-1989), smanjuju ozbiljnost SDR, povećavaju sintezu surfaktanta i smanjuju incidencu bronhopulmonalne displazije. Međutim, ova metoda, kao i planirana primjena plazminogena prijevremeno rođenoj novorođenčadi, je istraživačka metoda za liječenje djece sa SDD.
Prognoza SDR-a ovisi o stepenu njegove težine i prisutnosti prateće patologije i komplikacija terapije. Stopa mortaliteta djece s porođajnom težinom većom od 1000 g uz racionalno liječenje ne prelazi 5-10%. U prvoj godini života djeca koja su oboljela od SDR često obolijevaju od upale pluća, a povećana je i incidencija sepse. Encefalopatija (posthipoksična) je jedno od karakterističnih popratnih stanja (ili komplikacija) kod djece sa SDD, a kod neke djece se jasno identificiraju tek u predškolskom i školskom uzrastu u vidu minimalne moždane disfunkcije, poremećaja u ponašanju i teškoća u učenju. S tim u vezi, u sistemu rehabilitacionih mera za decu sa SDD, potrebno je predvideti ranu primenu (od 3-4. dana) lekova koji poboljšavaju trofizam mozga (gliatilin 10-15 mg/kg/dan, nootropil 50). mg/kg intravenozno ili oralno 2-3 puta dnevno), nadzor neurologa.
Prevencija. Antenatalna hormonska terapija. Primena intramuskularno ili oralno majci u slučaju opasnosti od preranog porođaja u 24-34 nedelje:
betametazon u dozi od 12 mg (2 puta sa razmakom od 24 sata) ili
Deksametazon 6 mg 4 puta sa intervalom od 12 sati.
Optimalno je da period između završetka hormonske terapije i porođaja bude više od 24 sata.Dejstvo ovog recepta traje 10 dana, a ako ne dođe do porođaja, jednokratna primena deksametazona u dozi od 6-12 mg je indicirano.
Antenatalni tok kortikosteroida dovodi ne samo do smanjenja učestalosti i težine SDR-a, već i smanjuje rizik od razvoja sindroma otvorenog ductus arteriosus, intraventrikularnog krvarenja, periventrikularne leukomalacije, nekrotizirajućeg enterokolitisa, trajanja i troškova njege vrlo prerano rođene djece. .
Dugoročne studije praćenja pokazale su da kurs antenatalne hormonske terapije ne povećava incidencu zaraznih bolesti kod novorođenčadi, ne utiče na kasniji fizički i psihomotorni razvoj (uključujući brzinu povećanja obima glave), kao ni na pluća. rast, i ne uzrokuje disfunkciju nadbubrežnih žlijezda ili vida ili sluha.
Trenutno se najperspektivnijim smatra razvoj za praktičnu primjenu sheme za uvođenje trijodtironina u amnionsku tekućinu, a optimalno - tireotropin-oslobađajućeg hormona (TRH). TRH lijekovi, i eksperimentalno i u ograničenim kliničkim ispitivanjima, pokazali su se vrlo efikasnim u prevenciji SDR-a. Međutim, dvije velike multicentrične studije provedene u SAD-u nisu pokazale korist od kombiniranja profilaktičkih kortikosteroida kod trudnica u kombinaciji sa hormonima štitnjače i/ili TRH (Ballard RA et al., 1998).
Korisno je "odgoditi" porođaj, jer ako bezvodni interval traje više od 2 dana, SDR se obično ne razvija, iako se kod takve djece češće primjećuju sepsa i, vjerovatno, intrakranijalna krvarenja.
Nadomjesna terapija egzogenim surfaktantima u prvih 30 minuta života (vidi gore) je vrlo učinkovita metoda prevencije teškog SDR-a.
Respiratorni distres sindrom (RDS) odnosi se na bilo koji patoloških promjena u plućima, javlja se kod fetusa ili novorođenčeta u prva 2-3 dana života, klinički se manifestuje teškim respiratornim zatajenjem.
SDR se češće opaža kod prijevremeno rođenih beba, posebno kod blizanaca, uglavnom kod dječaka. Glavni uzroci njegovog nastanka su: a) pneumopatija - pluća, hijaline membrane, edematozno-hemoragični sindrom, krvarenja u plućima, plućne malformacije; ) intrauterini - , sepsa; intrakranijalne hemoragije.
Anatomska i funkcionalna zrelost pluća zavisi od količine surfaktanta koji oblaže unutrašnju površinu alveola, stvarajući površinski alveolarni film koji sprečava kolaps alveola i razvoj atelektaze. Za normalno funkcionisanje pluća dovoljna količina surfaktanta postiže se do 35. sedmice. njegov sadržaj u fetalnom plućnom tkivu može se odrediti na osnovu nivoa lecitina u amnionskoj tečnosti. U tu svrhu koristi se Clements pjenasti test. Njegova suština je sljedeća.
Test "pjene" se također provodi sa sadržajem želuca novorođenčeta. SDR je najizraženiji u prva 2 dana života i postepeno nestaje do 12-14 dana. Njegova težina se procjenjuje po Silvermanovoj skali 30 minuta nakon rođenja djeteta, zatim nakon 3-6-12 sati tokom 2-3 dana. a rezultati ukazuju na prisustvo sindroma. Sa ocenom 10 stanje deteta je izuzetno teško.
Silvermanova skala
|
Klinički simptomi |
|||
|
Neujednačeno |
Paradoksalno |
||
|
Retrakcija interkostalnog prostora |
Odsutan |
Umjereno |
Oštro izraženo |
|
Sternalna retrakcija |
Odsutan. |
Umjereno na inspiraciji |
Konstantno, izraženo |
Znakovi SDD se uočavaju u prvom životu djeteta. Tu spadaju: pojačano disanje (preko 60-70 u minuti), povlačenje međurebarnih prostora i ksifoidnog procesa pri udisanju, širenje krila nosa, otežano izdisanje, funkcionalno stanje centralnog nervnog sistema.
Primarne atelektaze mogu biti male, raštrkane po oba pluća ili grupisane u velike konglomerate koji zauzimaju nekoliko segmenata (polisegmentalna atelektaza).
Djeca postaju letargična, dolazi do smanjenja mišićnog tonusa i adinamije. Pojavljuje se oštar osjećaj, disanje postaje ubrzano i otežano, paradoksalno, poput "ljuljačke". Grudni koš je bačvastog oblika i krut na palpaciju. Javlja se zatupljenost ili skraćenje perkusionog zvuka i oslabljeno disanje na zahvaćenoj strani, otežano, pojačano disanje na preostalim dijelovima pluća. Mogu se čuti pojedinačni, isprekidani hripanja. Nekomplikovano patološki proces kolabirano plućno tkivo se ispravlja u roku od 4-5 dana. Raštrkane diseminirane atelektaze su češće primarne i zapažaju se kod djece s malom težinom i nezrelim plućnim tkivom. često rođeni u stanju gušenja, mlohavi, sa smanjenim mišićnim tonusom, izraženom cijanozom. Sindrom respiratornog poremećaja u početku je blago izražen, na 2-4 poena po Silvermanovoj skali, ali do kraja 2-3 dana dolazi do vrhunca bolesti. postaje sve učestalije, nozdrve se šire, pojavljuju se grčeviti uzdasi. Grudi su "testaste" na dodir. Perkusioni zvuk se skraćuje u cijelom ili u određenim područjima pluća. tvrdog, teškog zvučnog izdisaja, na čijoj pozadini se čuju izolirani povremeni zvižduci. Ako je tok povoljan, simptomi počinju u 5. nedelji i postepeno nestaju do kraja 2. nedelje. Naglo stanje 5-6. dana je znak upale pluća.
Djeca sa sindromom hijalinske membrane mogu se roditi u zadovoljavajućem stanju. interval ponekad traje i do 12 sati, nakon čega se razvija teška respiratorna insuficijencija, disanje postaje sve češće i pojavljuje se cijanoza kože koja ne nestaje udisanjem kisika. Uočeni su ponovljeni napadi gušenja; gusta, povećana u veličini; potkožna baza raste. Prilikom auskultacije pluća su oslabljena i mogu se čuti mali piskovi. Nakon toga se uočavaju funkcije centralnog, potpunog i čestog prestanka disanja. blijedo sa sivkasto-cijanotičnom nijansom.
Edemsko-hemoragični sindrom- jedan od mnogih teški oblici pneumopatija. To je lokalna manifestacija patološke hidratacije cijelog organizma novorođenčeta, koja nastaje kao posljedica metaboličkih poremećaja i intrauterina asfiksija. Karakteristična karakteristika sindrom je iscjedak pjenaste krvave tekućine iz usta. Respiratorni i znaci SDR pojavljuju se pri rođenju. Na koži i potkožnom tkivu često se javljaju opsežna krvarenja. U plućima se opaža jak edem: pri perkusiji zvuk se skraćuje i slabi, posebno u donjim dijelovima, a čuje se veliki broj finih mjehurićavih hripanja.
Edemsko-hemoragijski sindrom je gotovo uvijek u kombinaciji s diseminiranom plućnom atelektazom, posebno kod prijevremeno rođene djece.
Hemoragija u mogu biti alveolarni, intersticijski i mješoviti. U 50% slučajeva se primjećuje
Respiratorni distres sindrom
V.F. Demin, A.A. Mikheeva
Katedra za dječje bolesti br. 3, Ruski državni medicinski univerzitet.
Terminologija
Termini respiratorni distres sindrom (RDS), respiratorni distres sindrom (RDS) i bolest hijalinskih membrana (HMD) često se koriste za opisivanje iste patologije. Prošle godine Mnogi autori ne koriste pojmove SDR i RDS kao sinonime za BGM, jer Postoje i druga patološka stanja u kojima dolazi do stvaranja hijalinskih membrana. U domaćoj literaturi se u vezi sa istim stanjem koriste i termini respiratorni distres sindrom i respiratorni distres sindrom.
Etiologija i patogeneza
Respiratorni distres sindrom se razvija u otprilike 20% nedonoščadi, ali njegova incidencija u velikoj mjeri ovisi o gestacijskoj dobi i može varirati od 5-10% kod djece rođene u 35-36 sedmica, i do 80-88% kod djece rođene u gestacijskoj dobi. starosti manje od 27 sedmica. Respiratorni distres sindrom javlja se kod 1-2% donošene novorođenčadi i povezan je uglavnom s morfo-funkcionalnom nezrelošću, asfiksijom pri rođenju i nekim drugim stanjima.
Razvoj respiratornog distres sindroma temelji se na strukturnoj i funkcionalnoj nezrelosti pluća i povezanom nedostatku stvaranja surfaktanta. Osim toga, uzrok razvoja SDR-a može biti kršenje strukture surfaktanta, njegovo povećano uništavanje ili inhibicija.
Anatomske i fiziološke karakteristike respiratornog sistema novorođenčeta predisponiraju na više brz razvoj respiratorna insuficijencija nego kod starije djece i odraslih. Larinks se nalazi više od grkljana odraslih i respiratornih organa putevi su veoma uski, pri čemu je subglotični prostor najuže mesto, gde zadebljanje sluznice i za 1 mm dovodi do suženja lumena za 75%. Pluća su punokrvna i manje elastična od pluća odrasle osobe. Broj alveola kod novorođenčeta je 10-15 puta manji nego kod odrasle osobe, što dovodi do ograničenih mogućnosti plućne izmjene plinova. Grudni koš novorođenčeta je u položaju udisanja, uzrokovan položajem rebara okomitih na kičmu, pa se povećanje volumena ventilacije događa uglavnom zbog brzine disanja.
Nakon što dijete prođe porođajni kanal pluća se nikada ne šire sama pod uticajem elastične vuče. Sile površinskog napona u sloju tečnosti između adherentnih alveola to sprečavaju. Za ispravljanje alveola neophodan je vakuum u grudnom košu, a transpulmonalni pritisak treba da bude do -40 cm H2O. Prvi plač novorođenčeta predstavlja važan adaptivni mehanizam. Volumen prvog udisaja je veći od volumena izdisaja; što je vrisak glasniji, to više razlike. Tako se stvara režim pozitivnog pritiska na kraju izdisaja, koji pomaže širenju pluća i stvaranju povećanog intrapulmonalnog pritiska, zbog čega se otvoreni dišni put brže zatvara. ovalni prozor i otvoreni ductus arteriosus, a plućni protok krvi se povećava, usmjeren kroz alveolarno tkivo. Proizvodnja surfaktanta postaje dovoljna, pluća se normalno šire.
Kada postoji nedostatak ili poremećaj u proizvodnji surfaktanta, površinska napetost u alveolama postaje vrlo visoka. Ako pri prvom udisanju transpulmonalni pritisak treba da bude do –40 cmH2O, onda za naredne inhalacije (surfaktant je već na snazi) iznosi –5 cmH2O.Ako postoji nedostatak surfaktanta, pritisak za otvaranje alveola ostaje kao visoko kao i pri prvom udisanju, plućni protok krvi se smanjuje, što remeti proizvodnju surfaktanta, ishemijsko tkivo postaje propusnije, plazma se transudira u alveole kroz alveolarnu kapilarnu membranu, a čak se i mala količina surfaktanta koji se nalazi u njima inaktivira sa formiranjem filma - hijalinske membrane. Godine 1959 Avery i Meed su prvi dokazali nedostatak surfaktanta kod novorođenčadi koja su umrla od BGM-a.
Surfaktant je monomolekularni sloj na granici između alveolarnog epitela i zraka. Sprječava kolaps alveola pri izdisaju i razvoj edema u plućima (regulišući propusnost zidova alveola i mikrocirkulaciju u plućima), štiti alveolarni epitel od oštećenja, a također učestvuje u lokalnim imunološkim reakcijama. Sa hemijske tačke gledišta, surfaktant je lipoprotein - smeša se sastoji od 90-95% lipida i 5-10% proteinske frakcije, koju predstavljaju četiri specifična proteina - SP-A, SP-B, SP-C, SP-D . Lipidni sastav surfaktanta uključuje fosfolipide (80%), čiji je glavni dio fosfatidilholin, i neutralne lipide.
Surfaktant se sintetizira od strane alveolocita tipa II počevši od 25-26 tjedna gestacije, a najaktivnija sinteza se opaža od 34 sedmice gestacije. Molekule surfaktanta su, s jedne strane, hidrofilne, fiksirane u vodenoj fazi, as druge, lipofilne, izbočene u gasnu fazu, što određuje aktivno površinsko djelovanje (zbog odbojnih intermolekularnih sila lipofilnih dijelova).
Tokom prenatalnog perioda, sazrevanje surfaktantnog sistema se dešava pod uticajem brojnih faktora. Važna uloga je dobro poznata steroidni hormoni u ovom procesu je utvrđen sinergistički efekat kortizola i hormona štitnjače i β-adrenergičkih agenasa. Postoji nekoliko mehanizama pomoću kojih glukokortikoidi utiču na sazrijevanje pluća. Endogeni glukokortikoidi utiču na adrenergički sistem, koji igra važnu ulogu u pripremi pluća za njihovu vanmaterničnu funkciju, stimulišu adrenergičke receptore i lučenje adrenalina u nadbubrežnim žlezdama fetusa. Glukokortikoidi direktno utiču na fibroblaste intersticijalnog tkiva, koji zauzvrat luče “fibroblast-pneumocitni faktor” - oligopeptid koji stimuliše sintezu fosfolipida u alveolocitima tipa 2.
Faktori koji doprinose razvoju SDR-a su:
- nedonoščad i morfo-funkcionalna nezrelost
- intrauterine infekcije
- intrauterina hipoksija i asfiksija tokom porođaja
- akutni gubitak krvi tokom porođaja
- dijabetes majke (insulin smanjuje proizvodnju surfaktanata)
- rođenje carskim rezom
- rođen kao drugi od blizanaca
- hlađenje djeteta, hiperoksija, hipovolemija.
Glavna karika u patogenezi SDR je i primarni nedostatak surfaktantnog sistema i patologija, kao što je aspiracija mekonijumske amnionske tečnosti, nedostatak plazminogena, edematozno-hemoragični plućni sindrom, dekompenzirani DIC sindrom, smanjena aktivnost antiproteaza, što dovodi do smanjenja ili povećana degradacija fosfatidilkolina.
Hipoventilacija i neadekvatna oksigenacija povezana s nedostatkom surfaktanta, popuštanjem prsnog koša, smanjenim disajnim volumenom, niskom pokornošću pluća i kratkim dahom dovode do teški poremećaji vitalne funkcije.
Sa nedovoljnom oksigenacijom tkiva metabolički procesi Kod novorođenčadi lakše prelaze na put anaerobne oksidacije nego kod odraslih, što dovodi do nakupljanja nedovoljno oksidiranih metaboličkih proizvoda u tijelu.
Hipoksija jetre doprinosi gubitku njene sposobnosti iskorištavanja glukoze, što dovodi do poremećaja resinteze ugljikohidrata iz mliječne kiseline. Povećanje nivoa mliječne kiseline u krvi tijekom hipoksije dostiže 9,4-9,9 mmol/l (normalno 2,0-2,4 mmol/l), pH krvi se smanjuje i razvija se acidoza. Povećanje katabolizma ugljikohidrata i odgovarajuće smanjenje njihove opskrbe potiče korištenje proteina kao energetskog supstrata. Karakterizira ga prisustvo hipoglikemije, hipoproteinemije, povećano izlučivanje dušika i smanjena tjelesna težina.
U pozadini hipoksije, povećava se propusnost kapilara, što dovodi do oslobađanja proteina u intersticijski prostor, onkotski tlak se smanjuje, a resorpcija tekućine je ograničena. Hipoksija i hipoksemija utiču na centralni nervni sistem, povećavajući propusnost moždanih sudova i podstičući pojavu krvarenja.
Hemodinamski poremećaji koji nastaju zbog respiratornog distres sindroma su vrlo opasni. Hiperkapnija dovodi do spazma plućnih sudova, što dovodi do pogoršanja plućnog krvotoka, povećanja pritiska u plućnom krugu i pojačanog šantiranja krvi kroz otvoreni foramen ovale i ductus arteriosus. Serous fluid kada se pritisak poveća, znoji se u alveole, pogoršavajući regionalni protok krvi i ventilaciju.
Anaerobni metabolizam negativno utječe na razmjenu energije u miokardu, smanjujući kontraktilnost srca, minutni volumen srca, povećanje kongestije u malom krugu, što zauzvrat dovodi do povećane hipoksije i hiperkapnije; metabolička acidoza nastavlja da raste. Kisela hrana razmjena ometa iskorištavanje kisika u tkivima i ometa tkivno disanje.
Akumulacija srednjih metaboličkih proizvoda doprinosi smanjenju tonusa prekapilarnih sfinktera. Krv slobodno prodire u kapilare, ali je ton sfinktera postkapilarnih vena otporniji na acidozu, što otežava otjecanje krvi. Akumulira se u mikrokapilarnom krevetu, povećavajući intravaskularnu koagulaciju. Kako se respiratorna insuficijencija pogoršava, razvija se deficit u volumenu cirkulirajuće krvi, što je također olakšano ekstravazacijom tekućine. Strukturni i funkcionalni poremećaji vaskularni endotel, znojenje plazme, javlja se edem.
Klinika.
Prvi znak sindrom u razvoju respiratorni poremećaj je kratak dah. Iako respiratorni mišići razvijaju veliki napor, a dušnik i bronhi otvoreni, plimni volumen se smanjuje nakon prvih udisaja. Pojačano disanje primjećuje se odmah nakon rođenja, a isprva otežano disanje (više od 60, kod vrlo nedonoščadi - više od 80 u minuti) nije praćeno cijanozom kože, jer je povezano s iritacijom kemoreceptora.
Kompleks simptoma respiratornog distres sindroma uključuje:
- Pojačana otežano disanje
- Širenje nosa
- Povlačenje podložnih područja grudnog koša
- Učešće u činu disanja pomoćnih mišića
- Cijanoza, koja se javlja kada je PaCO 2 veći od 30-40 mm Hg, u početku je perioralna, zatim akrocijanoza i generalizirana cijanoza.
- Blijeda koža
- Ekspiratorna buka uzrokovana kompenzacijskim grčem glotisa tokom izdisaja, sprječavajući kolaps alveola početna faza razvoj respiratornog distres sindroma.
- Auskultacijom se čuje slabljenje disanja u plućima, a kasnije se javljaju visoki, suvi, fino mehurasti i krepitirajući hripavi.
Ozbiljnost respiratorne insuficijencije kod prijevremeno rođene djece određuje se pomoću Silvermanove skale (Tabela 1)
Tabela 1. Silvermanova skala.
|
Faza 0 |
Faza 1 |
Faza 2 |
|
Gornji dio grudnog koša kada je dijete položeno na leđa i prednji trbušni zid sinhrono učestvuju u činu disanja |
Nedostatak sinhronizacije ili minimalno spuštanje gornjeg dela grudnog koša pri podizanju prednjeg trbušnog zida tokom inspiracije |
Primetna depresija grudnog koša tokom podizanja prednjeg trbušnog zida tokom inspiracije |
|
Nema povlačenja interkostalnih prostora tokom inspiracije |
Lagano povlačenje interkostalnih prostora tokom inspiracije |
Primetno povlačenje interkostalnih prostora tokom inspiracije |
|
Nema povlačenja ksifoidnog nastavka sternuma tokom inspiracije |
Lagano povlačenje ksifoidnog nastavka sternuma tokom inspiracije |
Primjetno povlačenje xiphoid procesa tokom inspiracije |
|
Nema pokreta brade pri disanju |
Spuštanje brade pri udisanju, zatvorenih usta |
Spuštanje brade pri udisanju, otvorenih usta |
|
Nema buke pri izdisaju |
Zvukovi izdisaja koji se čuju pri auskultaciji grudnog koša |
Ekspiratorni šum se čuje kada se fonendoskop prinese ustima ili bez fonendoskopa |
Ako je ukupan rezultat manji od 5 - početak SDR, 5 bodova - umjereni SDR, 6-9 bodova - teški i 10 bodova - izuzetno teški SDR.
Za SDR su tipični simptomi poremećaja cirkulacijskog sistema: sniženi krvni pritisak, poremećaji mikrocirkulacije, tahikardija. Auskultacijom se otkrivaju prigušeni tonovi.
Jetra se može povećati.Usljed hipoksičnog oštećenja endotela kapilara razvija se hipovolemija koja često dovodi do perifernog edema i zadržavanja tekućine. Karakteristična je depresija centralnog nervnog sistema, a kod djeteta se često otkrivaju periventrikularna krvarenja. Ostaje otvoreno pitanje šta je primarno - oštećenje mozga ili pluća. Daljnjom progresijom respiratornog distres sindroma razvija se dekompenzirani DIC sindrom. Tu je i visokog rizika dodatak sekundarne infekcije - pneumonija se razvija kod gotovo svakog drugog djeteta s respiratornim distres sindromom.
Tok SDR-a: najveća težina stanja je uočena prvog dana života, u budućnosti težina kliničkih manifestacija ovisi o komplikacijama koje nastaju (intraventrikularne hemoragije, sindromi "propuštanja zraka", teška plućna hipertenzija, dekompenzirani DIC sindrom , nekrotizirajući enterokolitis, itd.)
Dijagnostika.
Dijagnoza SDR se tradicionalno postavlja na osnovu anamneze, kliničkih i radioloških simptoma. Trijada znakova karakterističnih za SDR određuje se rendgenskim snimkom, koji se pojavljuje već u prvim satima bolesti:
- difuzno smanjenje transparentnosti plućnih polja
- reticulogranular reticularis
- prisustvo čistih pruga na tom području korijen pluća(zračni bronhogram)
IN teški slučajevi moguće je potpuno zamračenje plućnih polja, granice srca se ne mogu razlikovati.
IN U poslednje vreme U arsenalu doktora pojavile su se metode koje određuju stepen zrelosti i samog plućnog tkiva i surfaktantnog sistema. Najčešći i informativni test je određivanje omjera lecitina i sfingomijelina u amnionskoj tekućini, trahealnoj tekućini ili želučanom aspiratu pri rođenju. Ako je ovaj pokazatelj veći od 3, onda su pluća zrela, a ako je manji od 2, rizik od razvoja SDR je vrlo visok (50-75%).
Također se koristi i "pjenasti" test: dodavanjem etanola tekućini koja sadrži surfaktant i protresanjem stvara se pjena. Iste metode se mogu koristiti i za prenatalnu dijagnostiku, ali o pitanju amniocenteze treba odlučivati pojedinačno iu gestacijskoj dobi od najmanje 32 sedmice, jer u više ranih datuma gestacije, nezrelost pluća je van sumnje, a upravljanje trudnoćom zahtijeva minimum invazivnih studija.
Diferencijalna dijagnoza provedeno s upalom pluća, drugim pneumopatijama, razvojnim nedostacima respiratornog sistema i drugi respiratorni poremećaji plućnog i vanplućnog porijekla (CHD, porođajna trauma, metabolički poremećaji, itd.). Na primjer, kada Choanal atresia poremećaji disanja se uočavaju nakon prvog udisaja, napadi cijanoze i nedostatak nosnog disanja. Dijagnoza se postavlja kada je nemoguće provući kateter iz nosa u nazofarinks, ali je najpreciznija rendgenski pregled sa kontrastnim sredstvom.
At dijafragmalna kila uočavaju se respiratorni poremećaji raznih vrsta stepen ozbiljnosti, povezane s veličinom kile, napadi cijanoze, spontani i nakon hranjenja ili kada se promijeni položaj djeteta. Rendgenski pregled ima dijagnostičku vrijednost kada grudnu šupljinu otkrivaju se trbušni organi.
Upala pluća, koji se razvio u prvim satima nakon rođenja, praktično se ne razlikuje od SDR-a, dijagnoza se postavlja na osnovu rezultata klinička analiza krv, hemokulture i trahealni sadržaj, rendgenski snimak grudnog koša; mogu biti prisutna i druga žarišta upale.
Ako dijete ima porođajne povrede centralnog nervnog sistema cijanoza je često paroksizmalne prirode, primjećuju se neurološki simptomi ( nagli pad refleksi, konvulzije itd.), RTG prsnog koša ne otkriva promjene karakteristične za SDR. Za pojašnjenje dijagnoze radi se neurosonografija, lumbalna punkcija, a za simptome ozljede kičmene moždine radi se radiografija kralježnice.
Simptomi urođena srčana mana„Plavi“ tip je ponekad teško razlikovati od kliničke slike SDR-a; u ovom slučaju se cijanoza s urođenom srčanom bolešću opaža s trenutak rođenja, a pri udisanju 100% kiseonika dete ne doživljava povećanje PaO 2. Dijagnoza se potvrđuje rendgenskim snimkom grudnog koša, EKG-om i ehokardiografijom.
Tretman.
Etiološka metoda tretman je uvod egzogeni surfaktanti . Njihova upotreba je moguća i u preventivne i u terapeutske svrhe.
Preparati surfaktanata spadaju u četiri kategorije:
1. prirodni preparati dobijeni iz amnionska tečnost osoba (ako je donošena trudnoća riješena carskim rezom)
2. prirodni preparati dobijeni od usitnjenih pluća prasadi i teladi
3. polusintetičke mješavine mljevenih telećih pluća s dipalmitoilfosfatidilkolinom (DPPC)
4. potpuno sintetički preparati surfaktanata.
Kada se koriste prirodni surfaktanti, početak se javlja brže klinički efekat, ali se konačni rezultati liječenja ne razlikuju od onih kod propisivanja umjetnih surfaktanata. Pretpostavlja se da surfaktant izoliran iz pluća teladi i prasadi može izazvati imunološku reakciju na strani protein, ali nisu dobiveni uvjerljivi podaci. Najprirodniji surfaktant za dijete, napravljen od plodove vode, ne može se široko koristiti, jer je za liječenje jednog djeteta potrebna upotreba plodove vode iz 10 carskih reza. Osim toga, postoji rizik HIV infekcija, infekcija citomegalovirusom, herpes.
U našoj zemlji da kliničku primjenu dozvoljeno i dosta široko korišteno: exosurf neonatal - sintetička droga i Kurosurf, prirodni surfaktant iz pluća svinje.
Prevencija SDR-a se provodi u prva 2 sata života:
1. novorođenčad s porođajnom težinom manjom od 1250g
2. novorođenčad teže od 1250 g s potvrđenom nezrelošću pluća (na primjer, omjer lecitina i sfingomijelina u amnionskoj tekućini)
Liječenje SDR provodi se od 2 do 24 sata kod djece sa klinički i radiološki potvrđenom dijagnozom SDR, intubirane i na mehaničkoj ventilaciji.
Ne postoje kontraindikacije za upotrebu surfaktanta.U slučaju teške asfiksije potrebna je preliminarna stabilizacija centralne i plućne cirkulacije.
Od velikog značaja u lečenju respiratornog distres sindroma je obezbeđivanje adekvatna njega . Osnova je tehnika “minimalnog dodira”. Pregled kod ljekara ne bi trebao biti dug, traumatski efekti moraju biti svedeni na minimum. Važno je održavati optimalno temperaturni režim, jer hlađenje pomaže da se smanji ili zaustavi sinteza surfaktanta. Što je niža porođajna težina i mlađi uzrast dijete, temperatura u inkubatoru bi trebala biti viša. Važno je održavati ne samo optimalnu temperaturu, već i vlažnost kako bi se spriječio gubitak tekućine kroz kožu, posebno kod djece s ekstremno malom porođajnom težinom (Tabela 2).
|
Dob /težina |
<1000г |
1000-1500g |
1501-2500g |
|||
|
temperatura |
vlažnost |
temperatura |
vlažnost |
temperatura |
vlažnost |
|
|
0-24 sata |
35-37 |
75-85 |
34-36 |
70-75 |
33-35 |
|
|
24-96 sati |
34-36 |
33-35 |
60-65 |
31-33 |
||
|
4-14 dana |
33-35 |
32-34 |
31-33 |
|||
|
2-4 sedmice |
32-34 |
50-60 |
31-33 |
30-32 |
40-50 |
|
Djeca sa respiratornim distres sindromom zahtijevaju obavezno kontinuirano praćenje indikatori kao što su otkucaji srca, brzina disanja. Svaka 4 sata određuje se krvni pritisak, temperatura, acidobazni status, PaO 2, PaCO 2, nivo glukoze i natrijuma u krvi,
IN akutni period respiratornog distres sindroma, potrebno je uraditi klinički test krvi, RTG prsnog koša, EKG, biohemijski test krvi, po mogućnosti koagulogram, određivanje zapremine krvi najmanje jednom u 2 dana. Također je potrebno često raditi hemokulture i trahealnog sadržaja i neurosonografiju.
Nastoje da ne koriste enteralnu prehranu u prva 2 dana života zbog rizika od regurgitacije i kardiopulmonalnih komplikacija. Već u prvom satu života počinju planirati parenteralna ishrana . Apsolutne indikacije za njegovu primjenu su hemodinamski poremećaji i hipoksemija (PaO2 arterijske krvi ispod 50 mmHg). Prvog dana života zapremina primenjene tečnosti je 30-40 ml/kg, zatim se postepeno povećava na 70-100 ml/kg do 7. dana života i na 150-180 do 1. meseca. Volumen tečnosti treba odrediti individualno, uzimajući u obzir dob djeteta, gestacijsku dob, diurezu, bcc, dinamiku tjelesne težine, stanje kardiovaskularnog sistema, perifernu cirkulaciju, acidobazni status, način dojenja djeteta i mehaničku ventilaciju način rada.
Mora se uzeti u obzir da višak tečnosti može dovesti do edema, uključujući plućni edem, i perzistentnosti otvorenog ductus arteriosus. Prvog dana života daje se 10% otopina glukoze (kod djece s porođajnom težinom manjom od 1000 g - 5% otopina glukoze). Aminokiseline se mogu koristiti od kraja prvog - početka drugog dana života, prvog dana primjene količina proteina ne smije prelaziti 1,5 g/kg, a zatim se postepeno povećava na 2,5-3 g/kg , a kod djece s porođajnom težinom manjom od 1000 g – do 4 g/kg. Koriste se standardne otopine aminokiselina, po mogućnosti koje sadrže aminokiselinu taurin (aminovenoza), jer smanjenje njegovog nivoa može dovesti do oštećenja mozga i retine.
Prisutnost plućne patologije je kontraindikacija za parenteralnu primjenu masti do 7 dana života; ako se parenteralna ishrana održava u ovoj dobi, masti se daju počevši od 0,5 g/kg, postepeno povećavajući do 2 g/kg. Infuzija masnih emulzija se provodi vrlo malom brzinom tokom cijelog dana. Potrebe za mineralima su: natrijum - 1,2 mmol/kg, kalijum - 0,8 mmol/kg, hloridi - 0,86 mmol/kg, kalcijum - 3,2 mol/kg, magnezijum - 0,16 mmol/kg. Koriste se natrijum hloridi, kalijum hloridi, kalcijum glukonat itd. Treba imati na umu da unošenje samo soli hlorovodonične kiseline može dovesti do hiperhloremične metaboličke acidoze, pa se stoga koriste i laktati, fosfati i druge soli.
Vrijeme primjene enteralne ishrane je individualno, ali treba napomenuti da njena rana primjena stimulira sazrijevanje gastrointestinalnog trakta, smanjuje učestalost holestaze, a pri hranjenju nativnim majčinim mlijekom smanjuje rizik od nastanka nekrotizirajućeg ulceroze. kolitis, a za to je dovoljno davati 0,5 ml/kg/sat. Preostale potrebe mogu se zadovoljiti parenteralnom ishranom. Indikovana je upotreba prirodnog majčinog mlijeka ili specijaliziranih formula za prijevremeno rođenu djecu. Probna doza od 5 ml mlijeka primjenjuje se kroz nazogastričnu sondu i, u odsustvu nadimanja abdomena, regurgitacije ili apneje, volumen enteralne prehrane se postepeno povećava.
Važan dio SDR terapije je pružanje i održavanje slobodan disajni put . Kada se dijete rodi u asfiksiji ili sa aspiracijom mekonija, potrebno je izvršiti intubaciju i odsisavanje sadržaja respiratornog trakta. Po potrebi se usisavanje ponavlja u toku bolesti (uzimajući u obzir kliničku i radilošku sliku), ali ne smijemo zaboraviti da se prilikom ove manipulacije javljaju hipoksemija, bradikardija i hipertenzija, a provocira se i razvoj intrakranijalnih krvarenja. Trahealna drenaža se poboljšava periodičnim promjenama položaja djeteta (okreće se na bok, na stomak).
U patogenezi SDR-a hipoksija i hipoksemija su od primarnog značaja, te stoga najvažniju ulogu u liječenju respiratornog distres sindroma imaju terapija kiseonikom. Prilikom odabira načina unošenja kisika i njegove koncentracije u respiratornu smjesu potrebno je uzeti u obzir da parcijalni tlak kisika u krvi iznad 50 mmHg već obezbjeđuje dovoljnu oksigenaciju, a kada je PaO 2 iznad 80 mmHg, toksični pojavljuju se svojstva kiseonika, što će biti navedeno u nastavku. Praćenje parcijalnog pritiska kiseonika u arterijskoj krvi i frakcione koncentracije kiseonika u mješavina za disanje omogućava doktoru da osigura dovoljnu oksigenaciju djeteta i izbjegne moguće komplikacije terapije kiseonikom. Također je potrebno kontrolirati temperaturu smjese za disanje i njenu vlažnost. Prilikom udisanja hladne mješavine razvija se klinika za hlađenje djeteta. Ovlaživanje respiratorne mješavine je potrebno kada je koncentracija kisika veća od 40%, jer je gubitak tekućine moguć zbog znojenja.
U terapiji kiseonikom se široko koriste nazalni kateteri, maske, šatori za kiseonik i inkubatori sa dovodom kiseonika. Uz istu koncentraciju kisika u smjesi, maksimalna koncentracija u respiratornom traktu se uočava u šatoru za kiseonik ili inkubatoru, ali je potrošnja kiseonika kod ovih metoda terapije kiseonikom velika. Nosni kateteri ne dozvoljavaju stvaranje visoke koncentracije kisika, a osim toga otežavaju nosno disanje i iritiraju nosnu sluznicu. Maske za lice mogu održavati stabilne i prilično visoke koncentracije kisika; njihovi nedostaci uključuju poteškoće u fiksiranju i zatvaranju.
Spontano kontinuirano disanje pod pozitivnim pritiskom (CPBP) sprečava zatvaranje disajnih puteva ekspiratorom, nadoknađujući smanjeni nivo surfaktanta i sprečava lepljenje alveola. Povećava se izmjena plinova, smanjuje se oticanje alveolarne kapilarne membrane, a parcijalni tlak kisika u arterijskoj krvi raste dok koncentracija u respiratornoj smjesi ostaje nepromijenjena. Često se primjećuje smanjenje PaCO 2. Indikacije za CPAP su hipoksemija (PaO 2 manji od 50 mmHg) kada se koristi 50% respiratorna mješavina, povezana s poremećenim omjerom ventilacije i perfuzije, visokim intrapulmonalnim ranžiranjem, smanjenom plućnom kompliansom, kao i upornim otežanim disanjem, Silverman rezultatom 5 bodova i više. Kontraindikacije: bronhopleuralne fistule, pneumotoraks i drugi sindromi “propuštanja zraka”.
Trenutno, najčešća metoda za CPAP je korištenje nazalnih kanila. SDPPD sa Martin vrećicom se rjeđe koristi. Postupak počinje udisanjem respiratorne mješavine zagrijane na 32-34 0 C i navlažene na 80-100%, a zatim se pod kontrolom PaO 2 koncentracija smjese smanjuje na 50%. Početni pozitivni pritisak je 4 cm vodenog stupca. Za prijevremeno rođene bebe sa porođajnom težinom manjom od 1500 g, pritisak bi trebao biti 2-3 cm vodenog stupca. Indikacije za zaustavljanje SDPPD-a su stabilizacija PaO 2 iznad 60 mm Hg pri udisanju 50% smjese i tlak jednak atmosferskom. Nakon prestanka CPAP-a, dijete se obično stavlja u šator za kiseonik.
Ako pri maksimalnom mogućem pritisku (do 8-10 cmH2O) i maksimalnoj koncentraciji kiseonika (100%) nema terapijskog efekta, dijete se mora premjestiti na umjetna ventilacija pluća (ALV) . Koriste se različiti načini ventilacije - prisilna ventilacija, prisilna ventilacija sa konstantnim pozitivnim pritiskom na kraju izdisaja, potpomognuta i visokofrekventna ventilacija.
Adekvatna mehanička ventilacija dovodi do eliminacije hiperkapnije i hipoksije, što je povezano s povećanjem volumena ventilacije, poboljšanjem omjera ventilacije i perfuzije i smanjenjem intrapulmonalnog ranžiranja. Uklanjanje respiratorne acidoze i postupna normalizacija pH doprinosi obnavljanju metaboličkih procesa. Mikrocirkulacija se poboljšava, hemodinamika se normalizuje.
Međutim, potrebno je spomenuti i moguće nepovoljne patofiziološke promjene - mijenja se mehanika disanja, smanjuje se popuštanje pluća, povećava se aerodinamički otpor respiratornog trakta, pogoršava se drenaža sputuma, što sa smanjenjem surfaktanta dovodi do razvoja mikroatelektaze. Povećan pritisak u plućnom traktu dovodi do poremećaja plućnog krvotoka – razvoja edema, ekstravazacije tečnosti u alveole. Karakteristike koje komplikuju mehaničku ventilaciju kod novorođenčadi uključuju male plimne zapremine, velike brzine protoka gasa i visok otpor disajnih puteva.
Apsolutne indikacije za vještačku ventilaciju su odsustvo spontanog disanja i patoloških ritmova disanja (oštećenje centralnog nervnog sistema, teška intoksikacija). Uz konstantno progresivnu hipoventilaciju, klinički znaci potrebe za mehaničkom ventilacijom su: pojačana cijanoza, povećanje brzine disanja 2 puta veće od normalne ili teška bradikardija, učešće pomoćnih mišića, acidobazna ravnoteža (PaCO 2 iznad 60 mm Hg ili povećanje više od 10 mm Hg Art., PaO 2 ispod 50 na 50% respiratorne smjese, acidoza - pH ispod 7,2 (uprkos uvođenju sode u dozi od 2-4 mmol po kg).
Početni parametri mehaničke ventilacije: brzina disanja 30-40 u minuti, i plimni volumen takav da maksimalni inspiratorni pritisak dostigne 20-25 cm H2O. Koncentracija kiseonika je podešena na 70-80%, odnos udaha i izdisaja je 1:1. Nakon 10-15 minuta analizira se acidobazna ravnoteža i plinovi u krvi. Mehanička ventilacija se može smatrati adekvatnom ako je parcijalni pritisak kiseonika u arterijskoj krvi 50-80 mmHg, zasićenost hemoglobina kiseonikom 91-96%, transkutana napetost kiseonika 60-90 mmHg, parcijalni pritisak ugljen-dioksida u arterijskoj krvi - 35- 45 mmHg, transkutani napon CO 2 -35-50 mmHg. Kako se stanje poboljšava, prvi korak je smanjenje koncentracije kisika što je brže moguće na netoksični nivo - ispod 50%. Zatim se postepeno smanjuje pozitivni pritisak na kraju izdisaja, smanjuje se omjer udaha i izdisaja, a tek tada se smanjuje frekvencija disanja.
Nakon mehaničke ventilacije dijete se prebacuje na ventilator s pritiskom od 3-5 cm H2O i koncentracijom kisika za 10% većom nego kod mehaničke ventilacije. Ako se znaci respiratorne insuficijencije ne pojačaju u roku od 12 sati, dijete se ekstubira.
Korekcija acidoze provodi se korištenjem 4% otopine natrijum bikarbonata, čija je količina (u ml) određena formulom BE x težina u kg/4.
KKB se takođe koristi u dozi od 5-8 mg/kg. Kokarboksilaza pomaže u normalizaciji pH stanice, poboljšanju sinteze ATP-a i iskorištavanju glukoze.
Antibakterijska terapija. Propisuje se od trenutka postavljanja dijagnoze SDR. Indicirano zbog rizika od razvoja intrauterine infekcije i dodavanja sekundarne infekcije, posebno tokom vještačke ventilacije.Penicilinski lijekovi (ampicilin u dozi od 150-300 hiljada U/kg/dan u 3-4 doze) ili cefalosporini (klaforan 50 ) obično se propisuju mg/kg/dan u 2-3 doze, Fortum 30-50 mg/kg/dan u 2 doze, Longacef ili Rocephin 50 mg/kg jednom dnevno itd.) u kombinaciji sa aminoglikozidima (amikacin ili selemicin u dnevnoj dozi 10-15 mg/kg, podijeljeno u 2 doze). Trajanje i priroda antibakterijske terapije utvrđuje se nakon pregleda na infekciju i prijema kliničkih rezultata. test krvi u dinamici.
U terapiji se koristi i vitamin E (α-tokoferol), koji stimuliše sintezu citokroma i ima efekat uštede surfaktanta. α-tokoferol se propisuje u dozi od 10-15 mg/dan, oralno ili parenteralno (kao 5% rastvor).
Primjena glukokortikoida djeci sa respiratornim distres sindromom indikovana je za sekundarnu insuficijenciju nadbubrežne žlijezde. Ranije su se ovi lijekovi koristili u liječenju SDR-a na planski način s ciljem ubrzanja sazrijevanja plućnog tkiva. Široka upotreba egzogenih surfaktanata u praksi omogućila je izbjegavanje nuspojava terapije glukokortikoidima (arterijska hipertenzija, gastrointestinalno krvarenje, nekrotizirajući enterokolitis, hiperglikemija)
Komplikacije SDR i terapije kiseonikom: retrolentna fibroplazija novorođenčadi, bronhopulmonalna displazija, sindromi curenja zraka iz pluća (pneumotoraks, pneumomedijastinum, pneumperikard).
Retrolentna fibroplazija (RLF) razvija se u pozadini hiperoksemije i nedovoljne vaskularizacije. Pri visokim vrijednostima PaO 2 (>100 mmHg) dolazi do perzistentnog suženja retinalnih žila, što je jedina klinička manifestacija početne faze bolesti. 1-2 mjeseca nakon završetka terapije kisikom dolazi do širenja krvnih žila retine i počinje njihova proliferacija i edem retine. Uz manje promjene, često se opaža spontani oporavak mrežnice. U 25% slučajeva se javlja dezinsercija retine, ožiljci i sljepilo. Učinkovito u više od polovine slučajeva kod ablacije retine hirurška intervencija. Ako je dijagnoza kasna i lezija je značajna, liječenje je neučinkovito. Zbog toga je potrebno strogo praćenje PaO 2 tokom terapije kiseonikom i obavezan pregled fundusa po otpustu iz bolnice.
Bronhopulmonalna displazija (BPD) - hronična progresivna bolest pluća, rezultat toksičnog dejstva kiseonika na plućno tkivo. Glavni razlozi njegovog razvoja su koncentracije kiseonika iznad 50% u respiratornoj mešavini i visoki nivoi pozitivnog pritiska (više od 30 cm vodenog stuba) tokom mehaničke ventilacije. Važnu ulogu ima i trajanje mehaničke ventilacije (više od 72 sata) i stepen nedonoščadi djeteta. Kod BPD-a oštećuju se gotovo sve plućne strukture, smanjuje se pokornost pluća, a povećava se aerodinamički otpor disajnih puteva i respiratorni rad. Razvijaju se hipoperfuzija pluća i plućna hipertenzija, a potom hipertrofija desne komore i plućno tijelo. Stopa mortaliteta za BPD je 30-50%.
Sindromi curenja zraka iz pluća. Ova grupa komplikacija uključuje:
1. intersticijski emfizem, kod kojeg se zrak akumulira u intersticijskom prostoru. Klinički je malo izražen, ali može biti praćen povećanjem potrebe za kiseonikom i povećanjem PaCO 2. Progresija intersticijalnog emfizema u polovini slučajeva dovodi do pneumotoraksa. Dijagnosticira se samo rendgenskim snimkom. U ovom slučaju na rendgenskom snimku se pojavljuju četkice i linearne čistine. Zahvaćenost pluća je obično bilateralna. S razvojem emfizema provode se promjene parametara mehaničke ventilacije (smanjenje vršnog inspiratornog pritiska i pozitivnog pritiska na kraju izdisaja).
2. pneumotoraks može biti ili spontan, povezan sa nezrelošću respiratornog sistema i SDR-om, ili kao rezultat respiratorne podrške (ventilator, podrška ventilatorima). Smatra se da se pneumotoraks javlja kod 30-50% djece sa SDD i one na mehaničkoj ventilaciji. Najčešće se radi o teškom pneumotoraksu, koji zahtijeva hitnu intervenciju. Dijagnoza se postavlja na osnovu kliničkih manifestacija: oštro pogoršanje stanja djeteta, slabljenje disanja, nedostatak sinhronizacije disanja, cijanoza, tahikardija; potvrđeno rendgenskim snimkom: nakupljanje zraka u pleuralnoj šupljini, pomak medijastinuma, kolaps pluća. Zahtijeva drenažu pleuralne šupljine.
3. Pneumomedijastinum. Rijetko se javlja, može biti spontan. Obično se manifestuje prigušenošću srčanih tonova, kratkim dahom i mogućom cijanozom. Dijagnoza se potvrđuje rendgenskim snimkom: bočni rendgenski snimak grudnog koša pokazuje zonu čišćenja koja se nalazi iza grudne kosti ili u gornjem dijelu medijastinuma. Na direktnom rendgenskom snimku, ponekad akumulirani zrak odvaja senku srca timusna žlezda(„krilo leptira“ ili „jedro“). Vazduh se sam rastvara, poseban tretman ova komplikacija nije potrebna.
4. pneumperikard je rijedak. Kod napetog patrljka-perikarda može doći do tamponade srca. Manifesti oštro pogoršanje stanje, cijanoza, teška tupost srčanih tonova. Liječenje: perikardijalna punkcija.
Periventrikularno krvarenje (PVH). Najčešći su kod djece s malom porođajnom težinom i velika je vjerovatnoća da će uzrokovati smrt (kod 40% pacijenata). PVC-ovi se mogu pojaviti do klinička manifestacija SDR, a na pozadini respiratornog distres sindroma zbog hipoksije, hiperkapnije, srčane disfunkcije, respiratorne i metaboličke acidoze itd. Što je respiratorni distres sindrom teži, to je veći rizik od razvoja periventrikularnih hemoragija. Ne smijemo zaboraviti ni jatrogene PVC-e koje nastaju pri oštrim modovima mehaničke ventilacije, mlaznom ubrizgavanju hiperosmolarnih otopina, gruboj manipulaciji, koja je povezana s povećanjem ili oštrim fluktuacijom sistemskog tlaka. Jedan od uobičajenih mehanizama za nastanak jatrogenog PVC-a je transport u drugi medicinska ustanova dijete sa SDD u akutnom periodu, posebno u prva tri dana života.
Prevencija SDR-a.
Glavna metoda je prevencija pobačaja. Najčešći uzroci prijevremenog porođaja su urogenitalne infekcije, neuro-hormonski poremećaji i izloženost egzogenim faktorima. To je jedino moguće sveobuhvatno rješenje ovaj problem, uključujući pripremu žene za trudnoću, saniranje mogućih žarišta infekcije, pravilno vođenje trudnoće i porođaja. Ne smijemo zaboraviti ni potrebu socijalne zaštite trudnica. Za druge važna metoda je upotreba lijekova koji ubrzavaju sazrijevanje plućnog tkiva u fetusa, kao što su glukokortikoidi, aminofilin, tiroksin, u nedostatku kontraindikacija za njihovu primjenu kod trudnice. Terapija glukokortikoidima za prijeteći prijevremeni porođaj postala je široko rasprostranjena. Trenutno se uglavnom koristi deksametazon (6 mg x 4 puta sa intervalom od 12 sati) ili betametazon (12 mg x 2 puta sa intervalom od 24 sata).
Slični članci
-
Šta je osiguranje vlasništva za promet nekretninama i koliko košta?
Osiguranje vlasništva je danas vrlo uobičajena vrsta osiguranja. To je zbog činjenice da velika većina bankarskih institucija izrazito nerado izdaje kredite osigurane nekretninama ili, jednom riječju,...
-
Kolekcionari - treba li ih se bojati?
Agencije za naplatu nisu najprijatnija aktivnost na svijetu. Oni kupuju gotovo loše dugove od banaka/kreditnih organizacija i pokušavaju da ih povrate, često koristeći prilično kontroverzne metode. Donedavno...
-
Kolekcionari su podneli tužbu. Trebamo li se plašiti? Kako se riješiti uterivača dugova: najbolji savjeti Čega se agencije za naplatu plaše
Važno je napomenuti da je prema uslovima ustupanja, odnosno ustupanja prava potraživanja, obavezni uslov obaveštavanje dužnika. Po zakonu, klijent mora od banke dobiti papir koji ga obavještava da je njegov dug prebačen na agenciju za naplatu...
-
Imenik - šifre vrsta dokumenata za porez
Kako bi pojednostavili tok dokumenata i smanjili opterećenje osoblja, poreski inspektorati koriste posebnu kodifikaciju. Neophodno je to znati ne samo službenicima, već i građanima. To se objašnjava činjenicom da u nekim...
-
Imenik - šifre vrsta dokumenata za porez
Ekonomska situacija prisiljava ljude da se kreću u potrazi za poslom. Da biste legalno dobili posao, potrebno je podnijeti zahtjev za patent ili sklopiti ugovor o radu. Državljani Rusije, najamni radnici - migranti koji su stigli na teritoriju...
-
Koja je šifra dokumenta o boravišnoj dozvoli?
Prilikom podnošenja izvještaja i potvrda Federalnoj poreznoj službi, koji zahtijevaju navođenje vrste dokumenta koji identifikuje osobu, potrebno je zabilježiti šifru vrste odgovarajućeg dokumenta. Gdje mogu dobiti ove kodove i koji kod...
