Zespół zaburzeń oddechowych u noworodków. Główne zespoły kliniczne w chorobach układu oddechowego
Zakład Propedeutyki Chorób Wewnętrznych
Rozwój metodologiczny
Za samodzielną pracę studentów trzeciego roku
Temat: „Podstawowe zespoły kliniczne na choroby układu oddechowego”
Stawropol
Główne zespoły kliniczne w chorobach
narządy oddechowe
Zespół – jest to zespół objawów połączonych jednym mechanizmem rozwoju (patogeneza)
Wyróżnia się następujące zespoły płucne:
1. Zespół normalnej tkanki płucnej
2. Zespół ogniskowego zagęszczenia tkanki płucnej
3. Zespół płatowego zagęszczenia tkanki płucnej
4. Zespół jamy w tkance płucnej
5. Zespół niedodmy obturacyjnej
6. Zespół niedodmy uciskowej
7. Zespół gromadzenia się płynów jama opłucnowa
8. Zespół gromadzenia się powietrza w jamie opłucnej
9. Zespół nadmiaru powietrza w płucach
10. Zespół zwężenia oskrzeli z lepkim wysiękiem
11. Zespół obstrukcji oskrzeli
12. Zespół Fibrothorax lub cumowanie
13. Syndrom niewydolność oddechowa
Zestaw objawów konkretnego zespołu płucnego wykrywa się przy użyciu głównych (badanie ogólne, badanie klatka piersiowa, palpacja, opukiwanie, osłuchiwanie) i dodatkowe (prześwietlenie klatki piersiowej, analiza krwi i plwociny) metody badawcze.
Normalny zespół tkanki płucnej
^
Reklamacje: nie
Badanie klatki piersiowej: klatka piersiowa ma regularny kształt, obie połowy klatki piersiowej są symetryczne i biorą w równym stopniu udział w akcie oddychania. Liczba ruchów oddechowych wynosi 16-18 na minutę. Oddychanie jest rytmiczne, rodzaj oddychania jest mieszany.
Palpacja
Perkusja: Na całej powierzchni tkanki płucnej wykrywa się wyraźny dźwięk płuc.
Osłuchiwanie: oddech pęcherzykowy słychać na całej powierzchni tkanki płucnej, nie występują niekorzystne dźwięki oddechowe.
Rentgen: tkanka płucna jest przezroczysta.
Badanie krwi i plwociny: bez zmiany.
^
Zespół ogniskowego zagęszczenia tkanki płucnej

Zespół ten charakteryzuje się tworzeniem małych ognisk zagęszczenia otoczonych prawidłową tkanką płuc.
^ Występuje, gdy:
A) ogniskowe zapalenie płuc (odoskrzelowe zapalenie płuc), pęcherzyki płucne są wypełnione płynem zapalnym i fibryną.
B) zawał płuc (wypełnienie pęcherzyków krwią)
B) stwardnienie płuc, karnizacja (wzrost tkanki płucnej z tkanką łączną lub nowotworową)
Patomorfologia: Tkanka płucna jest zwarta, ale zawiera trochę powietrza.
^ Reklamacje: duszność, kaszel.
Generalna Inspekcja : bez zmiany.
Badanie klatki piersiowej: pewne opóźnienie „chorej” połowy klatki piersiowej podczas oddychania.
Palpacja: klatka piersiowa bezbolesna, elastyczna. Drżenie głosu nasila się z dużym ogniskiem płucnym zlokalizowanym powierzchownie.
Perkusja
Osłuchiwanie: oddychanie oskrzelowo-pęcherzykowe, drobno wilgotne - i
Średnio bulgoczący, dźwięczny świszczący oddech, zlokalizowany w określonym obszarze. Zwiększona bronchofonia.
Rentgen: ogniska nacieku zapalnego płuc
Tkanki występują na przemian z obszarami prawidłowej tkanki płuc; obraz płuc w „dotkniętym odcinku” może być wzmocniony.
^ Badanie krwi : umiarkowana leukocytoza, przyspieszona ESR.
Badanie plwociny: plwocina śluzowa, może być pokryta krwią, nie zawiera duża liczba leukocyty, erytrocyty.
^
Zespół płatowego zagęszczenia tkanki płucnej
P  W tym zespole, w przeciwieństwie do zespołu ogniskowego zagęszczenia tkanki płucnej, w proces zaangażowany jest cały płat płuca.
W tym zespole, w przeciwieństwie do zespołu ogniskowego zagęszczenia tkanki płucnej, w proces zaangażowany jest cały płat płuca.
^
Występuje, gdy:
A) płatowe zapalenie płuc(pleuropneumonia) pęcherzyki płucne są wypełnione płynem zapalnym i fibryną.
b) stwardnienie płuc, karnizacja (kiełkowanie płata płuca z tkanką łączną i nowotworową).
Wyniki fizykalne w płatowym zapaleniu płuc:
Patomorfologia: tkanka płucna jest zwarta, ale zawiera pewną ilość powietrza (stadium I-III), tkanka płucna jest gęsta i pozbawiona powietrza (stadium II).
^ Reklamacje: ból w klatce piersiowej, duszność, kaszel.
Generalna Inspekcja: akrocyjanoza trójkąta nosowo-wargowego, wysypki opryszczkowe na ustach, nosie.
Badanie klatki piersiowej: opóźnienie „chorej” połowy klatki piersiowej podczas oddychania.
Palpacja: ból w dotkniętej połowie klatki piersiowej, drżenie głosu jest nieznacznie zwiększone (stadium I-III), znacznie zwiększone (stadium II).
Perkusja: przytępienie dźwięku perkusyjnego z odcieniem bębenkowym w stadiach I-III, przytępienie w stopniu II (gęste, pozbawione powietrza płuco).
Osłuchiwanie: osłabienie oddychania pęcherzykowego z zabarwieniem oskrzeli w stadiach I-III, oskrzelowe w stadiach II. Crepitacja początkowa (crepitatio indux) w etapie I, krepitacja rozdzielczości (crepitatio redux) w etapie III.
Bronchofonia jest nieznacznie lub znacząco zwiększona. Może wystąpić tarcie opłucnej.
Rentgen: jednorodne ciemnienie tkanki płucnej obejmujące odcinek lub płat płuca.
^ Badanie krwi : leukocytoza, przyspieszona ESR.
Badanie plwociny: śluzowo-ropna plwocina zmieszana z krwią („rdzawa”), zawiera dużo leukocytów, erytrocytów
^
Zespół jamy płucnej
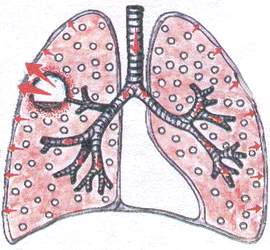
Aby zdiagnozować ubytek metodami badania fizykalnego, musi on spełniać następujące warunki:
Średnica wnęki musi wynosić co najmniej 4 cm.
jama musi być połączona z oskrzelem.
wnęka musi być „pusta”.
wnęka jest „stara”, o gęstych krawędziach.
wnęka musi być zlokalizowana powierzchownie.
Zespół ten występuje, gdy:
a) ropień płuc
b) rozstrzenie oskrzeli
D) z zapadnięciem się tkanki płucnej
Uskarżanie się: kaszel z ropną plwociną w dużych ilościach, częściej pełne usta, temperatura septyczna z obfitymi nocnymi potami (charakterystyczna dla ropnia płuc, rozstrzeni oskrzeli), kaszel z krwawą plwociną lub krwią (z gruźlicą jamistą, zapadnięciem się tkanki płucnej).
^ Ogólna inspekcja: akrocyjanoza, sinica rozlana, zmiany w paliczkach końcowych („ Pałeczki„, „okulary do zegarków”).
Badanie klatki piersiowej: opóźnienie „chorej” połowy klatki piersiowej podczas oddychania, tachypne.
Palpacja: czasami ból w klatce piersiowej, nasilone drżenie głosu.
Perkusja: matowy dźwięk bębenkowy, z dużą wnęką zlokalizowaną na obrzeżach - dźwięk bębenkowy o metalicznym odcieniu.
Osłuchiwanie: oddychanie oskrzelowe lub amforyczne, wilgotne, średnio- i wielkopęcherzykowe, dźwięczne świszczący oddech. Zwiększona bronchofonia.
Rentgen: Na tle ciemnienia obserwuje się oczyszczanie tkanki płucnej przy poziomym poziomie płynu.
^ Badanie krwi : hiperleukocytoza, znacznie przyspieszona ESR, możliwa niedokrwistość.
Badanie plwociny: plwocina jest ropna, może mieszać się z krwią, zawiera dużą liczbę leukocytów, może zawierać czerwone krwinki, włókna elastyczne.
^
Zespół niedodmy obturacyjnej
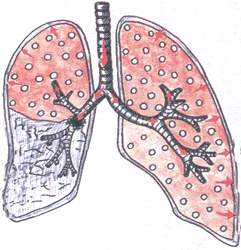
W przypadku tego zespołu zapadnięcie się tkanki płucnej obserwuje się w wyniku częściowego lub całkowitego zablokowania dużego oskrzela przez guz, powiększone węzły chłonne lub ciało obce.
Patomorfologia: gdy oskrzela są całkowicie zablokowane, powietrze nie dostaje się do płuc, tkanka płuc jest gęsta. Przy częściowym zablokowaniu oskrzeli tkanka płuc jest zagęszczona, ale zawiera niewielką ilość powietrza.
^ Reklamacje: silna duszność, kaszel, ból w klatce piersiowej.
Generalna Inspekcja: bladość skóra, umiarkowana sinica.
Badanie klatki piersiowej: przy długotrwałej blokadzie następuje cofnięcie „chorej” połowy klatki piersiowej (zapadnięta tkanka płuc zajmuje mniej miejsca), przyspieszony oddech, opóźnienie „chorej” połowy podczas głębokiego oddychania.
Palpacja: pewna sztywność dotkniętej połowy klatki piersiowej. Drżenie głosu jest osłabione przy częściowym zablokowaniu oskrzeli, znacznie osłabione lub wcale przy całkowitym zablokowaniu oskrzela doprowadzającego (nie ma warunków do przepływu powietrza).
Perkusja: przy niepełnej blokadzie oskrzeli występuje tępy dźwięk bębenkowy, przy całkowitej blokadzie - absolutnie tępy dźwięk.
Osłuchiwanie: oddech jest osłabiony, pęcherzykowy lub w ogóle niesłyszalny. Bronchofonia jest znacznie osłabiona lub w ogóle nie obserwowana.
Rentgen: jednorodny cień w obszarze niedodmy. Serce i duże statki przeciągnięty na stronę „chorą”.
Badanie krwi i plwociny: Nie będzie znaczących zmian.
^
Zespół niedodmy uciskowej
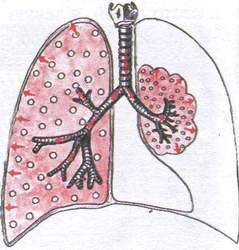
Zespół ten obserwuje się, gdy tkanka płuc jest ściskana z zewnątrz przez płyn (opłucnowa) lub powietrze (odma opłucnowa).
Patomorfologia: tkanka płucna jest zwarta, ale zawiera pewną ilość powietrza, ponieważ połączenie z oskrzelami nie jest zerwane i powietrze w dalszym ciągu napływa do płuc.
^ Reklamacje: duszność, kaszel, ból w klatce piersiowej.
Generalna Inspekcja: sinica, zmiany w paliczkach końcowych („pałeczki perkusyjne”).
Badanie klatki piersiowej: wysunięcie „chorej” połowy klatki piersiowej z powodu gromadzenia się płynu lub powietrza w jamie opłucnej, przyspieszony oddech, opóźnienie „chorej” połowy podczas oddychania.
Palpacja: sztywność „dotkniętej” połowy klatki piersiowej, drżenie głosu jest nieznacznie zwiększone.
Perkusja: otępienie z odcieniem bębenkowym.
Osłuchiwanie: osłabienie oddychania pęcherzykowego z zabarwieniem oskrzelowym lub oskrzelowym (stworzono do tego warunki przewodzenie - płucne tkanina jest gruba).
Rentgen: w obszarze niedodmy występuje jednorodny cień związany z oskrzelem.
^ Badanie krwi i plwociny : Nie będzie znaczących zmian.
Zespół gromadzenia się płynu w jamie opłucnej
(opłucnowa)
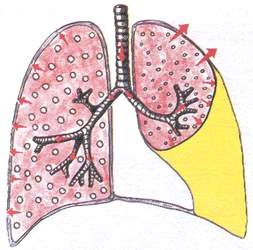
Zespół ten charakteryzuje się nagromadzeniem płynu niezapalnego (przesiękiem) - w przypadku niewydolności serca lub nagromadzeniem płynu zapalnego (wysiękowe zapalenie opłucnej) lub nagromadzeniem krwi (w przypadku urazu klatki piersiowej, skazy krwotocznej).
Uskarżanie się: Na wysiękowe zapalenie opłucnej(ból w klatce piersiowej, duszność, kaszel, gorączka), z niewydolnością serca (ból serca, kołatanie serca, ból w prawym podżebrzu, obrzęk).
^ Ogólna inspekcja
Badanie klatki piersiowej: wysunięcie „chorej” połowy klatki piersiowej (stopień wypukłości zależy od ilości płynu), przyspieszony oddech, opóźnienie „chorej” połowy podczas oddychania.
Palpacja: po uszkodzonej stronie klatka piersiowa jest bolesna i sztywna. Drżenie głosu jest znacznie osłabione lub nieobecne, w zależności od ilości płynu w jamie opłucnej.
Perkusja: często tępy (udowy) dźwięk. Podczas stagnacji poziom cieczy jest niski i poziomy po obu stronach. W przypadku wysiękowego zapalenia opłucnej poziom płynu może być wysoki, otępienie określa ukośna linia Damoiseau po jednej stronie.
Osłuchiwanie: oddychanie jest znacznie osłabione lub nieobecne, w zależności od ilości płynu w jamie opłucnej. Po zdrowej stronie słychać wzmożone oddychanie pęcherzykowe. Może wystąpić tarcie opłucnej.
Bronchofonia jest znacznie osłabiona lub nieobecna.
Rentgen: jednorodne ciemnienie w dotkniętej części pola płucnego, przemieszczenie narządów śródpiersia, często w przeciwna strona, z guzowym zapaleniem opłucnej, narządy śródpiersia są przyciągane w stronę „chorej”.
^ Badanie krwi i plwociny : z wysiękowym zapaleniem opłucnej - leukocytoza, przyspieszona ESR.
Zespół gromadzenia się powietrza w jamie opłucnej
(odma płucna)

Występuje przy połączeniu oskrzeli z jamą opłucnową (podopłucnowa lokalizacja jamy gruźliczej, ropień), przy urazie klatki piersiowej, samoistnej odmie opłucnowej lub przy sztucznym wprowadzeniu powietrza do jamy opłucnej za pomocą cel terapeutyczny chorych na gruźlicę jamistą.
^ Reklamacje
Generalna Inspekcja: blada skóra, sinica.
Badanie klatki piersiowej: wysunięcie „chorej” połowy klatki piersiowej, w której zgromadziło się powietrze, wygładzenie przestrzeni międzyżebrowych, przyspieszony oddech, opóźnienie „chorej” połowy podczas oddychania.
Palpacja: ból, sztywność dotkniętej połowy klatki piersiowej. Drżenie głosu jest znacznie osłabione lub nie występuje.
Perkusja: głośny dźwięk bębenkowy, czasem metaliczny cień.
Osłuchiwanie: oddech jest osłabiony, pęcherzykowy lub niesłyszalny. Bronchofonia jest znacznie osłabiona lub nieobecna.
Rentgen: jasne pole płucne bez układu płucnego, bliżej korzenia cień zapadniętego płuca.
^ Badanie krwi i plwociny : Nie będzie znaczących zmian.
Zespół nadmiaru powietrza w płucach (rozedma płuc)
Zespół ten obserwuje się, gdy faza wydechowa jest trudna (zmniejszenie światła oskrzeli w wyniku ich skurczu lub wypełnienia wysiękiem, zmniejszenie elastyczności tkanki płucnej), płuca rozszerzają się, zwiększa się w nich zawartość powietrza, ale wycieczka oddechowa ich maleje.
Patomorfologia: zwiększona przewiewność tkanki płucnej.
Uskarżanie się: duszność, kaszel.
^ Ogólna inspekcja: obrzęk twarzy, sinica, obrzęk żył szyi.
Badanie klatki piersiowej: skrzynia w kształcie beczki,
Przestrzenie międzyżebrowe są poszerzone, dół pod- i nadobojczykowy gładki lub wypukły, ruchy oddechowe klatka piersiowa jest zmniejszona, tachypne.
Palpacja: klatka piersiowa jest sztywna. Drżenie głosu jest osłabione.
Perkusja: Dźwięk skrzyni jest wykrywany na całej długości tkanki płucnej, dolne granice płuc są obniżone, a przemieszczanie się dolnych granic płuc jest ograniczone.
Osłuchiwanie: równomiernie osłabione oddychanie pęcherzykowe, rzężenia suche i wilgotne.
Rentgen: zwiększona przezroczystość pól płucnych, osłabienie układu płucnego, niska lokalizacja i mała ruchomość przepony.
Badanie krwi i plwociny: Nie będzie znaczących zmian.
^
Zespół zwężenia oskrzeli z lepkim wysiękiem
mi  zespół ten jest najbardziej typowy dla ostrego lub przewlekłe zapalenie oskrzeli, w którym dochodzi do zapalenia błony śluzowej oskrzeli i wypełnienia światła oskrzeli lepką wydzieliną.
zespół ten jest najbardziej typowy dla ostrego lub przewlekłe zapalenie oskrzeli, w którym dochodzi do zapalenia błony śluzowej oskrzeli i wypełnienia światła oskrzeli lepką wydzieliną.
^ Reklamacje: kaszel, może ból w klatce piersiowej.
Generalna Inspekcja: akrocyjanoza, bladość skóry.
Badanie klatki piersiowej: znaczących zmian nie będzie.
Palpacja: klatka piersiowa bezbolesna, elastyczna. Drżenie głosu przebiega dobrze, jednakowo po obu stronach.
Perkusja: Na całej powierzchni tkanki płucnej wykrywa się wyraźny szmer płucny.
Osłuchiwanie: ciężki oddech, suchy świszczący oddech o różnej wysokości i barwie.
Rentgen: wzmocnienie układu płucnego.
^ Badanie krwi: umiarkowana leukocytoza, przyspieszona ESR.
Badanie plwociny: Plwocina jest śluzowa, śluzowo-ropna i zawiera niewielką liczbę leukocytów.
^
Zespół niedrożności oskrzeli
D  Zespół ten charakteryzuje się naruszeniem niedrożność oskrzeli w wyniku skurczu oskrzeli, zapalenia i obrzęku błony śluzowej oskrzeli małego kalibru (przewlekłe obturacyjne zapalenie oskrzeli, astma oskrzelowa).
Zespół ten charakteryzuje się naruszeniem niedrożność oskrzeli w wyniku skurczu oskrzeli, zapalenia i obrzęku błony śluzowej oskrzeli małego kalibru (przewlekłe obturacyjne zapalenie oskrzeli, astma oskrzelowa).
^ Reklamacje: kaszel, duszność.
Generalna Inspekcja: sinica, „podudzia” (zmiany na paliczkach końcowych).
Badanie klatki piersiowej: tachypnoe, z przedłużoną niedrożnością oskrzeli - klatka piersiowa ma kształt beczki, ruchy oddechowe są zmniejszone.
Palpacja: klatka piersiowa jest nieco sztywna, drżenie głosu jest osłabione.
Perkusja: lekkie przytępienie dźwięku perkusyjnego z pudełkowatym odcieniem.
Osłuchiwanie: oddech jest ciężki lub osłabiony, pęcherzykowy z masą rozproszoną, suchą, a w dolnych partiach wilgotny, delikatny, bezgłosowy świszczący oddech.
Rentgen: zwiększona przezroczystość tkanki płucnej, niskie położenie kopuły przepony i ograniczenie jej ruchomości.
^ Badanie krwi : leukocytoza, przyspieszona ESR, może być eozynofilia, limfocytoza.
Badanie plwociny: plwocina jest śluzowa, śluzowo-ropna, zawiera niewielką liczbę leukocytów i eozynofilów.
^
Zespół Fibrothorax lub cumowanie
P  W tym zespole obserwuje się wymianę tkanki płucnej tkanka łączna, ze względu na długotrwały proces zapalny o różnej etiologii.
W tym zespole obserwuje się wymianę tkanki płucnej tkanka łączna, ze względu na długotrwały proces zapalny o różnej etiologii.
^ Reklamacje: duszność, ból w klatce piersiowej.
Generalna Inspekcja: blada skóra, sinica.
Badanie klatki piersiowej: cofnięcie „chorej” połowy klatki piersiowej, tachypnoe, opóźnienie „chorej” połowy podczas głębokiego oddychania.
Perkusja: tępota dźwięku perkusji.
Osłuchiwanie: oddech jest osłabiony, pęcherzykowy lub niesłyszalny. Odgłos tarcia opłucnej. Bronchofonia jest znacznie osłabiona lub nieobecna.
Rentgen: w obszarze fibrothorax występuje jednorodny cień.
Badanie krwi i plwociny: Nie będzie znaczących zmian.
^
Zespol zaburzen oddychania
Niewydolność oddechowa (DN) to stan organizmu, w którym utrzymuje się prawidłowe skład gazu krwi lub osiąga się to poprzez intensywniejszą pracę urządzenia oddychanie zewnętrzne i serce, co prowadzi do spadku funkcjonalność ciało.
Normalna wymiana gazowa w płucach jest możliwa przy wyraźnym związku między trzema składnikami.
1) wentylacja
2) dyfuzja gazów przez błonę pęcherzykowo-kapilarną
3) perfuzja krew kapilarna w płucach
Przyczynami DN mogą być wszelkie procesy patologiczne w organizmie lub niekorzystne czynniki środowisko, które wpływają na co najmniej jeden z tych składników.
Istnieją dwie grupy DN:
z dominującym uszkodzeniem mechanizmów płucnych
z dominującym udziałem mechanizmów pozapłucnych
Utrudnienie majora drogi oddechowe
Mała niedrożność dróg oddechowych
Redukcja tkanki płucnej
Zaburzenie ograniczenia tkanki pęcherzykowej
Upośledzony przepływ krwi w płucach
Naruszenie proporcji wentylacji i perfuzji
Pogrubienie błony pęcherzykowo-kapilarnej
1. Naruszenie centralnej regulacji oddychania
2. Uszkodzenie mięśni oddechowych
3. Uszkodzenie klatki piersiowej
W zależności od przyczyn i mechanizmu DN wyróżnia się trzy rodzaje naruszenia funkcji wentylacyjnej płuc:
-zatykający
-ograniczający
-mieszany
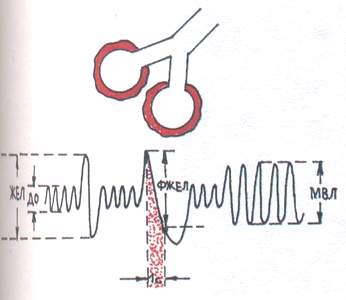
Dla typu obstrukcyjnego (ryc. 1) charakteryzuje się utrudnionym przepływem powietrza przez oskrzela na skutek zapalenia oskrzeli, skurczu oskrzeli, zwężenia lub ucisku tchawicy i dużych oskrzeli. Spośród faz oddychania największy wpływ ma wydech.
W badaniu spirograficznym obserwuje się zmniejszenie maksymalnej wentylacji płuc (MVL) i natężonej objętości wydechowej w ciągu 1 s. (FVC) z niewielkim spadkiem Pojemność życiowa płuca (VC).
 Ryc.1
Ryc.1
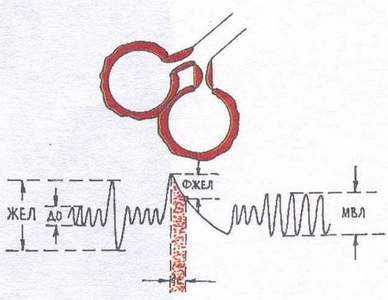
Typ restrykcyjny (ryc. 2) zaburzenia wentylacji obserwuje się przy ograniczonej zdolności płuc do rozszerzania się i zapadania (opłucnowa, odma opłucnowa, stwardnienie płuc, kifoskolioza, masywne zrosty opłucnej, kostnienie chrząstek żebrowych, ograniczona ruchomość żeber). Spośród faz oddychania wpływa głównie na wdychanie. Badanie spirograficzne wykazuje spadek VC i MVL.
 Ryc.2
Ryc.2
Typ mieszany (ryc. 3) występuje w przewlekłych chorobach płuc i serca i łączy w sobie objawy 2 rodzajów zaburzeń wentylacji (obturacyjnej i restrykcyjnej), często z przewagą jednego z nich.
^
Ryc.3
Istnieją trzy stopnie DN
1 łyżka.duszność występuje, gdy była wcześniej dostępna aktywność fizyczna, sinica jest nieobecna, zmęczenie jest szybkie, pomocnicze mięśnie oddechowe nie biorą udziału w oddychaniu.
2. duszność występuje przy nawykowym wysiłku, sinica jest łagodnie wyrażona, zmęczenie jest wyraźne, a podczas ćwiczeń mięśnie pomocnicze biorą udział w oddychaniu.
3. duszność w spoczynku, sinica, zmęczenie jest wyraźne, mięśnie pomocnicze są stale zaangażowane w oddychanie.
Obecność DN i jej stopień ocenia się na podstawie jej nasilenia objawy kliniczne takie jak duszność, tachykardia, sinica i zmiany w organizmie objętości oddechowe i pojemniki. Dane pochodzące z badań fizykalnych będą zależeć od choroby podstawowej, z którą wiąże się rozwój niewydolności oddechowej.
N.A.Mukhin, V.S.Moiseev. Propedeutyka chorób wewnętrznych. – M., 2002
AV Strutyński „Podstawy semiotyki chorób” narządy wewnętrzne„ - Moskwa -. MED-press-inform.- 2007.
Pytania kontrolne
Jakie główne zespoły płucne znasz?
Charakterystyczne cechy osłuchiwania w stadiach I, III i II płatowego zapalenia płuc?
Dla jakich chorób najbardziej charakterystyczny jest zespół ogniskowego zagęszczenia tkanki płucnej?
Jak to się zmieni ogólna analiza krew i plwocina w przypadku zespołu jamy w tkance płucnej?
Jaką jamę w tkance płucnej stwierdza się metodami badania fizykalnego?
Dlaczego przy niedodmie obturacyjnej oddech jest osłabiony pęcherzykowo lub w ogóle niesłyszalny?
Jaki dźwięk perkusji jest najbardziej charakterystyczny dla zespołu niedrożności oskrzeli?
Jak zmienia się drżenie głosu przy zespole kondensacji płata?
Dlaczego „dotknięta” połowa klatki piersiowej jest sztywna w zespole niedodmy uciskowej?
Jakie dolegliwości ma pacjent z zespołem opłucnej?
Co oznacza skrzynia beczkowa i na jakie choroby jest typowa?
Jaki jest mechanizm rozwoju zespołu rozedmy płuc?
Jakie zmiany na radiogramie obserwuje się w przypadku wysiękowego zapalenia opłucnej i zastoinowej niewydolności serca?
Co utrzymuje prawidłową wymianę gazową w płucach?
Jakie są trzy rodzaje dysfunkcji wentylacji płuc?
Syndrom terminów zaburzenia oddechowe(WSZYSTKIEGO NAJLEPSZEGO Z OKAZJI URODZIN), zespol zaburzen oddychania(RDS) i choroba błony szklistej (HMD) są synonimami w literaturze zagranicznej. Przykładowo w najpopularniejszych podręcznikach neonatologii w USA używa się terminów opisujących ten sam stan (chorobę): w wydaniu 7 Averys Diseases of the Newborn (1998) – choroba błony szklistej, a w wydaniu 7 Neonatal -Medycyna Perinatalna (Ed. A.A.Fanaroff i R.J.Martin, 2002) - zespół niewydolności oddechowej. Preferujemy koncepcję zespołu niewydolności oddechowej.
Częstotliwość rozwoju SDR zależy średnio od stopnia wcześniactwa noworodka i wynosi średnio 82-88% w przypadku urodzenia dziecka w okresie ciąży trwającym krócej niż 27 tygodni, 78-80% - w okresie 27-28 tygodni, 70% - przez okres 29 -30 tygodni, 50-55% - przez okres 3 1 - 3 2 tygodnie, 20-22% - przez okres 33-34 tygodni, 5 - 1 0% - przez okres 35-36 tygodni. i mniej niż 1 - 2% - w wieku ciążowym wynoszącym 37 tygodni. i więcej.
HDM (typ I SDR, RDS) i jej następstwa są przyczyną 30-50% zgonów noworodków.
Etiologia. Czynniki przyczynowe rozwoju B GM to:
niedobór tworzenia i uwalniania środka powierzchniowo czynnego;
wada jakościowa środka powierzchniowo czynnego;
hamowanie i niszczenie środka powierzchniowo czynnego;
niedojrzałość konstrukcji tkanka płuc. Wszystkie te procesy ułatwiają:
wcześniactwo;
infekcje wewnątrzmaciczne;
niedotlenienie okołoporodowe, asfiksja oraz niedokrwienie i kwasica płuc spowodowane nimi;
retinopatia wcześniaków;
Miejscowe, płucne:
zespoły wycieku powietrza;
obrzęk płuc;
zapalenie płuc;
krwotoki w płucach;
dysplazja oskrzelowo-płucna;
Zaburzenia związane z niewłaściwa pozycja lub niedrożność dróg oddechowych, uszkodzenie krtani i tchawicy (zwężenie przestrzeni podgłośniowej, obrzęk, zwężenie, nadżerka, ziarniniak).
Postępowanie z pacjentami z GBM wymaga od neonatologa połączenia głębokiej wiedzy z zakresu fizjologii związanej z wiekiem i algorytmów intensywna opieka i opanowanie sztuki ciągłej analizy dynamiki objawy kliniczne, współczucie, empatia dla dziecka. Wymagane jest ciągłe monitorowanie podstawowych parametrów życiowych i jako informacja zwrotna konieczna jest szybka korekta parametrów wentylacji mechanicznej i infuzji. terapia lekowa. Wydaje się, że u wielu dzieci z HBM nasilenie stanu po pierwszym dniu życia wynika nie tyle z początkowego nasilenia choroby płuc, ile z ich uszkodzenia (z wtórnym niedoborem surfaktantów) z nieodpowiednim (niezmiennym w zależności od reakcja dziecka) parametry wentylacji mechanicznej, nadmierna lub niewystarczająca infuzja, farmakoterapia, schładzanie.
Rozpoznanie stawia się na podstawie obrazu klinicznego i zdjęcia RTG klatki piersiowej.
Radiologicznie HBM charakteryzuje się triadą objawów pojawiających się w ciągu pierwszych 6 godzin życia:
rozsiane, symetryczne ogniska o zmniejszonej przezroczystości (objaw matowej szyby bez lub z objawami siatkowatych płuc);
bronchogram powietrzny;
zmniejszona pneumatyzacja obwodowych pól płucnych.
Te rozległe zmiany są lepiej widoczne w dolnych partiach płuc i na ich wierzchołkach. Ponadto widoczne jest zmniejszenie objętości płuc, różne nasilenie kardiomegalii (wzrost wskaźnika kardiochirurgicznego), zmiany guzkowo-siatkowe (różni autorzy określają je jako siatkowe, mozaikowe, ziarniste, paciorkowe itp., ale nadal są to tzw. częściej interpretowane jako rozlana niedodma).
W przypadku zespołu obrzękowo-krwotocznego typowe jest zmniejszenie wielkości pól płucnych i niewyraźny obraz RTG, co klinicznie często łączy się z uwolnieniem pienistego płynu z krwią z jamy ustnej.
Jeśli wymienione objawy HD nie zostaną wykryte na radiogramach 3 godziny po urodzeniu, wówczas rozpoznanie HD jest wątpliwe. Cechy radiograficzne SDR są niespecyficzne (np. podobne do paciorkowcowego zapalenia płuc typu B), ale nadal konieczne jest wykonanie prześwietlenia klatki piersiowej, aby wykluczyć inne schorzenia, które czasami wymagają operacji. Rentgenowskie objawy HD znikają po kilku godzinach lub od 1 do 3 dni, w zależności od ciężkości choroby, charakteru terapii, w szczególności stosowania egzogennego środka powierzchniowo czynnego.
RJ Rodrigues i in. (2002) podkreślają, że nawet w większości ośrodków noworodkowych w USA diagnozując SDR opierają się wyłącznie na danych klinicznych i radiologicznych, choć oczywiście dla prawidłowego rozpoznania SDR ważne jest uzyskanie dowodów na niedobór surfaktantu. Dlatego też czasami używa się określenia niewydolność oddechowa wcześniaków, gdy leczenie wcześniaka wymaga wentylacji mechanicznej i dodatkowego tlenu, a nie ma typowe znaki WSZYSTKIEGO NAJLEPSZEGO Z OKAZJI URODZIN.
Diagnostyka prenatalna opiera się na fakcie, że płyn z płuc płodu z dróg oddechowych przedostaje się do płynu owodniowego, a jego skład fosfolipidowy pozwala ocenić dojrzałość płuc płodu. Płyn owodniowy uzyskuje się poprzez amniopunkcję lub pobranie płynu z kanału rodnego matki. Jeśli poziom lecytyny i sfingomieliny, nasyconej fosfatydylocholiny w płyn owodniowy, przekracza 5 mg/l lub fosfatydyloglicerolu - 3 µmol/l, SDR rozwija się bardzo rzadko (mniej niż 1% przypadków). Jeżeli stosunek lecytyna/sfingomielina (L/S) jest większy niż 2,0, prawdopodobieństwo SDR wynosi 2%, jeśli jest mniejsze niż 2,0, ale większe niż 1,0, - 50%, a jeśli mniejsze niż 1,0, -75%. Kiedy się spóźnisz rozwój wewnątrzmaciczny współczynnik L/C nie zawsze prawidłowo odzwierciedla dojrzałość funkcjonalną płuc płodu, dlatego w tych przypadkach zaleca się kierować się podanymi powyżej bezwzględnymi poziomami nasyconej fosfatydylocholiny i fosfatydyloglicerolu oraz białek surfaktantów A. W niektóre ośrodki noworodkowe, aby ocenić dojrzałość płuc płodu, uciekają się do badania aktywności tromboplastycznej płynu owodniowego i liczenia komórek pomarańczowych, ale nie jest to ogólnie akceptowane.
Test piany jest najprostszym testem dojrzałości płuc. Do wykonania testu wykorzystuje się płyn owodniowy lub 1 ml treści żołądkowej pobranej za pomocą cewnika polietylenowego w pierwszej godzinie życia. Badanie jest wykonywane w następujący sposób: dodać 0,5 ml absolutnego etanolu (95%) do 0,5 ml płynu owodniowego lub treści żołądkowej. Szklaną probówkę (o średnicy 1 cm) wytrząsa się energicznie przez 15 s, po 15 minutach ocenia się wynik badania zbliżając probówkę do czarnego papieru. Test jest pozytywny, jeśli na powierzchni znajduje się pojedynczy lub podwójny pierścień pęcherzyków. Wynik testu jest negatywny, jeśli nie ma pęcherzyków, i słabo pozytywny, jeśli wokół menisku znajdują się pojedyncze małe pęcherzyki, wypełniające 1/3 obwodu lub mniej. Gdy pozytywny test prawdopodobieństwo HMD wynosi około 4%, słabo dodatnie - 20%, ujemne - 60%.
Zakres badań (monitoringu) u dzieci z RDS:
Ciągłe monitorowanie tętna i ABP.
Przezskórna oksyhemoglobinometria, czyli jeszcze lepiej, przezskórne oznaczanie Pao2 i Paco2 w krew tętnicza. Bardzo niebezpieczne jest poleganie wyłącznie na danych pulsoksymetru, ponieważ dobrze odzwierciedla on nasilenie hipoksemii, ale nie reaguje na hiperoksję, a nawet przy dolnej granicy normy oksyhemoglobina Raoha wynosi 100%. Niebezpieczeństwo hiperoksji jest ogromne: wiąże się to z przewlekłym uszkodzeniem płuc i oczu u noworodków.
Optymalne jest oznaczenie Pao2 i Paco2 we krwi uzyskanej poprzez cewnikowanie tętnicy pępowinowej, promieniowej lub piszczelowej oraz z żyły centralnej, z analizą tętniczo-żylnej różnicy prężności tlenu, tj. zużycie tlenu przez tkanki.
Co 3 - 4 godziny należy mierzyć i zapisywać w karcie obserwacyjnej temperaturę skóry brzucha, ciśnienie krwi, diurezę, CBS, poziom glikemii i stężenie tlenu w powietrzu wdychanym (Fio2).
W fazie ostrej SDR wykonuje się codziennie lub co drugi dzień:
Rentgen klatki piersiowej;
oznaczenie wskaźnika hematokrytu;
kliniczne badanie krwi;
posiew krwi i zawartości tchawicy;
oznaczanie w surowicy krwi poziomu azotu mocznikowego, potasu, sodu, wapnia i magnezu, totalna proteina i albumina;
pożądane jest określenie objętości krążącej krwi, szybkości mózgowego przepływu krwi i osmolarności krwi;
koagulogram z oznaczeniem fibrynogenu i produktów rozkładu fibryny (wg wskazań);
oznaczanie poziomu sodu we krwi na początek – 2 – 4 razy dziennie, gdyż istnieje duże ryzyko wystąpienia hipernatremii na skutek odwodnienia.
Diagnostykę różnicową przeprowadza się w przypadku chorób układu oddechowego zarówno pochodzenia płucnego (zapalenie płuc, wady rozwojowe płuc itp.), jak i pochodzenia pozapłucnego (wtórne choroby układu oddechowego - wewnątrzczaszkowy uraz głowy lub głowy w czasie porodu rdzeń kręgowy, wrodzone wady serca, przepuklina przeponowa, czerwienica, Zaburzenia metaboliczne itd.). Diagnostyka różnicowa z zapaleniem płuc opisano poniżej.
Agenezja nozdrzy tylnych powoduje niemożność oddychania przez nos oraz pojawienie się sinicy i zaburzeń oddychania po prawidłowym pierwszym oddechu. Typowym objawem jest obfita wydzielina śluzowa wypełniająca nos. Wada rozwojowa staje się oczywista, gdy nie jest możliwe wprowadzenie cewnika lub sondy przez nos do nosogardzieli. Leczenie jest chirurgiczne, ale drogi oddechowe są natychmiast wprowadzane do jamy ustnej.
Przetoki tchawiczo-przełykowe objawiają się klinicznie duszeniem, napadami sinicy, kaszlem i pojawieniem się świszczącego oddechu w płucach podczas karmienia lub bezpośrednio po nim. Badanie kontrastowe przełyku (z rozpuszczalnym w wodzie środkiem kontrastowym) i bronchoskopia potwierdzą rozpoznanie.
Przepuklinę przeponową wykrywa się przy urodzeniu lub wkrótce po nim, zwiększając się poważne zaburzenie oddechowy. Typowe są mały brzuch trzeszczkowy i cofnięta przednia ściana brzucha po urodzeniu. Podczas badania zwraca się uwagę na asynchroniczne ruchy prawej i lewej połowy klatki piersiowej oraz przemieszczenie wierzchołka serca, częściej w prawo (ponieważ przepuklina przeponowa lewa występuje 5-10 razy częściej niż prawa dwustronne), gwałtowne skrócenie tonu opukowego w dolnej części płuc i brak w tym miejscu szmerów oddechowych, nagła sinica przy ułożeniu dziecka na zdrowym boku. Decydujące znaczenie diagnostyczne ma zdjęcie rentgenowskie klatki piersiowej, które wykazuje obecność w klatce piersiowej nietypowych dla niej struktur (jelita, wątroba itp.). Leczenie jest chirurgiczne.
U dzieci z porodowym urazem mózgu i rdzenia kręgowego oraz zaburzeniami oddychania występują także oznaki uszkodzenia ośrodkowego układu nerwowego. Badania pomocnicze pomagają również w szybkiej diagnostyce patologii mózgu: neurosonografia, radiografia kręgosłupa, nakłucie lędźwiowe itp.
Wrodzone wady serca typu niebieskiego i przetrwały zespół krążenia płodowego są czasami trudne do odróżnienia od DFS. Jednak w pierwszych godzinach życia dzieci z SDD często mają normalny kolor skóry. Przy stosowaniu do oddychania 100% tlenem przez 10-15 minut, zwłaszcza przy stałym dodatnim ciśnieniu w drogach oddechowych, u dzieci z SDR wzrasta Raoh, czasami nawet powyżej 100 Torr, podczas gdy nie dzieje się tak w przypadku wad serca typu niebieskiego. Oczywiście dane też są ważne. badanie kliniczne, osłuchiwanie, ocena w skali Silvermana, a także badania dodatkowe (RTG klatki piersiowej, EKG, wyniki echokardiografii).
Zapalenie płuc wywołane przez paciorkowce B i inne paciorkowce (peptokoki, enterokoki) dają obraz kliniczny praktycznie nie do odróżnienia od BGM, ponieważ powodują hamowanie surfaktantu, a co za tym idzie jego niedobór. Wartość diagnostyczna w tym przypadku posiada identyfikację innych ognisk zakaźnych (itp.), wyniki klinicznych badań krwi, posiewów krwi i zawartości tchawicy.
Leczenie. Ochrona temperaturowa. Pielęgnacja ma na celu przede wszystkim zapobieganie wychłodzeniu, ponieważ pomaga zmniejszyć lub nawet zatrzymać (przy temperaturze ciała 35°C i niższej) syntezę surfaktantu i zwiększyć kwasica metaboliczna, rozwój ataków bezdechu. Zaraz po urodzeniu dziecko owija się w sterylną podgrzewaną pieluchę, płyn owodniowy pobiera się ze skóry poprzez dokładne osuszenie i umieszcza pod promieniującym źródłem ciepła, a następnie w inkubatorze (temperatura w inkubatorze zależy od masy ciała w chwili urodzenia; np. szczegółowe informacje można znaleźć w rozdziale VIII). Co 1 - 2 godziny rejestruje się temperaturę ciała dziecka, a jeżeli jest poniżej 36°C, to temperaturę powietrza w inkubatorze podnosi się o 1 - 2°C, a jeżeli przekracza 37°C, obniża się ją (zazwyczaj nie powinna być niższa niż 32°C). Więcej szczegółów w Rozdziale VIII.
Należy pamiętać, że dziecko leżące pod promieniującym źródłem ciepła na stole reanimacyjnym zużywa o 5-10% więcej energii na utrzymanie temperatury ciała niż dziecko w inkubatorze. Dlatego też wskazane jest umieszczanie wcześniaków o bardzo małej masie ciała, nawet w inkubatorze, w plastikowej komorze, aby ograniczyć utratę ciepła na drodze konwekcji, a także niezauważalną utratę wody. Każdemu dziecku należy założyć czapkę na głowę, ponieważ utrata ciepła i wody z głowy jest bardzo duża.
Ważne jest, aby zapobiegać wahaniom temperatury otoczenie zewnętrzne; Podczas badania dziecka w inkubatorze minimalizuj traumatyczne skutki - ból itp.
Badanie lekarskie powinno być jak najkrótsze, szczególnie ważne jest, gdy dziecko potrzebuje obrócić się, aby podeprzeć głowę, ograniczając ruchy bierne w odcinku szyjnym kręgosłupa.
Utrzymanie drożności dróg oddechowych. Przy urodzeniu dziecka z asfiksją obecność smółki w płynie owodniowym w postaci grochówka konieczna jest intubacja dotchawicza i delikatne, ale energiczne odsysanie zawartości dróg oddechowych. Ssanie powtarza się w ostrej fazy choroby wielokrotnie, kierując się obrazem klinicznym i danymi osłuchowymi, ale pamiętając, że toaleta tchawicza powoduje przejściową, ale znaczną hipoksemię, bradykardię i nadciśnienie, znaczną zmianę intensywności mózgowego przepływu krwi, co może powodować krwotoki śródczaszkowe, zmiany przykomorowe.
Pozycja dziecka z SDD na stole lub w inkubatorze powinna być z głową lekko wyciągniętą (pozycja kichania). W tym celu pod górną część klatki piersiowej należy umieścić poduszkę o grubości 3-4 cm. Okresowa zmiana pozycji dziecka (lekki obrót w bok, na brzuchu itp.) stymuluje drenaż tchawicy. Pod koniec ostrego okresu uciekają się do masażu wibracyjnego, fizjoterapii i terapii aerozolowej.
Terapia infuzyjna i żywienie. Z reguły dzieci z SDD nie są karmione dojelitowo przez pierwsze 2–3 dni życia ze względu na ryzyko powikłań krążeniowo-oddechowych i niedomykalności. Jednak już od pierwszych godzin życia dziecko nie powinno odczuwać głodu i pragnienia. Ponadto niezwykle ważne jest zapobieganie rozwojowi hipoglikemii. Dlatego już 30-40 minut po urodzeniu rozpoczyna się planowana terapia infuzyjna. Objętość podawanego płynu w pierwszym dniu życia wynosi 50-60 ml/kg i w każdym kolejnym dniu zwiększa się o 20 ml/kg (w siódmym dniu około 140-150 ml/kg). Szczególnie ostrożnie należy podawać płyn i zwiększać jego dobową objętość w przypadku skąpomoczu u dziecka. Gdy pojawia się diureza (powyżej 2 mil/kg/h), objętość płynu zwiększa się bardziej śmiało (do 40 ml/kg na dobę). W fazie skąpomoczu nadmierna objętość płynu może pomóc w utrzymaniu przetrwałego przewodu tętniczego, czego przyczyną może być obrzęk płuc zwiększone ryzyko dalszy rozwój BPD. Przywrócenie diurezy jest zwiastunem rozpoczęcia fazy rekonwalescencji.
W pierwszym dniu życia przetaczanym płynem jest 5-10% roztwór glukozy, od drugiego dnia dodaje się do niego sód i chlor w ilości 2-3 mol/kg/dobę. oraz potas, wapń 2 mol/kg/dzień. Skład roztworu do infuzji dobiera się w zależności od monogramu krwi, utrzymując poziom natremii w granicach 135-145 mmol/l osocza. Aby zapobiec zakrzepicy cewnika i naczynia regionalnego, zwłaszcza u dzieci stosujących całkowite żywienie pozajelitowe, do podawanych roztworów dodaje się heparynę w dawce 0,2–0,5 jednostki na 1 ml przetoczonego płynu.
Ogólnie jak wiadomo, objętość i charakter terapia infuzyjna ustalana w zależności od:
dynamika masy ciała;
dynamika ADC i natężenie przepływu mózgowego;
państwo układu sercowo-naczyniowego, w szczególności stan krążenia obwodowego;
CBS i jonogramy surowicy krwi;
warunki opieki, w szczególności adekwatność ochrony termicznej, metody wentylacji mechanicznej lub IVL.
Biorąc pod uwagę wszystkie te parametry i korekcję głośności - złożone zadania, wymagające zarówno wiedzy, jak i umiejętności lekarza, ponieważ do tej pory noworodki są nie tyle leczone, co pielęgnowane.
karmienie dawcy, mleko matki lub mieszankę dostosowaną dla wcześniaków rozpoczyna się, gdy stan się poprawi, a duszność zmniejszy się do 60 na minutę, brak długotrwałego bezdechu, niedomykalność, po kontrolnym podaniu do środka wody destylowanej. Rodzaj karmienia (jednorazowa lub ciągła zgłębnik żołądkowy lub przezodźwiernikowy, butelka) zależy od dostępności odruch ssania, ciężkość stanu. Obliczanie ilości mleka – patrz rozdział VI, w którym można przeczytać także o sposobie żywienia pozajelitowego, jeśli stan pacjenta nie pozwala na rozpoczęcie żywienia dojelitowego.
Normalizację składu gazometrycznego krwi uzyskuje się poprzez wzbogacenie wdychanego powietrza w tlen, różne opcje wytwarzanie zwiększonego ciśnienia w drogach oddechowych podczas oddychania spontanicznego (oddychanie spontaniczne przy stałym dodatnim ciśnieniu w drogach oddechowych) poprzez kaniule nosowe (pCPAP – nosowe ciągłe dodatnie ciśnienie w drogach oddechowych) przy stałym wysokie ciśnienie krwi i wentylację mechaniczną.
Jeśli nie ma oznak SDR, wcześniak umieszcza się w inkubatorze, gdzie zawartość tlenu w powietrzu wynosi około 40–45%. Jeśli w ciągu 4 godzin ciśnienie tętnicze (lub określone przez czujnik skórny) utrzyma się powyżej 8 kPa (60 torr = mmHg), wówczas stężenie tlenu spada o 5% na godzinę do poziomu 30 - 35%. Gdy Pa o 2 jest mniejsze niż 6,6·7 kPa (5 0 torr = mm Hg), stężenie tlenu we wdychanym powietrzu zwiększa się do maksimum poprzez założenie nasadki w inkubatorze na głowę dziecka. Jeżeli nie prowadzi to do normalizacji Pao2 we krwi, wówczas rozpoczyna się SDPPD (optymalnie przez kaniule nosowe).
Inne wskazania do rozpoczęcia SDP to:
uporczywa duszność i odgłosy wydechowe;
Silverman zdobędzie 5 punktów lub więcej (nawet przy normalny kolor skóra);
ujemna próba piankowa z płynu owodniowego lub zawartości żołądka uzyskana bezpośrednio po urodzeniu, brak w nich fosfatydyloglicerolu.
Obecnie najczęściej stosowaną metodą jest pCPAP, znacznie rzadziej stosowana jest metoda Martina (worka Martina). Worek mocowany jest do szyi dziecka za pomocą taśmy piankowej, dzięki czemu mały palec lekarza może swobodnie wnikać pomiędzy worek a szyję. Ciśnienie wydechowe przy użyciu CPAP mieści się zwykle w przedziale 4-6 cm wody. Sztuka. (czyli rurka, przez którą wychodzi powietrze z worka jest zanurzona na tę głębokość), rzadko trzeba ją zwiększać w przypadku dużej sztywności płuc do 10 cm wody. Sztuka. Jeśli sztywność płuc jest niska, wówczas nadmierne ciśnienie podczas wydechu prowadzi do zakłócenia odpływu krwi z mózgu, zmniejszenia jej przepływu do serca i przyczynia się do rozwoju niewydolności serca i obrzęku mózgu.
SDPPD rozpoczyna się od podania nawilżonego tlenu ogrzanego do temperatury 32-34°C, a następnie pod kontrolą efektu klinicznego i PaO2 we krwi, stopniowo zmniejsza się jego stężenie w wdychanej mieszaninie, osiągając PaO2 we krwi tętniczej na poziomie 6,67-10,67 kPa (50-80 torr = mm Hg), a krew tętnicza z pięty powyżej 8 kPa uważana jest za potencjalnie toksyczną, wymagającą zmniejszenia stężenia tlenu w wdychanym powietrzu.
Jeśli dziecko jest bardzo niespokojne, co jest szczególnie częste w przypadku pCPAP, przepisuje się hydroksymaślan sodu lub seduksen, ale nie fenobarbital, który selektywnie tłumi struktury wydechowe ośrodka oddechowego zlokalizowanego w rdzeniu przedłużonym.
Wskazaniami do wentylacji mechanicznej są:
Niemożność osiągnięcia normalizacji krwi Pao2 na tle pCPAP, wynik Silvermana większy niż 5 punktów, który nie zmniejsza się na tle pCPAP;
Pao2 wynosi poniżej 8,00 kPa (60 mm Hg) przy Fio2>0,7 (F1O2 to udział tlenu w wdychanej mieszaninie tlenu i powietrza), natomiast jeśli masa urodzeniowa jest mniejsza niż 1250 g, to przy Fio2>0,4;
Paco2 ma ponad 8,79 kPa (65 mm Hg), a przy masie ciała poniżej 1250 g - Paco2 >8,00 kPa (60 mm Hg) i pH<7,25;
Metodologia wykonywania wentylacji mechanicznej- patrz rozdz. XXVI.
Pozaustrojowe natlenianie membranowe jest stosowane za granicą w leczeniu dzieci z wyjątkowo ciężkim SDR, gdy jest nieskuteczne tradycyjne metody Wentylacja mechaniczna u dzieci z ciężkimi wadami serca. Ze względu na brak odpowiedniego sprzętu w Rosji, w tym podręczniku nie opisujemy jego metod.
Niebezpieczeństwa terapii tlenowej:
suchy i zimny tlen uszkadza płuca, powoduje skurcz tętniczek, nadciśnienie płucne, kwasicę i hamowanie syntezy środków powierzchniowo czynnych. Obowiązkowe jest podgrzewanie tlenu do temperatury 32-34°C (przy wentylacji mechanicznej do 36-37°C), podobnie jak jego nawilżanie. W przypadku braku specjalnych nawilżaczy tlen przepuszcza się przez słoik Bobrowa (wysokość słupa wody wynosi co najmniej 15 cm). Nadmierne nawilżanie (100% wilgotności względnej przez ponad 2 godziny) prowadzi do przegrzania dziecka, przeciążenia wodą i przyczynia się do obrzęku płuc. efekt toksyczny Niedobór tlenu ma miejsce wtedy, gdy we krwi tętniczej Pao2 wynosi więcej niż 10,67 kPa i utrzymuje się przez kilka godzin, co prowadzi do uszkodzenia oczu, płuc i centralnego układu nerwowego. Utrzymanie OŚ. Korygowanie kwasicy patologicznej (pH poniżej 7,25 i BE powyżej minus 10 mmol/l) jest konieczne dopiero po wprowadzeniu wentylacji mechanicznej lub IVL.Jeżeli patologia płuc doprowadziła do tak znacznego upośledzenia CBS, wówczas jest to bezpośrednie wskazanie do wentylacji mechanicznej lub IVL. Ilość wodorowęglanu sodu w mmol (tj. liczba ml 8,4% roztworu) χ (wartość BE - 5) χ masa ciała (kg) χ 0,4. Odpowiednią ilość sody oczyszczonej podaje się kroplami w postaci 4,2% roztworu w ciągu 1 h. Należy pamiętać, że u wcześniaków zasadowica powoduje krwotoki śródczaszkowe i zatrzymanie oddechu.
Zwalczanie anemii i hipowolemii, niedociśnienie. W ostrej fazie choroby konieczne jest utrzymanie wartości hematokrytu na poziomie co najmniej 0,4, ponieważ anemia jest czynnikiem utrzymującym niedotlenienie tkanek, co oznacza niedobór surfaktantu, obrzęk tkanek itp. Przetacza się masę czerwonych krwinek. W przypadku ciężkiej anemii i ciężki przebieg W przypadku SDR bardziej wskazana jest bezpośrednia transfuzja krwi, ponieważ świeże krwinki czerwone zawierają więcej 2,3-difosfoglicerynianu, który zmniejsza niedotlenienie tkanek. Ponadto świeża krew jest bardziej wskazana do korygowania zaburzeń hemostazy w przypadku niewyrównanego zespołu DIC, a także stanowi immunoprotektor w przypadku infekcji. Jednocześnie zarzucono zastępcze transfuzje krwi w przypadku SDR, ponieważ przyczynia się to do wzrostu częstości i nasilenia retinopatii wcześniaków. W 2. tygodniu życia i później wskazaniem do przetoczenia krwinek czerwonych jest hematokryt poniżej 0,3. Obecnie wskazania do przetoczenia krwi pełnej są mocno ograniczone ze względu na ryzyko infekcji (nie tylko wirusowego zapalenia wątroby typu B i C, HIV, ale także cytomegalii, ponieważ 6-12% dawców ma we krwi cytomegalowirusa), izosensybilizację.
Hipowolemia (objaw pozytywny Biała plama- 3 s i więcej), szczególnie u dzieci z niedokrwistością, najbardziej wskazane jest skorygowanie poprzez transfuzję roztwór izotoniczny chlorek sodu, ale można też przetoczyć świeżo mrożone osocze lub 10% roztwór albuminy. Ilość przetaczanego leku wynosi 10-15 ml/kg masy ciała. Wlewać powoli strumieniem (1-2 ml/kg/min).
Jeśli po skorygowaniu niedokrwistości i hipowolemii, tętnicze ciśnienie krwi niskie (maksymalne ciśnienie poniżej 45 torr, tj. mm Hg), wówczas rozpoczynają podawanie mikrostrumienia dopaminy (dawka początkowa 5 mcg/kg/min z dalszym zwiększaniem według wskazań do 10-15-20 mcg/kg/min) (szczegóły w rozdziale XIX).
Uzupełnienie niedoboru środka powierzchniowo czynnego. Z pierwszych prac T. Fujiwary i in. w 1980 r. wprowadzono lek w celu uzupełnienia niedoborów środka powierzchniowo czynnego u bardzo wcześniaków pozytywny efekt taka terapia.
Obecnie wykorzystują zarówno naturalne surfaktanty pozyskiwane z płuc bydła (krajowy BL-surfactant, opracowany w St. Petersburgu przez prof. O.A. Rosenberga, zagraniczne – Survanta, Alveofact, Infrasurf), świń (Curosurf), jak i syntetyczne (ALEK, Exosurf , Surfaxin, „Sfenticute”. Najskuteczniejsze naturalne środki powierzchniowo czynne zawierają, oprócz fosfolipidów, środek powierzchniowo czynny białko B (tabele 12.3, 12.4). Należy podkreślić, że lek Surfaxin, opracowany w USA przez laboratorium Discovery, zawiera kombinację fosfolipidów (dipalmitylofosfatydylocholina – DPPC, pa– POPG, kwas palmitynowy – PA) oraz rekombinowany, syntetyczny peptyd składający się z fragmentów aminokwasów lizyny (K) i leucyny (L) w sekwencji KLLLLKLLLLKLLLLKLLLL (KC). peptyd ma właściwości białka powierzchniowo czynnego B. Enticute zawiera rekombinowane białko powierzchniowo czynne C.
Liczne badania z randomizacją wykazały, że egzogenny środek powierzchniowo czynny sprzyja:
zwiększenie podatności płuc i funkcjonalnej pojemności zalegającej, zmniejszając w ten sposób pracę mięśni oddechowych;
zmniejszenie podczas wentylacji mechanicznej Fio2 (proporcja tlenu w powietrzu wdychanym), PIP (szczytowe ciśnienie wdechowe), MAP (średnie ciśnienie w drogach oddechowych), PEEP (dodatnie ciśnienie końcowo-wydechowe), poprawa wskaźnika natlenienia gradientu tlenu w pęcherzykach włosowatych;
zmniejszenie śmiertelności w SDR (jego profilaktyczne stosowanie jest szczególnie skuteczne u dzieci z okresem ciąży krótszym niż 30 tygodni w połączeniu
podczas stosowania kortykosteroidów w okresie ciąży), zespół aspiracji smółki, SDR typu dorosłego;
skrócenie czasu wentylacji mechanicznej i zmniejszenie częstości występowania skutków ubocznych wentylacji mechanicznej (zespoły nieszczelności powietrza itp.);
zmniejszenie częstości występowania MDD, IVH, retinopatii;
Nie hamuje syntezy endogennego środka powierzchniowo czynnego.
Należy zaznaczyć, że naturalne środki powierzchniowo czynne są skuteczniejsze od syntetycznych, mogą jednak mieć charakter antygenowy; ponadto mają mniej stabilny skład, wymagają bardziej rygorystycznych warunków przechowywania i mają bardziej ograniczony okres przydatności do spożycia, a także mogą potencjalnie zawierać środki prionowe.
Mamy doświadczenie w stosowaniu leków Curosurf i Exosurf w Szpitalu Dziecięcym nr 1 (St. Petersburg). Obydwa leki miały powyższe skutki. Natomiast po wprowadzeniu Curosurf, Fio2, PIP, MAP można było zmniejszyć o około 30% po 3-3,5 godzinach, natomiast po wprowadzeniu Exosurf dopiero po 6 godzinach. Po podaniu leku Curosurf obserwowano zmniejszenie oporu naczyń płucnych, zmniejszenie obciążenia następczego prawej komory i zwiększenie obciążenia wstępnego lewej komory. Jednocześnie zaobserwowano zmniejszenie różnicy pęcherzykowo-kapilarnej w prężności tlenu i poprawę wskaźnika natlenienia. Niestety, randomizowane badania porównawcze Nie ma zastosowania krajowego surfaktantu BL i nie mamy doświadczenia w jego stosowaniu, ale od naszych kolegów wiemy, że jest on znacznie mniej skuteczny w przypadku ciężkich SDR niż Curosurf.
Według profesora J. Gadzinowskiego (2003) w wieloośrodkowych europejskich badaniach porównawczych z randomizacją (biorą w nich udział także neonatolodzy z Petersburga, ale badanie jest podwójnie ślepe i nie znamy jeszcze naszych wyników) zastosowanie profilaktyczne Surfaxin, Exosurf i Surv a n t a u dzieci z masą urodzeniową mniejszą niż 1 2 5 0 g pierwszy lek był skuteczniejszy, co jego zdaniem może wynikać z wcześniejszej poprawy utlenowania (już po kilku minutach podczas gdy po zastosowaniu innych preparatów powierzchniowo czynnych zauważa się to po 3-6 godzinach), trwalszy efekt ze względu na odporność syntetycznego leku Surfaxin na hamowanie przez składniki surowicy i utleniacze.
Skutki uboczne i powikłania terapii surfaktantami mają w dużej mierze charakter jatrogenny. W przypadku braku odpowiedniego monitorowania i zróżnicowania parametrów wentylacji mechanicznej może rozwinąć się uraz ciśnieniowy i wolutrauma płuc, zespoły nieszczelności powietrza, krwotok płucny, hiperoksja, a co za tym idzie retinopatia wcześniaków, krwotok płucny, IVH. Być może jedyną rzeczą, która została odnotowana przez wielu badaczy niemal we wszystkich ośrodkach, jest wzrost częstości funkcjonowania przewodu tętniczego i napadów bezdechu po zastosowaniu egzogennego środka powierzchniowo czynnego. Częstość funkcjonującego przewodu tętniczego u dzieci leczonych Curosurfem w naszych obserwacjach wyniosła 7,6%.
Najskuteczniejsze profilaktyczne podanie surfaktantu następuje przy urodzeniu lub w pierwszych 15 – 30 minutach życia. Dawkę przeznaczoną do podania podgrzewa się (w ciągu 1 godziny do 37°C) i wlewa przez rurkę dotchawiczą do tchawicy w 4 dawkach w ciągu 1 0 - 1 5 minut lub mikrostrumieniem za pomocą infuzora w ciągu 2 0 - 3 0 minut, po kolejnym m wlewu zmienia się pozycja dziecka. W razie potrzeby infuzje powtarza się po 12 h. Nie odnotowano żadnych poważnych skutków ubocznych. Za niezwykle ważne uważa się jak najwcześniejsze przerwanie wentylacji mechanicznej i przeniesienie dziecka do p SRA R. W wyniku tej terapii o charakterze ogólnie zapobiegawczym, częstość i nasilenie SDR ulegają znacznemu zmniejszeniu. Leczenie surfaktantem już rozwiniętego SDR lub zapalenia płuc jest znacznie mniej skuteczne niż leczenie zapobiegawcze. Jednocześnie niezwykle ważne jest, aby przed podaniem jakiegokolwiek leku powierzchniowo czynnego ustabilizować stan dziecka i w miarę możliwości skorygować podstawowe parametry życiowe. Po podaniu leku należy uważnie monitorować m.in.: parametry wentylacji mechanicznej, Fio2, wizualną analizę udziału mięśni pomocniczych w procesie oddychania, przezskórną analizę saturacji (Brog), częstość akcji serca, ADC, CBS, klatkę piersiową. radiogram przed i 3 - 6 godzin po podaniu. Ponownie konieczne jest elastyczne zmienianie parametrów I V L i F 1 0 2, unikanie urazu ciśnieniowego i objętościowego urazu płuc oraz hiperoksji. Sp o 2 musi być utrzymywane w przedziale 9 0 - 9 4%, co zapobiega hiperoksji. Nie zaleca się odsysania zawartości tchawicy przez 3 do 6 godzin po podaniu środka powierzchniowo czynnego.
Zamknięcie przetrwałego przewodu tętniczego uznaje się za medyczne u dzieci z SDR na podstawie badania echokardiograficznego i dopplerowskiego w 4-5 dobie życia. Taktykę stosowania indometacyny lub brufenu opisano w rozdziale XIX.
Terapia antybiotykowa. W przypadku rozpoznania SDR, nawet jeśli istnieje podejrzenie, ampicylinę przepisuje się w połączeniu z jednym z aminoglikozydów (zwykle gentamycyną). Wynika to z jednej strony z faktu, że zakażenie paciorkowcami B objawia się uszkodzeniem płuc, które nie różni się (nawet często radiologicznie) od SDR, a z drugiej strony przeniesieniem pacjenta do wentylacji mechanicznej, która jest często towarzyszy infekcja. Jednak już po 3 dniach od otrzymania wyników posiewów krwi i badań klinicznych krwi należy z biegiem czasu stwierdzić obecność infekcji, a jeśli jej nie ma, odstawić antybiotyki.
Terapia witaminowa. Nie potwierdzono poglądu, że profilaktyczne podawanie witaminy E zmniejsza częstość występowania dysplazji oskrzelowo-płucnej. A jednak wskazane jest podawanie domięśniowo witaminy E w dawce 10 mg/kg dziennie przy stosowaniu mieszaniny tlenu i powietrza z Fio2 większym niż 0,4, ponieważ zmniejsza to częstość występowania i nasilenie retinopatii wcześniaków. Kurs 7 - 1 0 zastrzyków. Witaminę A, podawaną dojelitowo w dawce 2000 jednostek co drugi dzień, należy przepisywać wszystkim dzieciom przed żywieniem dojelitowym, gdyż zmniejsza to częstość występowania martwiczego zapalenia jelit i dysplazji oskrzelowo-płucnej.
Diuretyki. Chociaż podawanie furosemidu zwiększa diurezę i poprawia stan płuc, zwiększa częstość występowania przetrwałego przewodu tętniczego, zwapnień w nerkach i dyselektrolitii, dlatego nie może być traktowane jako rutynowe. Furosemid jest przepisywany tylko w przypadku obrzęku płuc i zespołu obrzękowego.
Glukokortykoidy. Odstąpiono od planowanego podawania glikokortykosteroidów i ich pochodnych (najczęściej stosowano deksametazon, ponieważ ma on maksymalne działanie tkankowe) w celu stymulacji syntezy surfaktantów u wszystkich dzieci z SDD. Wynika to z wprowadzenia do terapii i profilaktyka wtórna SDR preparatów powierzchniowo czynnych, doskonalenie metod wspomagania oddychania, wentylacji mechanicznej, a także skutki uboczne terapia glukokortykoidami, z których głównymi, nawet przy krótkim przebiegu, są: hiperglikemia, nadciśnienie tętnicze, krwawienie z przewodu pokarmowego, martwicze entero i inne infekcje. Glikokortykoidy przepisuje się pacjentom z SDR, u których według danych klinicznych i laboratoryjnych występuje niewydolność kory nadnerczy.
Wielu neonatologów za granicą doszło do wniosku, że podawanie deksametazonu w leczeniu pointubacyjnego zapalenia krtani lub tchawicy z ciężkim zwężeniem daje pozytywny efekt. The Neonatal Formulary (BMJ, 2000) zaleca podawanie 4 dawek po 200 mcg w 8-godzinnych odstępach, przy czym pierwszą dawkę należy podać 4 godziny przed ekstubacją dzieciom z obrzękiem lub urazem krtani.
W niektórych klinikach noworodkowych zaczęto aktywnie stosować hormony tarczycy w leczeniu dzieci z SDD, w oparciu o częste wykrywanie niski poziom hormonów tarczycy u bardzo wcześniaków z GBM. Brak jest jednak ogólnie przyjętych danych, opartych na wynikach badań z randomizacją, które bezsprzecznie dowodzą korzyści płynących z takiej recepty, dlatego jest to terapia eksperymentalna. Bardziej uzasadnione jest śródowodniowe stosowanie L-tyroksyny u kobiet w ciąży wysokiego ryzyka przedwczesny poród, ale nawet tutaj nie ma ogólnie przyjętych schematów i ogólnie przyjętych wyników.
Ryboksyna i inozytol przepisywane dożołądkowo co 6 godzin w dawce 40 mg/kg od końca pierwszego dnia do 10 dnia życia, wg M. Hallmana wsp. (1986-1989), zmniejszają nasilenie SDR, zwiększają syntezę środka powierzchniowo czynnego i zmniejszają częstość występowania dysplazji oskrzelowo-płucnej. Jednakże metoda ta, podobnie jak planowane podawanie plazminogenu wcześniakom, jest metodą eksperymentalną w leczeniu dzieci z SDD.
Rokowanie w przypadku SDR zależy od jej ciężkości i obecności współistniejąca patologia, powikłania terapii. Śmiertelność dzieci z masą urodzeniową powyżej 1 0 0 0 g przy racjonalnym postępowaniu nie przekracza 5 - 1 0%. W pierwszym roku życia dzieci cierpiące na SDR często zapadają na zapalenie płuc, zwiększa się także częstość występowania sepsy. Encefalopatia (po niedotlenieniu) jest jednym z charakterystycznych schorzeń współistniejących (lub powikłań) u dzieci z SDD, a u niektórych dzieci można je wyraźnie rozpoznać dopiero w wieku przedszkolnym i wiek szkolny w postaci minimalnych dysfunkcji mózgu, zaburzeń zachowania i trudności w nauce. W związku z tym w systemie zajęć rehabilitacyjnych dla dzieci z SDD należy uwzględnić wczesne podanie (od 3-4 dnia) leków poprawiających trofizm mózgu (gliatylina 10-15 mg/kg/dobę, nootropil 50 mg/kg dożylnie lub doustnie 2-3 razy dziennie), obserwacja neurologa.
Zapobieganie. Hormonalna terapia przedporodowa. Podanie domięśniowe lub doustne matce w przypadku zagrożenia przedwczesnym porodem w wieku ciążowym 2 4 - 3 4
betametazon w dawce 12 mg (2 razy w odstępie 24 godzin) lub
Deksametazon 6 mg 4 razy w odstępie 12 godzin.
Optymalne jest, aby okres między zakończeniem terapii hormonalnej a porodem wynosił więcej niż 24 h. Efekt takiej recepty utrzymuje się przez 10 dni, a jeśli poród nie nastąpi, wówczas jednorazowe podanie deksametazonu w dawce 6- Wskazane jest 12 mg.
Stosowanie kortykosteroidów w okresie przedporodowym prowadzi nie tylko do zmniejszenia częstości i nasilenia DR, ale także zmniejsza ryzyko rozwoju zespołu przetrwałego przewodu tętniczego, krwotoków dokomorowych, leukomalacji okołokomorowej, martwiczego zapalenia jelit, czasu i kosztów opieki nad bardzo wcześniakiem .
Długoterminowe badania kontrolne wykazały, że przebieg ciąży terapia hormonalna nie zwiększa częstotliwości choroba zakaźna u noworodków nie wpływa na dalszy rozwój fizyczny i psychomotoryczny (w tym na tempo zwiększania się obwodu głowy), a także na rozrost płuc, nie powoduje dysfunkcji nadnerczy, wzroku i słuchu.
Obecnie testuję dla praktyczne zastosowanie schematy wprowadzania trójjodotyroniny do płynu owodniowego, a optymalnie - hormonu uwalniającego tyreotropinę (TRH). Preparaty TRH zarówno eksperymentalnie, jak i w ograniczonych warunkach Badania kliniczne okazało się bardzo skuteczne w zapobieganiu SDR. Jednakże dwa duże, wieloośrodkowe badania przeprowadzone w USA nie wykazały żadnych korzyści ze stosowania skojarzenia. zastosowanie profilaktyczne kortykosteroidy w ciąży w połączeniu z hormonami tarczycy i/lub TRH (Ballard R.A. i in., 1998).
Opóźnienie porodu jest przydatne, ponieważ jeśli przerwa bezwodna trwa dłużej niż 2 dni, SDR zwykle nie rozwija się, chociaż u takich dzieci częściej obserwuje się sepsę i prawdopodobnie krwotoki śródczaszkowe.
Terapia zastępcza egzogennymi środkami powierzchniowo czynnymi w pierwszych 30 minutach życia (patrz wyżej) jest wysoce skuteczną metodą zapobiegania ciężkim SDR.
Terminy „zespół zaburzeń oddechowych” (RDS), „zespół zaburzeń oddechowych” (RDS) i „choroba błony szklistej” (HMD) są w literaturze zagranicznej synonimami. Przykładowo w najpopularniejszych podręcznikach neonatologii w USA używa się terminów opisujących ten sam stan (chorobę): w 7. wydaniu Avery's Diseases of the Newborn (1998) – choroba błony szklistej, a w 7. wydaniu Noworodek – Medycyna okołoporodowa (Ed. A.A.Fanaroff i R.J.Martin, 2002) – zespół zaburzeń oddechowych Preferujemy termin „zespół zaburzeń oddechowych”.
Częstotliwość rozwoju SDR zależy średnio od stopnia wcześniactwa noworodka i wynosi średnio 82-88% w przypadku urodzenia dziecka w okresie ciąży trwającym krócej niż 27 tygodni, 78-80% - w okresie 27-28 tygodni, 70% - przez okres 29 -30 tygodni, 50-55% - przez okres 31-32 tygodni, 20-22% - przez okres 33-34 tygodni, 5-10% - przez okres 35-36 tygodni. i mniej niż 1-2% - w wieku ciążowym 37 tygodni. i więcej.
HDM (typ I SDR, RDS) i jej następstwa są przyczyną 30-50% zgonów noworodków.
Etiologia. Czynnikami sprawczymi rozwoju HD są:
niedobór tworzenia i uwalniania środka powierzchniowo czynnego;
wada jakościowa środka powierzchniowo czynnego;
hamowanie i niszczenie środka powierzchniowo czynnego; "
niedojrzałość struktury tkanki płucnej.
Wszystkie te procesy ułatwiają:
wcześniactwo;
infekcje wewnątrzmaciczne;
wywołane nimi niedotlenienie okołoporodowe, asfiksja i niedokrwienie płuc
i kwasica;
cukrzyca matki;
ostra utrata krwi podczas porodu.
Ponadto częstość występowania HD zwiększa się u dzieci z:
krwotoki śródkomorowe i ogólnie zmiany okołokomorowe, które wystąpiły przed porodem i w jego trakcie;
przejściowa niedoczynność tarczycy i nadnerczy;
hipowolemia;
hiperoksja;
chłodzenie (zarówno podczas ogólnego chłodzenia, jak i podczas oddychania nieogrzewaną mieszaniną tlenu i powietrza);
urodził się z pomocą cesarskie cięcie;
w drugim bliźniaku.
Ostry stres okołoporodowy, w szczególności wydłużenie czasu porodu, może zmniejszyć częstość występowania i/lub nasilenie BGM. To wyjaśnia, dlaczego czynnikiem ryzyka rozwoju HD jest planowe cięcie cesarskie, a wydłużenie przerwy bezwodnej zmniejsza ryzyko HD.
Patogeneza. Wiodącym ogniwem w patogenezie typu SDRI (HD) jest niedobór ilościowy i defekt jakościowy środka powierzchniowo czynnego.
Środek powierzchniowo czynny jest środkiem powierzchniowo czynnym syntetyzowanym przez pęcherzyki płucne typu II (pokrywające około 3% powierzchni pęcherzyków płucnych) i bezwłose komórki oskrzelików (komórki Clara). Składa się z 90% lipidów, z czego 80% to fosfolipidy: fosfatydylocholina (lecytyna) – 70% (45-50% – utleniona, nasycona i 20-25% – nienasycona), fosfatydyloglicerol – 6% i pozostałe fosfolipidy – 6%; 8% - lipidy obojętne. 8-10% suchej masy środka powierzchniowo czynnego stanowią białka: białka: A, B, C, D.
Środek powierzchniowo czynny ma następujące główne funkcje:
zapobiega zapadaniu się pęcherzyków płucnych podczas wydechu;
chroni nabłonek pęcherzykowy przed uszkodzeniem i wspomaga oczyszczanie śluzowo-rzęskowe;
ma działanie bakteriobójcze wobec drobnoustrojów Gram-dodatnich i stymuluje reakcję makrofagów w płucach;
uczestniczy w regulacji mikrokrążenia w płucach i przepuszczalności ścian pęcherzyków płucnych, zapobiega rozwojowi obrzęku płuc.
Ważną rolę w pełnieniu tych funkcji surfaktantów odgrywają białka, z których A (SpA) i D (SpD) – hydrofilowe – biorą udział w mechanizmach ochronnych organizmu dziecka (nie zawarte w surfaktantach płuc zwierząt) oraz białka B (SpB) i C (SpC) - hydrofobowe - zmniejszają napięcie powierzchniowe pęcherzyków poprzez stymulację absorpcji fosfolipidów na powierzchni bariery powietrznej i sprzyjają równomiernemu rozprowadzeniu środka powierzchniowo czynnego na powierzchni pęcherzyków (zawartego w otrzymanych środkach powierzchniowo czynnych) z płuc zwierząt). Geny determinujące syntezę białek powierzchniowo czynnych SpA i SpD znajdują się na 10. chromosomie, SpB na 2., a SpC na 8. chromosomie. SpA pojawia się w płynie owodniowym człowieka w 19. tygodniu ciąży, a SpB w 31. tygodniu ciąży; w przyszłości ich poziom będzie stale wzrastał.
Ponadto, według współczesnych koncepcji, wśród tych białek najważniejsze jest białko B, surfaktant, gdyż jego dziedziczny lub wrodzony niedobór jest dla człowieka śmiertelny (de Mello D.E. i in., 1994; Nogee L.M., 1995; Chetcuti PAJ., Ball R.J., 1995). Niedobór SpB jest dziedziczony w sposób aytosomalny recesywny i objawia się u donoszonych noworodków z obrazem klinicznym typowego SDD wcześniactwa, wymagających długotrwałej wentylacji mechanicznej. Terapia zastępcza środkami powierzchniowo czynnymi pochodzenia zwierzęcego ma jedynie działanie przejściowe. Możliwą metodą leczenia jest przeszczep płuc.
Syntezę białek surfaktantów stymulują glukokortykoidy, hormony tarczycy, estrogeny, adrenalina i noradrenalina, natomiast hamuje insulina.
Surfaktant zaczyna być wytwarzany u płodu od 20-24 tygodnia rozwoju wewnątrzmacicznego przez komórki pęcherzykowe typu II. Gromadzi się w nich w postaci osmiofilnych granulek, które migrują na powierzchnię pęcherzyków płucnych, gdzie w hipofazie tworzy cienką warstwę. Szczególnie intensywne uwalnianie środka powierzchniowo czynnego następuje w momencie porodu, co przyczynia się do procesu pierwotnej ekspansji płuc. Okres półtrwania środka powierzchniowo czynnego wynosi 10-20 godzin.
Istnieją dwie drogi syntezy głównego składnika fosfolipidów – fosfatydylocholiny (lecytyny): 1) metylacja fosfatydyloetanoloaminy (kefaliny) przy użyciu metylotransferazy (źródłem grupy metylowej jest metionina); 2) synteza z choliny difosforanu cytydyny w obecności transferazy fosfocholinowej, która reaguje z diglicerydem. Ustalono, że do 33-35 tygodnia rozwoju wewnątrzmacicznego synteza surfaktantów odbywa się głównie poprzez metylację etanoloaminy, a później transferazy fosfatydylocholinowej.
Pierwsza droga syntezy surfaktantów łatwo ulega wyczerpaniu pod wpływem niedotlenienia, kwasicy i hipotermii. Dlatego uważa się, że układ środków powierzchniowo czynnych w pełni dojrzewa w 35-36 tygodniu rozwoju wewnątrzmacicznego. U dziecka urodzonego przed tym okresem dostępne rezerwy środka powierzchniowo czynnego zapewniają początek oddychania i tworzenie funkcjonalnej resztkowej pojemności płuc, ale z powodu opóźnienia w syntezie środka powierzchniowo czynnego w stosunku do szybkości jego rozpadu występuje niedobór tej substancji , co prowadzi do zapadnięcia się pęcherzyków płucnych podczas wydechu, gwałtownego wzrostu pracy mięśni oddechowych , ponieważ z powodu niestabilnej funkcjonalnej pojemności resztkowej płuc i ich zwiększonej „sztywności” wysiłki wymagane przy każdym kolejnym nadmuchaniu płuca powinny być takie same jak przy pierwszym oddechu. Ponadto z powodu zapadnięcia się pęcherzyków płucnych nie dochodzi do ciągłej wymiany gazowej w płucach, co powoduje rozwój hipoksemii i hiperkapni.
Wyjaśnijmy to, wraz z fosfatydylocholiną normalne funkcjonowanie powierzchniowo czynny, ważne są także inne jego składniki, zwłaszcza fosfatydyloglicerol i fosfatydyloinozytol. Na przykład w popłuczynach płuc dzieci zmarłych na SDR i urodzonych przez matki chore na cukrzycę, ilość lecytyny i sfingomieliny oraz ich stosunek są w normie, ale występuje niedobór glutenu fosfatydylowego. Natomiast u bardzo wcześniaka, z niskim poziomem lecytyny w płynie owodniowym, ale przy prawidłowej zawartości fosfatydyloglicerolu, SDR nie rozwija się. W SDR oprócz zaniku fosfatydyloglicerolu z surfaktantu zmniejsza się ilość zawartej w nim nasyconej fosfatydylocholiny i zwiększa się zawartość fosfatydyloseryny i sfingomieliny.
Zmniejsz syntezę środków powierzchniowo czynnych:
„uraz spowodowany zimnem, w tym użycie nieogrzanej mieszaniny tlenu i powietrza podczas wentylacji mechanicznej;
kwasica patologiczna;
hipowolemia;
czerwienica;
hipoksemia;
hiperoksja;
barotrauma i volutrauma płuc;
infekcji, zarówno przed-, wewnątrz-, jak i poporodowych. Wymienione czynniki uszkadzają pęcherzyki płucne, aktywują syntezę cytokin prozapalnych, układu dopełniacza i chemokin (anafilotoksyny, bradykinina itp.), co prowadzi do zwiększonej przepuszczalności śródbłonka i obrzęku pęcherzyków płucnych.
Inaktywacji środka powierzchniowo czynnego i jego zniszczeniu sprzyjają:
infekcje (zwłaszcza Gram-ujemne, mykoplazma);
białka osocza, które „wyciekły” do pęcherzyków płucnych;
kwasica patologiczna;
nadmiar utleniaczy, związków nadtlenkowych, cytokin prozapalnych.
Ważnym czynnikiem predysponującym do rozwoju SDR jest niedojrzałość płuc u płodów, które rozwijały się w niekorzystnych warunkach. Histologicznie niedojrzałość płuc objawia się szerokimi warstwami tkanki śródmiąższowej w groniakach, zmniejszeniem liczby przewodów pęcherzykowych i pęcherzyków płucnych, niepełnym różnicowaniem gron i luźnym dopasowaniem naczyń włosowatych do pęcherzyków płucnych. W płucach dzieci zmarłych na SDR może występować jednocześnie niedodma, błony szkliste i zmiany obrzękowo-krwotoczne w różnych obszarach.
Błony szkliste składają się z macierzy fibrynowej i resztek komórkowych – produktu końcowego fragmentów komórek krwi i uszkodzonego nabłonka. Okres poprawy SDR charakteryzuje się regeneracją ścian pęcherzyków płucnych, pęcherzyków płucnych, w tym pneumocytów typu II i w efekcie wzrostem syntezy środka powierzchniowo czynnego. Błony szkliste same w sobie nie powodują rozwoju niedodmy. U niektórych dzieci, zarówno pod względem klinicznym, jak i patomorfologicznym (w przypadku śmierci), wyraźnie dominują objawy choroby błony szklistej lub pierwotnej niedodmy oraz zespołu obrzękowo-krwotocznego. Dlatego termin „zespół zaburzeń oddechowych” jest obecnie prawdopodobnie bardziej popularny za granicą niż „choroba błony szklistej”.
Czynnikami prowokującymi przejaw niedoboru środka powierzchniowo czynnego w postaci BHM są:
aspiracja płynu owodniowego ze smółką (dzieci matek, które cierpiały na długotrwałą - ponad 4 tygodnie - gestozę);
obrzękowo-krwotoczny zespół płucny (zwiększone czynniki ryzyka to niedotlenienie okołoporodowe, zwłaszcza pochodzenia mieszanego, niewydolność serca, niedobór prokoagulantów, których synteza zależy od witaminy K, fibrynogenu, ilościowy i jakościowy defekt płytkowego składnika hemostazy);
niedobór plazminogenu, a co za tym idzie niska aktywność fibrynolizy;
niewystarczająca aktywność antyproteaz (oc-antytrypsyna i ag-makroglobulina, antytrombina III itp.);
zdekompensowany zespół DIC.
U pacjentów z SDR rozwija się:
zmniejszona podatność, podatność płuc i funkcjonalna pojemność resztkowa;
zmniejszenie minutowej wentylacji płuc i wykorzystania (transportu) tlenu w płucach;
zwiększona praca oddechowa;
ciężka hipoksemia i niedotlenienie; hiperkapnia;
kwasica mieszana (oddechowo-metaboliczna);
zmniejszona synteza fosfolipidów i białek powierzchniowo czynnych;
wyraźny nadciśnienie płucne i ogólnoustrojowe niedociśnienie;
zmniejszony efektywny przepływ krwi w płucach;
hipowolemia, zaburzenia mikrokrążenia, obrzęki obwodowe tj. zjawiska szoku;
skompensowane lub zdekompensowane rozsiane krzepnięcie wewnątrznaczyniowe (zespół skompensowany lub zdekompensowany DIC);
zaburzenia metaboliczne (hipoproteinemia, skłonność do hipoglikemii, hipokalcemia, ale hiperkaliemia itp.);
niedociśnienie mięśniowe;
zaburzenia stanu funkcjonalnego mózgu spowodowane głównie HIE;
dysfunkcja mięśnia sercowego z niewydolnością serca (głównie typu prawokomorowego z przeciekami prawo-lewymi);
niestabilność temperaturowa z tendencją do wychłodzenia, w szczególności ze względu na charakterystyczną przejściową hipotyroksynemię;
słaba perfuzja nerek i obwodowa ze skąpomoczem, obrzękami;
czynnościowa niedrożność jelit (ryc. 12.1).
Obraz kliniczny. Pierwsza oznaka rozwoju SDR typu I (DMS)
to duszność (powyżej 60 oddechów na minutę), która w przypadku choroby błony szklistej i zespołu obrzękowo-krwotocznego objawia się zwykle w ciągu pierwszej godziny po urodzeniu, a w przypadku niedodmy pierwotnej – w pierwszych minutach życia. Pojawienie się duszności 3 godziny po urodzeniu i później nie jest typowe dla BGM. Zabarwienie skóry dziecka w momencie pojawienia się duszności jest normalne. Powodem, dla którego duszność w SDR występuje na tle różowej skóry, jest większe powinowactwo hemoglobiny płodowej do tlenu. Za hipoksemię uważa się spadek Pao2 we krwi do 8,67 kPa (65 torr lub mm Hg). Sinica u noworodków pojawia się przy poziomie Pao2 we krwi wynoszącym 4,27-5,87 kPa (32-44 mm Hg), a u dorosłych - 5,6-6,93 kPa (42-52 mm Hg). W rezultacie przy łagodnej hipoksemii skóra noworodka może być różowa, ale w wyniku podrażnienia chemoreceptorów naczyniowych u dziecka pojawia się już duszność.
Następnym objawem są odgłosy wydechowe zwane „chrząkaniem”. Odgłosy wydechowe są spowodowane faktem, że w początkowych stadiach SDR skurcz głośni podczas wydechu rozwija się jako mechanizm kompensacyjny (oddychanie typu oddechowego), co pomaga zwiększyć funkcjonalną pojemność resztkową płuc i zapobiega zapadnięciu się pęcherzyki. Przy ostrym rozluźnieniu nagłośni, przepływ powietrza pod zwiększonym ciśnieniem w drogach oddechowych pod strunami głosowymi powoduje hałas wydechowy.
Recesja klatki piersiowej podczas wdechu (cofanie wyrostek mieczykowaty mostek, okolica nadbrzusza, przestrzenie międzyżebrowe, dół nadobojczykowy) jest trzecią oznaką SDR pod względem czasu pojawienia się.
(l
I
ja i
Schemat 12.1. Patogeneza zespołu niewydolności oddechowej: IUI – zakażenia wewnątrzmaciczne; DIC – rozsiane wykrzepianie wewnątrznaczyniowe. W tym samym czasie lub nieco później pojawia się napięcie skrzydełek nosa, napady bezdechu, sinica (okołoustna, a później akrocyjanoza lub uogólniona) na tle bladości skóry, obrzęk policzków (oddychanie „trębacza”), sztywny rytm serca, oddychanie paradoksalne (cofanie się mięśnia przedniego ściana jamy brzusznej natchnieniem), piana w ustach (u połowy pacjentów), obrzęk dłoni i stóp. Typowa jest płaska klatka piersiowa (w kształcie pudełka zapałek).
Osłuchiwanie w pierwszych godzinach życia, nad płucami słychać wyraźnie osłabiony oddech, następnie na tle wentylacji mechanicznej słychać zwykłe, normalne dźwięki oddechowe, a dopiero później przy wdechu i wydechu pojawiają się wysokie, suche rzężenia, trzeszczące i dobrze bulgoczące rzężenia.
Typowe typowe objawy to:
niestabilność temperatury z tendencją do hipotermii;
letarg, brak ruchu, objawy depresji ośrodkowego układu nerwowego aż do adynamii, letargu, a nawet śpiączki (pamiętaj o możliwości wystąpienia hipoglikemii, hiperamonemii!);
obrzęk obwodowy tkanki podskórnej;
hiporefleksja i hipotonia mięśni;
hipowolemia i niedociśnienie tętnicze;
skąpomocz;
niedomykalność, wzdęcia, a nawet oznaki niedrożności jelit;
duże straty początkowej masy ciała;
Kończyny dolne często znajdują się w „pozycji żaby” (jak przy urazie kręgosłupa lędźwiowego).
Często u chorego dziecka diagnozuje się krwotok śródkomorowy (IVH), zwykle w stopniu I-II, lub ultrasonograficzne objawy leukomalacji okołokomorowej (PVL). U konkretnego dziecka czasami trudno jest określić, co jest pierwotne – uszkodzenie płuc (SDR) czy mózgu (IVH, PVL). W miarę postępu SDR, pomimo intensywnego leczenia, rozwijają się objawy wstrząsu i niewyrównanego DIC, w tym krwawienie z miejsca wstrzyknięcia, krwotok płucny itp.
Silverman zaproponował skalę oceny nasilenia zaburzeń oddechowych u noworodków (tab. 12.1).
Za każdy objaw w kolumnie „I etap” przyznawany jest 1 punkt, w kolumnie „II etap” – 2 punkty. Cechą szczególną skali jest to, że nie uwzględnia ona objawów niewydolności oddechowej, takich jak duszność i sinica, gdyż pojawienie się tych objawów u noworodka może wynikać także z pozapłucnych przyczyn zaburzeń układu oddechowego. Według Silvermana, przy łącznej punktacji 10 punktów, noworodek ma wyjątkowo ciężki SDR, 6-9 punktów - ciężki, 5 punktów - umiarkowane nasilenie, poniżej 5 - początkowy SDR.
Dane osłuchowe i perkusyjne w początkowym okresie SDR nie są poglądowe, ale później, na tle osłabionego oddechu, pojawiają się rozproszone trzeszczenia i ciche rzężenia drobnopęcherzykowe.
Zaburzenia sercowo-naczyniowe są bardzo typowe dla SDR. Początkowo rozwija się tachykardia i stłumione tony serca. Dalsze zmiany zależą od nasilenia nadciśnienia płucnego i zaburzeń hemoreologicznych. Skala Silvermana Etap 0 Etap I Etap II Górna część klatka piersiowa (przy dziecku ułożonym na plecach) i przednia ściana brzucha synchronicznie uczestniczą w akcie oddychania Brak synchronizacji lub minimalne opadanie górnej części klatki piersiowej przy unoszeniu się przedniej ściany brzucha podczas wdechu Zauważalne zagłębienie górnej klatki piersiowej podczas unoszenia się przedniej ściany brzucha przy wdechu. Brak cofania się żeber międzyżebrowych wdychanie Płuca cofanie się przestrzeni międzyżebrowych podczas wdechu zauważalne cofanie się przestrzeni międzyżebrowych podczas wdechu brak cofania się wyrostka mieczykowatego mostka podczas wdechu nieznaczne cofanie wyrostka mieczykowatego mostka podczas wdechu zauważalne cofanie wyrostka mieczykowatego mostka podczas wdechu brak ruch podbródka podczas oddychania Opuszczanie podbródka na wdechu, usta zamknięte Podbródek opada na wdechu, usta otwarte Brak hałasu przy wydechu Podczas osłuchiwania klatki piersiowej słychać odgłosy wydechowe („chrząkanie wydechowe”) Słychać odgłosy wydechowe („chrząkanie wydechowe”) przy przykładaniu fonendoskopu do ust lub nawet bez fonendoskopu Nadciśnienie płucne prowadzi do utrzymywania się przecieków płodowych i przecieków prawo-lewych przewód tętniczy i otwór owalny.
Ze względu na zwiększoną przepuszczalność naczyń obserwuje się hipowolemię, zagęszczenie krwi oraz wzrost liczby hematokrytu i stężenia hemoglobiny. Kiedy mechanizmy kompensacyjne zostaną wyczerpane, ciśnienie krwi spada i rozwija się trzeci etap wstrząsu.
Kolejnym powikłaniem SDR może być przeciek lewo-prawy (przez przetrwały przewód tętniczy), będący konsekwencją zbyt szybkiego powiększenia płuc po urodzeniu lub wentylacji mechanicznej. Zazwyczaj takie dzieci wykazują oznaki niedotlenienia i przeludnienie w płucach pod koniec pierwszego - początek drugiego tygodnia życia wzrasta ciśnienie tętna, na naczyniach słychać szmer skurczowo-rozkurczowy.
Diagnostykę różnicową przetrwałego zespołu krążenia płodowego i przetrwałego przewodu tętniczego przedstawiono w tabeli 12.2.
Nawarstwianie się wtórnej infekcji stanowi poważne zagrożenie dla dzieci z SDD, u 40-50% pacjentów rozwija się zapalenie płuc.
Obecny SDR. W przypadku SDR o umiarkowanym nasileniu i nieskomplikowanym przebiegu maksymalne nasilenie stanu obserwuje się w 1. dniu życia, a następnie intensywność cofania mostka, cofania przestrzeni międzyżebrowych, a także napadów bezdechu, obrzęku i skąpomocz stopniowo ustępuje. Zwiększa się diureza, napięcie mięśniowe i spontaniczna aktywność ruchowa, poprawia się stan neurologiczny, zmniejsza się zapotrzebowanie na tlen i wentylację mechaniczną. Jeżeli choroba nie jest powikłana krwotokiem dokomorowym, leukomalacją okołokomorową, rozedmą śródmiąższową i innymi rodzajami „przecieku powietrza”, utrzymującym się
Tabela 12.2
Diagnostyka różnicowa zespołów wtórnych spowodowanych funkcjonującym przewodem tętniczym Objaw Zespół przetrwałego krążenia płodowego (przeciek prawy-lewy) Zespół przetrwałego przewodu tętniczego (przeciek lewy-prawy) Zamartwica i aspiracja podczas porodu Typowa Nietypowa Wentylacja mechaniczna w pierwszych godzinach życia Maj być Typowa Niedodma płuc Typowa Rzadko Nawracający bezdech pod koniec pierwszego - początek drugiego tygodnia życia Może być typowa Sinica uogólniona W pierwszych dniach życia z wiśniowym odcieniem Pod koniec pierwszego - w drugim tygodniu życia, z marmurkowym odcieniem Zróżnicowana sinica (głównie nóg) Typowa Nietypowa Reakcja na oddychanie 100% tlenu Poprawy z reguły nie obserwuje się, Pao2 utrzymuje się poniżej 9,33 kPa Poprawa, Pao wzrasta powyżej 10,67 kPa W kapilarze krew rąk, Pao wynosi 1,33 kPa, a pH jest o 0,02 wyższe niż we krwi nóg Typowy Nietypowy Obfitość krepujących się rzeżek pod wpływem inspiracji, różowa piana Nietypowe, ale może wystąpić w pierwszych dniach życia Typowe dla końca pierwszego tygodniu życia i starsze Tętno Słabe i małe Duże i szybkie, galopujące Ciśnienie krwi Podwyższone lub obniżone Zwiększone tętno z niskim rozkurczem Granica serca Umiarkowanie rozszerzona, głównie w prawo Poszerzona, głównie w lewo, pasek Herharta Rozmiary wątroby Zwykle nie gwałtownie wzrosło Ostro wzrosło Prześwietlenie narządów klatki piersiowej Niedodma, zapalenie płuc, sieć guzkowo-siatkowa, serce rozszerzone głównie w prawo, konturuje jego nierówności, zubożenie krążenia płucnego. W stadium III - obrzęk płuc Początkowo zwiększa się dopływ krwi do płuc, obrzęk środkowych, a następnie obwodowych pól płuc. Serce powiększone głównie w lewo i do góry. Szmer w okolicy serca często nie występuje lub jest skurczowy w drugiej przestrzeni międzyżebrowej na lewo od mostka. Typowe są elektrokardiograficzne objawy przeciążenia prawej części serca. Szmer skurczowy i rozkurczowy jest typowy, szmer skurczowy może być obecny lub nieobecny.
Na EKG najpierw występuje przeciążenie lewej części serca, potem prawej
Tabela 12.2 (ciąg dalszy)
Objawy Zespół przetrwałego krążenia płodowego (przeciek prawy-lewy) Zespół przetrwałego przewodu tętniczego (przeciek lewy-prawy) Badanie ultrasonograficzne serca (wskaźnik: lewy przedsionek - aorta) Poniżej 1,0 Ponad 1,3 Kliniczny efekt leczenia Glikozydy nasercowe Może powodować pogorszenie hemodynamiczne Dodatni Tolazolina (do żyły głowy) Poprawa Pogorszenie Indometacyna Brak zmian Poprawa Droperydol Pewna poprawa Zwiększony hałas
nadciśnienie, następnie już w połowie pierwszego tygodnia życia dziecko zostaje najpierw przeniesione na IVL (kaniule nosowe), a następnie samodzielnie oddycha, karmione jest dojelitowo,
Ale.
U dzieci z masą urodzeniową mniejszą niż 1500 g SDR zwykle występuje z wymienionymi poniżej powikłaniami (jeden lub więcej), a następnie wentylacja mechaniczna jest opóźniona, czasami o kilka tygodni. Typowe powikłania u dzieci z SDD. System:
niewyrównana ciężka kwasica, wstrząs mieszanego pochodzenia, niewyrównany zespół DIC;
krwotoki śródkomorowe;
przetrwały przewód tętniczy;
uporczywy zespół krążenia płodowego;
zespół przetrwałego przewodu tętniczego;
przejściowa hiperamonemia;
hipoglikemia;
martwicze zapalenie jelit;
retinopatia wcześniaków;
niewydolność nerek. Miejscowe, płucne:
zespoły wycieku powietrza;
obrzęk płuc;
zapalenie płuc;
krwotoki w płucach;
dysplazja oskrzelowo-płucna;
zaburzenia związane z nieprawidłowym położeniem lub niedrożnością dróg oddechowych, zmiany chorobowe krtani i tchawicy (zwężenie przestrzeni podgłośniowej, obrzęki, zwężenia, nadżerki, ziarniniak).
Postępowanie z pacjentami z GBM wymaga od neonatologa połączenia głębokiej wiedzy z zakresu fizjologii związanej z wiekiem, algorytmów intensywnej terapii z opanowaniem sztuki ciągłej analizy dynamiki objawów klinicznych, współczucia i empatii dla dziecka. Konieczne jest ciągłe monitorowanie podstawowych parametrów życiowych i jako informacja zwrotna konieczna jest szybka korekta zarówno parametrów wentylacji mechanicznej, jak i terapii infuzyjnej i farmakologicznej. Wydaje się, że u wielu dzieci z HBM nasilenie stanu po pierwszym dniu życia wynika nie tyle z początkowego nasilenia choroby płuc, ile z ich uszkodzenia (z wtórnym niedoborem surfaktantów) z nieodpowiednim (niezmiennym w zależności od „reakcja dziecka”) parametry wentylacji mechanicznej, nadmierna lub niewystarczająca infuzja, farmakoterapia, schładzanie.
Rozpoznanie stawia się na podstawie obrazu klinicznego i zdjęcia RTG klatki piersiowej.
Radiologicznie HBM charakteryzuje się triadą objawów pojawiających się w ciągu pierwszych 6 godzin życia:
rozsiane, symetryczne ogniska o zmniejszonej przezroczystości (objaw matowej szyby bez lub z objawami „płuc siateczkowych”);
bronchogram powietrzny;
zmniejszona pneumatyzacja obwodowych pól płucnych.
Te rozległe zmiany są lepiej widoczne w dolnych partiach płuc i na ich wierzchołkach. Ponadto widoczne jest zmniejszenie objętości płuc, różne nasilenie kardiomegalii (wzrost wskaźnika kardiochirurgicznego), zmiany guzkowo-siatkowe (różni autorzy określają je jako siatkowe, mozaikowe, ziarniste, paciorkowe itp., ale nadal są to tzw. częściej interpretowane jako rozlana niedodma).
W przypadku zespołu obrzękowo-krwotocznego typowe jest zmniejszenie wielkości pól płucnych i „niewyraźny” obraz rentgenowski, co klinicznie często łączy się z uwolnieniem pienistego płynu z krwią z ust.
Jeśli wymienione objawy HD nie zostaną wykryte na radiogramach 3 godziny po urodzeniu, wówczas rozpoznanie HD jest wątpliwe. Cechy radiograficzne SDR są niespecyficzne (np. podobne do paciorkowcowego zapalenia płuc typu B), ale nadal konieczne jest wykonanie prześwietlenia klatki piersiowej, aby wykluczyć inne schorzenia, które czasami wymagają operacji. Rentgenowskie objawy HD ustępują po kilku godzinach lub 1-3 dniach, w zależności od ciężkości choroby, charakteru terapii, w szczególności od zastosowania egzogennego środka powierzchniowo czynnego.
RJ Rodrigues i in. (2002) podkreślają, że nawet w większości ośrodków noworodkowych w USA diagnozując SDR opierają się wyłącznie na danych klinicznych i radiologicznych, choć oczywiście dla prawidłowego rozpoznania SDR ważne jest uzyskanie dowodów na niedobór surfaktantu. Dlatego czasami używa się dziś określenia „niewydolność oddechowa wcześniaków”, gdy leczenie wcześniaka wymaga wentylacji mechanicznej i dodatkowego tlenu, a prześwietlenie klatki piersiowej nie wykazuje typowych objawów RDD.
Diagnostyka prenatalna opiera się na fakcie, że płyn z płuc płodu z dróg oddechowych przedostaje się do płynu owodniowego, a jego skład fosfolipidowy pozwala ocenić dojrzałość płuc płodu. Płyn owodniowy uzyskuje się poprzez amniopunkcję lub pobranie płynu z kanału rodnego matki. Jeśli poziom lecytyny i sfingomieliny, nasyconej fosfatydylocholiny w płynie owodniowym przekracza 5 mg/l lub fosfatydyloglicerolu - 3 µmol/l, SDR rozwija się bardzo rzadko (poniżej 1% przypadków). Jeśli stosunek lecytyna/sfingomielina (L/S) jest większy niż 2,0, prawdopodobieństwo SDR wynosi 2%, jeśli mniejsze niż 2,0, ale większe niż 1,0, wynosi 50%, a jeśli mniejsze niż 1,0, wynosi -75%. W przypadku wewnątrzmacicznego opóźnienia wzrostu stosunek L/C nie zawsze prawidłowo odzwierciedla dojrzałość funkcjonalną płuc płodu, dlatego też w tych przypadkach zaleca się kierować się podanymi powyżej bezwzględnymi poziomami nasyconej fosfatydylocholiny i fosfatydyloglicerolu, gdyż a także białka surfaktantów A. W niektórych ośrodkach noworodkowych stosuje się badania mające na celu ocenę dojrzałości płuc płodu, aktywność tromboplastyczną płynu owodniowego i zliczanie „komórek pomarańczowych”, ale nie jest to powszechnie akceptowane.
„Test piany” jest najprostszym testem dojrzałości płuc. Do wykonania testu wykorzystuje się płyn owodniowy lub 1 ml treści żołądkowej pobranej za pomocą cewnika polietylenowego w pierwszej godzinie życia. Badanie przeprowadza się w następujący sposób: 0,5 ml absolutnego etanolu (95%) dodaje się do 0,5 ml płynu owodniowego lub treści żołądkowej. Szklaną probówkę (o średnicy 1 cm) wytrząsa się energicznie przez 15 s, po 15 minutach ocenia się wynik badania zbliżając probówkę do czarnego papieru. Test jest pozytywny, jeśli na powierzchni znajduje się pojedynczy lub podwójny pierścień pęcherzyków. Wynik testu jest negatywny, jeśli nie ma pęcherzyków, i słabo pozytywny, jeśli wokół menisku znajdują się pojedyncze małe pęcherzyki, wypełniające 1/3 obwodu lub mniej. W przypadku testu pozytywnego prawdopodobieństwo HDM wynosi około 4%, słabo pozytywnego – 20%, negatywnego – 60%.
Zakres badań (monitoringu) u dzieci z RDS:
Ciągłe monitorowanie tętna i ABP.
Przezskórna oksyhemoglobinometria, czyli jeszcze lepiej, przezskórne oznaczanie Pao2 i Paco2 we krwi tętniczej. Bardzo niebezpieczne jest poleganie wyłącznie na danych pulsoksymetru, ponieważ dobrze odzwierciedla on nasilenie hipoksemii, ale nie reaguje na hiperoksję, a nawet przy dolnej granicy normy oksyhemoglobina Raoha wynosi 100%. Niebezpieczeństwo hiperoksji jest ogromne: wiąże się to z przewlekłym uszkodzeniem płuc i oczu u noworodków.
Optymalne jest oznaczenie Pao2 i Paco2 we krwi uzyskanej poprzez cewnikowanie tętnicy pępowinowej, promieniowej lub piszczelowej oraz z żyły centralnej, z analizą tętniczo-żylnej różnicy prężności tlenu, tj. zużycie tlenu przez tkanki.
Co 3-4 godziny należy mierzyć i zapisywać w karcie obserwacyjnej temperaturę skóry brzucha, ciśnienie krwi, diurezę, CBS, poziom glikemii i stężenie tlenu w powietrzu wdychanym (Fio2).
W fazie ostrej SDR wykonuje się codziennie lub co drugi dzień:
Rentgen klatki piersiowej;
oznaczenie wskaźnika hematokrytu;
EKG;
kliniczne badanie krwi;
posiew krwi i zawartości tchawicy;
oznaczanie w surowicy krwi poziomu azotu mocznikowego, potasu, sodu, wapnia i magnezu, białka całkowitego i albumin;
pożądane jest określenie objętości krążącej krwi, szybkości mózgowego przepływu krwi i osmolarności krwi;
koagulogram z oznaczeniem fibrynogenu i produktów rozkładu fibryny (wg wskazań);
oznaczenie poziomu sodu we krwi na początek – 2-4 razy dziennie, gdyż istnieje duże ryzyko wystąpienia hipernatremii na skutek odwodnienia.
Diagnostykę różnicową przeprowadza się w przypadku chorób układu oddechowego zarówno pochodzenia płucnego (zapalenie płuc, wady rozwojowe płuc itp.), jak i pochodzenia pozapłucnego (wtórne zaburzenia oddechowe - wewnątrzczaszkowe uszkodzenie mózgu lub rdzenia kręgowego, wrodzone wady serca, przepuklina przeponowa, czerwienica, zaburzenia metaboliczne zaburzenia itp.). Poniżej przedstawiono diagnostykę różnicową zapalenia płuc.
Agenezja nozdrzy tylnych powoduje niemożność oddychania przez nos oraz pojawienie się sinicy i zaburzeń oddychania po prawidłowym pierwszym oddechu. Typowym objawem jest obfita wydzielina śluzowa wypełniająca nos. Wada rozwojowa staje się oczywista, gdy nie jest możliwe wprowadzenie cewnika lub sondy przez nos do nosogardzieli. Leczenie jest chirurgiczne, ale przewód powietrzny jest natychmiast wprowadzany do jamy ustnej.
Przetoki tchawiczo-przełykowe objawiają się klinicznie duszeniem, napadami sinicy, kaszlem i pojawieniem się świszczącego oddechu w płucach podczas karmienia lub bezpośrednio po nim. Badanie kontrastowe przełyku (rozpuszczalnym w wodzie środkiem kontrastowym) i bronchoskopia potwierdzą diagnozę.
Przepuklina przeponowa jest wykrywana zaraz po urodzeniu lub wkrótce po urodzeniu w wyniku coraz poważniejszych zaburzeń oddychania. Typowe są mały brzuch trzeszczkowy i cofnięta przednia ściana brzucha po urodzeniu. Podczas badania zwraca się uwagę na asynchroniczne ruchy prawej i lewej połowy klatki piersiowej oraz przemieszczenie wierzchołka serca, częściej w prawo (ponieważ przepuklina przeponowa lewa występuje 5-10 razy częściej niż prawa dwustronne), gwałtowne skrócenie tonu opukowego w dolnej części płuc i brak szmerów oddechowych, nagła sinica przy ułożeniu dziecka na zdrowym boku. Decydujące znaczenie diagnostyczne ma zdjęcie rentgenowskie klatki piersiowej, które wykazuje obecność w klatce piersiowej nietypowych dla niej struktur (jelita, wątroba itp.). Leczenie jest chirurgiczne.
U dzieci z porodowym urazem mózgu i rdzenia kręgowego oraz zaburzeniami oddychania występują także oznaki uszkodzenia ośrodkowego układu nerwowego. Badania pomocnicze pomagają również w szybkiej diagnostyce patologii mózgu: neurosonografia, radiografia kręgosłupa, nakłucie lędźwiowe itp.
Wrodzone wady serca typu niebieskiego i przetrwały zespół krążenia płodowego są czasami trudne do odróżnienia od DFS. Jednak w pierwszych godzinach życia dzieci z SDD często mają normalny kolor skóry. Przy stosowaniu do oddychania 100% tlenem przez 10-15 minut, zwłaszcza przy stałym dodatnim ciśnieniu w drogach oddechowych, u dzieci z SDR wzrasta Raoh, czasami nawet powyżej 100 Torr, podczas gdy nie dzieje się tak w przypadku wad serca typu niebieskiego. Oczywiście istotne są także dane z badania klinicznego, osłuchiwania, oceny w skali Silvermana, a także badań dodatkowych (prześwietlenie klatki piersiowej, EKG, wynik echokardiografii).
Zapalenie płuc wywołane przez paciorkowce B i inne paciorkowce (peptokoki, enterokoki) dają obraz kliniczny praktycznie nie do odróżnienia od BGM, ponieważ powodują hamowanie surfaktantu, a co za tym idzie jego niedobór. Znaczenie diagnostyczne w tym przypadku ma identyfikacja innych ognisk zakaźnych (zapalenie opon mózgowo-rdzeniowych itp.), Wyniki klinicznych badań krwi, posiewów krwi i zawartości tchawicy.
Leczenie. Ochrona temperaturowa. Pielęgnacja ma na celu przede wszystkim zapobieganie wychłodzeniu, ponieważ pomaga zmniejszyć lub nawet zatrzymać (przy temperaturze ciała 35°C i niższej) syntezę surfaktantów oraz nasilić kwasicę metaboliczną, rozwój napadów bezdechu. Zaraz po urodzeniu dziecko owija się w sterylną podgrzewaną pieluchę, płyn owodniowy pobiera się ze skóry poprzez dokładne osuszenie i umieszcza pod promieniującym źródłem ciepła, a następnie w inkubatorze (temperatura w inkubatorze zależy od masy ciała w chwili urodzenia; np. szczegółowe informacje można znaleźć w rozdziale VIII). Co 1-2 godziny rejestruje się temperaturę ciała dziecka, a jeśli jest niższa niż 36°C, to temperaturę powietrza w inkubatorze podnosi się o 1-2°C, a jeśli przekracza 37°C, obniża się ją (zazwyczaj nie powinna być niższa niż 32°C). Więcej szczegółów w Rozdziale VIII.
Należy pamiętać, że dziecko leżące pod promieniującym źródłem ciepła na stole reanimacyjnym zużywa o 5-10% więcej energii na utrzymanie temperatury ciała niż dziecko w inkubatorze. Dlatego też wskazane jest umieszczanie wcześniaków o bardzo małej masie ciała, nawet w inkubatorze, w plastikowej komorze, aby ograniczyć utratę ciepła na drodze konwekcji, a także niezauważalną utratę wody. Każdemu dziecku należy założyć czapkę na głowę, ponieważ utrata ciepła i wody z głowy jest bardzo duża.
Ważne jest, aby zapobiegać wahaniom temperatury otoczenia; Podczas badania dziecka w inkubatorze minimalizuj traumatyczne skutki - ból itp.
Badanie lekarskie powinno być jak najkrótsze, szczególnie ważne jest, gdy dziecko potrzebuje obrócić się, aby podeprzeć głowę, ograniczając ruchy bierne w odcinku szyjnym kręgosłupa.
Utrzymanie drożności dróg oddechowych. Kiedy dziecko rodzi się z asfiksją, obecność smółki w płynie owodniowym w postaci „grochówki” wymaga intubacji dotchawiczej i delikatnego, ale energicznego odessania zawartości dróg oddechowych. Odsysanie powtarza się kilkukrotnie w ostrej fazie choroby, kierując się obrazem klinicznym i danymi osłuchowymi, pamiętając jednak, że toaleta tchawicza powoduje przejściową, ale znaczną hipoksemię, bradykardię i nadciśnienie, istotną zmianę w natężeniu mózgowego przepływu krwi, co może wywołać krwotoki śródczaszkowe, zmiany przykomorowe .
Pozycja dziecka z SDD na stole lub w inkubatorze powinna być z lekko wysuniętą głową („pozycja kichania”). W tym celu pod górną część klatki piersiowej należy umieścić poduszkę o grubości 3-4 cm. Okresowa zmiana pozycji dziecka (lekki obrót w bok, na brzuchu itp.) stymuluje drenaż tchawicy. Pod koniec ostrego okresu uciekają się do masażu wibracyjnego, fizjoterapii i terapii aerozolowej.
Terapia infuzyjna i żywienie. Z reguły dzieci z SDD nie są karmione dojelitowo przez pierwsze 2–3 dni życia ze względu na ryzyko powikłań krążeniowo-oddechowych i niedomykalności. Jednak już od pierwszych godzin życia dziecko nie powinno odczuwać głodu i pragnienia. Ponadto niezwykle ważne jest zapobieganie rozwojowi hipoglikemii. Dlatego już 30-40 minut po urodzeniu rozpoczyna się planowana terapia infuzyjna. Objętość podawanego płynu w pierwszym dniu życia wynosi 50-60 ml/kg i w każdym kolejnym dniu zwiększa się o 20 ml/kg (w siódmym dniu około 140-150 ml/kg). W przypadku skąpomoczu u dziecka należy szczególnie ostrożnie podawać płyn i zwiększać jego dobową objętość. Gdy pojawia się diureza (powyżej 2 mil/kg/h), objętość płynu zwiększa się bardziej śmiało (do 40 ml/kg na dobę). Nadmierna objętość płynu w fazie skąpomoczu może przyczyniać się do utrzymania przetrwałego przewodu tętniczego, obrzęku płuc i być czynnikiem zwiększonego ryzyka późniejszego rozwoju BPD. Przywrócenie diurezy jest zwiastunem rozpoczęcia fazy rekonwalescencji.
W pierwszym dniu życia przetaczanym płynem jest 5-10% roztwór glukozy, od drugiego dnia dodaje się do niego sód i chlor w ilości 2-3 mol/kg/dobę. oraz potas, wapń 2 mol/kg/dzień. Skład roztworu do infuzji dobiera się w zależności od monogramu krwi, utrzymując poziom natremii w granicach 135-145 mmol/l osocza. Aby zapobiec zakrzepicy cewnika i naczynia regionalnego, szczególnie u dzieci stosujących całkowite żywienie pozajelitowe, do podawanych roztworów dodaje się heparynę w dawce 0,2-0,5 jednostki na 1 ml przetoczonego płynu.
Ogólnie, jak wiadomo, objętość i charakter terapii infuzyjnej określa się w zależności od:
OCC;
diureza;
dynamika masy ciała;
dynamika ADC i natężenie przepływu mózgowego;
stan układu sercowo-naczyniowego, w szczególności stan krążenia obwodowego;
CBS i jonogramy surowicy krwi;
warunki opieki, w szczególności adekwatność ochrony termicznej, metody wentylacji mechanicznej lub IVL.
Uwzględnienie wszystkich tych parametrów i skorygowanie objętości to skomplikowane zadania, wymagające zarówno wiedzy, jak i umiejętności lekarza, ponieważ do tej pory noworodki są nie tyle leczone, co karmione piersią.
Karmienie dawcą, mlekiem matki lub mieszanką dostosowaną dla wcześniaków rozpoczyna się po poprawie stanu zdrowia i zmniejszeniu duszności do 60 na minutę, braku długotrwałych bezdechów, niedomykalności, po kontrolnym podaniu wody destylowanej. Rodzaj karmienia (jednorazowa lub stała zgłębnik żołądkowy lub przezodźwiernikowy, z butelki) zależy od obecności odruchu ssania i ciężkości stanu chorobowego. Obliczanie ilości mleka – patrz rozdział VI, w którym można przeczytać także o sposobie żywienia pozajelitowego, jeśli stan pacjenta nie pozwala na rozpoczęcie żywienia dojelitowego.
Normalizację składu gazowego krwi osiąga się poprzez wzbogacanie wdychanego powietrza tlenem, różne możliwości wytworzenia podwyższonego ciśnienia w drogach oddechowych podczas oddychania spontanicznego (oddychanie spontaniczne przy stałym dodatnim ciśnieniu w drogach oddechowych) poprzez kaniule nosowe (sCPAP - nosowy ciągły dodatni ciśnienie w drogach oddechowych) przy stałym podwyższonym ciśnieniu i wentylacji mechanicznej.
Jeśli nie ma oznak SDR, wcześniak umieszcza się w inkubatorze, gdzie zawartość tlenu w powietrzu wynosi około 40-45%. Jeżeli w ciągu 4 godzin Rao krwi tętniczej (lub określone przez czujnik skórny) utrzyma się powyżej 8 kPa (60 torr = mmHg), wówczas stężenie tlenu spada o 5% na godzinę do poziomu 30-35%. Gdy Pao2 jest mniejsze niż 6,67 kPa (50 torr = mmHg), stężenie tlenu we wdychanym powietrzu zwiększa się do maksimum poprzez założenie nasadki w inkubatorze na głowę dziecka. Jeżeli nie prowadzi to do normalizacji Pao2 we krwi, wówczas rozpoczyna się SDPPD (optymalnie przez kaniule nosowe).
Inne wskazania do rozpoczęcia SDP to:
uporczywa duszność i odgłosy wydechowe;
Silverman zdobędzie 5 lub więcej punktów (nawet przy normalnym kolorze skóry);
negatywny „test piany” z płynu owodniowego lub zawartości żołądka uzyskany bezpośrednio po urodzeniu, brak w nich fosfatydyloglicerolu.
Obecnie najczęściej stosowaną metodą jest pCPAP, znacznie rzadziej stosowana jest metoda Martina (worka Martina). Worek mocowany jest do szyi dziecka za pomocą taśmy piankowej, dzięki czemu mały palec lekarza może swobodnie wnikać pomiędzy worek a szyję. Ciśnienie wydechowe przy użyciu CPAP mieści się zwykle w przedziale 4-6 cm wody. Sztuka. (czyli rurka, przez którą wychodzi powietrze z worka jest zanurzona na tę głębokość), rzadko trzeba ją zwiększać w przypadku dużej sztywności płuc do 10 cm wody. Sztuka. Jeśli sztywność płuc jest niska, wówczas nadmierne ciśnienie podczas wydechu prowadzi do zakłócenia odpływu krwi z mózgu, zmniejszenia jej przepływu do serca i przyczynia się do rozwoju niewydolności serca i obrzęku mózgu.
SDPPD rozpoczyna się od podania nawilżonego tlenu ogrzanego do temperatury 32-34°C, a następnie pod kontrolą efektu klinicznego i PaO2 we krwi, stopniowo zmniejsza się jego stężenie w wdychanej mieszaninie, osiągając PaO2 we krwi tętniczej na poziomie 6,67-10,67 kPa (50-80 torr = mm Hg), a krew tętnicza z pięty powyżej 8 kPa uważana jest za potencjalnie toksyczną, wymagającą zmniejszenia stężenia tlenu we wdychanym powietrzu.
Jeśli dziecko jest bardzo niespokojne, co obserwuje się szczególnie często w obecności pCPAP, przepisuje się hydroksymaślan sodu lub seduksen, ale nie fenobarbital, który selektywnie tłumi struktury wydechowe ośrodka oddechowego zlokalizowanego w rdzeniu przedłużonym.
Wskazaniami do wentylacji mechanicznej są:
niemożność osiągnięcia normalizacji krwi Pao2 na tle pCPAP, wynik Silvermana większy niż 5 punktów, który nie zmniejsza się na tle pCPAP;
Pao2 wynosi poniżej 8,00 kPa (60 mm Hg) przy Fio2>0,7 (F1O2 to udział tlenu w wdychanej mieszaninie tlenu i powietrza), natomiast jeśli masa urodzeniowa jest mniejsza niż 1250 g, to przy Fio2>0,4;
Paco2 wynosi powyżej 8,79 kPa (65 mm Hg), a przy masie ciała poniżej 1250 g - Paco2 >8,00 kPa (60 mm Hg) i pH pH. Sposób prowadzenia wentylacji mechanicznej znajduje się w rozdz. XXVI.
Pozaustrojowe natlenianie membranowe stosuje się za granicą w leczeniu dzieci ze skrajnie ciężkim SDR, gdy tradycyjne metody wentylacji mechanicznej są nieskuteczne oraz u dzieci z ciężkimi wadami serca. Ze względu na brak odpowiedniego sprzętu w Rosji, w tym podręczniku nie opisujemy jego metod.
Niebezpieczeństwa terapii tlenowej:
suchy i zimny tlen uszkadza płuca, powoduje skurcz tętniczek, nadciśnienie płucne, kwasicę i hamowanie syntezy środków powierzchniowo czynnych. Ogrzewanie
obowiązkowy jest tlen do 32-34°C (przy wentylacji mechanicznej - do 36-37°C), a także jego nawilżanie. W przypadku braku specjalnych nawilżaczy tlen przepuszcza się przez słoik Bobrowa (wysokość słupa wody wynosi co najmniej 15 cm). Nadmierna wilgoć (100% wilgotności względnej przez ponad 2 godziny) prowadzi do przegrzania dziecka, przeciążenia wodą i przyczynia się do obrzęku płuc; zagrożenie zatruciem tlenem jest realne, gdy Pao2 we krwi tętniczej przekracza 10,67 kPa i utrzymuje się przez kilka godzin, co prowadzi do uszkodzenia oczu, płuc i centralnego układu nerwowego.
Utrzymanie OŚ. Konieczne jest jedynie skorygowanie kwasicy patologicznej (pH poniżej 7,25 i BE powyżej minus 10 mmol/l) i dopiero po wprowadzeniu wentylacji mechanicznej lub IVL. Jeśli patologia płuc doprowadziła do tak znacznego upośledzenia CBS, jest to bezpośrednie wskazanie do wentylacji mechanicznej lub IVL. Ilość wodorowęglanu sodu w mmol (tj. liczba ml 8,4% roztworu) x (wartość BE - 5) x masa ciała (kg) x 0,4. Odpowiednią ilość sody oczyszczonej podaje się kroplami w postaci 4,2% roztworu w ciągu 1 h. Należy pamiętać, że u wcześniaków zasadowica powoduje krwotoki śródczaszkowe i zatrzymanie oddechu.
Zwalczanie anemii i hipowolemii, niedociśnienie. W ostrej fazie choroby konieczne jest utrzymanie wartości hematokrytu na poziomie co najmniej 0,4, ponieważ anemia jest czynnikiem utrzymującym niedotlenienie tkanek, co oznacza niedobór surfaktantu, obrzęk tkanek itp. Przetacza się masę czerwonych krwinek. W przypadku ciężkiej niedokrwistości i ciężkiego SDR bardziej wskazana jest bezpośrednia transfuzja krwi, ponieważ świeże krwinki czerwone zawierają więcej 2,3-difosfoglicerynianu, który zmniejsza niedotlenienie tkanek. Ponadto świeża krew jest bardziej wskazana do korygowania zaburzeń hemostazy w przypadku niewyrównanego zespołu DIC, a także stanowi immunoprotektor w przypadku infekcji. Jednocześnie zarzucono zastępcze transfuzje krwi w przypadku SDR, ponieważ przyczynia się to do wzrostu częstości i nasilenia retinopatii wcześniaków. W 2. tygodniu życia i później wskazaniem do przetoczenia krwinek czerwonych jest hematokryt poniżej 0,3. Obecnie wskazania do przetoczenia krwi pełnej są mocno ograniczone ze względu na ryzyko infekcji (nie tylko wirusowego zapalenia wątroby typu B i C, HIV, ale także cytomegalii, ponieważ 6-12% dawców ma we krwi cytomegalowirusa), izosensybilizację.
Hipowolemię (dodatni „objaw białej plamki” – 3 s lub dłużej), szczególnie u dzieci z niedokrwistością, najlepiej korygować poprzez transfuzję izotonicznego roztworu chlorku sodu, ale można również przetoczyć świeżo mrożone osocze lub 10% roztwór albuminy. Ilość przetaczanego leku wynosi 10-15 ml/kg masy ciała. Wlewać powoli strumieniem (1-2 ml/kg/min).
Jeżeli po skorygowaniu niedokrwistości i hipowolemii ciśnienie tętnicze jest niskie (maksymalne ciśnienie poniżej 45 torr, tj. mm Hg), wówczas podaje się dopaminę mikrostrumieniem (dawka początkowa 5 mcg/kg/min z dalszym zwiększaniem według wskazań) do 10-15-20 mcg/kg/min) (szczegóły patrz rozdział XIX).
Uzupełnienie niedoboru środka powierzchniowo czynnego. Z pierwszych prac T. Fujiwary i in. w 1980 r., w celu uzupełnienia niedoborów środka powierzchniowo czynnego u bardzo wcześniaków, stwierdzono pozytywny efekt takiej terapii.
Obecnie wykorzystują zarówno surfaktanty naturalne, pozyskiwane z płuc bydła (krajowy BL-surfactant, opracowany w St. Petersburgu przez prof. OARozenberga, zagraniczny – Survanta, Alveofact, Infrasurf), świń (Curosurf), jak i syntetyczne (ALEK, Exosurf , Surfaxin, „Sfenticute”. Najskuteczniejsze naturalne środki powierzchniowo czynne zawierają, oprócz fosfolipidów, środek powierzchniowo czynny białko B (tabele 12.3, 12.4). Należy podkreślić, że lek Surfaxin, opracowany w USA przez laboratorium Discovery, zawiera kombinację fosfolipidów (dipalmitylofosfatydylocholina – DPPC, pa– POPG, kwas palmitynowy – PA) oraz rekombinowany, syntetyczny peptyd składający się z fragmentów aminokwasów lizyny (K) i leucyny (L) w sekwencji KLLLLKLLLLKLLLLKLLLL (KC). peptyd ma właściwości białka powierzchniowo czynnego B. Lek \enticute zawiera rekombinowane białko powierzchniowo czynne C.
Liczne badania z randomizacją wykazały, że egzogenny środek powierzchniowo czynny sprzyja:
zwiększenie podatności płuc i funkcjonalnej pojemności zalegającej, zmniejszając w ten sposób pracę mięśni oddechowych;
zmniejszenie podczas wentylacji mechanicznej Fio2 (proporcja tlenu w powietrzu wdychanym), PIP (szczytowe ciśnienie wdechowe), MAP (średnie ciśnienie w drogach oddechowych), PEEP (dodatnie ciśnienie końcowo-wydechowe), poprawa wskaźnika natlenienia gradientu tlenu w pęcherzykach włosowatych;
zmniejszenie śmiertelności w SDR (jego profilaktyczne stosowanie jest szczególnie skuteczne u dzieci z okresem ciąży krótszym niż 30 tygodni w połączeniu
Tabela 12.3
Skład niektórych środków powierzchniowo czynnych
(Gadzinowski J., 2003) Skład Surfaxin Survanta Curosurf Białko/peptydy 0,8+2 mg/ml SpB i SpC Tabela 12.4
Skład białkowy niektórych środków powierzchniowo czynnych
(Gadzinowski J., 2003)
Lek Stosunek SpB w mg i fosfolipidów w mmol Stosunek SpC w mg i fosfolipidów w mmol Alveofact 2,7+0,8 1,4+0,5 Curosurf 2,4+2,2 5,2+5,6 Surfaksyna 19, 8 * 1 Kwas palmitynowy zachowuje funkcję SpC.
podczas stosowania kortykosteroidów w okresie ciąży), zespół aspiracji smółki, SDR typu dorosłego;
skrócenie czasu wentylacji mechanicznej i zmniejszenie częstości występowania skutków ubocznych wentylacji mechanicznej (zespoły nieszczelności powietrza itp.);
zmniejszenie częstości występowania MDD, IVH, retinopatii;
nie hamuje syntezy endogennego środka powierzchniowo czynnego.
Należy zaznaczyć, że naturalne środki powierzchniowo czynne są skuteczniejsze od syntetycznych, mogą jednak mieć charakter antygenowy; ponadto mają mniej stabilny skład, wymagają bardziej rygorystycznych warunków przechowywania i mają bardziej ograniczony okres przydatności do spożycia, a także mogą potencjalnie zawierać środki prionowe.
Mamy doświadczenie w stosowaniu leków Curosurf i Exosurf w Szpitalu Dziecięcym nr 1 (St. Petersburg). Obydwa leki miały powyższe skutki. Natomiast po wprowadzeniu Curosurf, Fio2, PIP, MAP można było zmniejszyć o około 30% po 3-3,5 godzinach, natomiast po wprowadzeniu Exosurf dopiero po 6 godzinach. Po podaniu leku Curosurf obserwowano zmniejszenie oporu naczyń płucnych, zmniejszenie obciążenia następczego prawej komory i zwiększenie obciążenia wstępnego lewej komory. Jednocześnie zaobserwowano zmniejszenie różnicy pęcherzykowo-kapilarnej w prężności tlenu i poprawę wskaźnika natlenienia. Niestety nie ma randomizowanych badań porównawczych stosowania krajowego surfaktantu BL i nie mamy doświadczenia w jego stosowaniu, ale od kolegów wiemy, że przy ciężkich SDR jest on znacznie mniej skuteczny niż Curosurf.
Według profesora J. Gadzinowskiego (2003) w wieloośrodkowych europejskich randomizowanych badaniach porównawczych (biorą w nich udział także neonatolodzy z Petersburga, ale badanie jest podwójnie ślepe i nie znamy jeszcze naszych wyników) profilaktycznego stosowania Surfaxin, Exosurf i Survanta u dzieci z masą urodzeniową poniżej 1250 g pierwszy lek był skuteczniejszy, co jego zdaniem może wynikać z wcześniejszej poprawy utlenowania (w ciągu kilku minut, natomiast po zastosowaniu inne leki powierzchniowo czynne, zauważa się to po 3-6 godzinach), efekt trwalszy ze względu na odporność syntetycznego leku Surfaxin na hamowanie przez składniki surowicy i utleniacze.
Skutki uboczne i powikłania terapii surfaktantami mają w dużej mierze charakter jatrogenny. W przypadku braku odpowiedniego monitorowania i zróżnicowania parametrów wentylacji mechanicznej może rozwinąć się uraz ciśnieniowy i wolutrauma płuc, zespoły nieszczelności powietrza, krwotok płucny, hiperoksja, a co za tym idzie retinopatia wcześniaków, krwotok płucny, IVH. Być może jedyną rzeczą, która została odnotowana przez wielu badaczy niemal we wszystkich ośrodkach, jest wzrost częstości funkcjonowania przewodu tętniczego i napadów bezdechu po zastosowaniu egzogennego środka powierzchniowo czynnego. Częstość funkcjonującego przewodu tętniczego u dzieci leczonych Curosurfem w naszych obserwacjach wyniosła 7,6%.
Najskuteczniejsze profilaktyczne podanie surfaktantu następuje przy urodzeniu lub w pierwszych 15-30 minutach życia. Dawkę przeznaczoną do podania podgrzewa się (w ciągu 1 godziny do 37°C) i podaje we wlewie przez rurkę dotchawiczą do tchawicy w 4 dawkach w ciągu 10-15 minut lub mikrostrumieniem za pomocą infuzora przez 20-30 minut, przy czym przy kolejnym wlewie zmienia się pozycję dziecka. W razie potrzeby infuzje powtarza się po 12 h. Nie odnotowano żadnych poważnych skutków ubocznych. Za niezwykle ważne uważa się jak najwcześniejsze przerwanie wentylacji mechanicznej i przeniesienie dziecka do pCPAP. W wyniku tej ogólnie zapobiegawczej terapii częstość i nasilenie SDR są znacznie zmniejszone.
Leczenie surfaktantem już rozwiniętego SDR lub zapalenia płuc jest znacznie mniej skuteczne niż leczenie zapobiegawcze. Jednocześnie niezwykle ważne jest, aby przed podaniem jakiegokolwiek leku powierzchniowo czynnego ustabilizować stan dziecka i w miarę możliwości skorygować podstawowe parametry życiowe. Po podaniu leku należy uważnie monitorować m.in.: parametry wentylacji mechanicznej, Fio2, wizualną analizę udziału mięśni pomocniczych w procesie oddychania, przezskórną analizę saturacji (Brog), częstość akcji serca, ADC, CBS, klatkę piersiową. radiogram przed i 3-6 godzin po podaniu. Ponownie konieczne jest elastyczne różnicowanie parametrów wentylacji mechanicznej i F102, unikając barotraumy i wolutraumy płuc oraz hiperoksji. Aby zapobiec hiperoksji, Spo2 należy utrzymywać na poziomie 90–94%. Nie zaleca się odsysania zawartości tchawicy przez 3-6 godzin po podaniu środka powierzchniowo czynnego.
Zamknięcie przetrwałego przewodu tętniczego uznaje się za medyczne u dzieci z SDR na podstawie badania echokardiograficznego i dopplerowskiego w 4-5 dobie życia. Taktykę stosowania indometacyny lub brufenu opisano w rozdziale XIX.
Terapia antybiotykowa. W przypadku rozpoznania SDR, nawet jeśli istnieje podejrzenie, ampicylinę przepisuje się w połączeniu z jednym z aminoglikozydów (zwykle gentamycyną). Wynika to z jednej strony z faktu, że zakażenie paciorkowcami B objawia się uszkodzeniem płuc, które nie różni się (nawet często radiologicznie) od SDR, a z drugiej strony przeniesieniem pacjenta do wentylacji mechanicznej, która jest często towarzyszy infekcja. Jednak już po 3 dniach od otrzymania wyników posiewów krwi i badań klinicznych krwi należy z biegiem czasu stwierdzić obecność infekcji, a jeśli jej nie ma, odstawić antybiotyki.
Terapia witaminowa. Nie potwierdzono poglądu, że profilaktyczne podawanie witaminy E zmniejsza częstość występowania dysplazji oskrzelowo-płucnej. A jednak wskazane jest podawanie domięśniowo witaminy E w dawce 10 mg/kg dziennie przy stosowaniu mieszaniny tlenu i powietrza z Fio2 większym niż 0,4, ponieważ zmniejsza to częstość występowania i nasilenie retinopatii wcześniaków. Kurs 7-10 zastrzyków. Witaminę A, podawaną dojelitowo w dawce 2000 jednostek co drugi dzień, należy przepisywać wszystkim dzieciom przed rozpoczęciem żywienia dojelitowego, gdyż zmniejsza to częstość występowania martwiczego zapalenia jelit i dysplazji oskrzelowo-płucnej.
Diuretyki. Chociaż podawanie furosemidu zwiększa diurezę i poprawia stan płuc, zwiększa częstość występowania przetrwałego przewodu tętniczego, zwapnień w nerkach i dyselektrolitii, dlatego nie może być traktowane jako rutynowe. Furosemid jest przepisywany tylko w przypadku obrzęku płuc i zespołu obrzękowego.
Glukokortykoidy. Odstąpiono od planowanego podawania glikokortykosteroidów i ich pochodnych (najczęściej stosowano deksametazon, ponieważ ma on maksymalne działanie tkankowe) w celu stymulacji syntezy surfaktantów u wszystkich dzieci z SDD. Wynika to z wprowadzenia do terapii i profilaktyki wtórnej SDR preparatów powierzchniowo czynnych, udoskonalenia metod wspomagania oddychania, wentylacji mechanicznej, a także skutków ubocznych terapii glikokortykosteroidami, z których główna, nawet przy krótkim przebiegu, są: hiperglikemia, nadciśnienie tętnicze, krwawienia z przewodu pokarmowego, martwicze zapalenie jelit i inne infekcje. Glikokortykoidy przepisuje się pacjentom z SDR, u których według danych klinicznych i laboratoryjnych występuje niewydolność kory nadnerczy.
Wielu neonatologów za granicą doszło do wniosku, że podawanie deksametazonu w leczeniu pointubacyjnego zapalenia krtani lub tchawicy z ciężkim zwężeniem daje pozytywny efekt. The Neonatal Formulary (BMJ, 2000) zaleca podawanie 4 dawek po 200 mcg w 8-godzinnych odstępach, przy czym pierwszą dawkę należy podać 4 godziny przed ekstubacją dzieciom z obrzękiem lub urazem krtani.
W niektórych klinikach noworodkowych zaczęto aktywnie stosować hormony tarczycy w leczeniu dzieci z SDD, w oparciu o częste wykrywanie niskiego poziomu hormonów tarczycy u bardzo wcześniaków z GBM. Brak jest jednak ogólnie przyjętych danych, opartych na wynikach badań z randomizacją, które bezsprzecznie dowodzą korzyści płynących z takiej recepty, dlatego jest to terapia eksperymentalna. Doowodniowe stosowanie L-tyroksyny u kobiet w ciąży z wysokim ryzykiem przedwczesnego porodu jest bardziej uzasadnione, ale nawet w tym przypadku nie ma ogólnie przyjętych schematów i ogólnie przyjętych wyników.
Ryboksyna i inozytol przepisywane dożołądkowo co 6 godzin w dawce 40 mg/kg od końca 1. do 10. dnia życia, wg M. Hallmana i wsp. (1986-1989), zmniejszają nasilenie SDR, zwiększają syntezę środka powierzchniowo czynnego i zmniejszają częstość występowania dysplazji oskrzelowo-płucnej. Jednakże metoda ta, podobnie jak planowane podawanie plazminogenu wcześniakom, jest metodą eksperymentalną w leczeniu dzieci z SDD.
Rokowanie SDR zależy od stopnia jej ciężkości oraz obecności współistniejących patologii i powikłań leczenia. Śmiertelność dzieci z masą urodzeniową powyżej 1000 g przy racjonalnym postępowaniu nie przekracza 5-10%. W pierwszym roku życia dzieci cierpiące na SDR często zapadają na zapalenie płuc, zwiększa się także częstość występowania sepsy. Encefalopatia (po niedotlenieniu) jest jednym z charakterystycznych schorzeń współistniejących (lub powikłań) u dzieci z SDD, przy czym u niektórych dzieci są one wyraźnie identyfikowane dopiero w wieku przedszkolnym i szkolnym w postaci minimalnych dysfunkcji mózgu, zaburzeń zachowania i trudności w nauce. W związku z tym w systemie zajęć rehabilitacyjnych dla dzieci z SDD należy uwzględnić wczesne podanie (od 3-4 dnia) leków poprawiających trofizm mózgu (gliatylina 10-15 mg/kg/dobę, nootropil 50 mg/kg dożylnie lub doustnie 2-3 razy dziennie), obserwacja neurologa.
Zapobieganie. Hormonalna terapia przedporodowa. Podanie domięśniowe lub doustne matce w przypadku zagrożenia przedwczesnym porodem w 24-34 tygodniu:
betametazon w dawce 12 mg (2 razy w odstępie 24 godzin) lub
Deksametazon 6 mg 4 razy w odstępie 12 godzin.
Optymalne jest, aby okres między zakończeniem terapii hormonalnej a porodem wynosił więcej niż 24 h. Efekt tej recepty utrzymuje się przez 10 dni, a jeśli poród nie nastąpi, wówczas jednorazowe podanie deksametazonu w dawce 6-12 mg jest wskazane.
Stosowanie kortykosteroidów w okresie przedporodowym prowadzi nie tylko do zmniejszenia częstości i nasilenia SDR, ale także zmniejsza ryzyko rozwoju zespołu przetrwałego przewodu tętniczego, krwotoku dokomorowego, leukomalacji okołokomorowej, martwiczego zapalenia jelit, czasu i kosztów opieki nad bardzo wcześniakiem .
Długoterminowe badania kontrolne wykazały, że przebieg przedporodowej terapii hormonalnej nie zwiększa częstości występowania chorób zakaźnych u noworodków, nie wpływa na dalszy rozwój fizyczny i psychomotoryczny (w tym tempo zwiększania się obwodu głowy) oraz płuc. wzrostu i nie powoduje dysfunkcji nadnerczy, wzroku i słuchu.
Obecnie za najbardziej obiecujące uważa się opracowanie do praktycznego zastosowania schematu wprowadzania trójjodotyroniny do płynu owodniowego, a optymalnie - hormonu uwalniającego tyreotropinę (TRH). Leki TRH, zarówno eksperymentalnie, jak i w ograniczonych badaniach klinicznych, okazały się bardzo skuteczne w zapobieganiu SDR. Jednakże dwa duże, wieloośrodkowe badania przeprowadzone w USA nie wykazały korzyści ze stosowania profilaktycznego stosowania kortykosteroidów u kobiet w ciąży w skojarzeniu z hormonami tarczycy i/lub TRH (Ballard RA i wsp., 1998).
Przydatne jest „opóźnienie” porodu, ponieważ jeśli przerwa bezwodna trwa dłużej niż 2 dni, SDR zwykle nie rozwija się, chociaż u takich dzieci częściej obserwuje się posocznicę i prawdopodobnie krwotoki śródczaszkowe.
Terapia zastępcza egzogennymi środkami powierzchniowo czynnymi w pierwszych 30 minutach życia (patrz wyżej) jest wysoce skuteczną metodą zapobiegania ciężkim SDR.
Zespół zaburzeń oddechowych (RDS) odnosi się do każdego zmiany patologiczne w płucach, występujące u płodu lub noworodka w pierwszych 2-3 dniach życia, klinicznie objawiające się ciężką niewydolnością oddechową.
SDR częściej obserwuje się u wcześniaków, zwłaszcza bliźniąt, głównie u chłopców. Głównymi przyczynami jego wystąpienia są: a) zapalenie płuc - płuca, błony szkliste, zespół obrzękowo-krwotoczny, krwotok w płucach, wady rozwojowe płuc; ) wewnątrzmaciczny - , posocznica; krwotoki śródczaszkowe.
Dojrzałość anatomiczna i funkcjonalna płuc zależy od ilości środka powierzchniowo czynnego, który wyścieła wewnętrzną powierzchnię pęcherzyków płucnych, tworząc powierzchowny film pęcherzykowy, który zapobiega zapadaniu się pęcherzyków i rozwojowi niedodmy. Do prawidłowego funkcjonowania płuc wystarczająca ilość środka powierzchniowo czynnego osiągana jest do 35. tygodnia. jego zawartość w tkance płuc płodu można określić na podstawie poziomu lecytyny w płynie owodniowym. W tym celu wykorzystuje się test piankowy Clementsa. Jego istota jest następująca.
Badanie „pianki” przeprowadza się także z zawartością żołądka noworodka. SDR jest najbardziej widoczna w ciągu pierwszych 2 dni życia i stopniowo zanika do 12-14 dnia. Jego nasilenie ocenia się w skali Silvermana 30 minut po urodzeniu dziecka, następnie po 3-6-12 godzinach przez 2-3 dni. a wyniki wskazują na obecność zespołu. Przy wyniku 10, stan dziecka jest wyjątkowo poważny.
Skala Silvermana
|
Kliniczny objawy |
|||
|
Nierówny |
Paradoksalny |
||
|
Retrakcja przestrzeni międzyżebrowej |
Nieobecny |
Umiarkowany |
Ostro wyrażone |
|
Cofnięcie mostka |
Nieobecny. |
Umiarkowane w inspiracji |
Stały, wyraźny |
Objawy SDD obserwuje się już w pierwszym życiu dziecka. Należą do nich: zwiększone oddychanie (ponad 60-70 na minutę), cofanie się przestrzeni międzyżebrowych i wyrostek mieczykowaty podczas wdechu, rozszerzanie skrzydełek nosa, trudności w wydechu, stan funkcjonalny ośrodkowego układu nerwowego.
Pierwotna niedodma może być niewielka, rozproszona w obu płucach lub zgrupowana w duże konglomeraty zajmujące kilka segmentów (niedodma wielosegmentowa).
Dzieci stają się ospałe, następuje zmniejszenie napięcia mięśniowego i adynamia. Pojawia się ostre uczucie, oddech staje się szybki i trudny, paradoksalny, jak „huśtawka”. Klatka piersiowa ma kształt beczki i jest sztywna w badaniu palpacyjnym. Występuje przytępienie lub skrócenie dźwięku uderzenia i osłabienie oddechu po uszkodzonej stronie, ciężki, wzmożony oddech w pozostałych częściach płuc. Można usłyszeć pojedyncze, przerywane trzeszczące rzężenia. Nieskomplikowany proces patologiczny zapadnięta tkanka płuc prostuje się w ciągu 4-5 dni. Rozsiana rozsiana niedodma częściej ma charakter pierwotny i występuje u dzieci z małą masą ciała i niedojrzałą tkanką płuc. często rodzą się w stanie uduszenia, wiotkie, ze zmniejszonym napięciem mięśniowym, wyraźną sinicą. Zespół zaburzeń oddechowych początkowo wyraża się łagodnie, w 2-4 punktach w skali Silvermana, ale pod koniec 2-3 dni następuje szczyt choroby. staje się częstsze, nozdrza rozszerzają się, pojawiają się konwulsyjne westchnienia. Klatka piersiowa jest „ciastkowata” w dotyku. Dźwięk perkusji ulega skróceniu w całym lub w niektórych obszarach płuc. twardy, trudny dźwięczny wydech, na tle którego słychać pojedyncze, przerywane, trzeszczące świszczące oddechy. Jeśli przebieg jest korzystny, objawy zaczynają się w 5. tygodniu i stopniowo zanikają do końca 2. tygodnia. Nagły stan w 5-6 dniu jest oznaką zapalenia płuc.
Dzieci z zespołem błony szklistej mogą urodzić się w zadowalającym stanie. przerwa czasami trwa do 12 godzin, po czym rozwija się ciężka niewydolność oddechowa, oddychanie staje się częstsze i pojawia się sinica skóry, która nie ustępuje po wdychaniu tlenu. Obserwuje się powtarzające się ataki uduszenia; gęsty, zwiększony; rośnie podstawa podskórna. Podczas osłuchiwania płuca są osłabione i słychać niewielki świszczący oddech. Następnie odnotowuje się funkcje centralnego, całkowitego i częstego ustania oddechu. blady z szarawo-cyjanotycznym odcieniem.
Zespół obrzękowo-krwotoczny- jeden z najbardziej ciężkie formy pneumopatia. Jest to miejscowy przejaw patologicznego nawodnienia całego organizmu noworodka, powstający na skutek zaburzeń metabolicznych i uduszenie wewnątrzmaciczne. Cecha charakterystyczna syndrom polega na wydzielaniu pienistego, krwawego płynu z ust. Układ oddechowy i objawy SDR pojawiają się po urodzeniu. Często na skórze i tkance podskórnej występują rozległe krwotoki. W płucach obserwuje się silny obrzęk: po uderzeniu dźwięk ulega skróceniu i osłabieniu, szczególnie w dolnych partiach, i słychać dużą liczbę drobnych pęcherzyków.
Zespół obrzękowo-krwotoczny prawie zawsze łączy się z rozsianą niedodmą płuc, szczególnie u wcześniaków.
Krwotoki w może być pęcherzykowy, śródmiąższowy i mieszany. W 50% przypadków jest to odnotowane
Zespol zaburzen oddychania
V.F. Demin, AA Michejewa
Katedra Chorób Dziecięcych nr 3 Rosyjskiego Państwowego Uniwersytetu Medycznego.
Terminologia
Do opisania tej samej patologii często używa się terminów zespół zaburzeń oddechowych (RDS), zespół zaburzeń oddechowych (RDS) i choroba błony szklistej (HMD). Ostatnie lata Wielu autorów nie używa terminów SDR i RDS jako synonimów BGM, ponieważ Istnieją również inne stany patologiczne, w których dochodzi do tworzenia się błon szklistych. W literaturze krajowej w odniesieniu do tego samego stanu używa się zarówno terminów „zespół zaburzeń oddechowych”, jak i „zespół zaburzeń oddechowych”.
Etiologia i patogeneza
Zespół zaburzeń oddechowych rozwija się u około 20% wcześniaków, ale jego częstość występowania w dużym stopniu zależy od wieku ciążowego i może wahać się od 5–10% u dzieci urodzonych w 35–36 tygodniu ciąży do 80–88% u dzieci urodzonych w czasie ciąży wiek mniej niż 27 tygodni. Zespół zaburzeń oddechowych występuje u 1-2% noworodków donoszonych i jest związany głównie z niedojrzałością morfo-funkcjonalną, zamartwicą porodową i niektórymi innymi schorzeniami.
Rozwój zespołu niewydolności oddechowej wynika z niedojrzałości strukturalnej i funkcjonalnej płuc i związanego z tym braku tworzenia się środka powierzchniowo czynnego. Ponadto przyczyną rozwoju SDR może być naruszenie struktury środka powierzchniowo czynnego, jego zwiększone zniszczenie lub zahamowanie.
Anatomiczne i fizjologiczne cechy układu oddechowego noworodka predysponują do ich więcej szybki rozwój niewydolność oddechową niż u starszych dzieci i dorosłych. Krtań położona jest wyżej niż krtań u dorosłych i układu oddechowego drogi są bardzo wąskie, najwęższym miejscem jest przestrzeń podgłośniowa, gdzie pogrubienie błony śluzowej nawet o 1 mm powoduje zwężenie światła światła o 75%. Płuca są bardziej ukrwione i mniej elastyczne niż u osoby dorosłej. Liczba pęcherzyków płucnych u noworodka jest 10-15 razy mniejsza niż u osoby dorosłej, co prowadzi do ograniczonych możliwości wymiany gazowej w płucach. Klatka piersiowa noworodka znajduje się w pozycji wdechowej, co wynika z ułożenia żeber prostopadle do kręgosłupa, zatem zwiększenie objętości wentylacji następuje głównie na skutek częstości oddechów.
Po przejściu dziecka kanał rodny płuca nigdy nie rozszerzają się same pod wpływem trakcji elastycznej. Zapobiegają temu siły napięcia powierzchniowego w warstwie cieczy pomiędzy przylegającymi pęcherzykami. Do wyprostowania pęcherzyków płucnych konieczne jest podciśnienie w klatce piersiowej, a ciśnienie przezpłucne powinno wynosić do -40 cm H2O. Pierwszy płacz noworodka stanowi ważny mechanizm adaptacyjny. Objętość pierwszego wdechu jest większa niż objętość wydechu; im głośniejszy krzyk, tym większa różnica. W ten sposób powstaje dodatni reżim ciśnienia końcowo-wydechowego, który pomaga rozszerzyć płuca i wytworzyć zwiększone ciśnienie śródpłucne, dzięki czemu otwarte drogi oddechowe zamykają się szybciej. owalne okno i przetrwały przewód tętniczy oraz zwiększa się przepływ krwi w płucach, kierowany przez tkankę pęcherzykową. Produkcja środka powierzchniowo czynnego staje się wystarczająca, płuca rozszerzają się normalnie.
Kiedy występuje niedobór lub zaburzenie produkcji środka powierzchniowo czynnego, napięcie powierzchniowe w pęcherzykach płucnych staje się bardzo wysokie. Jeżeli podczas pierwszego wdechu ciśnienie przezpłucne powinno wynosić do –40 cmH2O, to przy kolejnych inhalacjach (surfaktant już działa) będzie to –5 cmH2O.W przypadku niedoboru surfaktantu ciśnienie otwierania pęcherzyków płucnych utrzymuje się na poziomie wysoki, ponieważ podczas pierwszej inhalacji następuje zmniejszenie przepływu krwi w płucach, co zakłóca wytwarzanie surfaktantu, niedokrwiona tkanka staje się bardziej przepuszczalna, osocze przedostaje się do pęcherzyków przez błonę naczyń włosowatych pęcherzyków płucnych i nawet niewielka ilość zawartego w nich surfaktantu ulega inaktywacji z utworzeniem filmu - błony szklistej. W 1959 r Avery'ego i Meeda jako pierwsi udowodnili niedobór środka powierzchniowo czynnego u noworodków zmarłych z powodu BGM.
Środek powierzchniowo czynny to jednocząsteczkowa warstwa na styku nabłonka pęcherzykowego z powietrzem. Zapobiega zapadaniu się pęcherzyków podczas wydechu i rozwojowi obrzęku w płucach (poprzez regulację przepuszczalności ścian pęcherzyków i mikrokrążenia w płucach), chroni nabłonek pęcherzyków płucnych przed uszkodzeniem, a także uczestniczy w lokalnych reakcjach immunologicznych. Z chemicznego punktu widzenia surfaktant jest lipoproteiną - mieszanina składa się z 90-95% lipidów i 5-10% frakcji białkowej, reprezentowanej przez cztery specyficzne białka - SP-A, SP-B, SP-C, SP-D . Skład lipidowy środka powierzchniowo czynnego obejmuje fosfolipidy (80%), których główną część stanowi fosfatydylocholina, oraz lipidy obojętne.
Synteza surfaktantu odbywa się w pęcherzykach płucnych typu II począwszy od 25-26 tygodnia ciąży, najbardziej aktywną syntezę obserwuje się od 34 tygodnia ciąży. Cząsteczki surfaktantu są z jednej strony hydrofilowe, utrwalone w fazie wodnej, z drugiej zaś lipofilowe, wystające do fazy gazowej, co warunkuje aktywne działanie powierzchniowe (ze względu na odpychające siły międzycząsteczkowe części lipofilowych).
W okresie prenatalnym dojrzewanie układu surfaktantów następuje pod wpływem wielu czynników. Ważna rola jest dobrze znana hormony steroidowe w tym procesie stwierdzono synergistyczne działanie kortyzolu i hormonów tarczycy oraz środków β-adrenergicznych. Istnieje kilka mechanizmów wpływu glukokortykoidów na dojrzewanie płuc. Endogenne glikokortykoidy wpływają na układ adrenergiczny, który odgrywa ważną rolę w przygotowaniu płuc do funkcji pozamacicznej, stymulują receptory adrenergiczne i wydzielanie adrenaliny w nadnerczach płodu. Glukokortykoidy bezpośrednio wpływają na fibroblasty tkanki śródmiąższowej, które z kolei wydzielają „czynnik fibroblastowo-pneumocytowy” – oligopeptyd stymulujący syntezę fosfolipidów w pęcherzykach płucnych typu 2.
Czynniki przyczyniające się do rozwoju SDR to:
- wcześniactwo i niedojrzałość morfofunkcjonalna
- infekcje wewnątrzmaciczne
- niedotlenienie wewnątrzmaciczne i asfiksja podczas porodu
- ostra utrata krwi podczas porodu
- cukrzyca matki (insulina zmniejsza produkcję środków powierzchniowo czynnych)
- poród przez cesarskie cięcie
- urodzony jako drugi z bliźniaków
- ochłodzenie dziecka, hiperoksja, hipowolemia.
Głównym ogniwem w patogenezie SDR jest zarówno pierwotny niedobór układu surfaktantów, jak i patologia, taka jak aspiracja smółki płynu owodniowego, niedobór plazminogenu, zespół obrzękowo-krwotoczny płuc, zespół zdekompensowanego DIC, zmniejszona aktywność antyproteaz, prowadząca do zmniejszonej syntezy lub zwiększoną degradacją fosfatydylocholin.
Hipowentylacja i niedostateczne natlenienie związane z niedoborem środka powierzchniowo czynnego, podatnością klatki piersiowej, zmniejszoną objętością oddechową, niską podatnością płuc i dusznością prowadzą do: poważne zaburzenia funkcje życiowe.
Przy niewystarczającym utlenowaniu tkanek procesy metaboliczne U noworodków łatwiej niż u dorosłych przechodzą na szlak utleniania beztlenowego, co prowadzi do gromadzenia się w organizmie niedotlenionych produktów przemiany materii.
Niedotlenienie wątroby przyczynia się do utraty jej zdolności do wykorzystania glukozy, co prowadzi do zakłócenia resyntezy węglowodanów z kwasu mlekowego. Wzrost poziomu kwasu mlekowego we krwi w czasie niedotlenienia sięga 9,4-9,9 mmol/l (zwykle 2,0-2,4 mmol/l), obniża się pH krwi i rozwija się kwasica. Zwiększenie katabolizmu węglowodanów i towarzyszący temu spadek ich podaży sprzyja wykorzystaniu białek jako substratu energetycznego. Charakteryzuje się obecnością hipoglikemii, hipoproteinemii, zwiększonym wydalaniem azotu i zmniejszoną masą ciała.
Na tle niedotlenienia zwiększa się przepuszczalność naczyń włosowatych, co prowadzi do uwolnienia białka do przestrzeni śródmiąższowej, zmniejsza się ciśnienie onkotyczne i ogranicza resorpcję płynów. Niedotlenienie i hipoksemia wpływają na centralny system nerwowy, zwiększając przepuszczalność naczyń mózgowych i sprzyjając występowaniu krwotoków.
Zaburzenia hemodynamiczne wynikające z zespołu niewydolności oddechowej są bardzo niebezpieczne. Hiperkapnia powoduje skurcz naczyń płucnych, co prowadzi do pogorszenia przepływu krwi w płucach, wzrostu ciśnienia w kole płucnym i zwiększonego przeciekania krwi przez drożny otwór owalny i przewód tętniczy. Poważny płyn gdy ciśnienie wzrasta, poci się do pęcherzyków płucnych, pogarszając regionalny przepływ krwi i wentylację.
Metabolizm beztlenowy negatywnie wpływa na wymianę energii w mięśniu sercowym, zmniejszając kurczliwość serca, rzut serca, zwiększając przekrwienie w małym okręgu, co z kolei prowadzi do zwiększonego niedotlenienia i hiperkapni; kwasica metaboliczna stale się nasila. Kwaśne potrawy wymiana zakłóca wykorzystanie tlenu przez tkanki i zakłóca oddychanie tkanek.
Nagromadzenie pośrednich produktów przemiany materii przyczynia się do zmniejszenia napięcia zwieraczy przedwłośniczkowych. Krew swobodnie przenika do naczyń włosowatych, ale napięcie zwieraczy żył pozakapilarnych jest bardziej odporne na kwasicę, co komplikuje odpływ krwi. Gromadzi się w złożu mikrokapilarnym, zwiększając krzepnięcie wewnątrznaczyniowe. W miarę pogłębiania się niewydolności oddechowej rozwija się deficyt objętości krwi krążącej, któremu sprzyja także wynaczynienie płynów. Strukturalne i zaburzenia funkcjonalneśródbłonek naczyń, pocenie się osocza, pojawia się obrzęk.
Klinika.
Pierwszy znak rozwijający się syndrom zaburzeniem układu oddechowego jest duszność. Choć mięśnie oddechowe pracują bardzo intensywnie, a tchawica i oskrzela są drożne, już po pierwszych oddechach objętość oddechowa maleje. Wzmożone oddychanie obserwuje się bezpośrednio po urodzeniu, a przy pierwszej duszności (ponad 60, u bardzo wcześniaków - ponad 80 na minutę) nie towarzyszy sinica skóry, ponieważ wiąże się to z podrażnieniem chemoreceptorów.
Zespół objawów zespołu niewydolności oddechowej obejmuje:
- Zwiększona duszność
- Rozszerzanie nosa
- Wycofanie podatnych obszarów klatki piersiowej
- Udział w akcie oddychania mięśni pomocniczych
- Sinica, która pojawia się, gdy PaCO2 jest większa niż 30-40 mm Hg, początkowo ma charakter okołoustny, następnie akrocyjanoza i uogólniona sinica.
- Blada skóra
- Szum wydechowy wywołany kompensacyjnym skurczem głośni podczas wydechu, zapobiegający zapadaniu się pęcherzyków płucnych etap początkowy rozwój zespołu niewydolności oddechowej.
- Podczas osłuchiwania słychać osłabienie oddechu w płucach, a później pojawiają się wysokie, suche, drobno bulgoczące i trzeszczące rzężenia.
Stopień nasilenia niewydolności oddechowej u wcześniaków określa się za pomocą skali Silvermana (tab. 1).
Tabela 1. Skala Silvermana.
|
Etap 0 |
Scena 1 |
Etap 2 |
|
Górna część klatki piersiowej przy ułożeniu dziecka na plecach oraz przednia ściana brzucha synchronicznie uczestniczą w akcie oddychania |
Brak synchronizacji lub minimalne opadanie górnej części klatki piersiowej podczas unoszenia przedniej ściany brzucha podczas wdechu |
Zauważalne zagłębienie klatki piersiowej podczas unoszenia się przedniej ściany brzucha podczas wdechu |
|
Brak cofania się przestrzeni międzyżebrowych podczas wdechu |
Nieznaczne cofnięcie przestrzeni międzyżebrowych podczas wdechu |
Zauważalne cofanie się przestrzeni międzyżebrowych podczas wdechu |
|
Brak cofania się wyrostka mieczykowatego mostka podczas wdechu |
Nieznaczne cofnięcie wyrostka mieczykowatego mostka podczas wdechu |
Zauważalne cofanie się wyrostka mieczykowatego podczas wdechu |
|
Brak ruchu brody podczas oddychania |
Opuszczanie brody podczas wdechu, usta zamknięte |
Opuszczanie brody podczas wdechu, usta otwarte |
|
Brak hałasu podczas wydechu |
Dźwięki wydechowe słyszalne podczas osłuchiwania klatki piersiowej |
Odgłosy wydechowe słychać po przyłożeniu fonendoskopu do ust lub bez fonendoskopu |
Jeżeli suma punktów jest mniejsza niż 5 – początkowy SDR, 5 punktów – umiarkowany SDR, 6-9 punktów – ciężki i 10 punktów – skrajnie poważny SDR.
Objawy zaburzeń układu krążenia są typowe dla SDR: obniżone ciśnienie krwi, zaburzenia mikrokrążenia, tachykardia. Osłuchiwanie ujawnia przytłumione tony.
Wątroba może się powiększyć.W wyniku niedotlenienia śródbłonka naczyń włosowatych rozwija się hipowolemia, która często prowadzi do obrzęków obwodowych i zatrzymania płynów. Charakterystyczna jest depresja ośrodkowego układu nerwowego, u dziecka często stwierdza się krwotoki okołokomorowe. Pytanie o to, co pierwotne – uszkodzenie mózgu czy płuc, pozostaje otwarte. Wraz z dalszym postępem zespołu niewydolności oddechowej rozwija się zespół niewyrównanej DIC. Jest również wysokie ryzyko dodanie wtórnej infekcji – zapalenie płuc rozwija się u prawie co drugiego dziecka z zespołem niewydolności oddechowej.
Przebieg SDR: największe nasilenie stanu obserwuje się w 1. dobie życia, w przyszłości nasilenie objawów klinicznych zależy od występujących powikłań (krwotoki śródkomorowe, zespoły „przecieku powietrza”, ciężkie nadciśnienie płucne, zespół niewyrównanego DIC martwicze zapalenie jelit itp.)
Diagnostyka.
Rozpoznanie SDR tradycyjnie stawia się na podstawie wywiadu, objawów klinicznych i radiologicznych. Triadę objawów charakterystycznych dla SDR określa się na podstawie badania rentgenowskiego, które pojawiają się już w pierwszych godzinach choroby:
- rozproszone zmniejszenie przezroczystości pól płucnych
- siateczkowatoziarnista
- obecność pasów oczyszczających na danym obszarze korzeń płuca(bronchogram powietrzny)
W ciężkie przypadki możliwe jest całkowite zaciemnienie pól płucnych, granice serca mogą być nieróżnicowane.
W Ostatnio W arsenale lekarzy pojawiły się metody określające stopień dojrzałości zarówno samej tkanki płucnej, jak i układu środków powierzchniowo czynnych. Najbardziej powszechnym i pouczającym badaniem jest oznaczenie stosunku lecytyny do sfingomieliny w płynie owodniowym, płynie tchawiczym lub aspiracie żołądkowym po urodzeniu. Jeśli wskaźnik ten jest większy niż 3, płuca są dojrzałe, a jeśli jest mniejszy niż 2, ryzyko rozwoju SDR jest bardzo wysokie (50-75%).
Stosuje się również test „piany”: dodanie etanolu do cieczy zawierającej środek powierzchniowo czynny i potrząsanie nią powoduje powstanie piany. Te same metody można zastosować także w diagnostyce prenatalnej, jednak kwestię amniopunkcji należy rozstrzygać indywidualnie i już w wieku ciążowym wynoszącym co najmniej 32 tygodnie, gdyż u więcej wczesne daty ciąży, niedojrzałość płuc nie ulega wątpliwości, a prowadzenie ciąży wymaga minimum badań inwazyjnych.
Diagnostyka różnicowa przeprowadzane z zapaleniem płuc, inną pneumopatią, wadami rozwojowymi Układ oddechowy oraz inne zaburzenia układu oddechowego, zarówno pochodzenia płucnego, jak i pozapłucnego (CHD, uraz porodowy, zaburzenia metaboliczne itp.). Na przykład kiedy Atrezja nozdrzy tylnych Już po pierwszej inhalacji obserwuje się zaburzenia oddychania, ataki sinicy i brak oddychania przez nos. Diagnozę stawia się, gdy niemożliwe jest wprowadzenie cewnika z nosa do nosogardzieli, ale najdokładniej jest Badanie rentgenowskie ze środkiem kontrastowym.
Na przepuklina przeponowa obserwuje się zaburzenia oddechowe różnego typu stopień dotkliwości, związane z wielkością przepukliny, ataki sinicy, zarówno samoistne, jak i po karmieniu lub przy zmianie pozycji dziecka. Badanie rentgenowskie ma wartość diagnostyczną, gdy Jama klatki piersiowej ujawniają się narządy jamy brzusznej.
Zapalenie płuc, która rozwinęła się w pierwszych godzinach po urodzeniu, jest praktycznie nie do odróżnienia od SDR, diagnozę stawia się na podstawie wyników analiza kliniczna krew, posiewy krwi i zawartość tchawicy, prześwietlenie klatki piersiowej; mogą występować inne ogniska zapalne.
Jeśli dziecko ma porodowe uszkodzenie ośrodkowego układu nerwowego sinica ma często charakter napadowy, obserwuje się objawy neurologiczne ( gwałtowny spadek odruchy, drgawki itp.), w badaniu RTG klatki piersiowej nie stwierdza się zmian charakterystycznych dla SDR. Aby wyjaśnić diagnozę, wykonuje się neurosonografię, nakłucie lędźwiowe, a w przypadku objawów uszkodzenia rdzenia kręgowego wykonuje się radiografię kręgosłupa.
Objawy wrodzona wada serca Typ „niebieski” jest czasami trudny do odróżnienia od obrazu klinicznego SDR; w tym przypadku obserwuje się sinicę z wrodzoną wadą serca moment narodzin, a oddychając 100% tlenem, dziecko nie odczuwa wzrostu PaO 2. Rozpoznanie potwierdza się za pomocą RTG klatki piersiowej, EKG i echokardiografii.
Leczenie.
Metoda etiologiczna leczenie to wprowadzenie egzogenne środki powierzchniowo czynne . Ich stosowanie jest możliwe zarówno w celach profilaktycznych, jak i terapeutycznych.
Preparaty środków powierzchniowo czynnych dzielą się na cztery kategorie:
1. naturalne preparaty otrzymywane z płyn owodniowy osoby (jeśli ciąża donoszona zostanie rozwiązana poprzez cesarskie cięcie)
2. naturalne preparaty otrzymywane z rozdrobnionych płuc prosiąt i cieląt
3. półsyntetyczne mieszaniny mielonych płuc cielęcych z dipalmitoilofosfatydylocholiną (DPPC)
4. całkowicie syntetyczne preparaty powierzchniowo czynne.
W przypadku stosowania naturalnych środków powierzchniowo czynnych początek następuje szybciej efekt kliniczny, ale ostateczne rezultaty leczenia nie odbiegają od tych przy przepisywaniu sztucznych środków powierzchniowo czynnych. Zakłada się, że surfaktant wyizolowany z płuc cieląt i prosiąt może powodować reakcję immunologiczną na obce białko, jednak nie uzyskano przekonujących danych. Najbardziej naturalny dla dziecka środek powierzchniowo czynny, wytwarzany z płynu owodniowego, nie może mieć szerokiego zastosowania, gdyż leczenie jednego dziecka wymaga użycia płynu owodniowego z 10 cięć cesarskich. Ponadto istnieje ryzyko Zakażenie wirusem HIV, zakażenie wirusem cytomegalii, opryszczka.
W naszym kraju do zastosowanie kliniczne dozwolone i dość powszechnie stosowane: exosurf noworodkowy - narkotyk syntetyczny i Kurosurf, naturalny środek powierzchniowo czynny z płuc świń.
Zapobieganie SDR przeprowadza się w ciągu pierwszych 2 godzin życia:
1. noworodki z masą urodzeniową poniżej 1250 g
2. noworodki o masie ciała powyżej 1250 g z potwierdzoną niedojrzałością płuc (np. stosunek lecytyny do sfingomieliny w płynie owodniowym)
Leczenie SDR prowadzi się od 2 do 24 godzin u dzieci z klinicznie i radiologicznie potwierdzonym rozpoznaniem SDR, zaintubowanych i wentylowanych mechanicznie.
Nie ma przeciwwskazań do stosowania surfaktantu.W przypadku ciężkiej asfiksji wymagana jest wstępna stabilizacja krążenia centralnego i płucnego.
Ogromne znaczenie w leczeniu zespołu niewydolności oddechowej ma zapewnienie odpowiednią opiekę . Podstawą jest technika „minimalnego dotyku”. Badanie lekarskie nie powinno być długotrwałe, należy zminimalizować skutki traumatyczne. Ważne jest, aby zachować optymalność reżim temperaturowy, ponieważ chłodzenie pomaga zmniejszyć lub zatrzymać syntezę środka powierzchniowo czynnego. Im niższa masa urodzeniowa i młodszy wiek dziecka, tym wyższa powinna być temperatura w inkubatorze. Ważne jest utrzymanie nie tylko optymalnej temperatury, ale także wilgotności, aby zapobiec utracie płynów przez skórę, zwłaszcza u dzieci ze skrajnie niską masą urodzeniową (tab. 2).
|
Wiek /waga |
<1000г |
1000-1500g |
1501-2500g |
|||
|
temperatura |
wilgotność |
temperatura |
wilgotność |
temperatura |
wilgotność |
|
|
0-24 godziny |
35-37 |
75-85 |
34-36 |
70-75 |
33-35 |
|
|
24-96 godzin |
34-36 |
33-35 |
60-65 |
31-33 |
||
|
4-14 dni |
33-35 |
32-34 |
31-33 |
|||
|
2-4 tygodnie |
32-34 |
50-60 |
31-33 |
30-32 |
40-50 |
|
Dzieci z zespołem niewydolności oddechowej wymagają obowiązkowej pracy ciągłej monitorowanie wskaźniki, takie jak tętno, częstość oddechów. Co 4 godziny oznaczane jest ciśnienie krwi, temperatura, kwasowość, PaO 2, PaCO 2, poziom glukozy i sodu we krwi,
W ostry okres zespół niewydolności oddechowej należy wykonać kliniczne badanie krwi, RTG klatki piersiowej, EKG, biochemiczne badanie krwi, w miarę możliwości koagulogram, oznaczenie objętości krwi przynajmniej raz na 2 dni. Konieczne jest także częste wykonywanie posiewów krwi i zawartości tchawicy oraz neurosonografia.
Starają się nie stosować żywienia dojelitowego przez pierwsze 2 dni życia ze względu na ryzyko niedomykalności i powikłań krążeniowo-oddechowych. Już w pierwszej godzinie życia zaczynają planować żywienie pozajelitowe . Bezwzględnymi wskazaniami do jego stosowania są zaburzenia hemodynamiczne i hipoksemia (PaO2 we krwi tętniczej poniżej 50 mmHg). W pierwszym dniu życia objętość podawanego płynu wynosi 30-40 ml/kg, następnie stopniowo zwiększa się ją do 70-100 ml/kg w 7. dniu życia i do 150-180 w 1. miesiącu życia. Objętość płynu należy ustalać indywidualnie, biorąc pod uwagę wiek dziecka, wiek ciążowy, diurezę, bcc, dynamikę masy ciała, stan układu sercowo-naczyniowego, krążenie obwodowe, gospodarkę kwasowo-zasadową, sposób karmienia dziecka i wentylację mechaniczną tryb.
Należy wziąć pod uwagę, że nadmiar płynu może prowadzić do obrzęków, w tym obrzęku płuc i utrzymywania się przetrwałego przewodu tętniczego. W pierwszym dniu życia podaje się 10% roztwór glukozy (u dzieci z masą urodzeniową poniżej 1000 g – 5% roztwór glukozy). Aminokwasy można stosować od końca pierwszego - początku drugiego dnia życia, w pierwszym dniu podawania ilość białka nie powinna przekraczać 1,5 g/kg, następnie stopniowo zwiększać ją do 2,5-3 g/kg a u dzieci z masą urodzeniową poniżej 1000 g – do 4 g/kg. Stosuje się standardowe roztwory aminokwasów, jeśli to możliwe, zawierające aminokwas taurynę (aminowenoza), ponieważ spadek jego poziomu może prowadzić do uszkodzenia mózgu i siatkówki.
Obecność patologii płuc jest przeciwwskazaniem do pozajelitowego podawania tłuszczów do 7 dnia życia; jeśli w tym wieku utrzymuje się żywienie pozajelitowe, podaje się tłuszcze począwszy od 0,5 g/kg, stopniowo zwiększając do 2 g/kg. Wlew emulsji tłuszczowych przeprowadza się z bardzo małą szybkością przez cały dzień. Zapotrzebowanie na minerały to: sód – 1,2 mmol/kg, potas – 0,8 mmol/kg, chlorki – 0,86 mmol/kg, wapń – 3,2 mol/kg, magnez – 0,16 mmol/kg. Stosuje się chlorki sodu, chlorki potasu, glukonian wapnia itp. Należy pamiętać, że wprowadzenie wyłącznie soli kwasu chlorowodorowego może prowadzić do hiperchloremicznej kwasicy metabolicznej, dlatego stosuje się również mleczany, fosforany i inne sole.
Moment wprowadzenia żywienia dojelitowego jest indywidualny, należy jednak zaznaczyć, że jego wczesne podanie stymuluje dojrzewanie przewodu pokarmowego, zmniejsza częstość występowania cholestazy, a przy karmieniu natywnym mlekiem matki zmniejsza ryzyko rozwoju martwiczego wrzodu zapalenie jelita grubego i w tym celu wystarczy podać 0,5 ml/kg/godz. Pozostałe potrzeby można zaspokoić poprzez żywienie pozajelitowe. Wskazane jest stosowanie naturalnego mleka matki lub specjalistycznych preparatów dla wcześniaków. Próbną dawkę 5 ml mleka podaje się przez sondę nosowo-żołądkową i przy braku wzdęć, zarzucania treści pokarmowej lub bezdechu stopniowo zwiększa się objętość żywienia dojelitowego.
Ważną częścią terapii SDR jest zapewnienie i utrzymanie wolne drogi oddechowe . Kiedy dziecko rodzi się w stanie zamartwicy lub z aspiracją smółki, należy wykonać intubację i odsysanie zawartości dróg oddechowych. Jeśli to konieczne, odsysanie powtarza się w trakcie choroby (biorąc pod uwagę obraz kliniczny i radiologiczny), ale nie możemy zapominać, że podczas tej manipulacji dochodzi do hipoksemii, bradykardii i nadciśnienia, a także prowokuje się rozwój krwotoków wewnątrzczaszkowych. Drenaż tchawicy poprawia się przy okresowych zmianach pozycji dziecka (obracanie się na bok, na brzuch).
W patogenezie SDR pierwszorzędne znaczenie mają niedotlenienie i hipoksemia, dlatego też najważniejszą rolę w leczeniu zespołu niewydolności oddechowej odgrywają: Terapia tlenowa. Wybierając sposób wprowadzania tlenu i jego stężenie w mieszaninie oddechowej należy wziąć pod uwagę, że ciśnienie parcjalne tlenu we krwi powyżej 50 mmHg zapewnia już wystarczające natlenienie, a gdy PaO 2 przekracza 80 mmHg, toksyczne pojawiają się właściwości tlenu, które zostaną podane poniżej. Monitorowanie ciśnienia cząstkowego tlenu we krwi tętniczej i ułamkowego stężenia tlenu w krwi tętniczej mieszanina oddechowa pozwala lekarzowi zapewnić dziecku wystarczające dotlenienie i uniknąć ewentualnych powikłań tlenoterapii. Konieczne jest także kontrolowanie temperatury mieszaniny oddechowej oraz jej wilgotności. Podczas wdychania zimnej mieszanki u dziecka rozwija się klinika schładzania. Nawilżanie mieszaniny oddechowej jest wymagane, gdy stężenie tlenu przekracza 40%, ponieważ możliwa jest utrata płynów w wyniku pocenia się.
W tlenoterapii powszechnie stosuje się cewniki donosowe, maski, namioty tlenowe i inkubatory z dopływem tlenu. Przy tym samym stężeniu tlenu w mieszaninie maksymalne stężenie w drogach oddechowych obserwuje się w namiocie tlenowym lub inkubatorze, ale zużycie tlenu przy tych metodach tlenoterapii jest wysokie. Cewniki do nosa nie pozwalają na wytworzenie dużego stężenia tlenu, a dodatkowo utrudniają oddychanie przez nos i podrażniają błonę śluzową nosa. Maski twarzowe potrafią utrzymać stałe i dość wysokie stężenie tlenu, do ich wad można zaliczyć trudności w mocowaniu i uszczelnianiu.
Spontaniczne, ciągłe oddychanie dodatnim ciśnieniem (CPBP) zapobiega wydechowemu zamknięciu dróg oddechowych, kompensując obniżony poziom środka powierzchniowo czynnego i zapobiega sklejaniu się pęcherzyków płucnych. Zwiększa się wymiana gazowa, zmniejsza się obrzęk błony naczyń włosowatych pęcherzyków płucnych, wzrasta ciśnienie parcjalne tlenu w krwi tętniczej, przy niezmienionym stężeniu w mieszaninie oddechowej. Często obserwuje się spadek PaCO2. Wskazaniami do CPAP są hipoksemia (PaO 2 poniżej 50 mmHg) podczas stosowania 50% mieszaniny oddechowej, związana z zaburzeniami stosunku wentylacji do perfuzji, dużym przeciekiem śródpłucnym, zmniejszoną podatnością płuc, a także utrzymującą się dusznością, Silverman zdobywa 5 punktów i więcej. Przeciwwskazania: przetoki oskrzelowo-opłucnowe, odma opłucnowa i inne zespoły „nieszczelności powietrza”.
Obecnie najpopularniejszą metodą CPAP jest użycie kaniuli nosowych. Rzadziej stosuje się SDPPD z torbą Martina. Zabieg rozpoczyna się od wdychania mieszaniny oddechowej podgrzanej do 32-34 0 C i zwilżonej do 80-100%, następnie pod kontrolą PaO 2 stężenie mieszaniny zmniejsza się do 50%. Początkowe nadciśnienie wynosi 4 cm słupa wody. W przypadku wcześniaków z masą urodzeniową mniejszą niż 1500 g ciśnienie powinno wynosić 2-3 cm słupa wody. Wskazaniami do zaprzestania SDPPD jest stabilizacja PaO 2 powyżej 60 mm Hg przy oddychaniu mieszaniną 50% i pod ciśnieniem równym atmosferycznym. Po zaprzestaniu stosowania CPAP dziecko zwykle umieszczane jest w namiocie tlenowym.
Jeżeli przy maksymalnym możliwym ciśnieniu (do 8-10 cmH2O) i maksymalnym stężeniu tlenu (100%) nie ma efektu terapeutycznego, dziecko należy przenieść do sztuczna wentylacja płuc (ALV) . Stosuje się różne tryby wentylacji – wentylację wymuszoną, wentylację wymuszoną ze stałym dodatnim ciśnieniem końcowo-wydechowym, wentylację wspomaganą i wentylację o wysokiej częstotliwości.
Odpowiednia wentylacja mechaniczna prowadzi do eliminacji hiperkapni i niedotlenienia, co wiąże się ze zwiększeniem objętości wentylacji, poprawą stosunku wentylacji do perfuzji i zmniejszeniem przecieku śródpłucnego. Eliminacja kwasicy oddechowej i stopniowa normalizacja pH przyczynia się do przywrócenia procesów metabolicznych. Poprawia się mikrokrążenie, normalizuje się hemodynamika.
Należy jednak wspomnieć o możliwych niekorzystnych zmianach patofizjologicznych – zmiana mechaniki oddychania, zmniejszenie podatności płuc, zwiększenie oporu aerodynamicznego dróg oddechowych, pogorszenie drenażu plwociny, co przy spadku stężenia surfaktantu prowadzi do rozwoju mikroniedmy. Zwiększone ciśnienie w drogach płucnych prowadzi do zakłócenia przepływu krwi w płucach - rozwoju obrzęku, wynaczynienia płynu do pęcherzyków płucnych. Do cech utrudniających wentylację mechaniczną u noworodków zaliczają się małe objętości oddechowe, duże prędkości przepływu gazów i duży opór dróg oddechowych.
Bezwzględnymi wskazaniami do sztucznej wentylacji jest brak oddechu spontanicznego i patologiczne rytmy oddychania (uszkodzenie centralnego układu nerwowego, ciężkie zatrucie). Przy stale postępującej hipowentylacji klinicznymi objawami konieczności wentylacji mechanicznej są: narastająca sinica, 2-krotne zwiększenie częstości oddechów w stosunku do normy lub ciężka bradykardia, udział mięśni pomocniczych, równowaga kwasowo-zasadowa (PaCO 2 powyżej 60 mm Hg lub wzrost o ponad 10 mm Hg art., PaO 2 poniżej 50 przy 50% mieszaniny oddechowej, kwasica - pH poniżej 7,2 (pomimo wprowadzenia sody w dawce 2-4 mmol na kg).
Początkowe parametry wentylacji mechanicznej: częstość oddechów 30-40 na minutę i objętość oddechowa taka, aby maksymalne ciśnienie wdechowe osiągało 20-25 cm H2O. Stężenie tlenu jest ustawione na 70-80%, stosunek wdechu do wydechu wynosi 1:1. Po 10-15 minutach analizuje się równowagę kwasowo-zasadową i gazometrię krwi. Wentylację mechaniczną można uznać za odpowiednią, jeśli ciśnienie cząstkowe tlenu we krwi tętniczej wynosi 50-80 mmHg, wysycenie hemoglobiny tlenem wynosi 91-96%, przezskórne ciśnienie tlenu wynosi 60-90 mmHg, ciśnienie parcjalne dwutlenku węgla we krwi tętniczej - 35- 45 mmHg, przezskórne napięcie CO 2 -35-50 mmHg. Gdy stan się poprawia, pierwszym krokiem jest jak najszybsze obniżenie stężenia tlenu do poziomu nietoksycznego – poniżej 50%. Następnie stopniowo zmniejsza się dodatnie ciśnienie końcowo-wydechowe, zmniejsza się stosunek wdech-wydech i dopiero wtedy zmniejsza się częstotliwość oddychania.
Po wentylacji mechanicznej dziecko przekazywane jest do respiratora o ciśnieniu 3-5 cm H2O i stężeniu tlenu o 10% wyższym niż przy wentylacji mechanicznej. Jeżeli w ciągu 12 godzin objawy niewydolności oddechowej nie nasilają się, dziecko zostaje ekstubowane.
Korekta kwasicy przeprowadzono przy użyciu 4% roztworu wodorowęglanu sodu, którego ilość (w ml) określa się wzorem BE x masa w kg / 4.
KKB stosuje się także w dawce 5-8 mg/kg. Kokarboksylaza pomaga normalizować pH komórek, poprawiać syntezę ATP i wykorzystanie glukozy.
Terapia antybakteryjna. Przepisywany od momentu rozpoznania SDR. Wskazany ze względu na ryzyko rozwoju zakażenia wewnątrzmacicznego i dodatek zakażenia wtórnego, zwłaszcza podczas sztucznej wentylacji.Leki penicylinowe (ampicylina w dawce 150-300 tys. j./kg/dobę w 3-4 dawkach) lub cefalosporyny (klaforan 50 ) są zwykle przepisywane w mg/kg/dzień w 2-3 dawkach, Fortum 30-50 mg/kg/dzień w 2 dawkach, Longacef lub Rocephin 50 mg/kg raz dziennie itp.) w połączeniu z aminoglikozydami (amikacyną lub selemycyną w dawce dziennej 10-15 mg/kg, podzielonej na 2 dawki). Czas trwania i charakter terapii przeciwbakteryjnej ustala się po badaniu pod kątem infekcji i otrzymaniu wyników klinicznych. badanie krwi w dynamice.
W terapii wykorzystuje się także witaminę E (α-tokoferol), która stymuluje syntezę cytochromu i działa oszczędzająco na środki powierzchniowo czynne. α-tokoferol przepisywany jest w dawce 10-15 mg/dobę, doustnie lub pozajelitowo (w postaci 5% roztworu).
Podawanie glikokortykosteroidów dzieciom z zespołem niewydolności oddechowej jest wskazane w przypadku wtórnej niewydolności kory nadnerczy. Wcześniej leki te stosowano w leczeniu SDR w sposób planowy, którego celem było przyspieszenie dojrzewania tkanki płucnej. Powszechne stosowanie w praktyce egzogennych środków powierzchniowo czynnych pozwoliło uniknąć skutków ubocznych terapii glikokortykosteroidami (nadciśnienie tętnicze, krwawienia z przewodu pokarmowego, martwicze zapalenie jelit, hiperglikemia).
Powikłania SDR i tlenoterapii: fibroplazja zasoczewkowa noworodków, dysplazja oskrzelowo-płucna, zespoły wycieku powietrza z płuc (odma opłucnowa, odma śródpiersia, odma osierdziowa).
Włóknienie zasoczewkowe (RLF) rozwija się na tle hiperoksemii i niewystarczającego unaczynienia. Przy wysokich wartościach PaO 2 (> 100 mmHg) dochodzi do utrzymującego się zwężenia naczyń siatkówki, które jest jedyną kliniczną manifestacją początkowego stadium choroby. Po 1-2 miesiącach od zakończenia tlenoterapii naczynia siatkówki rozszerzają się, rozpoczyna się ich proliferacja i obrzęk siatkówki. Przy niewielkich zmianach często obserwuje się samoistną regenerację siatkówki. W 25% przypadków tak się dzieje dysinsercja siatkówki, blizny i ślepota. Skuteczny w ponad połowie przypadków odwarstwienia siatkówki interwencja chirurgiczna. Jeśli diagnoza jest późna, a zmiana jest znacząca, leczenie jest nieskuteczne. Dlatego konieczne jest ścisłe monitorowanie PaO 2 podczas terapii tlenowej i obowiązkowe badanie dna oka po wypisaniu ze szpitala.
Dysplazja oskrzelowo-płucna (BPD) - przewlekła, postępująca choroba płuc, będąca wynikiem toksycznego działania tlenu na tkankę płucną. Głównymi przyczynami jego rozwoju są stężenia tlenu powyżej 50% w mieszaninie oddechowej oraz wysoki poziom nadciśnienia (ponad 30 cm słupa wody) podczas wentylacji mechanicznej. Ważną rolę odgrywa także czas trwania wentylacji mechanicznej (ponad 72 godziny) i stopień wcześniactwa dziecka. W przypadku BPD prawie wszystkie struktury płuc ulegają uszkodzeniu, zmniejsza się podatność płuc, wzrasta opór aerodynamiczny dróg oddechowych i wzrasta praca oddechowa. Rozwija się hipoperfuzja płuc i nadciśnienie płucne, a następnie przerost prawej komory i serce płucne. Śmiertelność w przypadku BPD wynosi 30–50%.
Zespoły nieszczelności płuc. Do tej grupy powikłań zalicza się:
1. rozedma śródmiąższowa, w której powietrze gromadzi się w przestrzeni śródmiąższowej. Klinicznie jest to mało wyrażone, ale może towarzyszyć wzrost zapotrzebowania na tlen i wzrost PaCO 2. Postęp rozedmy śródmiąższowej w połowie przypadków prowadzi do odmy opłucnowej. Diagnozuje się wyłącznie na podstawie prześwietlenia rentgenowskiego. W tym przypadku na radiogramie pojawiają się prześwity w kształcie pędzla i liniowe. Zajęcie płuc jest zwykle obustronne. Wraz z rozwojem rozedmy następują zmiany parametrów wentylacji mechanicznej (spadek szczytowego ciśnienia wdechowego i dodatniego ciśnienia końcowo-wydechowego).
2. odma opłucnowa może mieć charakter samoistny, związany z niedojrzałością układu oddechowego i SDR, lub na skutek wspomagania oddechowego (respirator, wspomaganie respiratora). Uważa się, że odma opłucnowa występuje u 30–50% dzieci z SDD i wentylowanych mechanicznie. Najczęściej jest to ciężka odma opłucnowa wymagająca natychmiastowej interwencji. Diagnozę stawia się na podstawie objawów klinicznych: gwałtownego pogorszenia stanu dziecka, osłabienia oddechu, braku synchronizacji oddechu, sinicy, tachykardii; potwierdzone w badaniu RTG: nagromadzenie powietrza w jamie opłucnej, przemieszczenie śródpiersia, zapadnięcie płuca. Wymaga drenażu jamy opłucnej.
3. Odma śródpiersia. Występuje rzadko, może być spontaniczny. Zwykle objawia się przytępieniem dźwięków serca, dusznością i możliwą sinicą. Rozpoznanie potwierdza badanie RTG: w bocznym zdjęciu RTG klatki piersiowej widoczna jest przejaśniona strefa zlokalizowana za mostkiem lub w górnej części śródpiersia. Na bezpośrednim prześwietleniu rentgenowskim czasami nagromadzone powietrze oddziela cień serca grasica(„skrzydło motyla” lub „żagiel”). Powietrze samoistnie się rozpływa, specjalne traktowanie ta komplikacja nie jest wymagana.
4. odma osierdziowa występuje rzadko. W przypadku napiętego kikuta-osierdzia może wystąpić tamponada serca. Manifestuje gwałtowne pogorszenie stan, sinica, silne przytępienie tonów serca. Leczenie: nakłucie osierdzia.
Krwotok okołokomorowy (PVH). Występują najczęściej u dzieci z niską masą urodzeniową i z dużym prawdopodobieństwem powodują śmierć (u 40% pacjentów). PVC może wystąpić do objaw kliniczny SDR oraz na tle zespołu zaburzeń oddechowych z powodu niedotlenienia, hiperkapnii, dysfunkcji serca, kwasicy oddechowej i metabolicznej itp. Im cięższy zespół zaburzeń oddechowych, tym większe ryzyko wystąpienia krwotoków okołokomorowych. Nie wolno nam również zapominać o jatrogennych PCV, które powstają podczas trudnych trybów wentylacji mechanicznej, wstrzykiwania strumieniowego roztworów hiperosmolarnych, nieostrożnej manipulacji, która wiąże się ze wzrostem lub gwałtownymi wahaniami ciśnienia ogólnoustrojowego. Jednym z powszechnych mechanizmów występowania jatrogennego PCV jest transport do innego instytucja medyczna dziecko z SDD w ostrym okresie, szczególnie w pierwszych trzech dniach życia.
Zapobieganie SDR.
Główną metodą jest zapobieganie poronieniom. Najczęstszymi przyczynami porodów przedwczesnych są infekcje układu moczowo-płciowego, zaburzenia neurohormonalne i narażenie na czynniki egzogenne. To tylko możliwe kompleksowe rozwiązanie tego problemu, obejmujące przygotowanie kobiety do ciąży, sanitację ewentualnych ognisk zakażenia, właściwe prowadzenie ciąży i porodu. Nie wolno nam także zapominać o konieczności ochrony socjalnej kobiet w ciąży. Do innych ważna metoda jest stosowanie leków przyspieszających dojrzewanie tkanki płucnej u płodu, takich jak glukokortykoidy, aminofilina, tyroksyna, przy braku przeciwwskazań do ich stosowania u kobiety w ciąży. Terapia glikokortykosteroidami w przypadku zagrażającego porodu przedwczesnego stała się powszechna. Obecnie stosuje się głównie deksametazon (6 mg x 4 razy w odstępie 12 godzin) lub betametazon (12 mg x 2 razy w odstępie 24 godzin).
Podobne artykuły
-
Co to jest fizjonomia i czego się uczy?
Indywidualność każdej osoby to zbiór wyraźnych cech osobowości, które dominują nad innymi, które są znacznie słabiej rozwinięte. To właśnie ten zestaw tworzy naszą wyjątkowość, tak uwielbianą przez wszystkich. Na szczęście dla nas najważniejsze funkcje...
-
Najlepsze sposoby na przepowiedzenie własnego losu na przyszłość
Kształt dłoni. Pewne cechy charakteru można rozpoznać po kształcie dłoni. Długość dłoni mierzona jest od nadgarstka do końca palców. Podstawowe interpretacje: Ziemia - szerokie, kwadratowe dłonie i palce, gruba lub szorstka skóra, rumiany kolor,...
-
Główny ośrodek religijny hinduizmu
HINDUIZM, zbiorcza nazwa dużej grupy religii, która rozwinęła się na terenie Indii i jest wyznawana przez większość jej ludności (na początku XXI w. wyznawało ją ponad 80% ludności), liczba wyznawców których wyznawców na świecie przekracza 1 miliard ludzi...
-
Ośrodki religijne hinduizmu
1.1 Powstanie hinduizmu Proces syntezy kilku głównych elementów etnokulturowych, w wyniku którego wyłoniła się bogata kultura współczesnych Indii, rozpoczął się trzy tysiące lat temu; Religia starożytnych stała się czynnikiem tworzącym system...
-
Te niesamowite małże
Niedoceniane ślimaki Ślimaki zasługują na znacznie większą uwagę opinii publicznej. Chociaż z reguły są niezwykle powolne, w żadnym wypadku nie należy ich nazywać nudnymi stworzeniami. Są świecące i przezroczyste ślimaki, niektóre...
-
Na co zmarł Bruce Lee? Tajemnica śmierci Bruce'a Lee. Bruce Lee: historia słynnej śmierci Z kim walczył Bruce Lee?
Zaciągnąłem całą rodzinę na cmentarz. Tak, tak, tutaj, na cmentarzu Lake View, mój idol z dzieciństwa i jedyny w swoim rodzaju superman, Bruce Lee, został pochowany obok jego syna Brandona Lee. Potem, na początku lat 90-tych, podziwiając umiejętności...
