Синдром на респираторни нарушения при новородени. Основните клинични синдроми при заболявания на дихателната система
Катедра по пропедевтика на вътрешните болести
Методическа разработка
За самостоятелна работа на третокурсници
Тема: „Основни клинични синдромипри заболявания на дихателната система"
Ставропол
Основните клинични синдроми при заболявания
дихателната система
Синдром – това е набор от симптоми, обединени от един механизъм на развитие (патогенеза)
Различават се следните белодробни синдроми:
1. Синдром на нормална белодробна тъкан
2. Синдром на фокално уплътняване на белодробната тъкан
3. Синдром на лобарно уплътняване на белодробната тъкан
4. Синдром на кухина в белодробната тъкан
5. Синдром на обструктивна ателектаза
6. Синдром на компресионна ателектаза
7. Синдром на натрупване на течност в плеврална кухина
8. Синдром на натрупване на въздух в плевралната кухина
9. Синдром на излишък на въздух в белите дробове
10. Синдром на стесняване на бронхите с вискозен ексудат
11. Синдром на бронхиална обструкция
12. Синдром на фиброторакс или акостиране
13. Синдром дихателна недостатъчност
Съвкупността от симптоми при конкретен белодробен синдром се открива с помощта на основните (общ преглед, преглед гръден кош, палпация, перкусия, аускултация) и допълнителни (рентгенография на гръдния кош, кръв и храчки) изследователски методи.
синдром на нормалната белодробна тъкан
^
Оплаквания: няма
Изследване на гръдния кош: гърдите са с правилна форма, двете половини на гърдите са симетрични, участват еднакво в акта на дишане. Броят на дихателните движения е 16-18 в минута. Дишането е ритмично, типът дишане е смесен.
палпация
Перкусии: определя се ясен белодробен звук по цялата повърхност на белодробната тъкан.
Аускултация: чува се везикуларно дишане по цялата повърхност на белодробната тъкан, липсват звуци от странично дишане.
Рентгенов: белодробната тъкан е прозрачна.
Изследване на кръв и храчки: няма промяна.
^
Синдром на фокално уплътняване на белодробната тъкан

Този синдром се характеризира с образуването на малки огнища на уплътняване, заобиколени от нормална белодробна тъкан.
^ Възниква при:
А) фокална пневмония (бронхопневмония), алвеолите са пълни с възпалителна течност и фибрин.
Б) белодробен инфаркт (алвеоли, пълни с кръв)
В) пневмосклероза, карнификация (покълване на белодробна тъкан от съединителна или туморна тъкан)
Патоморфология:белодробната тъкан е уплътнена, но съдържа малко въздух.
^ Оплаквания: задух, кашлица.
Обща проверка : няма промяна.
Изследване на гръдния кош: известно изоставане на "болната" половина на гръдния кош по време на дишане.
палпация: гърдите неболезнени, еластични. Гласовото треперене се засилва с голямо пневмонично огнище, разположено повърхностно.
Перкусии
Аускултация: бронховезикуларно дишане, мокро фино - и
Средно бълбукащи звучни хрипове, локализирани в определена област. Бронхофонията се засилва.
Рентгенов: огнища на възпалителна инфилтрация на белия дроб
Тъканите се редуват с области на нормална белодробна тъкан, възможно е да се увеличи белодробният модел в „засегнатия сегмент“.
^ Кръвен тест : умерена левкоцитоза, ускорена СУЕ.
Изследване на храчки: Слузеста храчка, може да е с кръв, не съдържа голям бройлевкоцити, еритроцити.
^
Синдром на лобарно уплътняване на белодробната тъкан
П  При този синдром, за разлика от синдрома на фокално уплътняване на белодробната тъкан, в процеса е включен цял лоб на белия дроб.
При този синдром, за разлика от синдрома на фокално уплътняване на белодробната тъкан, в процеса е включен цял лоб на белия дроб.
^
Възниква при:
а) лобарна пневмония(плевропневмония), алвеолите са пълни с възпалителна течност и фибрин.
б) пневмосклероза, карнификация (прорастване на лоба на белия дроб със съединителна и туморна тъкан).
Физикални находки при крупозна пневмония:
Патоморфология: белодробната тъкан е уплътнена, но съдържа определено количество въздух (етапи I-III), белодробната тъкан е плътна, безвъздушна (етап II).
^ Оплаквания: болка в гърдите, задух, кашлица.
Обща проверка: акроцианоза на назолабиалния триъгълник, херпесни изригванияна устните, носа.
Изследване на гръдния кош: изоставане на "болната" половина на гръдния кош по време на дишане.
палпация: болезненост в засегнатата половина на гръдния кош, треперенето на гласа е леко повишено (етапи I-III), значително повишено (етап II).
Перкусии: тъпота на перкуторния звук с тимпанична сянка в етапи I-III, тъпота в стадий II (плътен безвъздушен бял дроб).
Аускултация: отслабено везикуларно дишане с бронхиална сянка в I-III стадий, бронхиално в II стадий. Първоначална крепитация (crepitatio indux) в стадий I, крепитация на разделителна способност (crepitatio redux) в стадий III.
Бронхофонията леко или значително повишена. Може да има плеврално триене.
Рентгенов: хомогенно потъмняване на белодробната тъкан, покриващо сегмент или дял на белия дроб.
^ Кръвен тест : левкоцитоза, ускорена СУЕ.
Изследване на храчки: мукопурулентна храчка, примесена с кръв ("ръждясала"), съдържа много левкоцити, еритроцити
^
Синдром на кухината в белодробната тъкан
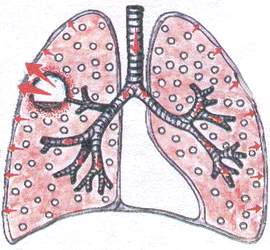
За да се диагностицира кухина чрез методи за физикален преглед, тя трябва да отговаря на следните условия:
Диаметърът на кухината трябва да бъде най-малко 4 cm.
кухината трябва да бъде свързана с бронха.
кухината трябва да е празна.
кухината е "стара", с плътни ръбове.
кухината трябва да бъде разположена повърхностно.
Този синдром възниква, когато:
а) белодробен абсцес
б) бронхиектазии
D) с колапс на белодробната тъкан
Оплаквания: кашлица с отделяне на гнойни храчки в големи количества, по-често пълна с уста, септична температура с нощно обилно изпотяване (характерно за белодробен абсцес, бронхиектазия), кашлица с кървави храчки или кръвни ивици (с кавернозна туберкулоза, разпадане на белодробна тъкан).
^ Обща проверка: акроцианоза, дифузна цианоза, промяна в крайните фаланги (" Палки за барабани“, „стъкла за часовници“).
Изследване на гръдния кош: изоставане на "болната" половина на гръдния кош по време на дишане, тахипнеозно.
палпация: понякога гърдите са болезнени, гласовото треперене се засилва.
Перкусии: тъп тимпаничен звук, с голяма кухина, разположена по периферията - тимпаничен звук с метален оттенък.
Аускултация:бронхиално или амфорично дишане, влажни средни и големи бълбукащи звучни хрипове. Бронхофонията се засилва.
Рентгенов:на фона на потъмняване, има просветление на белодробната тъкан с хоризонтално ниво на течност.
^ Кръвен тест : хиперлевкоцитоза, значително ускорена СУЕ, възможна анемия.
Изследване на храчки: гнойна храчка, може да е примесена с кръв, съдържа голям брой левкоцити, може да има еритроцити, еластични влакна.
^
Синдром на обструктивна ателектаза
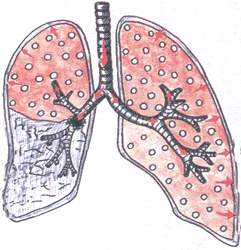
При този синдром се наблюдава колапс на белодробната тъкан в резултат на частично или пълно запушване на голям бронх от тумор, увеличени лимфни възли и чуждо тяло.
Патоморфология: при пълно блокиране на бронха, въздухът не навлиза в белите дробове, белодробната тъкан е плътна. При частична обструкция на бронхите белодробната тъкан е уплътнена, но съдържа малко количество въздух.
^ Оплаквания: тежък задух, кашлица, болка в гърдите.
Обща проверка: бледност кожата, умерена цианоза.
Изследване на гръдния кош: при продължителна блокада има прибиране на "болната" половина на гръдния кош (свитата белодробна тъкан заема по-малко място), тахипнея, изоставане от "болната" половина с дълбоко дишане.
палпация: известна ригидност на „засегнатата половина на гръдния кош. Гласовото треперене е отслабено с частично запушване на бронха, рязко отслабено или изобщо не се извършва с пълно запушване на аферентния бронх (няма условия за въздушна проводимост).
Перкусии: с непълно запушване на бронха, тъп тимпаничен звук, с пълно запушване - абсолютно тъп звук.
Аускултация: дишането е отслабено, везикуларно или изобщо не се чува. Бронхофонията е рязко отслабена или напълно отсъства.
Рентгенов: хомогенна сянка в областта на ателектазата. сърце и големи съдовепривлечени към "болната" страна.
Изследване на кръв и храчки: Няма да има голяма промяна.
^
Синдром на компресионна ателектаза
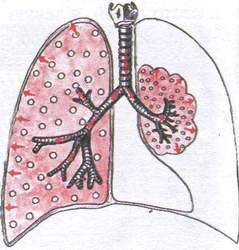
Този синдром се наблюдава, когато белодробната тъкан се компресира отвън от течност (хидроторакс) или въздух (пневмоторакс).
Патоморфология: белодробната тъкан е уплътнена, но съдържа малко въздух, тъй като връзката с бронхите не е нарушена и въздухът продължава да тече в белите дробове.
^ Оплаквания: задух, кашлица, болка в гърдите.
Обща проверка: цианоза, промяна в крайните фаланги ("барабанни пръчици").
Изследване на гръдния кош: изпъкналост на "болната" половина на гръдния кош поради натрупване на течност или въздух в плевралната кухина, тахипнея, изоставане на "болната" половина по време на дишане.
палпация: ригидност на "засегнатата" половина на гръдния кош, вокалното треперене е донякъде повишено.
перкусии:тъпота с тимпанична сянка.
Аускултация: отслабено везикуларно дишане с бронхиален оттенък или бронхиално (създадени са условия за проводимост - белодробнадебел плат).
Рентгенов: в областта на ателектазата, хомогенна сянка, свързана с бронха.
^ Изследване на кръв и храчки : Няма да има голяма промяна.
Синдром на натрупване на течност в плевралната кухина
(хидроторакс)
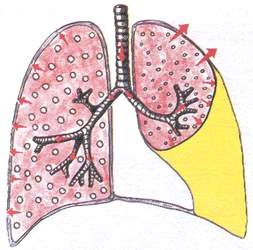
Този синдром се характеризира с натрупване на невъзпалителна течност (трансудат) - със сърдечна недостатъчност или натрупване на възпалителна течност (ексудативен плеврит) или натрупване на кръв (с гръдна травма, хеморагична диатеза).
Оплаквания: при ексудативен плеврит(болка в гърдите, задух, кашлица, треска), със сърдечна недостатъчност (болка в сърцето, сърцебиене, болка в десния хипохондриум, подуване).
^ Обща проверка
Изследване на гръдния кош: изпъкналост на "болната" половина на гръдния кош (степента на изпъкналост зависи от количеството течност), тахипнеозно, изоставане от "болната" половина по време на дишане.
палпация:от страната на лезията гръдният кош е болезнен, твърд. Гласовото треперене е рязко отслабено или липсва в зависимост от количеството течност в плевралната кухина.
Перкусии: по-често тъп (бедрен) звук. При стагнация нивото на течността е ниско хоризонтално от двете страни. При ексудативен плеврит нивото на течността може да бъде високо, тъпотата се определя от наклонената линия Damuazo от едната страна.
Аускултация: дишането е рязко отслабено или липсва в зависимост от количеството течност в плевралната кухина. От здравата страна се чува усилено везикуларно дишане. Може да има плеврално триене.
Бронхофонията е рязко отслабена или липсва.
Рентгенов:хомогенно потъмняване в засегнатата част на белодробното поле, изместване на медиастиналните органи, по-често в обратната страна, с туморен плеврит, медиастиналните органи се изтеглят до "болната" страна.
^ Изследване на кръв и храчки : с ексудативен плеврит - левкоцитоза, ускорена СУЕ.
Синдром на натрупване на въздух в плевралната кухина
(пневмоторакс)

Това се случва, когато бронхите комуникират с плевралната кухина (субплеврално разположение на туберкулозната кухина, абсцес), с гръдна травма, спонтанен пневмоторакс или с изкуствено въвеждане на въздух в плевралната кухина с терапевтична целпациенти с кавернозна туберкулоза.
^ Оплаквания
Обща проверка: бледа кожа, цианоза.
Изследване на гръдния кош: изпъкналост на "болната" половина на гръдния кош, в която се е натрупал въздух, изглаждане на междуребрените пространства, тахипнея, изоставане на "болната" половина по време на дишане.
палпация:болезненост, скованост на засегнатата половина на гръдния кош. Гласовото треперене е рязко отслабено или не се извършва.
Перкусии: силен тимпаничен звук, понякога с метализъм сянка.
Аускултация:дишането е отслабено, везикуларно или не се чува. Бронхофонията е рязко отслабена или липсва.
Рентгенов: светло белодробно поле без белодробен модел, а по-близо до корена - сянка на колабирал бял дроб.
^ Изследване на кръв, храчки : Няма да има голяма промяна.
Синдром на излишно съдържание на въздух в белите дробове (емфизем)
Този синдром се наблюдава, когато фазата на издишване е затруднена (намаляване на лумена на бронхите поради техния спазъм или пълнене с ексудат, намаляване на еластичността на белодробната тъкан), белите дробове се разширяват, съдържанието на въздух в тях се увеличава, но дихателна екскурзияте намаляват.
Патоморфология: повишена въздушност на белодробната тъкан.
Оплаквания: задух, кашлица.
^ Обща проверка: подпухналост на лицето, цианоза, подуване на югуларните вени.
Изследване на гръдния кош: гърдите са във формата на варел,
Междуребрените пространства са разширени, гладкост или изпъкналост на суб- и супраклавикуларните ямки, дихателни движениянамален обем на гръдния кош, тахипнея.
палпация:гръдният кош е твърд. Гласовото треперене е отслабено.
перкусии:в цялата белодробна тъкан се определя звук на кутия, долните граници на белите дробове са понижени, екскурзията на долните ръбове на белите дробове е ограничена.
Аускултация:равномерно отслабено везикуларно дишане, сухи и мокри хрипове.
Рентгенов: повишена прозрачност на белодробните полета, отслабване на белодробния модел, ниска позиция и ниска подвижност на диафрагмата.
Изследване на кръв, храчки: Няма да има голяма промяна.
^
Синдром на бронхиална констрикция с вискозен ексудат
д  Този синдром е най-характерен за остри или хроничен бронхит, при което има възпаление на лигавицата на бронхите и запълване на лумена на бронхите с вискозен секрет.
Този синдром е най-характерен за остри или хроничен бронхит, при което има възпаление на лигавицата на бронхите и запълване на лумена на бронхите с вискозен секрет.
^ Оплаквания:кашлица, може да е болка в гърдите.
Обща проверка: акроцианоза, бледност на кожата.
Изследване на гръдния кош:няма да има голяма промяна.
палпация: гърдите неболезнени, еластични. Гласовото треперене се провежда добре, еднакво от двете страни.
Перкусии: определя се ясен белодробен звук по цялата повърхност на белодробната тъкан.
Аускултация: затруднено дишане, сухи хрипове с различна височина и тембър.
Рентгенов: повишен белодробен модел.
^ Кръвен тест: умерена левкоцитоза, ускорена ESR.
Изследване на храчки:храчките са мукозни, мукопурулентни, съдържат малко количество левкоцити.
^
Синдром на бронхиална обструкция
д  Този синдром се характеризира с бронхиална проходимостпоради бронхоспазъм, възпаление и подуване на лигавицата на бронхите с малък калибър (хроничен обструктивен бронхит, бронхиална астма).
Този синдром се характеризира с бронхиална проходимостпоради бронхоспазъм, възпаление и подуване на лигавицата на бронхите с малък калибър (хроничен обструктивен бронхит, бронхиална астма).
^ Оплаквания: кашлица, задух.
Обща проверка: цианоза, "тъпани" (промяна в крайните фаланги).
Изследване на гръдния кош: тахипнозен, с продължителна бронхиална обструкция - гръдният кош е бъчвовиден, дихателните движения са намалени по обем.
палпация: гръдният кош е малко схванат, треперенето на гласа е отслабено.
Перкусии: леко притъпяване на перкусионния звук с боксова сянка.
Аускултация: дишането е затруднено или отслабено, везикуларно с маса от разпръснати сухи, а в долните части на мокри фини мехурчета беззвучни хрипове.
Рентгенов: повишена прозрачност на белодробната тъкан, ниско положение на купола на диафрагмата и ограничаване на нейната подвижност.
^ Кръвен тест : левкоцитоза, ускорена ESR, може да бъде еозинофилия, лимфоцитоза.
Изследване на храчки: храчката е лигавична, мукопурулентна, съдържа малко количество левкоцити, еозинофили.
^
Синдром на фиброторакс или акостиране
П  При този синдром се наблюдава заместване на белодробна тъкан съединителната тъкан, поради дълготраен възпалителен процес с различна етиология.
При този синдром се наблюдава заместване на белодробна тъкан съединителната тъкан, поради дълготраен възпалителен процес с различна етиология.
^ Оплаквания: задух, болка в гърдите.
Обща проверка: бледа кожа, цианоза.
Изследване на гръдния кош: прибиране на „болната” половина на гръдния кош, тахипнеозно, изоставане от „болната” половина с дълбоко дишане.
Перкусии: притъпяване на перкусионния звук.
Аускултация: дишането е отслабено, везикуларно или не се чува. Шум от триене на плеврата. Бронхофонията е рязко отслабена или липсва.
Рентгенов: в областта на фиброторакса - хомогенна сянка.
Изследване на кръв, храчки: Няма да има голяма промяна.
^
Синдром на дихателна недостатъчност
Дихателна недостатъчност (DN) е състояние на организма, при което поддържането на нормалното газов съставкръв или се постига благодарение на по-интензивна работа на апарата външно дишанеи сърцето, което води до намаляване функционалносторганизъм.
Нормалният газообмен в белите дробове е възможен при ясна връзка на трите компонента.
1) вентилация
2) дифузия на газове през алвеоларно-капилярната мембрана
3) перфузия капилярна кръвв белите дробове
Причините за DN могат да бъдат всякакви патологични процеси в тялото или неблагоприятни фактори заобикаляща средакоито засягат поне един от тези компоненти.
Има две групи DN:
с преобладаваща лезия на белодробните механизми
с преобладаваща лезия на извънбелодробните механизми
запушване на големи респираторен тракт
Запушване на малки дихателни пътища
Свиване на белодробната тъкан
Рестрикционно нарушение на алвеоларната тъкан
Нарушена белодробна циркулация
Нарушаване на съотношението вентилация-перфузия
Удебеляване на алвеоларно-капилярната мембрана
1. Нарушение на централната регулация на дишането
2. Увреждане на дихателната мускулатура
3. Контузия на гръдния кош
В зависимост от причините и механизма на DN има три вида нарушения на вентилационната функция на белите дробове:
-обструктивна
- ограничителен
-смесени
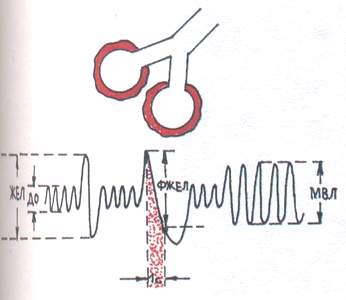
За обструктивен тип (фиг. 1) се характеризира със затруднено преминаване на въздуха през бронхите поради възпаление на бронхите, бронхоспазъм, стесняване или компресия на трахеята и големите бронхи. От фазите на дишането преобладаващо се засяга издишването.
При спирографско изследване се наблюдава намаляване на максималната вентилация на белите дробове (MVL) и форсирания експираторен обем за 1 s. (FVC) с лек спад жизнен капацитетбели дробове (VC).
 Фиг. 1
Фиг. 1
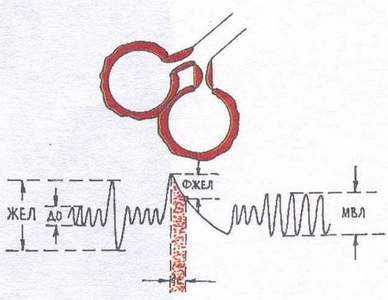
Ограничителен тип (Фиг. 2) вентилационните нарушения се наблюдават, когато способността на белите дробове за разширяване и колапс е ограничена (хидроторакс, пневмоторакс, пневмосклероза, кифосколиоза, масивни плеврални сраствания, костална осификация на хрущяла, ограничена подвижност на ребрата). От фазите на дишането страда предимно вдишването. При спирографско изследване се наблюдава намаляване на VC и MVL.
 Фиг.2
Фиг.2
смесен тип (Фиг. 3) възниква при продължителни белодробни и сърдечни заболявания и съчетава признаци на 2 вида вентилационни нарушения (обструктивни и рестриктивни), често с преобладаване на един от тях.
^
Фиг.3
Има три степени на DN
1 ст.възниква недостиг на въздух с предварително налични физическа дейност, цианоза липсва, умората е бърза, спомагателната дихателна мускулатура не участва в дишането.
2-ро. задух се появява при обичайно усилие, цианозата не е изразена, умората е изразена, при усилие спомагателните мускули участват в дишането.
3-тозадух в покой, цианоза, умора е изразена, спомагателните мускули постоянно участват в дишането.
За наличието на ДН и степента му се съди по тежестта на такова клинични признацикато задух, тахикардия, цианоза и промяна приливни обемии контейнери. Данните от физическите методи на изследване ще зависят от основното заболяване, което е свързано с развитието на дихателна недостатъчност.
Н. А. Мухин, В. С. Моисеев. Пропедевтика на вътрешните болести. - М., 2002.
А.В. Струтински „Основи на семиотиката на болестите вътрешни органи" - Москва -. MED-press-inform.- 2007.
Контролни въпроси
Кои са основните белодробни синдроми?
Отличителни черти на аускултацията при I, III и II стадий на крупозна пневмония?
За какви заболявания е най-характерен синдромът на фокално уплътняване на белодробната тъкан?
Как ще се промени общ анализкръв и храчки при синдром на кухина в белодробната тъкан?
Каква кухина в белодробната тъкан се разкрива чрез физикални методи на изследване?
Защо дишането е отслабено везикуларно или изобщо не се чува при обструктивна ателектаза?
Какъв перкуторен звук е най-типичен за синдрома на бронхиална обструкция?
Как се променя треперенето на гласа при синдрома на лобарно уплътняване на белодробната тъкан?
Защо "засегнатата" половина на гръдния кош е ригидна при синдром на компресионна ателектаза?
Какви са оплакванията на пациент със синдром на хидроторакс?
Какво означава цилиндър и за какви заболявания е характерен?
Какъв е механизмът на развитие на синдрома на емфизем?
Какви промени на рентгеновата снимка се наблюдават при ексудативен плеврит и застойна сърдечна недостатъчност?
Как се поддържа нормалният газообмен в белите дробове?
Какви са трите вида нарушения на белодробната вентилация?
Термини синдром респираторни нарушения(ЧЕСТИТ РОЖДЕН ДЕН), респираторен дистрес синдром(RDS) и хиалинната мембранна болест (HMD) в чуждестранната литература са синоними. Например, в най -популярните наръчници за неонатология в Съединените щати, термините се използват за описание на същото състояние (болест): В 7 -мото издание на болестите на Averys от новороденото (1998) - хиалинова мембранна болест и в 7 -мото издание на неонатално -перинатална медицина (изд. Aa.Fanaroff и R.J.Martin, 2002) - респираторни синдромиси. Ние предпочитаме концепцията за респираторен дистрес синдром.
Честотата на развитие на SDR зависи средно от степента на недоносеност на новороденото и е средно 82-88% при раждане на дете на гестационна възраст под 27 седмици, 78-80% - на период от 27-28 седмици, 70% - на период от 29-30 седмици, 50-55% - на период от 3 1 - 3 2 седмици, 20-22% - на период от период от 33-34 седмици, 5 - 10% - за период от 35-36 седмици. и по-малко от 1 - 2% - с гестационна възраст 37 седмици. и още.
BGM (SDR тип I, RDS) и неговите последствия са причина за 30-50% от неонаталните смъртни случаи.
Етиология. Причинни факториразвитие B G M са:
дефицит в образуването и освобождаването на повърхностно активно вещество;
дефект в качеството на повърхностно активното вещество;
инхибиране и разрушаване на повърхностно активното вещество;
незрялост на структурата белодробна тъкан. Всички тези процеси се улесняват от:
недоносеност;
вътрематочни инфекции;
перинатална хипоксия, асфиксия и причинена от тях белодробна исхемия и ацидоза;
ретинопатия на недоносените;
Местни, белодробни:
синдроми на изтичане на въздух;
белодробен оток;
пневмония;
кръвоизливи в белите дробове;
бронхопулмонална дисплазия;
Нарушения, свързани с грешна позицияили запушване на дихателните тръби, лезии на ларинкса и трахеята (стесняване на субглотисното пространство, оток, стеноза, ерозия, гранулом).
Управлението на пациенти с ХМ изисква неонатологът да комбинира задълбочени познания по свързаната с възрастта физиология, алгоритми интензивни грижии овладяване на изкуството за постоянно анализиране на динамиката клинични симптоми, съчувствие, емпатия към детето. Необходимо е постоянно да се наблюдават основните параметри на жизнената дейност и като обратна връзка бързо да се коригират както параметрите на механичната вентилация, така и на инфузията, лекарствена терапия. Изглежда, че при много деца с ХМ тежестта на състоянието след първия ден от живота се дължи не толкова на първоначалната тежест на белодробното заболяване, колкото на тяхното увреждане (с вторичен дефицит на сърфактант) с неадекватни (невариращи в зависимост от отговора на детето) параметри на вентилацията, прекомерна или недостатъчна инфузия, лекарствена терапия и охлаждане.
Диагнозата се основава на клиничната картина и рентгенографията на гръдния кош.
Рентгенографски BGM се характеризира с триада от симптоми, появяващи се през първите 6 часа от живота:
дифузни симетрични огнища с намалена прозрачност (симптом на смляно стъкло без или със признаци на мрежести бели дробове);
въздушна бронхограма;
намалена пневматизация на периферните белодробни полета.
Тези общи промени се виждат по-добре в долните части на белите дробове и във върховете. В допълнение, има намаляване на белодробния обем, различна тежест на кардиомегалия (увеличаване на кардиоторакалния индекс), нодозо-ретикуларни промени (различни автори ги описват като мрежести, мозаечни, зърнести, зърнести и др., Но все пак те сега по-често се интерпретират като дисеминирана ателектаза).
За едематозно-хеморагичен синдром е типично намаляване на размера на белодробните полета, замъглена рентгенова картина, която клинично често се комбинира с освобождаване на пенлива течност с кръв от устата.
Ако споменатите признаци на ХМ не се открият на рентгенография 3 часа след раждането, тогава диагнозата ХМ е съмнителна. Рентгенографските находки при SDR са неспецифични (напр. подобни на тези при стрептококова пневмония B), но рентгенографията на гръдния кош все още е необходима, за да се изключат други състояния, които понякога изискват операция. Рентгеновите признаци на BGM изчезват след няколко часа или 1-3 дни, в зависимост от тежестта на заболяването, естеството на терапията, по-специално от това дали е използвано екзогенно повърхностно активно вещество или не.
R.J. Rodrigues и др. (2002) подчертават, че дори в повечето неонатални центрове в Съединените щати диагнозата SDR се ръководи само от клинични и радиографски данни, въпреки че, разбира се, за правилната диагноза на SDR е важно да се получат доказателства за дефицит на сърфактант. Затова понякога терминът дихателна недостатъчност на недоносеното се използва и днес, когато е необходима механична вентилация за лечението на недоносено бебе, допълнителен кислород, но няма типични признациЧЕСТИТ РОЖДЕН ДЕН.
Пренаталната диагноза се основава на факта, че белодробната течност на плода от дихателните пътища навлиза в амниотичната течност и нейният фосфолипиден състав може да се използва за преценка на зрелостта на белите дробове на плода. Амниотичната течност се получава или чрез амниоцентеза, или се събира изтичащата вода от родовия канал на майката. Ако нивата на лецитин и сфингомиелин, наситен фосфатидилхолин в амниотична течност, надвишава 5 mg / l или фосфатидилглицерол - 3 μmol / l, SDR се развива много рядко (по-малко от 1% от случаите). Ако съотношението лецитин / сфинго-миелин (L / S) е повече от 2,0, вероятността за SDR е 2%, ако е по-малко от 2,0, но повече от 1,0, - 50%, а ако е по-малко от 1,0, -75%. При закъснение пренатално развитиеСъотношението L/C не винаги отразява правилно функционалната зрялост на белите дробове на плода и затова в тези случаи се препоръчва да се ръководи от горепосочените абсолютни нива на наситен фосфатидилхолин и фосфатидилглицерол, както и повърхностно активни протеини А. В някои неонатални центрове изследването на тромбопластичната активност на амниотичната течност и броят на оранжевите клетки се използват за оценка на зрелостта на белите дробове на плода s, но това не е общоприето.
Тестът с пяна е най-простият тест за зрялост на белите дробове. За производството на теста се използва амниотична течност или 1 ml стомашно съдържимо, получено с помощта на полиетиленов катетър през първия час от живота. Изпълнение на теста по следния начин: 0,5 ml абсолютен етанол (95%) се добавя към 0,5 ml амниотична течност или стомашно съдържимо. Стъклена епруветка (диаметър 1 cm) се разклаща енергично в продължение на 15 s, след 15 минути резултатът от теста се оценява чрез доближаване на епруветката до черна хартия. Тестът е положителен, ако на повърхността има единичен или двоен пръстен от мехурчета. Тестът е отрицателен, ако няма мехурчета, и слабо положителен, ако има единични малки мехурчета около менискуса, които запълват 1/3 от кръга или по-малко. Кога положителен тествероятността за BGM е около 4%, слабо положителен - 20%, отрицателен - 60%.
Обемът на изследване (мониторинг) при деца с RDS:
Непрекъснат мониторинг на сърдечната честота и AKD.
Перкутанна оксихемоглобинометрия и по-добро транскутанно определяне на Pao2 и Paco2 в артериална кръв. Много е опасно да се съсредоточите само върху данните от пулсовия оксиметър, тъй като той отразява доста добре тежестта на хипоксемията, но не реагира на хипероксия и вече при долната граница на нормата Raog на оксихемоглобина е 100%. Опасността от хипероксия е голяма: именно с нея се свързват хроничните лезии на белите дробове и очите при новородени.
Оптимално е да се определят Pao2 и Paco2 в кръв, получена чрез катетеризация на пъпната, радиалната или тибиалната артерия и от централната вена, с анализ на разликата в артериовенозното напрежение на кислорода, т.е. консумация на кислород в тъканите.
На всеки 3-4 часа е необходимо да се измерва и записва в таблицата за наблюдение температурата на кожата на корема, кръвното налягане, диурезата, CBS, нивото на гликемия и концентрацията на кислород във вдишания въздух (Fio2).
По време на острата фаза на SDR ежедневно или през ден произвеждат:
рентгенова снимка на гръдния кош;
определяне на хематокрит;
клиничен кръвен тест;
посявка на кръв и съдържимо от трахеята;
определяне на серумните нива на урея азот, калий, натрий, калций и магнезий, общ протеини албумин;
желателно е да се определи обемът на циркулиращата кръв, скоростта на церебралния кръвоток и осмоларитета на кръвта;
коагулограма с определяне на фибриноген и продукти на разпадане на фибрин (по показания);
определяне нивото на натрий в кръвта в началото - 2 - 4 пъти на ден, тъй като има висок риск от хипернатриемия поради дехидратация.
Диференциална диагноза се извършва с респираторни нарушения както от белодробен (пневмония, малформации на белите дробове и др.), така и от небелодробен генезис (вторични респираторни нарушения - интракраниална родова травма на главата или гръбначен мозък, вродени сърдечни дефекти, диафрагмална херния, полицитемия, метаболитни нарушенияи т.н.). Диференциална диагнозас пневмония е описано по-долу.
Хоаналната агенезия причинява невъзможност за дишане през носа и появата на цианоза, респираторни нарушения след нормално първо вдишване. Характерно е обилно лигавично течение, изпълващо носа. Малформацията става очевидна, когато не е възможно да се прекара катетър или сонда през носа в назофаринкса. Лечението е оперативно, но веднага се поставя въздуховод в устата.
Трахеоезофагеалните фистули се проявяват клинично чрез задушаване, пристъпи на цианоза, кашлица, хрипове в белите дробове по време на хранене или непосредствено след него. контрастно изследванехранопровод (с водоразтворим контрастен агент) и бронхоскопия ще потвърдят диагнозата.
Диафрагмалната херния се открива при раждането или малко след това тежко разстройстводишане. Типичен е малък навикуларен корем, обърната предна коремна стена при раждането. При преглед се обръща внимание на асинхронните движения на дясната и лявата половина на гръдния кош и изместването на върховия ритъм на сърцето, по-често надясно (тъй като лявата диафрагмална херния се среща 5-10 пъти по-често от дясната), рязко скъсяване на перкуторния тон в долната част на белия дроб и липсата на дихателни звуци тук, внезапна цианоза, когато детето е поставено върху здрава страна. От решаващо диагностично значение е рентгенографията на гръдния кош, която показва наличието в гръдния кош на необичайни за него структури (черва, черен дроб и др.). Хирургично лечение.
При деца с родова травма на мозъка и гръбначния мозък, наред с дихателните нарушения, има и признаци на увреждане на ЦНС. Помагат за навременна диагностика на мозъчната патология и спомагателни изследвания: невросонография, рентгенография на гръбначния стълб, лумбална пункция и др.
Вродените сърдечни дефекти от син тип и синдромът на персистираща фетална циркулация понякога са трудни за разграничаване от SDR. Въпреки това, в първите часове от живота си, децата със SDR често имат нормален цвят на кожата. При използване на 100% кислород за дишане за 10-15 минути, особено при постоянно положително налягане в дихателните пътища, при деца със SDR, Pao се повишава, понякога дори над 100 torr, докато това не се случва при сърдечни дефекти от син тип. Разбира се, данните също имат значение. клиничен преглед, аускултация, оценка на Silverman, както и допълнителни изследвания (рентгенография на гръдния кош, ЕКГ, резултати от ехокардиография).
Пневмонията, причинена от стрептококи В, други стрептококи (Pepto-Reptococci, Enterococci) дават клинична картина, практически неразличима от BGM, тъй като предизвикват инхибиране на сърфактанта и оттам неговия дефицит. Диагностична стойноств този случай има идентифициране на други инфекциозни огнища (и т.н.), резултатите от клинични кръвни тестове, кръвни култури, трахеално съдържание.
Лечение. Температурна защита. Грижата е насочена предимно към предотвратяване на охлаждането, тъй като помага да се намали или дори да се спре (при телесна температура от 35 ° C и по-ниска) синтеза на повърхностно активно вещество и да се увеличи метаболитна ацидозаразвитие на пристъпи на апнея. Веднага след раждането детето се увива в стерилна затоплена пелена, амниотичната течност се отстранява от кожата чрез леко попиване и се поставя под източник на лъчиста топлина и след това в инкубатора (температурата в инкубатора зависи от телесното тегло при раждането; вижте глава VIII за подробности). На всеки 1-2 часа се записва телесната температура на детето и ако тя е под 36 °C, тогава температурата на въздуха в кувьоза се повишава с 1-2 °C, а ако е над 37 °C, тогава се понижава (обикновено не трябва да е по-ниска от 32 °C). Повече подробности в глава VIII.
Трябва да се помни, че дете, лежащо под източник на лъчиста топлина на маса за интензивно лечение, изразходва 5-10% повече енергия за поддържане на телесната температура, отколкото дете в кувьоз. Поради това е препоръчително недоносените бебета с много ниско телесно тегло да се поставят дори в кувьоз в пластмасова камера, за да се намалят топлинните загуби чрез конвекция, както и незабележимата загуба на вода. Всички деца трябва да носят шапка на главата си, защото загубата на топлина и вода от главата е много голяма.
Важно е да се предотвратят температурни колебания външна среда; при изследване на дете в кувьоз минимизирайте травматичните ефекти - болка и др.
Прегледът при лекаря трябва да бъде възможно най-кратък, особено важно е, ако детето се обърне, за да поддържа главата си, намалявайки пасивните движения в цервикалната област.
Поддържане на проходимостта на дихателните пътища. При раждане на дете в асфиксия, наличието на мекониум в амниотичната течност под формата супа от грахнеобходима е трахеална интубация и нежна, но енергична аспирация на съдържанието на дихателните пътища. Изсмукването се повтаря за остра фазазаболявания многократно, ръководени от клиничната картина и аускултаторните данни, но като се помни, че тоалетната на трахеята причинява преходна, но значителна хипоксемия, брадикардия и хипертония, значителна промяна в интензивността на мозъчния кръвоток, което може да провокира вътречерепни кръвоизливи, паравентрикуларни лезии.
Позицията на дете със SDR на маса или в кувьоз трябва да бъде с леко изправена глава (положение на кихане). За целта под горната част на гръдния кош се поставя валяк с дебелина 3-4 см. Периодичната смяна на положението на детето (леко обръщане на една страна, по корем и др.) стимулира трахеалния дренаж. В края на острия период прибягват до вибрационен масаж, физиотерапия и аерозолна терапия.
Инфузионна терапия и хранене. По правило децата със SDR не се хранят ентерално през първите два или три дни от живота си поради риск от кардиопулмонални усложнения и регургитация. Въпреки това, детето от първите часове на живота си не трябва да гладува и да изпитва жажда. Освен това е изключително важно да се предотврати развитието на хипогликемия. Следователно, вече 30-40 минути след раждането започва планираната инфузионна терапия. Обемът на приложената течност през първия ден от живота е 50-60 ml/kg с по-нататъшно увеличение с 20 ml/kg за всеки следващ ден (на 7-ия ден около 140-150 ml/kg). Особено внимателно е необходимо да се въведе течност и да се увеличи дневният й обем в случай на олигурия при дете. Когато се появи диуреза (повече от 2 mi / kg / h), обемът на течността се увеличава по-смело (до 40 ml / kg на ден). Във фазата на олигурия излишният обем течност може да помогне за поддържането на отворен дуктус артериозус, белодробен оток, фактор повишен рискпоследващо развитие на BPD. Възстановяването на диурезата е предвестник на началото на фазата на възстановяване.
През първия ден от живота трансфузираната течност е 5-10% разтвор на глюкоза, от втория ден към нея се добавят натрий и хлор 2-3 mol / kg / ден. и калий, калций, 2 mol / kg / ден. Съставът на инфузионния разтвор се коригира в зависимост от монограмата на кръвта, поддържайки нивото на натрий в рамките на 135-145 mmol / l плазма. За предотвратяване на тромбоза на катетъра и регионалния съд, особено при деца, които са на пълно парентерално хранене, към инфузираните разтвори се добавя хепарин в доза от 0,2-0,5 IU на 1 ml прелята течност.
Като цяло, както е известно, обемът и характерът инфузионна терапияопределя се в зависимост от:
динамика на телесното тегло;
динамика на AKD и интензивност на церебралния кръвен поток;
държави на сърдечно-съдовата система, по-специално състоянието на периферното кръвообращение;
КОС и йонограми на кръвен серум;
условия на кърмене, по-специално адекватността на методите за термична защита, вентилация или IVL.
Отчитане на всички тези параметри и корекция на обема - предизвикателни задачиизискващи както знания, така и изкуството на лекаря, защото досега новородените не се лекуват толкова, колкото се кърмят.
Донорско хранене, майчиното млякоили със смес, адаптирана за недоносени бебета, те започват с подобряване на състоянието и намаляване на диспнеята до 60 за 1 минута, липса на продължителна апнея, регургитация, след контролно даване вътре в дестилирана вода. Видът на храненето (еднократно или продължително стомашни или транспилорни сонди, шише) зависи от наличността сукателен рефлекс, тежестта на състоянието. Изчисляване на количеството кърма - вижте глава VI, където можете да прочетете и за начина на парентерално хранене, ако състоянието на пациента не позволява започване на ентерално хранене.
Нормализирането на газовия състав на кръвта се постига чрез обогатяване на вдишания въздух с кислород, различни опциисъздаване на повишено налягане в дихателните пътища по време на спонтанно дишане (SPAPD - спонтанно дишане с постоянно положително налягане в дихателните пътища) чрез назални канюли (nCPAP - nos continiouse positive airway pressure - назално постоянно налягане на дихателните пътища) при постоянно високо кръвно наляганеи IVL.
Ако няма признаци на SDR, тогава недоносеното бебе се поставя в инкубатор, където съдържанието на кислород във въздуха е около 40 - 45%. Ако в рамките на 4 часа R a o g на артериалната кръв (или когато се определя от кожен сензор) остане над 8 kPa (60 Torr = mm Hg), тогава концентрацията на кислород се намалява с 5% на час до ниво от 3 0 - 3 5%. Когато Pa o 2 е по-малко от 6,6 7 kPa (5 0 Torr = mm Hg t. C.), концентрацията на кислород във вдишания въздух се повишава до максимум чрез поставяне на капачка в инкубатора над главата на детето. Ако това не доведе до нормализиране на кръвния Pao2, тогава започнете SPPD (оптимално през назални канюли).
Други индикации за стартиране на SDP са:
постоянен задух и експираторни шумове;
Силвърман резултат от 5 или повече точки (дори с нормален цвяткожа);
отрицателен тест за пяна с амниотична течност или стомашно съдържимо, получено веднага след раждането, липсата на фосфатидил-глицерол в тях.
Най-често срещаните в момента са pSRAP, много по-рядко се използва методът на Мартин (Martin bag). Чантата се прикрепя към врата на детето с дунапренова лента, така че малкият пръст на лекаря да може свободно да проникне между торбата и врата. Експираторното налягане при разширяване при SPPD обикновено е в диапазона 4-6 cm воден ъгъл. Изкуство. (т.е. на тази дълбочина се потапя тръба, през която излиза въздух от торбата), рядко трябва да се увеличи при изразена ригидност на белите дробове до 10 см воден ъгъл. Изкуство. Ако твърдостта на белите дробове е ниска, тогава свръхналягането по време на издишване води до нарушаване на изтичането на кръв от мозъка, намаляване на притока му към сърцето, допринася за развитието на сърдечна недостатъчност, мозъчен оток.
SDPPD започва с подаване на овлажнен кислород, загрят до 32-34 ° C, и след това, под контрола на клиничния ефект и Pao2 на кръвта, концентрацията му в инхалираната смес постепенно се намалява, постигайки PaO2 на артериална кръв от 6,67-10,67 kPa (50-80 Torr = mm Hg), а повече от 8 kPa артериализирана кръв от петата се счита за потенциално токсична, изисква намаляване на концентрацията на кислород във вдишания въздух.
При тежко безпокойство при детето, което се отбелязва особено често на фона на pSRAP, се предписва натриев оксибутират или седуксен, но не фенобарбитал, който селективно потиска експираторните структури на дихателния център, разположен в продълговатия мозък.
Показания за IVL са:
Невъзможност за постигане на нормализиране на Pao2 в кръвта на фона на pSRAP, оценка на Silverman над 5 точки, без да намалява на фона на pSRAP;
Pao2 е под 8,00 kPa (60 mm Hg) с Fio2>0,7 (F1O2 е делът на кислорода във вдишаната кислородно-въздушна смес), но ако телесното тегло при раждането е по-малко от 1250 g, тогава с Fio2>0,4;
Paco2 повече от 8,79 kPa (65 mm Hg) и с телесно тегло под 1250 g - Paco2> 8,00 kPa (60 mm Hg) и pH<7,25;
методология провеждане на IVL- виж гл. XXVI.
Екстракорпоралната мембранна оксигенация се използва в чужбина за лечение на деца с изключително тежка SDR с неефективност. традиционни методи IVL и при деца с тежки сърдечни дефекти. Поради липсата на подходящо оборудване в Русия, ние не описваме методологията му в този учебник.
Опасностите от кислородната терапия:
сух и студен кислород уврежда белите дробове, насърчава спазъм на артериолите, белодробна хипертония, ацидоза, инхибиране на синтеза на сърфактант. Задължително е загряването на кислорода до 32-34°С (при апаратна вентилация - до 36-37°С), както и овлажняването му. При липса на специални овлажнители кислородът се пропуска през буркан Бобров (височината на водния стълб е най-малко 15 см). Прекомерното овлажняване (100% относителна влажност за повече от 2 часа) води до прегряване на детето, претоварване с вода, допринася за опасност от белодробен оток токсично действиекислородът е реален, когато Pao2 в артериалната кръв е повече от 10,67 kPa, задържане за няколко часа, което води до увреждане на очите, белите дробове и централната нервна система. Поддръжка на КОС. Необходимо е да се коригира само патологичната ацидоза (рН по-малко от 7,25 и BE повече от минус 10 mmol / l) и само след установяване на механична вентилация или IVL. Количеството натриев бикарбонат в mmol (т.е. количеството ml от 8,4% разтвор) χ (стойност BE - 5) χ телесно тегло (kg) χ 0,4. Необходимото количество натриев бикарбонат се прилага капково под формата на 4,2% разтвор за 1 час.Важно е да се помни, че алкалозата провокира вътречерепни кръвоизливи, спиране на дишането при недоносени деца
Борба с анемия и хиповолемия, хипотония. В острата фаза на заболяването е необходимо да се поддържа хематокрит най-малко 0,4, тъй като анемията е фактор, който поддържа тъканна хипоксия, което означава дефицит на сърфактант, тъканен оток и др. Преливане на червени кръвни клетки. При тежка анемия и тежко протичане SDR е по-показан за директно кръвопреливане, тъй като в свежите еритроцити има повече 2,3-дифосфоглицерат, което намалява тъканната хипоксия. В допълнение, прясната кръв е по-показана за коригиране на нарушенията на хемостазата при декомпенсиран DIC, а също така е имунопротектор при инфекции. В същото време заместващите кръвопреливания за SDR вече са изоставени, тъй като това допринася за увеличаване на честотата и тежестта на ретинопатията на недоносените. През 2-та седмица от живота и по-късно индикацията за трансфузия на еритроцитна маса е хематокрит под 0,3. Понастоящем индикациите за кръвопреливане са рязко ограничени поради риска от инфекции (не само хепатит В и С, ХИВ, но и цитомегаловирус, тъй като 6-12% от донорите имат цитомегаловирус в кръвта), изосенсибилизация.
хиповолемия (положителен симптом) бяло петно- 3 s или повече), особено при деца с анемия, най-препоръчително е да се коригира с кръвопреливане изотоничен разтворнатриев хлорид, но може да се прелее и прясно замразена плазма или 10% разтвор на албумин. Количеството на трансфузирания медикамент е 10-15 ml/kg телесно тегло. Изсипете бавно струя (1-2 ml/kg/min).
Ако след корекция на анемия и хиповолемия, артериална кръвно наляганениско (максимално налягане под 45 torr, т.е. mm Hg), след това започва прилагането на допамин с микроструя (начална доза 5 μg / kg / min, с по-нататъшно увеличение според показанията до 10-15-20 μg / kg / min) (за подробности вижте глава XIX).
Заместване на дефицита на сърфактант. От първите работи на T.Fujiwara и др. през 1980 г. относно заместването на дефицита на сърфактант при много преждевременно родени бебета, положителен ефекттакава терапия.
Понастоящем се използват както естествени повърхностно активни вещества, получени от белите дробове на бикове (домашно BL-повърхностно активно вещество, разработено в Санкт Петербург от проф. O.A. Rozenberg, чуждестранни - Survanta, Alveofact, Infrasurf), прасета (Curosurf), така и синтетични (ALEK, Exosurf, Surfaxin, "Sfenticute"). Най-ефективни са естествените повърхностноактивни вещества, съдържащи, в допълнение към фосфолипидите, повърхностно активен протеин В ( Таблици 12.3, 12.4). Трябва да се подчертае, че лекарството Surfaxin, разработено в САЩ от лабораторията Discovery, съдържа комбинация от фосфолипиди (дипалмитилфосфатидилхолин - DPPC, палмитил фосфатидилглицерол - POPG, палмитинова киселина - PA) и рекомбинантен, синтетичен пептид, състоящ се от аминокиселинни фрагменти на лизин (K) и лев cine (L) в последователността KLLLLKLLLLKLLLLKLLLL (KC). Този рекомбинантен пептид има свойствата на повърхностно активен протеин В. Ентикутният препарат съдържа рекомбинантен повърхностноактивен протеин С.
Многобройни рандомизирани проучвания показват, че екзогенното повърхностно активно вещество допринася за:
повишаване на белодробния комплайънс и функционалния остатъчен капацитет, като по този начин се намалява работата на дихателните мускули;
намаляване по време на механична вентилация Fio2 (делът на кислорода във вдишания въздух), PIP (пиково инспираторно налягане - пиково инспираторно налягане), MAP (средно налягане в дихателните пътища - средно налягане в дихателните пътища), PEEP (положително налягане в края на издишването - положително налягане в края на издишването), подобряване на индекса на оксигенация на алвеолокапилярния кислороден градиент;
намаляване на смъртността при SDR (превантивната му употреба е особено ефективна при деца с гестационен период под 30 седмици, когато се комбинира
с антенатална употреба на кортикостероиди), синдром на аспирация на мекониум, SDR за възрастни;
съкращаване на времето на механична вентилация и намаляване на честотата на страничните ефекти на механичната вентилация (синдроми на изтичане на въздух и др.);
намаляване на честотата на BDD, IVH, ретинопатия;
Не инхибира синтеза на ендогенно сърфактант.
Трябва да се отбележи, че естествените повърхностноактивни вещества са по-ефективни от синтетичните, но те могат да бъдат антигенни; в допълнение, те са по-малко стабилни по състав, изискват по-строги условия на съхранение и имат по-ограничен срок на годност и могат потенциално да съдържат прионови агенти.
Имаме опит в използването на препарати Curosurf и Exosurf в Детска болница № 1 (Санкт Петербург). И двете лекарства имаха горните ефекти. Въпреки това, след въвеждането на Curosurf Fio2, PIP, MAP може да бъде намалено с около 30% още след 3-3,5 часа, докато след въвеждането на Exosurf - само след 6 часа. След въвеждането на Curosurf се наблюдава намаляване на белодробното съдово съпротивление, намаляване на дяснокамерното следнатоварване и увеличаване на лявокамерното преднатоварване. В същото време се наблюдава намаляване на разликата в алвеоларно-капилярното напрежение на кислорода, подобряване на индекса на оксигенация. За съжаление, рандомизиран сравнителни изследванияНе се използва местно BL-повърхностно активно вещество и ние нямаме опит с употребата му, но нашите колеги знаят, че то е много по-малко ефективно при тежки SDR от Curosurf.
Според проф. J. Gadzinowski (2003), в многоцентрови европейски сравнителни рандомизирани проучвания (в тях участват и неонатолози от Санкт Петербург, но изследването е двойно-сляпо и ние все още не знаем нашите резултати) превантивна употреба Surfaxin, Exosurf и S urva n t a при деца с тегло при раждане под 1 2 5 0 g, първото лекарство е по-ефективно, което според него може да бъде свързано с по-ранно подобрение на оксигенацията (вече след няколко минути, докато след употребата на други повърхностноактивни препарати това се отбелязва след 3-6 часа), по-дълъг ефект поради резистентността на синтетичното лекарство Surfaxin към инхибиране от серумни компоненти и оксиданти.
Страничните ефекти и усложненията на терапията със сърфактант са до голяма степен ятрогенни. При липса на адекватно наблюдение и промяна на параметрите на механичната вентилация могат да се развият баротравма и волютравма на белите дробове, синдроми на изтичане на въздух, белодробен кръвоизлив, хипероксия и следователно ретинопатия на недоносените, белодробен кръвоизлив, IVH. Може би единственото нещо, което е отбелязано от много изследователи в почти всички центрове, е увеличаването на честотата на функциониращ дуктус артериозус и апнея след употребата на екзогенен сърфактант. Честотата на функциониращ дуктус артериозус при деца, лекувани с Curosurf при нашите наблюдения е 7,6%.
Най-ефективното профилактично приложение на сърфактант при раждането или през първите 15-30 минути от живота. Дозата, предназначена за приложение, се загрява предварително (в рамките на 1 час до 37 ° C) и се излива през ендотрахеалната тръба в трахеята на удари за 4 дози за 10-15 минути или микропоток с помощта на инфузер за 20-30 минути, като следващата инфузия променя позицията на детето. Ако е необходимо, инфузията се повтаря след 12 ч. Не са отбелязани тежки странични ефекти. Счита се за изключително важно спирането на IVL възможно най-скоро и прехвърлянето на детето в n C R A R. В резултат на такава, като цяло, превантивна терапия, честотата и тежестта на SDR са значително намалени. Сърфактантното лечение на вече развита SDR или пневмония е много по-малко ефективно от профилактичното лечение. В същото време е изключително важно да се стабилизира състоянието на детето и, ако е възможно, да се коригират основните параметри на жизнената активност преди въвеждането на какъвто и да е препарат за сърфактант. След прилагане на лекарството е необходимо внимателно наблюдение, включително: параметри на механична вентилация, Fio2, визуален анализ на участието на спомагателните мускули в акта на дишане, перкутанен анализ на сатурация (Brog), сърдечна честота, кръвно налягане, CBS, рентгенография на гръдния кош преди и 3-6 часа след приложението. Отново е необходимо гъвкаво да се променят параметрите на IV L и F 1 0 2, като се избягват баротравма и волютравма на белите дробове, хипероксия. S p o 2 трябва да се поддържа в диапазона 9 0 - 9 4%, което предотвратява хипероксията. Препоръчително е съдържанието на трахеята да не се аспирира в рамките на 3-6 часа след прилагане на сърфактанта.
Затварянето на открития дуктус артериозус се обмисля от медицинска гледна точка при деца със SDR според ехокардиографията и доплеровите изследвания на 4-5-ия ден от живота. Тактиката за използване на индометацин или бруфен е описана в глава XIX.
Антибиотична терапия. При диагностициране на SDR и дори при съмнение за него, ампицилин се предписва в комбинация с един от аминогликозидите (обикновено гентамицин). Това се дължи, от една страна, на факта, че стрептококова B-инфекция се проявява чрез увреждане на белите дробове, което не се различава (дори често радиографски) от CDR, от друга страна, чрез прехвърляне на пациента на механична вентилация, което често е придружено от инфекция. Въпреки това, 3 дни след получаване на резултатите от хемокултури и клинични кръвни изследвания в динамика, е необходимо да се реши въпросът за наличието на инфекция и, ако не, антибиотиците трябва да бъдат прекратени.
Витаминна терапия. Не е потвърдено мнението, че профилактичният прием на витамин Е намалява заболеваемостта от бронхопулмонална дисплазия. И все пак е показано назначаването на витамин Е интрамускулно при 10 mg / kg дневно, като се използва кислородно-въздушна смес с Fio2 повече от 0,4, тъй като това намалява честотата и тежестта на ретинопатията на недоносените. Курс 7-10 инжекции. Витамин А, приложен ентерално по 2000 IU през ден, трябва да се дава на всички деца преди началото на ентералното хранене, тъй като това намалява честотата на некротизиращ ентероколит и бронхопулмонална дисплазия.
Диуретик. Въпреки че назначаването на фуроземид повишава диурезата и подобрява състоянието на белите дробове, то увеличава честотата на открит дуктус артериозус, калцификации в бъбреците, диселектролитемия и следователно не може да се счита за рутинна. Фуроземид се предписва само при белодробен оток, едематозен синдром.
Глюкокортикоиди. От планираното приложение на глюкокортикоиди и техните производни (по-често се използва дексаметазон като с максимален тъканен ефект) за стимулиране на синтеза на сърфактант, всички деца със SDR вече са изоставени. Това се дължи на въвеждането в терапията и вторична профилактика SDR на повърхностноактивни препарати, подобряване на методите за респираторна поддръжка, механична вентилация, както и с странични ефектиглюкокортикоидна терапия, основните от които, дори и с кратък курс, са: хипергликемия, артериална хипертония, стомашно-чревно кървене, некротизиращи ентеро и други инфекции. Глюкокортикоидите се предписват на пациенти със SDR, които според клиничните и лабораторни данни имат надбъбречна недостатъчност.
Много неонатолози в чужбина са стигнали до извода, че назначаването на дексаметазон при постинтубационен едематозен ларингит или трахеит с тежка стеноза има положителен ефект. Формулярът за новородени (BMJ, 2000) препоръчва даването на 4 дози от 200 mcg през 8 часа, като първата доза се дава 4 часа преди екстубация при деца с оток или нараняване на ларинкса.
Тироидните хормони за лечение на деца със SDR започнаха да се използват активно в някои неонатологични клиники, въз основа на честото откриване на ниско нивохормони на щитовидната жлеза при много недоносени бебета с BGM. Въпреки това, няма общоприети данни, базирани на резултатите от рандомизирани проучвания, които безспорно да доказват ползата от такова предписание, поради което това е изследователска терапия. По-оправдано интраамниотично приложение на L-тироксин при високорискови бременни жени преждевременно раждане, но и тук няма общоприети схеми и общопризнати резултати.
Рибоксин и инозитол, прилагани интрагастрално на всеки 6 часа в доза от 40 mg/kg от края на първия ден до 10-ия ден от живота, според M. Hallman et al. (1986-1989), намаляват тежестта на SDR, увеличават синтеза на сърфактант, намаляват честотата на бронхопулмонална дисплазия. Въпреки това, този метод, както и планираното приложение на плазминоген при недоносени бебета, е метод за изследване за лечение на деца със SDR.
Прогнозата на SDR зависи от неговата тежест и наличието на съпътстваща патология, усложнения на терапията. Смъртността при деца с тегло над 1000 g при рационално лечение не надвишава 5-10%. През първата година от живота децата, прекарали SDR, често страдат от пневмония, а честотата на сепсиса при тях също се увеличава. Енцефалопатията (постипоксична) е едно от характерните съпътстващи състояния (или усложнения) при деца със SDR, като при някои деца те се откриват ясно само в предучилищна и училищна възрастпод формата на минимална мозъчна дисфункция, поведенчески разстройства, затруднения в обучението. В тази връзка в системата за рехабилитационни мерки за деца със SDR е необходимо да се предвиди ранно предписване (от 3-4-ия ден) на лекарства, които подобряват мозъчния трофизъм (глиатилин 10-15 mg / kg / ден, ноотропил 50 mg / kg интравенозно или перорално 2 - 3 пъти на ден), наблюдение на невропатолог.
Предотвратяване. Антенатална хормонална терапия. Въвеждане интрамускулно или даване вътре в майката със заплаха от преждевременно раждане на период от 2 4 - 3 4 седмици
бетаметазон в доза от 12 mg (2 пъти с интервал от 24 часа) или
дексаметазон 6 mg 4 пъти с интервал от 12 часа.
Оптимално е периодът между края на хормоналната терапия и раждането да бъде повече от 24 часа.Ефектът от такова назначение продължава 10 дни и ако не настъпи раждане, тогава е показано еднократно приложение на дексаметазон в доза от 6-12 mg.
Антенаталният курс на кортикостероиди не само намалява честотата и тежестта на CDR, но също така намалява риска от развитие на открит дуктус артериозус, интравентрикуларен кръвоизлив, перивентрикуларна левкомалация, некротизиращ ентероколит и продължителността и разходите за кърмене на много недоносено новородено.
Дългосрочни последващи проучвания показват, че протичането на антенаталната хормонална терапияне повишава честотата инфекциозни заболяванияпри новородени, не засяга последващото физическо и психомоторно развитие (включително скоростта на растеж на обиколката на главата), както и растежа на белите дробове, не причинява надбъбречна дисфункция, зрение или слух.
В момента най-обещаващото е развитието на практическо приложениесхеми за въвеждане на трийодтиронин в амниотичната течност и оптимално - тиротропин-освобождаващ хормон (TRH). TRH препарати както в експеримента, така и при ограничени клинични изпитваниясе оказаха много ефективни в превенцията на SDR. Въпреки това две големи многоцентрови проучвания, проведени в САЩ, не показват ползата от комбинирането превантивна целбременни жени с кортикостероиди в комбинация с тиреоидни хормони и/или TRH (Ballard R.A. et al., 1998).
Полезно е да се забави раждането, тъй като ако безводната празнина продължава повече от 2 дни, SDR обикновено не се развива, въпреки че сепсисът и, вероятно, вътречерепните кръвоизливи са по-чести при такива деца.
Заместителната терапия с екзогенни повърхностноактивни вещества през първите 30 минути от живота (виж по-горе) е високоефективен метод за превенция на тежка SDR.
Термините "респираторен дистрес синдром" (RDS), "respiratory distress syndrome" (RDS) и "hyaline membrane disease" (HMD) са синоними в чуждестранната литература. Например в най-популярните наръчници по неонатология в Съединените щати термините се използват за описание на едно и също състояние (заболяване): в 7-мо издание на Avery's Diseases of the Newborn (1998) - хиалинна мембранна болест, и в 7-мо издание на Neonatal-Perinatal Medicine (Ed. AA.Fanaroff и R.J.Martin, 2002) - респираторен дистрес синдром Предпочитаме понятието "респираторен дистрес синдром".
Честотата на развитие на SDR зависи средно от степента на недоносеност на новороденото и е средно 82-88%, когато детето се роди на гестационна възраст под 27 седмици, 78-80% - на период от 27-28 седмици, 70% - на период от 29-30 седмици, 50-55% - на период от 31-32 седмици, 20-22% - на период от 3 3-34 седмици, 5-10% - за период от 35-36 седмици. и по-малко от 1-2% - с гестационна възраст 37 седмици. и още.
BGM (SDR тип I, RDS) и неговите последствия са причина за 30-50% от неонаталните смъртни случаи.
Етиология. Причинни фактори за развитието на BGM са:
дефицит в образуването и освобождаването на повърхностно активно вещество;
дефект в качеството на повърхностно активното вещество;
инхибиране и разрушаване на повърхностно активното вещество; "
незрялост на структурата на белодробната тъкан.
Всички тези процеси се улесняват от:
недоносеност;
вътрематочни инфекции;
перинатална хипоксия, асфиксия и последваща исхемия на белия дроб
и ацидоза;
диабет на майката;
остра загуба на кръв по време на раждане.
В допълнение, честотата на BGM се увеличава при деца с:
интравентрикуларни кръвоизливи и като цяло перивентрикуларни лезии, възникнали преди и по време на раждането;
преходна хипофункция на щитовидната жлеза и надбъбречните жлези;
хиповолемия;
хипероксия;
охлаждане (както при общо охлаждане, така и при дишане с незагрята кислородно-въздушна смес);
роден с помощта цезарово сечение;
във втория близнак на близнаците.
Острият перинатален стрес, по-специално удължаването на времето за раждане, може да намали честотата и/или тежестта на BGM. Така става ясно защо планираното цезарово сечение е рисков фактор за развитие на БГМ, а увеличаването на продължителността на безводния интервал намалява риска от БГМ.
Патогенеза. Водещото звено в патогенезата - SDRI тип (BGM) е количествен дефицит и качествен дефект на сърфактанта.
Повърхностно активното вещество е повърхностно активно вещество, синтезирано от алвеолоцити тип II (покриващи около 3% от повърхността на алвеолите) и безкосмени бронхиоларни клетки (клетки на Клара). Състои се от 90% липиди, от които 80% са фосфолипиди: фосфатидилхолин (лецитин) - 70% (45-50% - окислени, наситени и 20-25% - ненаситени), фосфатидилглицерол - 6% и други фосфолипиди - 6%; 8% - неутрални липиди. 8-10% от сухото тегло на повърхностно активното вещество са протеини: протеини A, B, C, D.
Повърхностно активното вещество има следните основни функции:
предотвратява колапса на алвеолите при издишване;
предпазва алвеоларния епител от увреждане и подпомага мукоцилиарния клирънс;
има бактерицидно действие срещу грам-положителни микроби и стимулира макрофагалната реакция в белите дробове;
участва в регулирането на микроциркулацията в белите дробове и пропускливостта на стените на алвеолите, предотвратява развитието на белодробен оток.
Важна роля в изпълнението на тези функции на сърфактанта играят протеини, от които A (SpA) и D (SpD) - хидрофилни - участват в защитните механизми на тялото на детето (не се съдържат в сърфактантите на белите дробове на животните), и протеини B (SpB) и C (SpC) - хидрофобни - намаляват повърхностното напрежение на алвеолите чрез стимулиране на повърхностната абсорбция на фосфолипиди. на въздушно-кръвната бариера и допринасят за равномерното разпределение на повърхностноактивните вещества.актант върху повърхността на алвеолите (съдържа се в повърхностноактивните вещества, получени от белите дробове на животни). Гените, които определят синтеза на сърфактантните протеини SpA и SpD, са разположени на 10-та хромозома, а SpB - на 2-ра и SpC - на 8-ма. SpA се появява в човешката амниотична течност на 19-та гестационна седмица, а SpB - на 31-ва; в бъдеще нивото им непрекъснато се повишава.
В същото време, според съвременните концепции, най-важният сред тези протеини е повърхностноактивният протеин В, тъй като неговият наследствен или вроден дефицит е фатален за хората (de Mello D.E. et al., 1994; Nogee L.M., 1995; Chetcuti PAJ., Ball R.J., 1995). Дефицитът на SpB се унаследява по автозомно-рецесивен начин и се проявява при доносени бебета като типичен SDR на недоносени деца с продължителна нужда от механична вентилация. Заместителната терапия с животински сърфактанти има само преходен ефект. Възможно лечение е трансплантация на бял дроб.
Синтезът на сърфактант протеини се стимулира от глюкокортикоиди, тиреоидни хормони, естрогени, адреналин и норепинефрин и се инхибира от инсулин.
Сърфактантът започва да се произвежда в плода от 20-24-та седмица на вътрематочно развитие от алвеоларни клетки тип II. Той се натрупва в тях под формата на осмиофилни гранули, мигриращи към повърхността на алвеолите, където образува тънък филм в хипофазата. Особено интензивно изхвърляне на повърхностно активно вещество възниква по време на раждането, което допринася за процеса на първично разширяване на белите дробове. Полуживотът на повърхностно активното вещество е 10-20 часа.
Има два начина за синтезиране на основния фосфолипиден компонент, фосфатидилхолин (лецитин): 1) метилиране на фосфатидилетаноламин (цефалин) с помощта на метилтрансфераза (източник на метионин метиловата група); 2) синтез от цитидин дифосфат холин в присъствието на фосфохолин трансфераза, която реагира с диглицерид. Установено е, че до 33-35-та седмица от вътрематочното развитие синтезът на сърфактант се осъществява главно чрез метилиране на етаноламин, а по-късно от фосфатидилхолин трансфераза.
Първият път на синтез на повърхностноактивно вещество лесно се изчерпва под въздействието на хипоксия, ацидоза и хипотермия. Следователно се смята, че сърфактантната система напълно узрява до 35-36-та седмица от вътрематочното развитие. При дете, родено преди това време, наличните резерви от сърфактант осигуряват началото на дишането и образуването на функционален остатъчен капацитет на белите дробове, но поради изоставането на синтеза на сърфактант от скоростта на неговото разпадане, има липса на това вещество, което води до колапс на алвеолите при издишване, рязко увеличаване на работата на дихателните мускули, тъй като поради нестабилния функционален остатъчен капацитет на белите дробове, тяхното повишено "сти ffness", усилията, необходими за всяко следващо надуване на белите дробове, трябва да бъдат същите като при първото вдишване. Освен това, поради колапса на алвеолите, не се осъществява непрекъснат обмен на газ в белите дробове, което провокира развитието на хипоксемия и хиперкапния.
Нека изясним, че заедно с фосфатидилхолин за нормално функциониранеповърхностноактивно вещество, другите му компоненти също са важни, особено фосфатидилглицерол и фосфатидилинозитол. Например в проби от белите дробове на деца, починали от SDR, родени от майки със захарен диабет, количеството на лецитин и сфингомиелин и съотношението между тях са нормални, но има дефицит на фосфатидилглицерин. От друга страна, много недоносено бебе с ниско ниво на лецитин в амниотичната течност, но нормално съдържание на фосфатидилглицерол не развива SDR. При SDR, в допълнение към изчезването на фосфатидилглицерол от повърхностно активното вещество, количеството на наситения фосфатидилхолин се намалява и съдържанието на фосфатидилсерин и сфингомиелин се повишава.
Намаляване на синтеза на повърхностно активно вещество:
„студено нараняване, включително използване на незагрята кислородно-въздушна смес по време на механична вентилация;
патологична ацидоза;
хиповолемия;
полицитемия;
хипоксемия;
хипероксия;
баротравма и волютравма на белите дробове;
инфекции, както пред-, интра-, постнатални. Тези фактори увреждат алвеолите, активират синтеза на провъзпалителни цитокини, системата на комплемента и хемокини (анафилотоксини, брадикинин и др.), което води до повишен ендотелен пермеабилитет и алвеоларен оток.
Инактивирането на повърхностно активното вещество, неговото разрушаване се улеснява от:
инфекции (особено грам-отрицателни, микоплазмени);
плазмени протеини, които "изтекоха" в алвеолите;
патологична ацидоза;
излишък от оксиданти, пероксидни съединения, провъзпалителни цитокини.
Важен предразполагащ фактор за развитието на SDR е незрелостта на белите дробове при фетуси, които са се развили при неблагоприятни условия. Хистологично, незрелостта на белите дробове се проявява чрез широки слоеве интерстициална тъкан в ацинуса, намаляване на броя на алвеоларните канали и алвеоли, непълна диференциация на ацините, хлабаво прилягане на капилярите към алвеолите. В белите дробове на деца, починали от SDR, може да има едновременно ателектази, хиалинни мембрани и едематозно-хеморагични промени в различни области.
Хиалиновите мембрани се състоят от фибринова матрица и клетъчен детрит, краен продукт от фрагменти от кръвни клетки и увреден епител. Периодът на подобрение на SDR се характеризира с регенерация на стените на алвеолите, алвеолоцитите, включително пневмоцитите тип II, и в резултат на това увеличаване на синтеза на повърхностно активно вещество. Хиалиновите мембрани сами по себе си не предизвикват развитие на ателектаза. При някои деца, както клинично, така и патоморфологично (в случай на смърт), проявите на заболяването на хиалиновите мембрани или първичната ателектаза и едематозно-хеморагичният синдром рязко доминират. Следователно, вероятно, терминът „синдром на респираторен дистрес“ сега е по-популярен в чужбина, отколкото „болест на хиалиновата мембрана“.
Провокиращите фактори за проявата на дефицит на сърфактант под формата на BGM са:
аспирация на амниотична течност с мекониум (деца от майки, страдащи от продължителна - повече от 4 седмици - прееклампсия);
едематозно-хеморагичен синдром на белите дробове (фактори на неговия повишен риск - перинатална хипоксия, особено със смесен генезис, сърдечна недостатъчност, дефицит на прокоагуланти, чийто синтез зависи от витамин К, фибриноген, количествен и качествен дефект в тромбоцитната хемостазна връзка);
дефицит на плазминоген и следователно ниска активност на фибринолизата;
недостатъчна активност на антипротеазите (oc-антитрипсин и ag-макроглобулин, антитромбин III и др.);
декомпенсиран DIC.
Пациентите със SDR развиват:
намалено съответствие, белодробно съответствие и функционален остатъчен капацитет;
намаляване на минутната белодробна вентилация и използването (транспортирането) на кислород в белите дробове;
повишена работа на дишането;
тежка хипоксемия и хипоксия; хиперкапния;
смесена (респираторно-метаболитна) ацидоза;
намален синтез на фосфолипиди и повърхностноактивни протеини;
произнесе белодробна хипертонияи системна хипотония;
намаляване на ефективния белодробен кръвен поток;
хиповолемия, нарушения на микроциркулацията, периферни отоци, т.е. шокови явления;
компенсирана или декомпенсирана дисеминирана вътресъдова коагулация (компенсиран или декомпенсиран DIC);
метаболитни нарушения (хипопротеинемия, склонност към хипогликемия, хипокалцемия, но хиперкалиемия и др.);
мускулна хипотония;
нарушения на функционалното състояние на мозъка, дължащи се предимно на HIE;
миокардна дисфункция със сърдечна недостатъчност (главно от десен вентрикуларен тип с дясно-ляв шънт);
температурна нестабилност с тенденция към охлаждане, дължаща се по-специално на тяхната преходна хипотироксинемия;
лоша бъбречна и периферна перфузия с олигурия, оток;
функционална чревна непроходимост (схема 12.1).
клинична картина. Първият признак за развитие на тип I SDR (BGM)
е недостиг на въздух (повече от 60 вдишвания за 1 минута), който при заболяване на хиалиновата мембрана и едематозно-хеморагичен синдром обикновено се проявява в рамките на първия час след раждането, а при първична ателектаза - в първите минути от живота. Появата на задух 3 часа след раждането и по-късно не е типична за BGM. Цветът на кожата на детето с появата на задух е нормален. Причината за появата на задух при SDR на фона на розовата кожа е по-големият афинитет на феталния хемоглобин към кислорода. Хипоксемията се счита за намаляване на Pao2 в кръвта до 8,67 kPa (65 Torr или mm Hg). Цианозата при новородени се появява при ниво на Pao2 в кръвта от 4,27-5,87 kPa (32-44 mm Hg), а при възрастни - 5,6-6,93 kPa (42-52 mm Hg). Следователно, при лека хипоксемия, цветът на кожата на новороденото може да бъде розов, но поради дразнене на съдовите хеморецептори, детето вече развива задух.
Следващият симптом е експираторни шумове, наречени "сумтене при издишване". Експираторните шумове се дължат на факта, че в началните етапи на SDR се развива спазъм на глотиса като компенсаторен механизъм при издишване (вдишване), което допринася за увеличаване на функционалния остатъчен капацитет на белите дробове и предотвратява колапса на алвеолите. При рязко отпускане на епиглотиса, преминаването на въздух под високо налягане в дихателните пътища под гласните струни предизвиква експираторни шумове.
Прибиране на гръдния кош при вдишване (прибиране мечовиден процесгръдна кост, епигастрална област, междуребрие, супраклавикуларни ямки) е третият симптом на SDR по време на възникване.
(л
аз
аз и
Схема 12.1. Патогенезата на синдрома на респираторни нарушения: IUI - вътрематочни инфекции; DIC - дисеминирана вътресъдова коагулация. Едновременно или малко по-късно се появява напрежение на крилата на носа, пристъпи на апнея, цианоза (периорална, а по-късно - акроцианоза или генерализирана) на фона на бледност на кожата, подуване на бузите ("дишане на тромпетист"), твърд сърдечен ритъм, парадоксално дишане (отдръпване на предното коремна стенапри вдишване), пяна от устата (при половината от пациентите), подуване на ръцете и краката. Характерен е плосък гръден кош (под формата на "кибритена кутия").
Аускултативно в първите часове от живота се чува рязко отслабено дишане над белите дробове, след това на фона на механичната вентилация - обикновени, нормални дихателни шумове и едва по-късно се появяват силни сухи хрипове при вдишване и издишване, крепитиращи и фино мехурчета.
Общите симптоми са типични:
температурна нестабилност с тенденция към хипотермия;
летаргия, слаби движения, признаци на депресия на ЦНС до адинамия, летаргия и дори кома (имайте предвид възможността за хипогликемия, хиперамонемия!);
периферен оток на подкожната тъкан;
хипорефлексия и мускулна хипотония;
хиповолемия и артериална хипотония;
олигурия;
регургитация, подуване на корема и дори признаци на чревна обструкция;
голяма загуба на първоначално телесно тегло;
долните крайници често са в "поза на жаба" (както при нараняване на гръбначния стълб на лумбално ниво).
Често болно дете се диагностицира с интравентрикуларен кръвоизлив (IVH), обикновено I-II степен, или ултразвукови признаци на перивентрикуларна левкомалация (PVL). При конкретно дете понякога е трудно да се реши какво е първично - увреждане на белите дробове (SDR) или мозъка (IVH, PVL). С прогресирането на SDR, въпреки интензивната терапия, се развиват признаци на шок и декомпенсиран DIC, включително кървене от местата на инжектиране, белодробно кървене и др.
Силвърман предложи скала за оценка на тежестта на респираторните нарушения при новородени (Таблица 12.1).
Всеки симптом в колона "Стадий I" се оценява с 1 точка, в колона "Стадий II" - 2 точки. Характеристика на скалата е, че тя не взема предвид такива признаци на дихателна недостатъчност като задух и цианоза, тъй като появата на тези симптоми при новородено може да се дължи и на небелодробни причини за респираторни нарушения. Според Силвърман, с общ резултат от 10 точки, новороденото има изключително тежка SDR, 6-9 точки - тежка, 5 точки - умерено, под 5 - начало на SDR.
Аускултаторните и перкуторните данни в началния период на SDR не са показателни, но по-късно на фона на отслабено дишане се появяват разпръснати крепитиращи и недоловими фини мехурчета.
Сърдечно-съдовите нарушения са много чести при SDR. Първо се развива тахикардия, заглушени сърдечни звуци. По-нататъшните промени се определят от тежестта на белодробната хипертония и хемореологичните нарушения. Скала на Силвърман Етап 0 Етап I Етап II Горна част of the chest (when the child is on the back) and the anterior abdominal wall are synchronously involved in the act of breathing Lack of synchrony or minimal descent of the upper part of the chest when lifting the anterior abdominal wall on inspiration Noticeable retraction of the upper part of the chest during lifting of the anterior abdominal wall on inspiration Absence of retraction of the intercostal spaces on inspiration вдишване Бял дроботдръпване на междуребрените пространства при вдишване Забележимо отдръпване на междуребрените пространства при вдишване Няма прибиране на мечовидния израстък на гръдната кост при вдишване Леко прибиране на мечовидния израстък на гръдната кост при вдишване Забелязано отдръпване на мечовидния израстък на гръдната кост при вдишване Без движение на брадичката по време на вдишване Падане на брадичката при вдишване, затворена уста Dr оп на брадичката при вдъхновение, устата е отворена Липса на експираторни шумове Експираторни шумове („експираторно сумтене“) се чуват при аускултация на гръдния кош Експираторни шумове („експираторно сумтене“) се чуват, когато фонендоскопът се доближи до устата или дори без фонендоскоп Белодробната хипертония води до запазване на феталните шунти и шунтиране на кръвта отдясно наляво ductus arteriosusи овална дупка.
Поради повишена съдова пропускливост, хиповолемия, съсирване на кръвта и повишаване на хематокрита, концентрацията на хемоглобина се отбелязват. С изчерпването на компенсаторните механизми кръвното налягане намалява и се развиват Pi III стадии на шок.
Друго усложнение на SDR може да бъде шънт отляво надясно (през отворен ductus arteriosus), който е резултат от твърде бързо разширяване на белите дробове след раждане или механична вентилация. Обикновено тези деца имат признаци на хипоксия и задръстванияв белите дробове в края на първата - началото на втората седмица от живота те се увеличават, пулсовото налягане се повишава, систоло-диастоличен шум се чува на съдовете.
Диференциалната диагноза на синдрома на персистираща фетална циркулация и отворен дуктус артериозус е представена в таблица 12.2.
Наслояването на вторична инфекция е сериозна опасност за децата със SDR, пневмония се развива при 40-50% от пациентите.
SDR поток. При SDR с умерена тежест и неговия неусложнен курс, максималната тежест на състоянието се наблюдава на 1-вия ден от живота, след което постепенно намалява интензивността на ретракция на гръдната кост, ретракция на междуребрените пространства, както и пристъпи на апнея, подуване и олигурия. Диурезата, мускулният тонус и спонтанната двигателна активност се повишават, неврологичният статус се подобрява, необходимостта от кислород и механична вентилация намалява. Ако заболяването не е усложнено от интравентрикуларен кръвоизлив, перивентрикуларна левкомалация, интерстициален емфизем и други видове "изтичане на въздух", персистиращ белодробен
Таблица 12.2
Диференциални диагностични признаци на вторични синдроми, причинени от функциониращ дуктус артериозус Симптом Синдром на персистираща фетална циркулация (дясно-ляв шунт) Синдром на отворен дуктус артериозус (ляв-десен шунт) Асфиксия и аспирация по време на раждането Типичен Нетипичен ALV през първите часове от живота Може да бъде Типичен белодробна ателектаза Типичен Редък Повтаряща се апнея в края на първия - в началото на раждането втората седмица от живота Може да е типична Генерализирана цианоза В първите дни от живота с черешов оттенък В края на първата - през втората седмица от живота, с мраморен оттенък Диференцирана цианоза (главно на краката) Типична Не е характерна Отговор на дишане със 100% кислород Подобрение, като правило, не се наблюдава, Pao2 остава под 9,33 kPa Подобрение, Pao2 става по-висока от 10,67 kPa kPa и pH - 0,02 повече, отколкото в кръвта на краката Обикновено Не е типично Изобилие от крепиращи хрипове при вдъхновение, розова пяна Не е типично, но може да бъде в първите дни от живота Обикновено в края на първата седмица от живота и по-стари Пулс Слаб и малък Голям и бърз, скачащ Кръвно налягане Повишено или намалено Гергарт Размер на черния дроб Обикновено не рязко увеличен Рязко увеличена рентгенова снимка на гръдните органи Ателектаза, пневмония, нодозо-ретикуларна мрежа, сърцето е увеличено предимно вдясно, контурите му са неравномерни, обедняване на белодробната циркулация. В III стадий - белодробен оток.Първоначално се увеличава кръвоснабдяването на белите дробове, подуване на централните, а след това и периферните полета на белите дробове. Сърцето е разширено предимно наляво и нагоре Шум в областта на сърцето По-често липсва или систоличен във второто междуребрие вляво от гръдната кост Електрокардиографските признаци на претоварване на дясното сърце са типични Типичен систолно-диастоличен шум, систоличен шум може или не може да присъства
На ЕКГ първо претоварване на лявото сърце, после на дясното
Таблица 12.2 (продължение)
Признак Синдром на персистираща фетална циркулация (шунт отдясно наляво) Открит дуктус артериозус (шунт отляво надясно) Сърдечен ултразвук (индекс: ляво ушна мида - аорта) По-малко от 1,0 Повече от 1,3 Клиничен ефект от лечението Сърдечни гликозиди Може да е хемодинамично влошаване Положителен Толазолин (във вената на главата) Подобрение Влошаване на Indomet qin Без промяна Подобрение Дроперидол Известно подобрение Увеличаване на шума
хипертония, след това до средата на първата седмица от живота детето първо се прехвърля на IVL (назални канюли), след което диша самостоятелно, храни се ентерално
Но.
При деца с тегло при раждане под 1500 g SDR, като правило, се проявява със следните усложнения (едно или повече), след което механичната вентилация се забавя, понякога за няколко седмици. Типични усложнения при деца със СДР. Системни:
декомпенсирана тежка ацидоза, шок със смесен произход, декомпенсиран DIC;
интравентрикуларни кръвоизливи;
цепнатина на артериалния канал;
синдром на персистираща фетална циркулация;
синдром на отворен канал;
преходна хиперамонемия;
хипогликемия;
некротизиращ ентероколит;
ретинопатия на недоносените;
бъбречна недостатъчност. Местни, белодробни:
синдроми на изтичане на въздух;
белодробен оток;
пневмония;
кръвоизливи в белите дробове;
бронхопулмонална дисплазия;
нарушения, свързани с неправилно положение или запушване на дихателните тръби, лезии на ларинкса и трахеята (стесняване на субглотисното пространство, оток, стеноза, ерозия, гранулом).
Управлението на пациенти с BGM изисква от неонатолог да съчетава задълбочени познания по възрастова физиология, алгоритми за интензивно лечение и изкуството да анализира непрекъснато динамиката на клиничните симптоми, емпатия, съпричастност към детето. Необходимо е постоянно да се наблюдават основните параметри на жизнената активност и като обратна връзка бързо да се коригират както параметрите на механичната вентилация, така и на инфузията, лекарствената терапия. Изглежда, че при много деца с ХМ тежестта на състоянието след първия ден от живота се дължи не толкова на първоначалната тежест на белодробното заболяване, а на тяхното увреждане (с вторичен дефицит на сърфактант) с неадекватни (невариращи в зависимост от „отговора“ на детето) параметри на вентилация, прекомерна или недостатъчна инфузия, лекарствена терапия и охлаждане.
Диагнозата се основава на клиничната картина и рентгенографията на гръдния кош.
Рентгенографски BGM се характеризира с триада от симптоми, появяващи се през първите 6 часа от живота:
дифузни симетрични огнища с намалена прозрачност (симптом на „мляно стъкло” без или с признаци на „мрежести бели дробове”);
въздушна бронхограма;
намалена пневматизация на периферните белодробни полета.
Тези общи промени се виждат по-добре в долните части на белите дробове и във върховете. Освен това има намаляване на обема на белите дробове, различна тежест на кардиомегалия (увеличаване на кардиоторакалния индекс), нодозо-ретикуларни промени (различни автори ги описват като мрежести, мозаечни, гранулирани, мехурчести и др., но в момента те се интерпретират по-често като дисеминирана ателектаза).
За едематозно-хеморагичен синдром е типично намаляване на размера на белодробните полета, "замъглено" рентгеново изображение, което клинично често се комбинира с освобождаване на пенлива течност с кръв от устата.
Ако споменатите признаци на ХМ не се открият на рентгенография 3 часа след раждането, тогава диагнозата ХМ е съмнителна. Рентгенографските находки при SDR са неспецифични (напр. подобни на тези при стрептококова пневмония B), но рентгенографията на гръдния кош все още е необходима, за да се изключат други състояния, които понякога изискват операция. Рентгеновите признаци на BGM изчезват след няколко часа или 1-3 дни, в зависимост от тежестта на заболяването, естеството на терапията, по-специално от това дали е използвано екзогенно повърхностно активно вещество или не.
RJ Rodrigues и др. (2002) подчертават, че дори в повечето неонатални центрове в Съединените щати диагнозата на SDR се ръководи само от клинични и радиологични данни, въпреки че, разбира се, за правилната диагноза на SDR е важно да се получат доказателства за дефицит на сърфактант. Следователно, понякога терминът „дихателна недостатъчност на недоносеност“ се използва и днес, когато е необходима механична вентилация, допълнителен кислород за лечението на недоносено бебе, но няма типични признаци на SDR на рентгенова снимка на гръдния кош.
Пренаталната диагноза се основава на факта, че белодробната течност на плода от дихателните пътища навлиза в амниотичната течност и нейният фосфолипиден състав може да се използва за преценка на зрелостта на белите дробове на плода. Амниотичната течност се получава или чрез амниоцентеза, или се събира изтичащата вода от родовия канал на майката. Ако нивата на лецитин и сфингомиелин, наситен фосфатидилхолин в амниотичната течност надвишават 5 mg / l или фосфатидилглицерол - 3 μmol / l, SDR се развива много рядко (по-малко от 1% от случаите). Ако съотношението лецитин/сфингомиелин (L/S) е повече от 2,0, вероятността за SDR е 2%, ако е по-малко от 2,0, но повече от 1,0, - 50%, а ако е по-малко от 1,0, -75%. При вътрематочно забавяне на растежа съотношението L/S не винаги отразява правилно функционалната зрялост на белите дробове на плода и затова в тези случаи се препоръчва да се ръководи от горепосочените абсолютни нива на наситен фосфатидилхолин и фосфатидилглицерол, както и повърхностноактивни протеини А. В някои неонатални центрове изследването на тромбопластичната активност на амниотичната течност и броенето на "портокалови клетки" " се използва за оценка на зрелостта на белите дробове на плода, но това не е общоприето.
„Тестът с пяна“ е най-простият тест за зрялост на белия дроб. За производството на теста се използва амниотична течност или 1 ml стомашно съдържимо, получено с помощта на полиетиленов катетър през първия час от живота. Изследването се извършва по следния начин: към 0,5 ml околоплодна течност или стомашно съдържимо се добавят 0,5 ml абсолютен етанол (95%). Стъклена епруветка (диаметър 1 cm) се разклаща енергично в продължение на 15 s, след 15 минути резултатът от теста се оценява чрез доближаване на епруветката до черна хартия. Тестът е положителен, ако на повърхността има единичен или двоен пръстен от мехурчета. Тестът е отрицателен, ако няма мехурчета, и слабо положителен, ако има единични малки мехурчета около менискуса, които запълват 1/3 от кръга или по-малко. В случай на положителен тест, вероятността за BGM е около 4%, слабо положителен - 20%, отрицателен - 60%.
Обемът на изследване (мониторинг) при деца с RDS:
Непрекъснат мониторинг на сърдечната честота и AKD.
Перкутанна оксихемоглобинометрия и по-добро транскутанно определяне на Pao2 и Paco2 в артериалната кръв. Много е опасно да се фокусирате само върху данните от пулсовия оксиметър, тъй като той отразява доста добре тежестта на хипоксемията, но не реагира на хипероксия и дори при долната граница на нормата съотношението на оксихемоглобина е 100%. Опасността от хипероксия е голяма: именно с нея се свързват хроничните лезии на белите дробове и очите при новородени.
Оптимално е да се определят Pao2 и Paco2 в кръв, получена чрез катетеризация на пъпната, радиалната или тибиалната артерия и от централната вена, с анализ на разликата в артериовенозното напрежение на кислорода, т.е. консумация на кислород в тъканите.
На всеки 3-4 часа е необходимо да се измерва и записва в таблицата за наблюдение температурата на кожата на корема, кръвното налягане, диурезата, CBS, нивото на гликемия и концентрацията на кислород във вдишания въздух (Fio2).
По време на острата фаза на SDR ежедневно или през ден произвеждат:
рентгенова снимка на гръдния кош;
определяне на хематокрит;
ЕКГ;
клиничен кръвен тест;
посявка на кръв и съдържимо от трахеята;
определяне на серумните нива на уреен азот, калий, натрий, калций и магнезий, общ протеин и албумин;
желателно е да се определи обемът на циркулиращата кръв, скоростта на церебралния кръвоток и осмоларитета на кръвта;
коагулограма с определяне на фибриноген и продукти на разпадане на фибрин (по показания);
определяне нивото на натрий в кръвта в началото - 2-4 пъти на ден, тъй като има висок риск от хипернатриемия поради дехидратация.
Диференциална диагноза се извършва с респираторни заболявания както от белодробен (пневмония, малформации на белите дробове и др.), така и от небелодробен генезис (вторични респираторни нарушения - интракраниална родова травма на мозъка или гръбначния мозък, вродени сърдечни дефекти, диафрагмална херния, полицитемия, метаболитни нарушения и др.). Диференциалната диагноза с пневмония е описана по-долу.
Хоаналната агенезия причинява невъзможност за дишане през носа и появата на цианоза, респираторни нарушения след нормално първо вдишване. Характерно е обилно лигавично течение, изпълващо носа. Малформацията става очевидна, когато не е възможно да се прекара катетър или сонда през носа в назофаринкса. Лечението е оперативно, но веднага се поставя въздуховод в устата.
Трахеоезофагеалните фистули се проявяват клинично чрез задушаване, пристъпи на цианоза, кашлица, хрипове в белите дробове по време на хранене или непосредствено след него. Контрастното изследване на хранопровода (с водоразтворим контрастен агент) и бронхоскопията ще потвърдят диагнозата.
Диафрагмалната херния се открива при раждането или малко след това чрез нарастващ тежък респираторен дистрес. Типичен е малък навикуларен корем, обърната предна коремна стена при раждането. При преглед се обръща внимание на асинхронните движения на дясната и лявата половина на гръдния кош и изместването на апикалния импулс на сърцето, по-често надясно (тъй като лявата диафрагмална херния се среща 5-10 пъти по-често от дясната), рязко скъсяване на перкуторния тон в долната част на белия дроб и липсата на дихателни звуци тук, внезапна цианоза, когато детето е поставено върху здрава страна. От решаващо диагностично значение е рентгенографията на гръдния кош, която показва наличието в гръдния кош на необичайни за него структури (черва, черен дроб и др.). Хирургично лечение.
При деца с родова травма на мозъка и гръбначния мозък, наред с дихателните нарушения, има и признаци на увреждане на ЦНС. Спомагателните изследвания също помагат за навременната диагностика на мозъчната патология: невросонография, рентгенография на гръбначния стълб, лумбална пункция и др.
Вродените сърдечни дефекти от син тип и синдромът на персистираща фетална циркулация понякога са трудни за разграничаване от SDR. Въпреки това, в първите часове от живота си, децата със SDR често имат нормален цвят на кожата. При използване на 100% кислород за дишане за 10-15 минути, особено при постоянно положително налягане в дихателните пътища, при деца със SDR, Pao се повишава, понякога дори над 100 torr, докато това не се случва при сърдечни дефекти от син тип. Разбира се, важни са и данните от клиничния преглед, аускултацията, оценката по скалата на Силвърман, както и допълнителни изследвания (рентгенография на гръдния кош, ЕКГ, резултати от ехокардиография).
Пневмонията, причинена от стрептококи B, други стрептококи (пептострептококи, ентерококи), дава клинична картина, която е практически неразличима от BGM, тъй като причиняват инхибиране на сърфактанта и оттам неговия дефицит. Диагностичната стойност в този случай е идентифицирането на други инфекциозни огнища (менингит и др.), Резултатите от клинични кръвни тестове, кръвни култури, трахеално съдържание.
Лечение. Температурна защита. Грижата е насочена предимно към предотвратяване на охлаждането, тъй като помага да се намали или дори да се спре (при телесна температура от 35 ° C и по-ниска) синтеза на повърхностно активно вещество и увеличаването на метаболитната ацидоза, развитието на атаки на апнея. Веднага след раждането детето се увива в стерилна затоплена пелена, амниотичната течност се отстранява от кожата чрез леко попиване и се поставя под източник на лъчиста топлина и след това в инкубатора (температурата в инкубатора зависи от телесното тегло при раждането; вижте глава VIII за подробности). На всеки 1-2 часа се записва телесната температура на детето и ако тя е под 36 °C, тогава температурата на въздуха в кувьоза се повишава с 1-2 °C, а ако е над 37 °C, тогава се понижава (обикновено не трябва да е по-ниска от 32 °C). Повече подробности в глава VIII.
Трябва да се помни, че дете, лежащо под източник на лъчиста топлина на маса за интензивно лечение, изразходва 5-10% повече енергия за поддържане на телесната температура, отколкото дете в кувьоз. Поради това е препоръчително недоносените бебета с много ниско телесно тегло да се поставят дори в кувьоз в пластмасова камера, за да се намалят топлинните загуби чрез конвекция, както и незабележимата загуба на вода. Всички деца трябва да носят шапка на главата си, защото загубата на топлина и вода от главата е много голяма.
Важно е да се предотвратят колебания в температурата на околната среда; при изследване на дете в кувьоз минимизирайте травматичните ефекти - болка и др.
Прегледът при лекаря трябва да бъде възможно най-кратък, особено важно е, ако детето се обърне, за да поддържа главата си, намалявайки пасивните движения в цервикалната област.
Поддържане на проходимостта на дихателните пътища. Когато детето се роди в асфиксия, наличието на мекониум в околоплодната течност под формата на "грахова супа" изисква трахеална интубация и леко, но енергично изсмукване на съдържанието на дихателните пътища. Изсмукването се повтаря многократно в острата фаза на заболяването, като се ръководи от клиничната картина и аускултаторните данни, но като се помни, че тоалетната на трахеята причинява преходна, но значителна хипоксемия, брадикардия и хипертония, значителна промяна в интензивността на мозъчния кръвоток, което може да провокира вътречерепни кръвоизливи, паравентрикуларни лезии.
Позицията на дете със SDR на маса или в кувьоз трябва да бъде с леко изправена глава („кихаща позиция“). За целта под горната част на гръдния кош се поставя валяк с дебелина 3-4 см. Периодичната смяна на положението на детето (леко обръщане на една страна, по корем и др.) стимулира трахеалния дренаж. В края на острия период прибягват до вибрационен масаж, физиотерапия и аерозолна терапия.
Инфузионна терапия и хранене. По правило децата със SDR не се хранят ентерално през първите два или три дни от живота си поради риск от кардиопулмонални усложнения и регургитация. Въпреки това, детето от първите часове на живота си не трябва да гладува и да изпитва жажда. Освен това е изключително важно да се предотврати развитието на хипогликемия. Следователно, вече 30-40 минути след раждането започва планираната инфузионна терапия. Обемът на приложената течност през първия ден от живота е 50-60 ml/kg с по-нататъшно увеличение с 20 ml/kg за всеки следващ ден (на 7-ия ден около 140-150 ml/kg). Особено внимателно е необходимо да се въведе течност и да се увеличи дневният й обем в случай на олигурия при дете. Когато се появи диуреза (повече от 2 mi / kg / h), обемът на течността се увеличава по-смело (до 40 ml / kg на ден). В олигуричната фаза излишният обем течност може да помогне за поддържане на отворен дуктус артериозус, белодробен оток и да бъде повишен рисков фактор за последващо развитие на BPD. Възстановяването на диурезата е предвестник на началото на фазата на възстановяване.
През първия ден от живота трансфузираната течност е 5-10% разтвор на глюкоза, от втория ден към нея се добавят натрий и хлор 2-3 mol / kg / ден. и калий, калций, 2 mol / kg / ден. Съставът на инфузионния разтвор се коригира в зависимост от монограмата на кръвта, поддържайки нивото на натрий в рамките на 135-145 mmol / l плазма. За предотвратяване на тромбоза на катетъра и регионалния съд, особено при деца, които са на пълно парентерално хранене, към инфузираните разтвори се добавя хепарин в доза от 0,2-0,5 IU на 1 ml прелята течност.
Като цяло, както знаете, обемът и естеството на инфузионната терапия се определят в зависимост от:
BCC;
диуреза;
динамика на телесното тегло;
динамика на AKD и интензивност на церебралния кръвен поток;
състоянието на сърдечно-съдовата система, по-специално състоянието на периферното кръвообращение;
КОС и йонограми на кръвен серум;
условия на кърмене, по-специално адекватността на методите за термична защита, вентилация или IVL.
Отчитането на всички тези параметри и коригирането на обема са сложни задачи, които изискват както знанията, така и уменията на лекаря, тъй като досега новородените не се лекуват толкова, колкото се кърмят.
Храненето с донорско, майчино мляко или формула, адаптирана за недоносени бебета, започва, когато състоянието се подобри и задухът намалее до 60 за 1 минута, няма продължителна апнея, регургитация, след контролното даване вътре в дестилирана вода. Видът на храненето (еднократно или постоянно чрез стомашна или транспилорна сонда, от шише) зависи от наличието на сукателен рефлекс, тежестта на състоянието. Изчисляване на количеството кърма - вижте глава VI, където можете да прочетете и за начина на парентерално хранене, ако състоянието на пациента не позволява започване на ентерално хранене.
Нормализирането на газовия състав на кръвта се постига чрез обогатяване на вдишания въздух с кислород, различни възможности за създаване на повишено налягане в дихателните пътища при спонтанно дишане (SPAPD - спонтанно дишане с постоянно положително налягане в дихателните пътища) чрез назални канюли (nCPAP - nose continiouse positive airway pressure - nasal constant airway pressure) при постоянно високо налягане и механична вентилация.
Ако няма признаци на SDR, тогава недоносеното бебе се поставя в инкубатор, където съдържанието на кислород във въздуха е около 40-45%. Ако в рамките на 4 часа Paog на артериалната кръв (или когато се определя от кожен сензор) остане над 8 kPa (60 Torr = mm Hg), тогава концентрацията на кислород се намалява с 5% на час до ниво от 30-35%. Когато Pao2 е по-малко от 6,67 kPa (50 Torr = mm Hg), концентрацията на кислород във вдишания въздух се повишава до максимум чрез поставяне на капачка в кувьоза над главата на детето. Ако това не доведе до нормализиране на кръвния Pao2, тогава започнете SPPD (оптимално през назални канюли).
Други индикации за стартиране на SDP са:
постоянен задух и експираторни шумове;
Резултатът на Силвърман е 5 точки или повече (дори с нормален цвят на кожата);
отрицателен "тест за пяна" с амниотична течност или стомашно съдържимо, получено веднага след раждането, липсата на фосфатидилглицерол в тях.
Най-често срещаните в момента са pSRAP, много по-рядко се използва методът на Мартин (Martin bag). Чантата се прикрепя към врата на детето с дунапренова лента, така че малкият пръст на лекаря да може свободно да проникне между торбата и врата. Експираторното налягане при разширяване при SPPD обикновено е в диапазона 4-6 cm воден ъгъл. Изкуство. (т.е. на тази дълбочина се потапя тръба, през която излиза въздух от торбата), рядко трябва да се увеличи при изразена ригидност на белите дробове до 10 см воден ъгъл. Изкуство. Ако твърдостта на белите дробове е ниска, тогава свръхналягането по време на издишване води до нарушаване на изтичането на кръв от мозъка, намаляване на притока му към сърцето, допринася за развитието на сърдечна недостатъчност, мозъчен оток.
SDPPD започва с подаване на овлажнен кислород, загрят до 32-34 ° C, и след това, под контрола на клиничния ефект и Pao2 на кръвта, концентрацията му в инхалираната смес постепенно се намалява, постигайки PaO2 на артериална кръв от 6,67-10,67 kPa (50-80 Torr = mm Hg), а повече от 8 kPa артериализирана кръв от петата се счита за потенциално токсична, изисква намаляване на концентрацията на кислород във вдишания въздух.
При изразено безпокойство на детето, което се отбелязва особено често на фона на pSRAP, се предписва натриев оксибутират или седуксен, но не и фенобарбитал, който селективно потиска експираторните структури на дихателния център, разположен в продълговатия мозък.
Показания за IVL са:
невъзможността да се постигне нормализиране на Pao2 в кръвта на фона на pSRAP, резултатът на Silverman е повече от 5 точки, което не намалява на фона на pSRAP;
Pao2 е под 8,00 kPa (60 mm Hg) с Fio2>0,7 (F1O2 е делът на кислорода във вдишаната кислородно-въздушна смес), но ако телесното тегло при раждането е по-малко от 1250 g, тогава с Fio2>0,4;
Paso2 е повече от 8,79 kPa (65 mm Hg), а при телесно тегло под 1250 g - Paso2> 8,00 kPa (60 mm Hg) и pH pH. XXVI.
Екстракорпоралната мембранна оксигенация се използва в чужбина за лечение на деца с изключително тежък курс на SDR с неефективността на традиционните методи за механична вентилация и при деца с тежки сърдечни дефекти. Поради липсата на подходящо оборудване в Русия, ние не описваме методологията му в този учебник.
Опасностите от кислородната терапия:
сух и студен кислород уврежда белите дробове, насърчава спазъм на артериолите, белодробна хипертония, ацидоза, инхибиране на синтеза на сърфактант. Отопление
кислород до 32-34°С е задължителен (при апаратна вентилация - до 36-37°С), както и неговото овлажняване. При липса на специални овлажнители кислородът се пропуска през буркан Бобров (височината на водния стълб е най-малко 15 см). Излишната влага (100% относителна влажност за повече от 2 часа) води до прегряване на детето, претоварване с вода, допринася за белодробен оток; опасността от токсично действие на кислорода е реална, когато Pao2 на артериалната кръв е над 10,67 kPa, което продължава няколко часа, което води до увреждане на очите, белите дробове и централната нервна система.
Поддръжка на КОС. Необходимо е да се коригира само патологичната ацидоза (рН по-малко от 7,25 и BE повече от минус 10 mmol / l) и само след установяване на механична вентилация или вентилация. Ако патологията на белите дробове е довела до такова значително нарушение на CBS, тогава това е пряка индикация за механична вентилация или IVL. Количеството натриев бикарбонат в mmol (т.е. количеството ml от 8,4% разтвор) x (BE стойност - 5) x телесно тегло (kg) x 0,4. Необходимото количество натриев бикарбонат се прилага капково под формата на 4,2% разтвор за 1 час.Важно е да се помни, че алкалозата провокира вътречерепни кръвоизливи, спиране на дишането при недоносени бебета.
Борба с анемия и хиповолемия, хипотония. В острата фаза на заболяването е необходимо да се поддържа хематокрит най-малко 0,4, тъй като анемията е фактор, който поддържа тъканна хипоксия, което означава дефицит на сърфактант, тъканен оток и др. Преливане на червени кръвни клетки. При тежка анемия и тежка SDR, директното кръвопреливане е по-показано, тъй като в свежите еритроцити има повече 2,3-дифосфоглицерат, което намалява тъканната хипоксия. В допълнение, прясната кръв е по-показана за коригиране на нарушенията на хемостазата при декомпенсиран DIC, а също така е имунопротектор при инфекции. В същото време заместващите кръвопреливания за SDR вече са изоставени, тъй като това допринася за увеличаване на честотата и тежестта на ретинопатията на недоносените. През 2-та седмица от живота и по-късно индикацията за трансфузия на еритроцитна маса е хематокрит под 0,3. Понастоящем индикациите за кръвопреливане са рязко ограничени поради риска от инфекции (не само хепатит В и С, ХИВ, но и цитомегаловирус, тъй като 6-12% от донорите имат цитомегаловирус в кръвта), изосенсибилизация.
Хиповолемията (положителен "симптом на бяло петно" - 3 s или повече), особено при деца с анемия, се коригира най-подходящо чрез преливане на изотоничен разтвор на натриев хлорид, но може да се прелее и прясно замразена плазма или 10% разтвор на албумин. Количеството на трансфузирания медикамент е 10-15 ml/kg телесно тегло. Изсипете бавно струя (1-2 ml/kg/min).
Ако след корекция на анемия и хиповолемия артериалното кръвно налягане е ниско (максималното налягане е под 45 torr, т.е. mm Hg), тогава допаминът се прилага микрофлуидно (начална доза 5 µg/kg/min с по-нататъшно увеличение според показанията до 10-15-20 µg/kg/min) (за подробности вижте глава XIX).
Заместване на дефицита на сърфактант. От първите работи на T.Fujiwara и др. през 1980 г. за заместване на дефицита на сърфактант при много недоносени бебета е установен положителен ефект от такава терапия.
Понастоящем се използват както естествени повърхностно активни вещества, получени от белите дробове на бикове (домашно BL-повърхностно активно вещество, разработено в Санкт Петербург от проф. OARozenberg, чуждестранни - Survanta, Alveofact, Infrasurf), прасета (Curosurf), така и синтетични (ALEK, Exosurf, Surfaxin, "Sfenticute"). Най-ефективните естествени повърхностно активни вещества, съдържащи, в допълнение към фосфолипидите, повърхностноактивен протеин В ( Таблици 12.3, 12.4). Трябва да се подчертае, че лекарството Surfaxin, разработено в САЩ от лабораторията Discovery, съдържа комбинация от фосфолипиди (дипалмитилфосфатидилхолин - DPPC, палмитолейил фосфатидилглицерол - POPG, палмитинова киселина - PA) и рекомбинантен, синтетичен пептид, състоящ се от аминокиселинни фрагменти на лизин (К) и лев cine (L) в последователността KLLLLKLLLLKLLLLKLLLL (KC) Този рекомбинантен пептид има свойствата на повърхностноактивен протеин B. Лекарството \enticute съдържа рекомбинантен повърхностноактивен протеин C.
Многобройни рандомизирани проучвания показват, че екзогенното повърхностно активно вещество допринася за:
повишаване на белодробния комплайънс и функционалния остатъчен капацитет, като по този начин се намалява работата на дихателните мускули;
намаляване по време на механична вентилация Fio2 (делът на кислорода във вдишания въздух), PIP (пиково инспираторно налягане - пиково инспираторно налягане), MAP (средно налягане в дихателните пътища - средно налягане в дихателните пътища), PEEP (положително крайно експираторно налягане - положително крайно експираторно налягане), подобряване на индекса на оксигенация на алвеоларния капилярен кислороден градиент;
намаляване на смъртността при SDR (превантивната му употреба е особено ефективна при деца с гестационен период под 30 седмици, когато се комбинира
Таблица 12.3
Състав на някои ПАВ
(Gadzinowski J., 2003) Състав Surfaxin Survanta Curosurf Протеин/пептиди 0,8+2 mg/ml SpB и SpC Таблица 12.4
Протеинов състав на някои ПАВ
(Gadzinowski J., 2003)
Лекарствено съотношение на SpB в mg и фосфолипиди в mmol Съотношение на SpC в mg и фосфолипиди в mmol Alveofact 2,7+0,8 1,4+0,5 Curosurf 2,4+2,2 5,2+5,6 Surfaxin 19,8 * 1 Палмитиновата киселина запазва функцията на SpC.
с антенатална употреба на кортикостероиди), синдром на аспирация на мекониум, SDR за възрастни;
съкращаване на времето на механична вентилация и намаляване на честотата на страничните ефекти на механичната вентилация (синдроми на изтичане на въздух и др.);
намаляване на честотата на BDD, IVH, ретинопатия;
не инхибира синтеза на ендогенно повърхностно активно вещество.
Трябва да се отбележи, че естествените повърхностноактивни вещества са по-ефективни от синтетичните, но те могат да бъдат антигенни; в допълнение, те са по-малко стабилни по състав, изискват по-строги условия на съхранение и имат по-ограничен срок на годност и могат потенциално да съдържат прионови агенти.
Имаме опит в използването на препарати Curosurf и Exosurf в Детска болница № 1 (Санкт Петербург). И двете лекарства имаха горните ефекти. Въпреки това, след въвеждането на Curosurf Fio2, PIP, MAP може да бъде намалено с около 30% още след 3-3,5 часа, докато след въвеждането на Exosurf - само след 6 часа. След въвеждането на Curosurf се наблюдава намаляване на белодробното съдово съпротивление, намаляване на дяснокамерното следнатоварване и увеличаване на лявокамерното преднатоварване. В същото време се наблюдава намаляване на разликата в алвеоларно-капилярното напрежение на кислорода, подобряване на индекса на оксигенация. За съжаление, няма рандомизирани сравнителни проучвания за употребата на вътрешно активно вещество BL и ние нямаме опит с употребата му, но нашите колеги знаят, че той е много по-малко ефективен от Curosurf при тежка SDR.
Според професор J. Gadzinowski (2003), в многоцентрови европейски сравнителни рандомизирани проучвания (те включват и неонатолози от Санкт Петербург, но изследването е двойно-сляпо и ние все още не знаем нашите резултати) за профилактичното използване на Surfaxin, Exosurf и Survanta при деца с тегло при раждане под 1250 g, първото лекарство се оказа по-ефективно, което според него може да се дължи на до по-ранно подобрение на оксигенацията (вече след няколко минути, докато след употребата на други повърхностноактивни препарати това се отбелязва след 3-6 часа), по-дълъг ефект поради резистентността на синтетичното лекарство Surfaxin към инхибиране от серумни компоненти и оксиданти.
Страничните ефекти и усложненията на терапията със сърфактант са до голяма степен ятрогенни. При липса на адекватно наблюдение и промяна на параметрите на механичната вентилация могат да се развият баротравма и волютравма на белите дробове, синдроми на изтичане на въздух, белодробен кръвоизлив, хипероксия и следователно ретинопатия на недоносените, белодробен кръвоизлив, IVH. Може би единственото нещо, което е отбелязано от много изследователи в почти всички центрове, е увеличаването на честотата на функциониращ дуктус артериозус и апнея след употребата на екзогенен сърфактант. Честотата на функциониращ дуктус артериозус при деца, лекувани с Curosurf при нашите наблюдения е 7,6%.
Най-ефективното профилактично приложение на сърфактант при раждането или през първите 15-30 минути от живота. Предназначената за приложение доза се загрява предварително (до 37 ° C за 1 час) и се излива през ендотрахеалната тръба в трахеята в 4 дози за 10-15 минути или микропоток с помощта на инфузер за 20-30 минути, като следващата инфузия променя позицията на детето. Ако е необходимо, инфузията се повтаря след 12 ч. Не са отбелязани тежки странични ефекти. Счита се за изключително важно спирането на механичната вентилация възможно най-рано и прехвърлянето на детето на pSRAP. В резултат на това, като цяло, превантивната терапия, честотата и тежестта на SDR са значително намалени.
Сърфактантното лечение на вече развита SDR или пневмония е много по-малко ефективно от профилактичното лечение. В същото време е изключително важно преди въвеждането на какъвто и да е препарат за повърхностно активно вещество да се стабилизира състоянието на детето и, ако е възможно, да се коригират основните параметри на жизнената активност. След прилагане на лекарството е необходимо внимателно наблюдение, включително: параметри на механична вентилация, Fio2, визуален анализ на участието на спомагателните мускули в акта на дишане, перкутанен анализ на сатурация (Brog), сърдечна честота, кръвно налягане, CBS, рентгенография на гръдния кош преди и 3-6 часа след приложението. Отново е необходимо гъвкаво да се променят параметрите на механичната вентилация и F102, като се избягват баротравма и волютравма на белите дробове, хипероксия. Spo2 трябва да се поддържа в рамките на 90-94%, за да се предотврати хипероксия. Препоръчително е съдържанието на трахеята да не се аспирира в рамките на 3-6 часа след прилагане на сърфактанта.
Затварянето на отворен артериален канал се обмисля от медицинска гледна точка при деца със SDR според ехокардиография и доплерови изследвания на 4-5-ия ден от живота. Тактиката за използване на индометацин или бруфен е описана в глава XIX.
Антибиотична терапия. При диагностициране на SDR и дори при съмнение за него, ампицилин се предписва в комбинация с един от аминогликозидите (обикновено гентамицин). Това се дължи, от една страна, на факта, че стрептококова В-инфекция се проявява чрез увреждане на белите дробове, което не се различава по нищо (дори рентгенологично) от SDR, от друга страна, чрез прехвърляне на пациента на механична вентилация, което често е придружено от инфекция. Въпреки това, 3 дни след получаване на резултатите от хемокултури и клинични кръвни изследвания в динамика, е необходимо да се реши въпросът за наличието на инфекция и, ако не, антибиотиците трябва да бъдат прекратени.
Витаминна терапия. Не е потвърдено мнението, че профилактичният прием на витамин Е намалява заболеваемостта от бронхопулмонална дисплазия. И все пак е показано назначаването на витамин Е интрамускулно при 10 mg / kg дневно, като се използва кислородно-въздушна смес с Fio2 повече от 0,4, тъй като това намалява честотата и тежестта на ретинопатията на недоносените. Курс 7-10 инжекции. Витамин А, прилаган ентерално по 2000 IU през ден, трябва да се дава на всички деца преди началото на ентералното хранене, тъй като това намалява честотата на некротизиращ ентероколит и бронхопулмонална дисплазия.
Диуретик. Въпреки че назначаването на фуроземид увеличава диурезата и подобрява състоянието на белите дробове, то увеличава честотата на открит дуктус артериозус, калцификации в бъбреците и диселектролитемия и следователно не може да се счита за рутинна. Фуроземид се предписва само при белодробен оток, едематозен синдром.
Глюкокортикоиди. От планираното приложение на глюкокортикоиди и техните производни (по-често се използва дексаметазон като с максимален тъканен ефект) за стимулиране на синтеза на сърфактант, всички деца със SDR вече са изоставени. Това се дължи на въвеждането на повърхностноактивни препарати в терапията и вторичната профилактика на SDR, подобряване на методите за респираторна поддръжка, механична вентилация, както и страничните ефекти на глюкокортикоидната терапия, основните от които, дори и с кратък курс, са: хипергликемия, артериална хипертония, стомашно-чревно кървене, некротизиращ ентероколит и други инфекции. Глюкокортикоидите се предписват на пациенти със SDR, които според клиничните и лабораторни данни имат надбъбречна недостатъчност.
Много неонатолози в чужбина са стигнали до извода, че назначаването на дексаметазон при постинтубационен едематозен ларингит или трахеит с тежка стеноза има положителен ефект. Формулярът за новородени (BMJ, 2000) препоръчва даването на 4 дози от 200 mcg през 8 часа, като първата доза се дава 4 часа преди екстубация при деца с оток или нараняване на ларинкса.
Тироидните хормони за лечение на деца със SDR започнаха да се използват активно в някои неонатологични клиники, въз основа на честото откриване на ниски нива на тиреоидни хормони при много преждевременно родени бебета с BGM. Въпреки това, няма общоприети данни, базирани на резултатите от рандомизирани проучвания, които безспорно да доказват ползата от такова предписание, поради което това е изследователска терапия. Интраамниотичната употреба на L-тироксин при бременни жени с висок риск от преждевременно раждане е по-оправдана, но тук няма общоприети схеми и общопризнати резултати.
Рибоксин и инозитол, прилагани интрагастрално на всеки 6 часа в доза от 40 mg/kg от края на първия ден до 10-ия ден от живота, според M. Hallman et al. (1986-1989), намаляват тежестта на SDR, увеличават синтеза на сърфактант, намаляват честотата на бронхопулмонална дисплазия. Въпреки това, този метод, както и планираното приложение на плазминоген при недоносени бебета, е метод за изследване за лечение на деца със SDR.
Прогнозата на SDR зависи от неговата тежест и наличието на съпътстваща патология, усложнения на терапията. Смъртността на деца с тегло при раждане над 1000 g при рационално управление не надвишава 5-10%. През първата година от живота децата, прекарали SDR, често страдат от пневмония, а честотата на сепсиса при тях също се увеличава. Енцефалопатията (постипоксична) е едно от характерните съпътстващи състояния (или усложнения) при деца със SDR, а при някои деца те се откриват ясно само в предучилищна и училищна възраст под формата на минимална мозъчна дисфункция, поведенчески разстройства и затруднения в обучението. В тази връзка в системата за рехабилитационни мерки за деца със SDR е необходимо да се предвиди ранното предписване (от 3-4-ия ден) на лекарства, които подобряват мозъчния трофизъм (глиатилин 10-15 mg / kg / ден, ноотропил 50 mg / kg интравенозно или перорално 2-3 пъти на ден), наблюдение от невропатолог.
Предотвратяване. Антенатална хормонална терапия. Въвеждане интрамускулно или вътре в майката със заплаха от преждевременно раждане за период от 24-34 седмици:
бетаметазон в доза от 12 mg (2 пъти с интервал от 24 часа) или
дексаметазон 6 mg 4 пъти с интервал от 12 часа.
Оптимално е периодът между края на хормоналната терапия и раждането да бъде повече от 24 часа.Ефектът от това назначение продължава 10 дни и ако не настъпи раждане, тогава е показано еднократно приложение на дексаметазон в доза от 6-12 mg.
Антенаталният курс на кортикостероиди не само намалява честотата и тежестта на SDR, но също така намалява риска от развитие на открит дуктус артериозус, интравентрикуларен кръвоизлив, перивентрикуларна левкомалация, некротизиращ ентероколит и продължителността и разходите за кърмене на много недоносено новородено.
Дългосрочните последващи проучвания показват, че курсът на антенатална хормонална терапия не увеличава честотата на инфекциозни заболявания при новородени, не засяга последващото физическо и психомоторно развитие (включително скоростта на увеличаване на обиколката на главата), както и растежа на белите дробове, не причинява надбъбречна дисфункция, зрение или слух.
Понастоящем най-обещаващо е разработването за практическо приложение на схемата за въвеждане на трийодтиронин в амниотичната течност и оптимално - тиротропин освобождаващ хормон (TRH). TRH препаратите, както експериментално, така и в ограничени клинични проучвания, са показали, че са много ефективни за предотвратяване на SDR. Въпреки това, две големи многоцентрови проучвания, проведени в САЩ, не показват ползата от комбинирането на кортикостероидна профилактика по време на бременност в комбинация с тиреоидни хормони и/или TRH (Ballard RA et al., 1998).
Полезно е да се "забави" раждането, тъй като ако безводната празнина продължава повече от 2 дни, SDR обикновено не се развива, въпреки че сепсисът и вероятно вътречерепните кръвоизливи са по-чести при такива деца.
Заместителната терапия с екзогенни повърхностноактивни вещества през първите 30 минути от живота (виж по-горе) е високоефективен метод за предотвратяване на тежка SDR.
Синдромът на респираторен дистрес (RDS) се отнася до всеки патологични променив белите дробове, които се появяват в плода или новороденото през първите 2-3 дни от живота, клинично проявени с тежка дихателна недостатъчност.
SDR е по-честа при недоносени бебета, особено при близнаци, предимно при момчета. Основните причини за възникването му са: а) пневмопатия - бели дробове, хиалинни мембрани, едематозно-хеморагичен синдром, кръвоизлив в белите дробове, малформации на белите дробове; ) вътрематочно -, сепсис; вътречерепен кръвоизлив.
Анатомичната и функционална зрялост на белите дробове зависи от количеството сърфактант, който покрива вътрешната повърхност на алвеолите, създава повърхностен алвеоларен филм, който предотвратява колапса на алвеолите и развитието на ателектаза. За нормалното функциониране на белите дробове до 35-та седмица се достига достатъчно количество сърфактант. съдържанието му в белодробната тъкан на плода може да се измери чрез нивото на лецитин в амниотичната течност. За това се използва тестът за пяна на Clements. Същността му е следната.
Тестът "пяна" се провежда и със съдържанието на стомаха на новородено. SDR е най-очевиден през първите 2 дни от живота и постепенно изчезва до 12-14-ия ден. Тежестта му се оценява в точки по скалата на Силвърман 30 минути след раждането на детето, след това след 3-6-12 часа в продължение на 2-3 дни. и оценка показват наличието на синдрома. С оценка 10 състоянието на детето е изключително тежко.
Скала на Силвърман
|
Клинични симптоми |
|||
|
Неравен |
Парадоксално |
||
|
Интеркостална ретракция |
Отсъстващ |
Умерен |
произнесе |
|
Втягане на гръдната кост |
Отсъстващ. |
Умерено по вдъхновение |
постоянен, изразен |
Признаци на SDR се наблюдават в първия живот на детето. Те включват: повишено дишане (над 60-70 за 1 минута), прибиране по време на вдишване на междуребрените пространства и мечовидния процес, подуване на крилата на носа, затруднено издишване и функционално състояние на централната нервна система.
Първичната ателектаза може да бъде малка, разпръсната в двата бели дроба или групирана в обширни конгломерати, заемащи няколко сегмента (полисегментарна ателектаза).
Децата стават летаргични, има намаляване на мускулния тонус, адинамия. Има остър, дишането става бързо и трудно, парадоксален тип "люлка". Гърдите са бъчвовидни, ригидни при палпация. Отбелязват се притъпяване или съкращаване на перкуторния звук и отслабено дишане от засегнатата страна, твърдо, учестено дишане в останалите бели дробове. Може да се чуят единични интермитентни крепитативни хрипове. Некомплициран патологичен процесколабиралата белодробна тъкан се изправя в рамките на 4-5 дни. Дисеминираните дисеминирани ателектази са по-често първични, наблюдавани при деца с ниско тегло и незряла белодробна тъкан. често се раждат в състояние на асфиксия, летаргични, с намален мускулен тонус, тежка цианоза. Синдромът на респираторен дистрес първоначално се изразява леко, при 2-4 точки по скалата на Силвърман, но до края на 2-3 дни настъпва пикът на заболяването. зачестява, ноздрите се подуват, появяват се конвулсивни въздишки. Гърдите са "тестени" на допир. Перкуторният звук е скъсен навсякъде или в определени области на белите дробове. твърдо, трудно звучно издишване, на фона на което се чуват единични интермитентни крепитативни хрипове. При благоприятен курс на 5-та, симптомите постепенно изчезват до края на 2-рата седмица. Острото състояние на 5-6-ия ден е признак на пневмония.
Със синдрома на хиалиновата мембрана може да се роди в задоволително състояние. интервалът понякога продължава до 12 часа, след което се развива тежка дихателна недостатъчност, дишането се учестява, появява се цианоза на кожата, която не изчезва при вдишване на кислород. Наблюдават се повтарящи се пристъпи на асфиксия; плътен, уголемен; нарастваща подкожна тъкан. При аускултация белите дробове са отслабени, чуват се малки хрипове. В бъдеще се отбелязват функциите на централно, пълно и често спиране на дишането. бледо със сиво-цианотичен оттенък.
Оток-хеморагичен синдром- един от най тежки формипневмопатия. Това е локална проява на патологична хидратация на цялото тяло на новородено, което възниква в резултат на нарушение на метаболитните процеси и вътрематочна асфиксия. характерна особеностСиндромът е отделяне от устата на пенеста кървава течност. Респираторните и SDR признаци се появяват при раждането. Често се появяват обширни кръвоизливи по кожата и подкожната тъкан. В белите дробове се наблюдава тежък оток: по време на перкусия звукът е съкратен, отслабен, особено в долните части, чуват се голям брой малки мехурчета.
Едемно-хеморагичният синдром почти винаги се комбинира с дисеминирана белодробна ателектаза, особено при недоносени бебета.
Кръвоизливи вможе да бъде алвеоларен, интерстициален и смесен. В 50% от случаите има
Синдром на респираторен дистрес
V.F. Демин, А.А. Михеев
Катедра по детски болести №3, RSMU.
Терминология
Термините синдром на респираторен дистрес (RDS), синдром на респираторен дистрес (RDS) и заболяване на хиалиновите мембрани (HMD) често се използват за описание на същата патология. Последните годинимного автори не използват термините SDR и RDS като синоними на BGM, т.к известни са и други патологични състояния, при които възниква образуването на хиалинови мембрани. В местната литература по отношение на едно и също състояние се срещат както терминът синдром на респираторен дистрес, така и синдром на респираторен дистрес.
Етиология и патогенеза
Синдромът на респираторен дистрес се развива при около 20% от недоносените бебета, но честотата му е силно зависима от гестационната възраст и може да варира от 5-10% при деца, родени на 35-36 седмици, до 80-88% при деца с гестационна възраст под 27 седмици. Синдромът на респираторните нарушения се среща при доносени деца в 1-2% и е свързан главно с морфофункционална незрялост, асфиксия при раждане и някои други състояния.
Развитието на синдрома на респираторните нарушения се основава на структурната и функционална незрялост на белите дробове и свързаната с това недостатъчност в образуването на повърхностно активно вещество. В допълнение, причината за развитието на SDR може да бъде нарушение на структурата на повърхностноактивното вещество, неговото повишено разрушаване или инхибиране.
Анатомо-физиологичните особености на дихателната система на новороденото предразполагат към повече бързо развитиедихателна недостатъчност, отколкото при по-големи деца и възрастни. Ларинксът е по-висок от възрастни и респираторнипътищата са много тесни, а субглотисното пространство е най-тясното място, където дори 1 mm удебеляване на лигавицата води до стесняване на лумена със 75%. Белите дробове са по-пълнокръвни и по-малко еластични от тези на възрастен. Броят на алвеолите при новородено е 10-15 пъти по-малък, отколкото при възрастен, което води до ограничени възможности за обмен на белодробен газ. Гръдният кош на новороденото е, така да се каже, в позиция на вдишване, поради разположението на ребрата, перпендикулярно на гръбначния стълб, така че увеличаването на вентилацията се дължи главно на дихателната честота.
След като детето е преминало родовия каналбелите дробове никога не се разширяват сами под действието на еластичния откат. Силите на повърхностното напрежение в слоя течност между слепналите алвеоли предотвратяват това. За изправяне на алвеолите е необходимо разреждане в гръдния кош, докато транспулмоналното налягане трябва да бъде до -40 cm воден стълб. Първият плач на новороденото е важен адаптивен механизъм. Обемът на първия дъх е по-голям от обема на издишването; колкото по-силен е викът, толкова повече разлика. Това създава положителен режим на налягане в края на издишването, който помага за разширяване на белите дробове и създаване на повишено вътребелодробно налягане, поради което отворената клапа се затваря по-бързо. овален прозореци отворен дуктус артериозус и белодробният кръвен поток се увеличава, се насочва през алвеоларната тъкан. Производството на сърфактант става достатъчно, белите дробове обикновено се изправят.
При липса или нарушение на производството на повърхностноактивно вещество, повърхностното напрежение в алвеолите става много високо. Ако при първото вдишване транспулмонарното налягане трябва да бъде до -40 см воден щам, то при следващите (повърхностноактивното вещество вече действа) е -5 см водно ст. При дефицит на сърфактант налягането за отваряне на алвеолите остава толкова високо, колкото при първото вдишване, белодробният кръвоток намалява, което нарушава производството на сърфактант, исхемичната тъкан става по-пропусклива, настъпва трансудация на плазмата през алвеолите. веоларна капилярна мембрана в алвеолите и инактивиране дори на това малко количество сърфактант, което се съдържа в тях с образуването на филм - хиалинова мембрана. През 1959гЕйвъри и Мийд бяха първите, които доказаха дефицит на сърфактант при новородени, починали от BGM.
Повърхностноактивното вещество е мономолекулен слой на границата между алвеоларния епител и въздуха. Предотвратява колапса на алвеолите при издишване и развитието на оток в белите дробове (поради регулирането на пропускливостта на стените на алвеолите и микроциркулацията в белите дробове), предпазва алвеоларния епител от увреждане, а също така участва в местни имунологични реакции. От химическа гледна точка повърхностно активното вещество е липопротеин - смес от 90-95% се състои от липиди и 5-10% от протеиновата фракция, представена от четири специфични протеина - SP-A, SP-B, SP-C, SP-D. Липидният състав на повърхностно активното вещество включва фосфолипиди (80%), основната част от които е фосфатидилхолин и неутрални липиди.
Повърхностно активното вещество се синтезира от алвеолоцити тип II, започвайки от 25-26 гестационна седмица, като най-активният синтез се наблюдава от 34 гестационна седмица. От една страна, молекулите на ПАВ са хидрофилни, фиксирани във водната фаза, а от друга страна, те са липофилни, изпъкнали в газовата фаза, което определя активното повърхностно действие (поради междумолекулните сили на отблъскване на липофилните части).
По време на вътрематочния период узряването на сърфактантната система се извършва под въздействието на множество фактори. Добре познатата важна роля стероидни хормонив този процес е установен синергизмът на действието на кортизола и тиреоидните хормони и β-адренергичните агенти. Има няколко механизма, чрез които глюкокортикоидите влияят върху съзряването на белите дробове. Ендогенните глюкокортикоиди влияят на адренергичната система, която играе важна роля в подготовката на белите дробове за извънматочната им функция, стимулират адренергичните рецептори и секрецията на адреналин в надбъбречните жлези на плода. Глюкокортикоидите въздействат директно върху фибробластите на интерстициалната тъкан, които от своя страна отделят „фибробластно-пневмоцитен фактор“ – олигопептид, който стимулира синтеза на фосфолипиди в алвеолоцитите тип 2.
Факторите, допринасящи за развитието на СПТ, са:
- недоносеност и морфофункционална незрялост
- вътрематочни инфекции
- вътрематочна хипоксия и родова асфиксия
- остра загуба на кръв по време на раждане
- диабет при майката (инсулинът намалява производството на сърфактант)
- раждане чрез цезарово сечение
- второ раждане на близнаци
- охлаждане на детето, хипероксия, хиповолемия.
Основната връзка в патогенезата на SDR е както първичен дефицит на сърфактантната система, така и патология, като аспирация на мекониева амниотична течност, дефицит на плазминоген, едематозно-хеморагичен белодробен синдром, декомпенсиран DIC, намаляване на антипротеазната активност, което води до намаляване на синтеза или увеличаване на разграждането на фосфатидилхолини.
Хиповентилация и неадекватна оксигенация, свързани с дефицит на повърхностноактивно вещество, гръдния податливост, намален дихателен обем, нисък белодробен податливост и диспнея водят до сериозни нарушенияжизнени функции.
Недостатъчна оксигенация на тъканите метаболитни процесипри новородени те преминават към анаеробния път на окисление по-лесно, отколкото при възрастни, което води до натрупване на недостатъчно окислени метаболитни продукти в организма.
Хипоксията на черния дроб допринася за загубата на способността му да използва глюкоза, което води до нарушаване на ресинтеза на въглехидрати от млечна киселина. Повишаването на нивото на млечна киселина в кръвта по време на хипоксия достига 9,4-9,9 mmol / l (норма - 2,0-2,4 mmol / l), рН на кръвта намалява, развива се ацидоза. Увеличаването на катаболизма на въглехидратите и съответното намаляване на тяхното предлагане насърчава използването на протеини като енергиен субстрат. Характеризира се с наличие на хипогликемия, хипопротеинемия, повишена екскреция на азот, загуба на тегло.
На фона на хипоксията се наблюдава повишаване на пропускливостта на капилярите, което води до освобождаване на протеин в интерстициалното пространство, намалява онкотичното налягане и ограничава резорбцията на течността. Хипоксията и хипоксемията засягат централната нервна система, повишавайки пропускливостта на мозъчните съдове и допринасяйки за появата на кръвоизливи.
Хемодинамичните нарушения, произтичащи от синдрома на респираторни нарушения, са много опасни. Хиперкапнията води до спазъм на белодробните съдове, което води до влошаване на белодробния кръвоток, повишаване на налягането в малкия кръг и увеличаване на шунтирането на кръвта през отворения овален отвор и дуктус артериозус. серозна течносткогато налягането се повиши, той се изпотява в алвеолите, нарушавайки регионалния кръвен поток и вентилация.
Анаеробният метаболизъм влияе отрицателно на енергийния обмен в миокарда, намалявайки контрактилитета на сърцето, сърдечен дебит, увеличаване на задръстванията в малкия кръг, което от своя страна води до повишена хипоксия и хиперкапния; метаболитната ацидоза продължава да расте. киселинни храниобмените предотвратяват използването на кислород от тъканите, нарушават тъканното дишане.
Натрупването на междинни продукти на метаболизма спомага за намаляване на тонуса на прекапилярните сфинктери. Кръвта свободно прониква в капилярите, но тонусът на сфинктерите на посткапилярните вени е по-устойчив на ацидоза, което затруднява изтичането на кръв. Натрупва се в микрокапилярното легло, повишава вътресъдовата коагулация. С нарастването на дихателната недостатъчност се развива дефицит на обема на циркулиращата кръв, което също се улеснява от екстравазацията на течности. Структурни и функционални нарушениясъдов ендотел, плазмено изпотяване, възниква оток.
Клиника.
Първият знак развиващ се синдромреспираторно разстройство е задух. Въпреки че инспираторните мускули развиват голямо усилие, а трахеята и бронхите са отворени, дихателният обем намалява след първите вдишвания. Учестеното дишане се отбелязва веднага след раждането и в началото задухът (повече от 60, при много недоносени бебета - повече от 80 в минута) не е придружен от цианоза на кожата, тъй като е свързан с дразнене на хеморецепторите.
Симптомният комплекс на синдрома на респираторните нарушения включва:
- Нарастващ задух
- Раздуване на носа
- Втягане на съобразени места на гръдния кош
- Участие в акта на дишане на спомагателните мускули
- Цианозата, която се появява, когато PaCO 2 е над 30-40 mm Hg, първоначално е периорална, след това акроцианоза и генерализирана цианоза.
- Бледност на кожата
- Експираторни шумове, причинени от компенсаторен спазъм на глотиса при издишване, което предотвратява колапса на алвеолите начална фазаразвитие на респираторен дистрес синдром.
- При аускултация в белите дробове се чува отслабване на дишането, по-късно се появяват силно сухи, фино мехурчести и крепитиращи хрипове.
Тежестта на дихателната недостатъчност при недоносени новородени се определя от скалата на Силвърман (Таблица 1)
Таблица 1. Скала на Силвърман.
|
Етап 0 |
Етап 1 |
Етап 2 |
|
Горната част на гръдния кош при положение на детето по гръб и предната коремна стена участват синхронно в акта на дишане. |
Липса на синхрон или минимално спускане на горната част на гърдите при повдигане на предната коремна стена при вдишване |
Забележимо прибиране на гръдния кош по време на повдигането на предната коремна стена при вдишване |
|
Няма междуребрена ретракция при вдишване |
Леко прибиране на междуребрените пространства при вдишване |
Забележимо прибиране на междуребрените пространства при вдишване |
|
Без ретракция на мечовидния процес на гръдната кост при вдишване |
Леко прибиране на мечовидния процес на гръдната кост при вдишване |
Забележимо отдръпване на мечовидния процес при вдишване |
|
Няма движение на брадичката при дишане |
Брадичката надолу при вдишване, затворена уста |
Брадичката надолу при вдишване, отворена уста |
|
Не се чува дъх |
При аускултация на гръдния кош се чуват експираторни шумове |
При доближаване на фонендоскопа до устата или без фонендоскоп се чуват експираторни шумове |
Резултат по-малък от 5 е за начална SDR, 5 за умерена SDR, 6-9 за тежка и 10 за изключително тежка SDR.
За SDR са характерни симптомите на нарушения на кръвоносната система: понижаване на кръвното налягане, нарушения на микроциркулацията, тахикардия. При аускултация се определят приглушени тонове.
Черният дроб може да се увеличи по размер.Поради хипоксично увреждане на капилярния ендотел се развива хиповолемия, която често води до периферни отоци и задържане на течности. Характерна е депресията на централната нервна система, често се откриват перивентрикуларни кръвоизливи при дете. Остава открит въпросът кое е първичното - увреждането на мозъка или белите дробове. При по-нататъшно прогресиране на синдрома на респираторни нарушения се развива декомпенсиран DIC. Също така съществува висок рискприсъединяване на вторична инфекция - пневмония се развива при почти всяко второ дете със синдром на респираторни нарушения.
Курсът на SDR: най-голямата тежест на състоянието се наблюдава на 1-вия ден от живота, в бъдеще тежестта на клиничните прояви зависи от възникналите усложнения (интравентрикуларни кръвоизливи, синдроми на "изтичане на въздух", тежка белодробна хипертония, декомпенсиран DIC, некротизиращ ентероколит и др.)
Диагностика.
Диагнозата SDR традиционно се поставя въз основа на анамнеза, клинични и рентгенографски находки. Рентгенологично се определя триада от признаци, характерни за SDR, които се появяват още в първите часове на заболяването:
- дифузно намаляване на прозрачността на белодробните полета
- ретикулогрануларен ретикулум
- наличието на ивици на просветление в района корен от бял дроб(въздушна бронхограма)
IN тежки случаивъзможно е пълно потъмняване на белодробните полета, границите на сърцето може да не се разграничат.
IN напоследъкв арсенала на лекарите се появиха методи, които определят степента на зрялост както на самата белодробна тъкан, така и на сърфактантната система. Най-често срещаният и информативен тест е определянето на съотношението на лецитин към сфингомиелин в амниотичната течност, трахеалната течност или стомашния аспират при раждането. Ако този показател е по-голям от 3, тогава белите дробове са зрели, а ако е по-малко от 2, рискът от развитие на SDR е много висок (50-75%).
Използва се и тест за "пяна": добавянето на етанол към течност, съдържаща повърхностно активно вещество, и разклащането произвежда пяна. Същите методи могат да се използват за пренатална диагностика, но въпросът за амниоцентезата трябва да се реши индивидуално и при гестационна възраст от поне 32 седмици, тъй като при повече ранни датигестационната незрялост на белите дробове е неоспорима и управлението на бременността включва минимум инвазивни изследвания.
Диференциална диагноза извършва се с пневмония, други пневмопатии, малформации дихателната системаи други респираторни нарушения както от белодробен, така и от извънбелодробен (CHD, родова травма, метаболитни нарушения и др.) генезис. Например, когато хоанална атрезияима респираторни нарушения след първото вдишване, пристъпи на цианоза, липса на назално дишане. Диагнозата се поставя при невъзможност за преминаване на катетър от носа към назофаринкса, но най-точната е рентгеново изследванес контрастно вещество.
При диафрагмална хернияразлични респираторни нарушения тежестсвързани с размера на хернията, пристъпи на цианоза, както спонтанни, така и след хранене или при промяна на позицията на детето. Рентгеновото изследване има диагностична стойност, когато гръдна кухинасе откриват коремни органи.
Пневмония, която се е развила в първите часове след раждането, практически не се различава от SDR, диагнозата се поставя според резултатите клиничен анализхемокултури, хемокултури и съдържание на трахея, рентгенография на гръден кош; може да има други възпалителни огнища.
Ако детето има Раждане на ЦНСцианозата е по-често пароксизмална по природа, отбелязват се неврологични симптоми ( рязък спадрефлекси, конвулсии и др.), рентгенографията на гръдния кош не разкрива промени, характерни за SDR. За изясняване на диагнозата се извършва невросонография, лумбална пункция и при симптоми на увреждане на гръбначния мозък се извършва рентгенова снимка на гръбначния стълб.
Симптоми вродено сърдечно заболяване"Синият" тип понякога е трудно да се разграничи от клиничната картина на SDR, в този случай се отбелязва цианоза с CHD с момент на раждане, а при дишане на 100% кислород детето няма увеличение на PaO 2. Диагнозата се потвърждава от рентгенография на гръдния кош, ЕКГ, ехокардиография.
Лечение.
Етиологичен методлечението е въвеждането екзогенни повърхностно активни вещества . Те могат да се използват както за превантивни, така и за терапевтични цели.
Повърхностноактивните препарати попадат в четири категории:
1. естествени препарати, получени от амниотична течностчовешки (с разрешаване на доносена бременност чрез цезарово сечение)
2. естествени препарати, получени от стрити бели дробове на прасенца и телета
3. полусинтетични смеси от натрошени телешки бели дробове с дипалмитоилфосфатидилхолин (DPPC)
4. напълно синтетични повърхностно активни вещества.
С използването на естествени повърхностно активни вещества става по-бързо клиничен ефект, но крайните резултати от лечението не се различават от тези при назначаването на изкуствени ПАВ. Предполага се, че сърфактантът, изолиран от белите дробове на телета и прасенца, може да предизвика имунологична реакция към чужд протеин, но не са получени убедителни доказателства. Най-естественият за дете сърфактант за амниотична течност не може да се използва широко, тъй като лечението на едно дете изисква използването на амниотична течност от 10 цезарови сечения. Освен това има риск HIV инфекция, цитомегаловирусна инфекция, херпес.
У нас до клинично приложениеса разрешени и доста широко използвани: exosurf neonatal - синтетична дрогаи curosurf, естествен сърфактант от свински дробове.
Предотвратяването на SDR се извършва през първите 2 часа от живота:
1. новородени с тегло при раждане под 1250 g
2. новородени с тегло над 1250 g с потвърдена незрялост на белите дробове (например в съотношението на лецитин към сфингомиелин в амниотичната течност)
Лечението на SDR се прилага на възраст между 2 и 24 часа при деца с клинично и рентгенологично потвърдена диагноза SDR, които са интубирани и на апарат за дишане.
Няма противопоказания за употребата на сърфактант.При тежка асфиксия е необходима предварителна стабилизация на централното и белодробното кръвообращение.
От голямо значение при лечението на синдрома на респираторен дистрес е разпоредбата адекватна грижа . Основата е техниката „минимално докосване“. Прегледът от лекар не трябва да бъде дълъг, необходимо е да се сведат до минимум травматичните ефекти. Важно е да се поддържа оптимално температурен режим, тъй като охлаждането помага за намаляване или спиране на синтеза на повърхностноактивно вещество. Колкото по-ниско е теглото при раждане и по-малко възрастбебе, толкова по-висока трябва да е температурата в кувьоза. Важно е да се поддържа не само оптимална температура, но и влажност, за да се предотврати загубата на течност през кожата, особено при деца с изключително ниско тегло при раждане (Таблица 2).
|
Възраст /тегло |
<1000г |
1000-1500гр |
1501-2500 |
|||
|
температура |
влажност |
температура |
влажност |
температура |
влажност |
|
|
0-24 часа |
35-37 |
75-85 |
34-36 |
70-75 |
33-35 |
|
|
24-96 часа |
34-36 |
33-35 |
60-65 |
31-33 |
||
|
4-14 дни |
33-35 |
32-34 |
31-33 |
|||
|
2-4 седмици |
32-34 |
50-60 |
31-33 |
30-32 |
40-50 |
|
Децата с респираторен дистрес синдром се нуждаят от задължително непрекъснато наблюдение показатели като пулс, дихателна честота. На всеки 4 часа се определят кръвното налягане, температурата, киселинно-алкалното състояние, PaO 2, PaCO 2, нивата на глюкоза и натрий в кръвта,
IN остър периодсиндром на респираторни нарушения, е необходимо да се направи клиничен кръвен тест, рентгенография на гръдния кош, ЕКГ, биохимичен кръвен тест, ако е възможно, коагулограма, определяне на BCC най-малко 1 път на 2 дни. Необходимо е също толкова често да се провеждат хемокултури и съдържание на трахеята, невросонография.
Ентералното хранене през първите 2 дни от живота се избягва поради риск от регургитация и кардиопулмонални усложнения. Още в първия час от живота, планирано парентерално хранене . Абсолютни показания за употребата му са хемодинамични нарушения и хипоксемия (PaO 2 на артериалната кръв под 50 mm Hg). През първия ден от живота обемът на приложената течност е 30-40 ml / kg, след което постепенно се увеличава до 70-100 ml / kg до 7-ия ден от живота и до 150-180 до 1-ия месец. Обемът на течността трябва да се определя индивидуално, като се вземат предвид възрастта на детето, гестационната възраст, диурезата, bcc, динамиката на телесното тегло, състоянието на сърдечно-съдовата система, периферното кръвообращение, киселинно-алкалното състояние, методът на кърмене на детето и режимът на вентилация.
Трябва да се има предвид, че излишното количество течност може да доведе до оток, включително белодробен оток, и запазване на отворен дуктус артериозус. На първия ден от живота се въвежда 10% разтвор на глюкоза (при деца с тегло при раждане под 1000 g - 5% разтвор на глюкоза). Аминокиселините могат да се използват от края на първия - началото на втория ден от живота, на първия ден от приложението количеството протеин не трябва да надвишава 1,5 g / kg, след което постепенно се увеличава до 2,5-3 g / kg, а при деца с тегло при раждане под 1000 g - до 4 g / kg. Използват се стандартни разтвори на аминокиселини, по възможност съдържащи аминокиселината таурин (аминовеноза), т.к. намаляването на нивото му може да доведе до увреждане на мозъка и ретината.
Наличието на белодробна патология е противопоказание за парентерално приложение на мазнини до 7 дни от живота; при парентерално хранене, оставащо до тази възраст, мазнините се прилагат от 0,5 g / kg, като постепенно се увеличават до 2 g / kg. Вливането на мастни емулсии се извършва с много ниска скорост през деня. Изискванията към минералите са: натрий – 1,2 mmol/kg, калий – 0,8 mmol/kg, хлориди – 0,86 mmol/kg, калций – 3,2 mol/kg, магнезий – 0,16 mmol/kg. Използват се натриев хлорид, калиев хлорид, калциев глюконат и др.. Трябва да се има предвид, че въвеждането само на соли на солна киселина може да доведе до хиперхлоремична метаболитна ацидоза, поради което се използват и лактати, фосфати и други соли.
Времето за назначаване на ентерално хранене е индивидуално, но трябва да се отбележи, че ранното му прилагане стимулира съзряването на стомашно-чревния тракт, намалява честотата на холестазата и когато се храни с естествена кърма, намалява риска от развитие на улцерозен некротизиращ колит и за това е достатъчно да се инжектират 0,5 ml / kg / час. Останалите нужди могат да бъдат компенсирани чрез парентерално хранене. Показано е използването на естествено кърма или специализирани смеси за недоносени бебета. Пробно инжектиране на 5 ml мляко през назогастрална сонда и при липса на подуване, регургитация, апнея постепенно увеличаване на количеството на ентералното хранене.
Важна връзка в лечението на SDR е осигуряването и поддържането свободна проходимост на дихателните пътища . Необходимо е при раждане на дете в асфиксия или с мекониева аспирация да се интубира и аспирира съдържанието на дихателните пътища. При необходимост изсмукването се повтаря в хода на заболяването (като се има предвид клиничната и рентгенологичната картина), но не трябва да се забравя, че при тази манипулация възникват хипоксемия, брадикардия и хипертония, а също така се провокира развитието на вътречерепни кръвоизливи. Трахеалният дренаж се подобрява с периодични промени в позицията на детето (завъртане настрани, по корем).
В патогенезата на SDR, хипоксията и хипоксемията са от първостепенно значение и следователно най-важната роля в лечението на синдрома на респираторен дистрес се играе от кислородна терапия. При избора на метода за въвеждане на кислород и неговата концентрация в дихателната смес трябва да се има предвид, че парциалното налягане на кислорода в кръвта над 50 mm Hg вече осигурява достатъчно оксигенация, а когато PaO 2 е над 80 mm Hg, се появяват токсичните свойства на кислорода, които ще бъдат разгледани по-долу. Контрол на парциалното налягане на кислорода в артериалната кръв и фракционната концентрация на кислород в дихателна смеспозволява на лекаря да осигури достатъчна оксигенация на детето и да избегне възможните усложнения на кислородната терапия. Също така е необходимо да се контролира температурата на дихателната смес и нейната влажност. При дишане със студена смес се развива клиника на охлаждане на детето. Необходимо е овлажняване на дихателната смес при концентрация на кислород над 40%, тъй като е възможна загуба на течност поради изпотяване.
В кислородната терапия широко се използват назални катетри, маски, кислородни палатки и инкубатори, захранвани с кислород. При същата концентрация на кислород в сместа, максималната концентрация в дихателните пътища се наблюдава в кислородна палатка или инкубатор, но консумацията на кислород при тези методи на кислородна терапия е висока. Носните катетри не ви позволяват да създавате висока концентрация на кислород и освен това затрудняват носното дишане и дразнят носната лигавица. Маските за лице могат да поддържат стабилни и сравнително високи концентрации на кислород; техните недостатъци включват трудност при фиксиране и запечатване.
Спонтанно дишане с постоянно положително налягане (CPAP) предотвратява експираторното затваряне на дихателните пътища, компенсира намаленото ниво на сърфактант, предотвратява слепването на алвеолите. Газообменът се увеличава, подуването на алвеолокапилярната мембрана намалява, парциалното налягане на кислорода в артериалната кръв се повишава при постоянна концентрация в дихателната смес. Често има намаляване на PaCO 2. Хипоксемия (PaO 2 по-малко от 50 mmHg) при използване на 50% респираторна смес, свързана с нарушени съотношения на вентилация и перфузия, висок интрапулмонарен шунт, намален белодробен комплаанс, както и персистираща диспнея, оценка на Silverman от 5 точки или повече, са индикации за DPAP. Противопоказания - бронхоплеврални фистули, пневмоторакс и други синдроми на "изпускане на въздух".
В момента най-разпространеният метод за APDD е чрез назални канюли. SPDS с чанта Martin се използва по-рядко. Провеждането започва с инхалация, загрята до 32-34 0 С и навлажнена с 80-100% дихателна смес.След това под контрола на PaO 2 концентрацията на сместа се намалява до 50%. Първоначалното положително налягане е 4 cm вода. При недоносени бебета с тегло под 1500 g налягането трябва да бъде 2-3 cm воден стълб. Показанието за прекратяване на SDPPD е стабилизирането на PaO 2 над 60 mm Hg при дишане с 50% смес и налягане, равно на атмосферното. След като PADS спре, детето обикновено се поставя в кислородна палатка.
Ако при максимално възможно налягане (до 8-10 cm воден стълб) и максимална концентрация на кислород (100%) няма терапевтичен ефект, тогава детето трябва да бъде прехвърлено на изкуствена белодробна вентилация (ALV) . Използват се различни режими на вентилация - форсирана вентилация, форсирана вентилация с постоянно положително налягане в края на издишването, асистирана и високочестотна вентилация.
Адекватната механична вентилация води до елиминиране на хиперкапния и хипоксия, което е свързано с увеличаване на обема на вентилация, подобряване на съотношенията вентилация-перфузия и намаляване на интрапулмоналното маневриране. Елиминирането на респираторната ацидоза и постепенното нормализиране на pH допринася за възстановяването на метаболитните процеси. Микроциркулацията се подобрява, хемодинамиката се нормализира.
Въпреки това е необходимо да се споменат възможните неблагоприятни патофизиологични промени - механиката на дишането се променя, белодробното спазване намалява, аеродинамичното съпротивление на дихателните пътища се увеличава, дренажът на храчките се влошава, което с намаляване на сърфактанта води до развитие на микроателектаза. Повишеното налягане в белодробния тракт води до нарушение на белодробния кръвен поток - развитие на оток, екстравазация на течност в алвеолите. Характеристиките, които усложняват IVL при новородени, включват малки дихателни обеми, високи скорости на газовия поток и високо съпротивление на дихателните пътища.
Абсолютни показания за изкуствена белодробна вентилация са липсата на спонтанно дишане и патологични дихателни ритми (увреждане на ЦНС, тежка интоксикация). При постоянно прогресираща хиповентилация клиничните признаци на необходимостта от механична вентилация са: увеличаване на цианозата, увеличаване на дихателната честота 2 пъти повече от нормалното или тежка брадикардия, участие на спомагателни мускули, показатели на киселинно-алкалния баланс (PaCO 2 над 60 mm Hg или увеличение с повече от 10 mm Hg, PaO 2 под 50 при 50% от дихателната смес, ацидоза - pH под 7. 2 (въпреки въвеждането на сода в доза 2-4 mmol на kg).
Първоначалните параметри на IVL: дихателна честота 30-40 в минута и такъв дихателен обем, че максималното инспираторно налягане достига 20-25 cm воден стълб. Концентрацията на кислород се настройва от 70-80%, съотношението на вдишване към издишване е 1:1. След 10-15 минути се извършва анализ на киселинно-алкалния баланс и кръвните газове. ALV може да се счита за подходящ, ако парциалното налягане на кислорода в артериалната кръв е 50-80 mm Hg, насищането на хемоглобина с кислород е 91-96%, транскутанното напрежение на кислорода е 60-90 mm Hg, парциалното налягане на въглеродния диоксид в артериалната кръв е 35-45 mm Hg, транскутанното напрежение на CO 2 е -35-50 mm Hg. С подобряването на състоянието, на първо място, е необходимо да се намали концентрацията на кислород възможно най-бързо до нетоксично ниво - под 50%. След това постепенно намалете положителното налягане в края на издишването, намалете съотношението вдишване-издишване и едва след това намалете дихателната честота.
След механична вентилация детето се прехвърля в SDPPD с налягане от 3-5 cm вода и концентрация на кислород с 10% по-висока, отколкото при механична вентилация. Ако в рамките на 12 часа признаците на дихателна недостатъчност не се увеличат, тогава детето се екстубира.
корекция на ацидозата извършва се с 4% разтвор на натриев бикарбонат, чието количество (в ml) се определя по формулата BE x маса в kg / 4.
KKB се използва и в доза 5-8 mg / kg. Кокарбоксилазата допринася за нормализиране на рН на клетките, повишен синтез на АТФ и използване на глюкоза.
Антибактериална терапия. Предписва се от момента на диагностициране на SDR. Показано поради риска от вътрематочна инфекция и добавяне на вторична инфекция, особено по време на механична вентилация.Обикновено се предписват пеницилинови лекарства (ампицилин в доза от 150-300 хиляди U / kg / ден в 3-4 дози) или цефалоспорини (клафоран 50 mg / kg / ден в 2-3 дози, фортум 30-50 mg / kg / ден в 2 дози, лонгацеф или роцефин 50 mg/kg веднъж дневно и др.) в комбинация с аминогликозиди (амикацин или селемицин в дневна доза 10-15 mg/kg, разделена на 2 приема). Продължителността и естеството на антибиотичната терапия се определят след изследване за инфекция и получаване на резултатите от клиничния преглед кръвен теств динамика.
В терапията се използва и витамин Е (α-токоферол), който стимулира синтеза на цитохром и има сурфактант-щадящ ефект. Назначен α-токоферол в размер на 10-15 mg / ден, перорално или парентерално (под формата на 5% разтвор).
Приложението на глюкокортикоиди при деца с респираторен дистрес синдром е показано при вторична надбъбречна недостатъчност. Преди това тези лекарства са били използвани при лечението на SDR по планиран начин за ускоряване на узряването на белодробната тъкан. Широкото използване на екзогенни повърхностноактивни вещества в практиката позволи да се избегнат страничните ефекти от глюкокортикоидната терапия (артериална хипертония, стомашно-чревно кървене, некротизиращ ентероколит, хипергликемия)
Усложнения на SDR и кислородна терапия: ретролентална фиброплазия на новородени, бронхопулмонална дисплазия, синдроми на изтичане на въздух от белите дробове (пневмоторакс, пневмомедиастинум, пневмоперикард).
Ретролентална фиброплазия (RLF) се развива на фона на хипероксемия и недостатъчна васкуларизация. При високи стойности на PaO 2 (> 100 mm Hg) възниква постоянно стесняване на съдовете на ретината, което е единствената клинична проява на началния стадий на заболяването. 1-2 месеца след края на кислородната терапия съдовете на ретината се разширяват и започва тяхната пролиферация и оток на ретината. При незначителни промени често се отбелязва спонтанно възстановяване на ретината. В 25% от случаите има дезинсерция на ретината, белези и слепота. При отлепване на ретината в повече от половината от случаите той е ефективен хирургична интервенция. При късна диагноза и значимост на лезията лечението е неефективно. Поради това е необходимо да се извършва строг мониторинг на PaO 2 по време на кислородна терапия и задължително изследване на фундуса при изписване от болницата.
Бронхопулмонална дисплазия (BPD) - хронично прогресиращо белодробно заболяване, резултат от токсичните ефекти на кислорода върху белодробната тъкан. Основните причини за развитието му са концентрацията на кислород над 50% в дихателната смес и високи нива на положително налягане (над 30 cm воден стълб) по време на механична вентилация. Важна роля играе и продължителността на механичната вентилация (повече от 72 часа), степента на недоносеност на детето. При BPD почти всички белодробни структури са увредени, белодробният комплайънс намалява и аеродинамичното съпротивление на дихателните пътища и дихателната работа се увеличават. Развиват се белодробна хипоперфузия и белодробна хипертония, а по-късно - дяснокамерна хипертрофия и пулмонално сърце. Смъртността при BPD е 30-50%.
Синдроми на изтичане на въздух от белите дробове. Тази група усложнения включва:
1. интерстициален емфизем, при който въздухът се натрупва в интерстициалното пространство. Клинично слабо изразен, но може да бъде придружен от повишена нужда от кислород и повишаване на PaCO 2. Прогресията на интерстициалния емфизем в половината от случаите води до пневмоторакс. Диагностицира се само с рентген. В същото време на рентгеновата снимка се появяват кистообразни и линеарни просветления. Белодробното засягане обикновено е двустранно. С развитието на емфизема се извършват промени в параметрите на механичната вентилация (намаляване на пиковото инспираторно налягане и положителното крайно експираторно налягане).
2. пневмотораксът може да бъде спонтанен, свързан с незрялост на дихателната система и SDR, или в резултат на респираторна поддръжка (IVL, SDPPD). Смята се, че пневмоторакс се среща при 30-50% от децата със SDR и които са на апаратна вентилация. Най-често това е тежък пневмоторакс, който изисква незабавна намеса. Диагнозата се поставя въз основа на клиничните прояви: рязко влошаване на състоянието на детето, отслабване на дишането, липса на дихателен синхрон, цианоза, тахикардия; рентгенологично потвърдено: натрупване на въздух в плевралната кухина, изместване на медиастинума, колабиран бял дроб. Изисква дренаж на плевралната кухина.
3. Пневмомедиастинум. Рядко, може да бъде спонтанно. Обикновено се проявява с глухота на сърдечните тонове, задух, възможна е цианоза. Диагнозата се потвърждава рентгенологично: на страничната рентгенова снимка на гръдния кош се вижда област на просветление, разположена зад гръдната кост или в горната част на медиастинума. На директна рентгенова снимка понякога натрупаният въздух отделя сянката на сърцето от тимус("крило на пеперуда" или "платно"). Въздухът се разсейва сам специално отношениетова усложнение не е задължително.
4. пневмоперикардът е рядък. При напрегнат пневмоперикард може да настъпи сърдечна тампонада. Проявени рязко влошаванесъстояния, цианоза, тежка глухота на сърдечните тонове. Лечение: перикардна пункция.
Перивентрикуларен кръвоизлив (PVC). Най-често при деца с ниско тегло при раждане и с голяма степен на вероятност може да бъде причина за смърт (при 40% от пациентите). PVC могат да се появят както преди клинична изява SDR и на фона на респираторен дистрес синдром поради хипоксия, хиперкапния, сърдечни нарушения, респираторна и метаболитна ацидоза и др. Колкото по-тежък е респираторният дистрес синдром, толкова по-висок е рискът от развитие на перивентрикуларни кръвоизливи. Не трябва да забравяме и ятрогенната PVK, която възниква при тежки режими на вентилация, струйно инжектиране на хиперосмоларни разтвори, груби манипулации, което е свързано с повишаване или рязко колебание на системното налягане. Един от честите механизми за възникване на ятрогенни PVCs е транспортирането в друг лечебно заведениедете със SDR в острия период, особено през първите три дни от живота.
Предотвратяване на SDR.
Основният метод е предотвратяването на спонтанен аборт. Най-честите причини за преждевременно раждане са урогенитални инфекции, нервно-хормонални нарушения и излагане на външни фактори. Може би само цялостно решениетози проблем, включително подготовка на жената за бременност, саниране на възможни огнища на инфекция, правилно водене на бременност и раждане. Не трябва да забравяме и необходимостта от социална защита на бременните жени. други важен методе използването на лекарства, които ускоряват узряването на белодробната тъкан в плода, като глюкокортикоиди, аминофилин, тироксин, при липса на противопоказания за употребата им при бременни жени. Глюкокортикоидната терапия при заплаха от преждевременно раждане е широко разпространена. Понастоящем се използват основно дексаметазон (6 mg х 4 пъти с интервал от 12 часа) или бетаметазон (12 mg х 2 пъти с интервал от 24 часа).
Подобни статии
-
Когато съпругът е против дете, как да забременеете без негово знание?
Понякога можете да забременеете по небрежност. За да не се случи това, е важно да знаете как можете да заченете дете случайно и какви средства можете да използвате, за да избегнете нежелана бременност. Също така в тази статия можете да намерите информация за...
-
Какви камъни и амулети са подходящи за Телец според хороскопа и датата на раждане Талисман на слон за Телец
Април-май Телците (21 април - 20 май) са премерени, не са суетливи и колосално продуктивни! Тяхната завидна упоритост може да доведе другите до дръжката, но те знаят точно какво правят и защо имат нужда от това. Сред положителните...
-
Ограничения за достъп до данни в роли 1c
Всички настройки на потребителските права, които ще направим в рамките на тази статия, се намират в раздел 1C 8.3 „Администриране“ - „Настройки на потребител и права“. Този алгоритъм е подобен в повечето конфигурации на ...
-
1c стартира тънък клиент вместо дебел
Платформи: 1C: Enterprise 8.3, 1C: Enterprise 8.2, 1C: Enterprise 8.1 Конфигурации: Всички конфигурации2012-11-16 21362 Те се стартират чрез указване на специални ...
-
Доказателства за известни начини за кражба на ток Как да разберете кой краде ток
Повишаването на енергийните тарифи е една от поразителните характеристики на задълбочаващата се икономическа криза. В този контекст кражбата на електроенергия и проблемите, свързани с разкриването й, са от първостепенно значение.Начини за разкриване на кражба ...
-
Характеристики на монтаж на контакти и превключватели на различни повърхности
Поздрави на всички читатели на нашия блог Днес, скъпи читатели, искам да подчертая темата как да инсталирам гнезда. Тази процедура е много често търсена при подмяна на стар контакт с нов в случай на повреда, когато ...
