Sindromul de detresă respiratorie la nou-născuți. Principalele sindroame clinice în bolile aparatului respirator
Departamentul Propedeutică a Bolilor Interne
Dezvoltarea metodologică
Pentru munca independentă a studenților din anul III
Subiect: „De bază sindroame clinice pentru boli respiratorii"
Stavropol
Principalele sindroame clinice în boli
organele respiratorii
Sindromul – acesta este un set de simptome unite printr-un singur mecanism de dezvoltare (patogeneza)
Se disting următoarele sindroame pulmonare:
1. Sindromul țesutului pulmonar normal
2. Sindromul compactării focale a țesutului pulmonar
3. Sindromul compactării lobare a țesutului pulmonar
4. Sindromul de cavitate în țesutul pulmonar
5. Sindromul de atelectazie obstructivă
6. Sindromul de atelectazie compresivă
7. Sindromul de acumulare de lichide cavitatea pleurala
8. Sindrom de acumulare de aer în cavitatea pleurală
9. Sindromul excesului de aer în plămâni
10. Sindrom de îngustare bronșică cu exsudat vâscos
11. Sindromul de bronhoobstrucție
12. Sindromul fibrotoraxului sau acostarea
13. Sindrom insuficiență respiratorie
Setul de simptome pentru un anumit sindrom pulmonar este detectat la utilizarea celor principale (examen general, examinare cufăr, palpare, percuție, auscultare) și metode de cercetare suplimentare (radiografie toracică, analize de sânge și spută).
Sindromul țesutului pulmonar normal
^
Reclamatii: nu
Examinarea toracelui: pieptul este de formă regulată, ambele jumătăți ale pieptului sunt simetrice și participă în mod egal la actul de respirație. Numărul de mișcări respiratorii este de 16-18 pe minut. Respirația este ritmică, tipul de respirație este mixt.
Palpare
Percuţie: Un sunet pulmonar clar este detectat pe întreaga suprafață a țesutului pulmonar.
Auscultatie: respirația veziculoasă se aude pe toată suprafața țesutului pulmonar, nu există sunete respiratorii adverse.
Raze X: tesutul pulmonar este transparent.
Examinarea sângelui și a sputei: nicio schimbare.
^
Sindromul de compactare focală a țesutului pulmonar

Acest sindrom se caracterizează prin formarea de focare mici de compactare înconjurate de țesut pulmonar normal.
^ Apare atunci când:
A) pneumonie focală (bronhopneumonie), alveolele sunt umplute cu lichid inflamator și fibrină.
B) infarct pulmonar (alveolele umplute cu sânge)
B) pneumoscleroză, carnificare (creșterea țesutului pulmonar cu țesut conjunctiv sau tumoral)
Patomorfologie:Țesutul pulmonar este compactat, dar conține puțin aer.
^ Plângeri: dificultăți de respirație, tuse.
Inspecție generală : nicio schimbare.
Examinarea toracelui: un oarecare decalaj al jumătății „bolnave” a pieptului atunci când respiră.
Palpare: piept nedureros, elastic. Tremorurile vocale sunt intensificate cu un focar pneumonic mare situat superficial.
Percuţie
Auscultatie: respiratie bronhoveziculara, umeda fin - si
Wheezing sonor cu barbotare medie, localizat într-o anumită zonă. Bronhofonia este crescută.
Raze X: focare de infiltratie inflamatorie a pulmonara
Țesuturile alternează cu zone de țesut pulmonar normal; modelul pulmonar în „segmentul afectat” poate fi îmbunătățit.
^ Test de sange : leucocitoză moderată, VSH accelerată.
Examinarea sputei: sputa mucoasa, poate fi striata de sange, nu contine un numar mare de leucocite, eritrocite.
^
Sindromul compactării lobare a țesutului pulmonar
P  În acest sindrom, spre deosebire de sindromul compactării focale a țesutului pulmonar, întregul lob al plămânului este implicat în proces.
În acest sindrom, spre deosebire de sindromul compactării focale a țesutului pulmonar, întregul lob al plămânului este implicat în proces.
^
Apare atunci când:
A) pneumonie lobară(pleuropneumonie), alveolele sunt umplute cu lichid inflamator și fibrină.
b) pneumoscleroză, carnificare (încolțirea lobului pulmonar cu țesut conjunctiv și tumoral).
Constatări fizice în pneumonia lobară:
Patomorfologie: țesutul pulmonar este compactat, dar conține o oarecare cantitate de aer (stadiul I-III), țesutul pulmonar este dens și lipsit de aer (stadiul II).
^ Plângeri: durere în piept, dificultăți de respirație, tuse.
Inspecție generală: acrocianoza triunghiului nazolabial, erupții cutanate herpetice pe buze, nas.
Examinarea toracelui: întârzierea jumătății „bolnave” a toracelui la respirație.
Palpare: durere in jumatatea toracelui afectata, tremor vocal este usor crescut (stadiul I-III), crescut semnificativ (stadiul II).
Percuţie: matitatea sunetului de percuție cu o tentă timpanică în stadiile I-III, totuși în stadiul II (plămân dens fără aer).
Auscultatie: respirație veziculoasă slăbită cu nuanță bronșică în stadiile I-III, bronșică în stadiul II. Crepitație inițială (crepitatio indux) în stadiul I, crepitație de rezoluție (crepitatio redux) în stadiul III.
Bronhofonia este ușor sau semnificativ crescută. Poate exista o frecare pleurală.
Raze X: întunecare omogenă a țesutului pulmonar, acoperind un segment sau lob al plămânului.
^ Test de sange : leucocitoză, VSH accelerată.
Examinarea sputei: sputa mucopurulenta, amestecata cu sange (“ruginit”), contine multe leucocite, eritrocite
^
Sindromul cavităţii pulmonare
Pentru a diagnostica o carie folosind metode de examinare fizică, aceasta trebuie să îndeplinească următoarele condiții:
Diametrul cavității trebuie să fie de cel puțin 4 cm.
cavitatea trebuie conectată la bronhie.
cavitatea trebuie să fie „goală”.
cavitatea este „veche”, cu margini dense.
cavitatea trebuie localizată superficial.
Acest sindrom apare atunci când:
a) abces pulmonar
b) bronşiectazie
D) cu colapsul țesutului pulmonar
Reclamații: tuse cu spută purulentă în cantități mari, mai des gura plina, temperatura septică cu transpirații nocturne abundente (caracteristice abcesului pulmonar, bronșiectaziei), tuse cu spută sângeroasă sau striată de sânge (cu tuberculoză cavernoasă, colaps al țesutului pulmonar).
^ Inspecție generală: acrocianoză, cianoză difuză, modificări ale falangelor terminale (“ Tobe", "ochelari de ceas").
Examinarea toracelui: întârzierea jumătății „bolnave” a toracelui la respirație, tahipne.
Palpare: uneori pieptul este dureros, tremorurile vocii sunt crescute.
Percuţie: sunet de timpan tern, cu o cavitate mare situată la periferie - sunet de timpan cu tentă metalică.
Auscultatie: respirație bronșică sau amforică, șuierătură sonoră umedă cu bule medii și mari. Bronhofonia este crescută.
Raze X: Pe fondul întunecării, se observă curățarea țesutului pulmonar cu un nivel de lichid orizontal.
^ Test de sange : hiperleucocitoză, VSH accelerat semnificativ, posibilă anemie.
Examinarea sputei: sputa este purulentă, poate fi amestecată cu sânge, conține un număr mare de leucocite, poate conține globule roșii, fibre elastice.
^
Sindromul de atelectazie obstructivă
Cu acest sindrom, colapsul țesutului pulmonar este observat ca urmare a blocării parțiale sau complete a unei bronhii mari de către o tumoare, ganglioni limfatici măriți sau un corp străin.
Patomorfologie: când bronhia este complet blocată, aerul nu intră în plămâni, țesutul pulmonar este dens. Cu blocarea parțială a bronhiilor, țesutul pulmonar este compactat, dar conține o cantitate mică de aer.
^ Plângeri: scurtarea severă a respirației, tuse, durere în piept.
Inspecție generală: paloare piele, cianoză moderată.
Examinarea toracelui: cu blocaj prelungit, are loc o retragere a jumătății „bolnave” a toracelui (țesutul pulmonar colaps ocupă mai puțin spațiu), tahipnee, întârziere a jumătății „bolnave” în timpul respirației profunde.
Palpare: oarecare rigiditate a jumătății afectate a toracelui. Tremorurile de voce sunt slăbite cu blocarea parțială a bronhiei, slăbită brusc sau deloc cu blocarea completă a bronhiei aferente (nu există condiții pentru trecerea aerului).
Percuţie: cu blocarea incompletă a bronhiei se aude un sunet de timpan plictisitor, cu blocaj complet - un sunet absolut plictisitor.
Auscultatie: respirația este slăbită, veziculoasă sau nu se aude deloc. Bronhofonia este slăbită brusc sau nu este observată deloc.
Raze X: umbră omogenă în zona atelectaziei. Inima și vase mari tras pe partea „bolnavă”.
Examinarea sângelui și a sputei: Nu vor fi schimbări semnificative.
^
Sindromul de atelectazie de compresie
Acest sindrom se observă atunci când țesutul pulmonar este comprimat din exterior de lichid (hidrotorax) sau aer (pneumotorax).
Patomorfologie: țesutul pulmonar este compactat, dar conține o anumită cantitate de aer, deoarece legătura cu bronhiile nu este întreruptă și aerul continuă să curgă în plămâni.
^ Plângeri: dificultăți de respirație, tuse, dureri în piept.
Inspecție generală: cianoză, modificări ale falangelor terminale („bețișoare de tobă”).
Examinarea toracelui: proeminență a jumătății „bolnave” a toracelui din cauza acumulării de lichid sau aer în cavitatea pleurală, tahipnee, întârziere a jumătății „bolnave” la respirație.
Palpare: rigiditatea jumătății „afectate” a toracelui, tremurul vocal este ușor crescut.
Percuţie: slăbiciune cu o tentă timpanică.
Auscultatie: respirație veziculoasă slăbită cu o nuanță bronșică sau bronșică (au fost create condiții pentru aceasta conducere – pulmonarățesătura este groasă).
Raze X: în zona atelectaziei există o umbră omogenă asociată cu bronhiile.
^ Examinarea sângelui și a sputei : Nu vor fi schimbări semnificative.
Sindromul de acumulare de lichid în cavitatea pleurală
(hidrotorax)
Acest sindrom se caracterizează prin acumularea de lichid neinflamator (transudat) - în caz de insuficiență cardiacă sau acumulare de lichid inflamator (pleurezie exudativă) sau acumulare de sânge (în caz de leziune toracică, diateză hemoragică).
Reclamații: la pleurezie exudativă(durere în piept, dificultăți de respirație, tuse, febră), cu insuficiență cardiacă (durere la nivelul inimii, palpitații, durere în hipocondrul drept, umflare).
^ Inspecție generală
Examinarea toracelui: proeminență a jumătății „bolnave” a toracelui (gradul de proeminență depinde de cantitatea de lichid), tahipnee, întârziere a jumătății „bolnave” la respirație.
Palpare: pe partea afectată pieptul este dureros și rigid. Tremorurile de voce sunt puternic slăbite sau absente, în funcție de cantitatea de lichid din cavitatea pleurală.
Percuţie: adesea un sunet surd (femural). În timpul stagnării, nivelul lichidului este scăzut și orizontal pe ambele părți. În cazul pleureziei exudative, nivelul lichidului poate fi ridicat, matitatea este determinată de linia oblică a lui Damoiseau pe o parte.
Auscultatie: respirația este brusc slăbită sau absentă, în funcție de cantitatea de lichid din cavitatea pleurală. Pe partea sănătoasă, se aude respirația veziculoasă crescută. Poate exista o frecare pleurală.
Bronhofonia este puternic slăbită sau absentă.
Raze X:întunecare omogenă în partea afectată a câmpului pulmonar, deplasarea organelor mediastinale, adesea în partea opusă, cu pleurezie tumorală, organele mediastinale sunt trase spre partea „bolnavă”.
^ Examinarea sângelui și a sputei : cu pleurezie exudativă - leucocitoză, VSH accelerată.
Sindromul de acumulare de aer în cavitatea pleurală
(pneumotorax)

Apare atunci când bronhiile comunică cu cavitatea pleurală (localizarea subpleurală a cavității tuberculoase, abces), cu traumatisme toracice, pneumotorax spontan sau cu introducerea artificială de aer în cavitatea pleurală cu scop terapeutic pacienții cu tuberculoză cavernoasă.
^ Plângeri
Inspecție generală: piele palidă, cianoză.
Examinarea toracelui: proeminență a jumătății „bolnave” a toracelui, în care s-a acumulat aer, netezirea spațiilor intercostale, tahipnee, întârziere a jumătății „bolnave” la respirație.
Palpare: durere, rigiditate a jumătății afectate a pieptului. Tremorurile de voce sunt puternic slăbite sau nu sunt prezente.
Percuţie: sunet timpanic puternic uneori cu metal umbră.
Auscultatie: respirația este slăbită, veziculoasă sau nu se aude. Bronhofonia este puternic slăbită sau absentă.
Raze X: un câmp pulmonar ușor fără model pulmonar, iar mai aproape de rădăcină există o umbră a unui plămân prăbușit.
^ Examinarea sângelui și a sputei : Nu vor fi schimbări semnificative.
Sindromul excesului de aer în plămâni (emfizem)
Acest sindrom se observă atunci când faza expiratorie este dificilă (reducerea lumenului bronhiilor din cauza spasmului sau umplerii lor cu exudat, scăderea elasticității țesutului pulmonar), plămânii se extind, conținutul de aer din ei crește, dar excursie de respirație ele scade.
Patomorfologie: aerisire crescută a țesutului pulmonar.
Reclamații: dificultăți de respirație, tuse.
^ Inspecție generală: umflarea feței, cianoză, umflarea venelor gâtului.
Examinarea toracelui: piept în formă de butoi,
Spațiile intercostale sunt lărgite, fosele sub și supraclaviculare sunt netede sau bombate, mișcări de respirație pieptul este redus în volum, tahipne.
Palpare: pieptul este rigid. Tremorurile de voce sunt slăbite.
Percuţie: Un sunet de cutie este detectat pe toată lungimea țesutului pulmonar, marginile inferioare ale plămânilor sunt coborâte și excursia marginilor inferioare ale plămânilor este limitată.
Auscultatie: respirație veziculoasă uniform slăbită, rafale uscate și umede.
Raze X: transparență crescută a câmpurilor pulmonare, slăbirea modelului pulmonar, localizare scăzută și mobilitate scăzută a diafragmei.
Examinarea sângelui și a sputei: Nu vor fi schimbări semnificative.
^
Sindrom de constricție bronșică cu exsudat vâscos
E  acest sindrom este cel mai tipic pentru acută sau bronșită cronică, în care există inflamația mucoasei bronșice și umplerea lumenului bronșic cu o secreție vâscoasă.
acest sindrom este cel mai tipic pentru acută sau bronșită cronică, în care există inflamația mucoasei bronșice și umplerea lumenului bronșic cu o secreție vâscoasă.
^ Reclamații: tuse, poate dureri în piept.
Inspecție generală: acrocianoză, piele palidă.
Examinarea toracelui: nu vor fi schimbări semnificative.
Palpare: piept nedureros, elastic. Tremorul de voce se desfășoară bine, în mod egal pe ambele părți.
Percuţie: Un sunet pulmonar clar este detectat pe întreaga suprafață a țesutului pulmonar.
Auscultatie: respirație grea, respirație șuierătoare uscată de înălțime și timbru variate.
Raze X: întărirea modelului pulmonar.
^ Test de sange: leucocitoză moderată, VSH accelerată.
Examinarea sputei: Sputa este mucoasă, mucopurulentă și conține un număr mic de leucocite.
^
Sindromul de bronhoobstrucție
D  Acest sindrom se caracterizează printr-o încălcare obstrucție bronșică din cauza bronhospasmului, inflamației și umflării mucoasei bronhiilor de calibru mic (cronic bronșită obstructivă, astm bronsic).
Acest sindrom se caracterizează printr-o încălcare obstrucție bronșică din cauza bronhospasmului, inflamației și umflării mucoasei bronhiilor de calibru mic (cronic bronșită obstructivă, astm bronsic).
^ Plângeri: tuse, dificultăți de respirație.
Inspecție generală: cianoză, „tobe” (modificări ale falangelor terminale).
Examinarea toracelui: tahipnee, cu obstrucție bronșică prelungită - toracele are formă de butoi, mișcările respiratorii sunt reduse în volum.
Palpare: pieptul este oarecum rigid, tremorul vocal este slăbit.
Percuţie: ușoară slăbiciune a sunetului de percuție cu o nuanță în formă de cutie.
Auscultatie: respirația este aspră sau veziculoasă slăbită cu o masă de împrăștiat uscat, iar în părțile inferioare, umedă, fină, șuierătoare non-vocală.
Raze X: transparență crescută a țesutului pulmonar, poziție joasă a cupolei diafragmei și limitarea mobilității acestuia.
^ Test de sange : leucocitoză, VSH accelerată, poate fi eozinofilie, limfocitoză.
Examinarea sputei: sputa este mucoasa, mucopurulenta, contine un numar mic de leucocite si eozinofile.
^
Sindromul fibrotoraxului sau acostarea
P  În acest sindrom, se observă înlocuirea țesutului pulmonar țesut conjunctiv, datorită unui proces inflamator de lungă durată de diverse etiologii.
În acest sindrom, se observă înlocuirea țesutului pulmonar țesut conjunctiv, datorită unui proces inflamator de lungă durată de diverse etiologii.
^ Plângeri: dificultăți de respirație, dureri în piept.
Inspecție generală: piele palidă, cianoză.
Examinarea toracelui: retragerea jumătății „bolnave” a toracelui, tahipnee, întârziere a jumătății „bolnave” în timpul respirației profunde.
Percuţie: matitatea sunetului de percuție.
Auscultatie: respirația este slăbită, veziculoasă sau nu se aude. Zgomot de frecare pleurală. Bronhofonia este puternic slăbită sau absentă.
Raze X: în zona fibrotoraxului există o umbră omogenă.
Examinarea sângelui și a sputei: Nu vor fi schimbări semnificative.
^
Sindromul de detresă respiratorie
Insuficiență respiratorie (DN) este o stare a organismului în care menținerea normală compozitia gazelor sânge sau se realizează datorită funcționării mai intense a dispozitivului respiratie externa si inima, ceea ce duce la scadere funcţionalitate corp.
Schimbul normal de gaze în plămâni este posibil cu o relație clară între cele trei componente.
1) ventilație
2) difuzia gazelor prin membrana alveolo-capilara
3) perfuzie sânge capilarîn plămâni
Cauzele DN pot fi orice procese patologice din organism sau factori nefavorabili mediu inconjurator, care afectează cel puțin una dintre aceste componente.
Există două grupuri de DN:
cu afectare predominantă a mecanismelor pulmonare
cu implicarea predominantă a mecanismelor extrapulmonare
Obstrucția majorului tractului respirator
Mică obstrucție a căilor respiratorii
Reducerea țesutului pulmonar
Tulburare de restricție a țesutului alveolar
Dereglarea fluxului sanguin pulmonar
Încălcarea raporturilor ventilație-perfuzie
Îngroșarea membranei alveolo-capilare
1. Încălcarea reglementării centrale a respirației
2. Leziuni ale mușchilor respiratori
3. Leziuni toracice
În funcție de cauzele și mecanismul DN, se disting trei tipuri de încălcare a funcției de ventilație a plămânilor:
-obstructiv
-restrictiv
-amestecat
Pentru tip obstructiv (Fig. 1) se caracterizează prin dificultăți în trecerea aerului prin bronhii din cauza inflamației bronhiilor, bronhospasmului, îngustării sau compresiei traheei și bronhiilor mari. Dintre fazele respirației, expirația este afectată predominant.
Într-un studiu spirografic, se observă o scădere a ventilației pulmonare maxime (MVL) și a volumului expirator forțat în 1 s. (FVC) cu o ușoară scădere capacitate vitala plămânii (VC).
 Fig.1
Fig.1
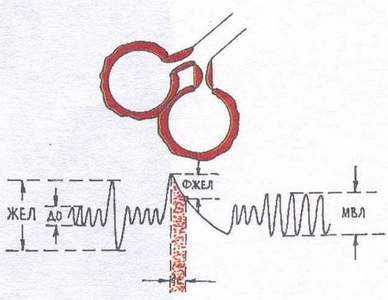
Tip restrictiv (Fig. 2) se observă tulburări de ventilație atunci când capacitatea plămânilor de a se extinde și colaps este limitată (hidrotorax, pneumotorax, pneumoscleroză, cifoscolioză, aderențe pleurale masive, osificare a cartilajelor costale, mobilitate limitată a coastelor). Dintre fazele respirației, inhalarea este predominant afectată. Un studiu spirografic arată o scădere a VC și MVL.
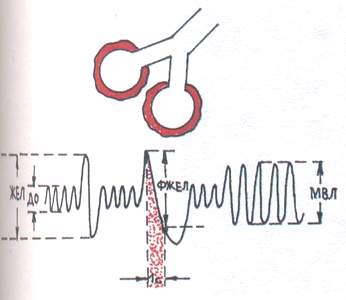 Fig.2
Fig.2
Tip mixt (Fig. 3) apare în bolile pulmonare și cardiace de lungă durată și combină semnele a 2 tipuri de afectare a ventilației (obstructivă și restrictivă), adesea cu predominanța unuia dintre ele.
^
Fig.3
Există trei grade de DN
1 lingura.respirația scurtă apare atunci când este disponibilă anterior activitate fizica, cianoza este absentă, oboseala este rapidă, mușchii respiratori auxiliari nu sunt implicați în respirație.
al 2-lea. respirația scurtă apare la efortul obișnuit, cianoza este ușor exprimată, oboseala este pronunțată și în timpul exercițiilor, mușchii auxiliari sunt implicați în respirație.
al 3-lea. scurtarea respirației în repaus, cianoza, oboseala este pronunțată, mușchii auxiliari sunt implicați în mod constant în respirație.
Prezența DN și gradul său se judecă după gravitatea acestuia semne clinice cum ar fi dificultăți de respirație, tahicardie, cianoză și modificări ale volumele de mareeși containere. Datele din metodele de examinare fizică vor depinde de boala de bază cu care este asociată dezvoltarea insuficienței respiratorii.
N.A.Mukhin, V.S.Moiseev. Propedeutica bolilor interne. – M., 2002
A.V. Strutynsky „Fundamentele semioticii bolilor” organe interne" - Moscova -. MED-press-inform.- 2007.
Întrebări de control
Ce sindroame pulmonare principale cunoașteți?
Caracteristici distinctive ale auscultației în stadiile I, III și II ale pneumoniei lobare?
Pentru ce boli este cel mai tipic sindromul compactării focale a țesutului pulmonar?
Cum se va schimba analiza generala sânge și spută în caz de sindrom de cavitate în țesutul pulmonar?
Ce cavitate din țesutul pulmonar este descoperită prin metodele de examinare fizică?
De ce, în cazul atelectaziei obstructive, respirația este slăbită vezicular sau nu se aude deloc?
Ce sunet de percuție este cel mai caracteristic sindromului de obstrucție bronșică?
Cum se schimbă tremorul vocal cu sindromul de condensare lobară?
De ce jumătatea „afectată” a toracelui este rigidă în sindromul de atelectazie compresivă?
Ce plângeri are un pacient cu sindrom hidrotorax?
Ce înseamnă un cufăr de butoi și pentru ce boli este tipic?
Care este mecanismul de dezvoltare a sindromului de emfizem pulmonar?
Ce modificări la radiografie se observă cu pleurezia exudativă și insuficiența cardiacă congestivă?
Ce menține schimbul normal de gaze în plămâni?
Care sunt cele trei tipuri de disfuncție a ventilației pulmonare?
sindromul termenilor tulburări respiratorii(LA MULȚI ANI), sindrom de detresă respiratorie(RDS) și boala membranei hialine (HMD) sunt sinonime în literatura străină. De exemplu, în cele mai populare manuale de neonatologie din Statele Unite, termenii sunt utilizați pentru a descrie aceeași afecțiune (boală): în a 7-a ediție a Averys Diseases of the Newborn (1998) - boala membranei hialine, iar în a 7-a ediție Neonatal -Medicina perinatala (Ed. A.A.Fanaroff si R.J.Martin, 2002) - sindromul de detresa respiratorie. Preferăm conceptul de sindrom de detresă respiratorie.
Frecvența dezvoltării SDR în medie depinde de gradul de prematuritate al nou-născutului și este în medie de 82-88% pentru nașterea unui copil la o perioadă de gestație mai mică de 27 de săptămâni, 78-80% - la o perioadă de 27-28 săptămâni, 70% - pe o perioadă de 29 -30 săptămâni, 50-55% - pe o perioadă de 3 1 - 3 2 săptămâni, 20-22% - pe o perioadă de 33-34 săptămâni, 5 - 1 0% - pentru o perioadă de 35-36 săptămâni. și mai puțin de 1 - 2% - la o vârstă gestațională de 37 de săptămâni. și altele.
HDM (tip I SDR, RDS) și consecințele sale sunt cauza a 30-50% din decesele neonatale.
Etiologie. Factori cauzali dezvoltarea B GM sunt:
deficiența formării și eliberării surfactantului;
defect de calitate al surfactantului;
inhibarea și distrugerea surfactantului;
imaturitatea structurii țesut pulmonar. Toate aceste procese sunt facilitate de:
prematuritate;
infecții intrauterine;
hipoxie perinatală, asfixie și ischemie pulmonară și acidoză cauzată de acestea;
retinopatie a prematurității;
Local, pulmonar:
sindroame de scurgeri de aer;
edem pulmonar;
pneumonie;
hemoragii în plămâni;
displazie bronhopulmonară;
Tulburări asociate cu poziție incorectă sau blocarea tuburilor respiratorii, afectarea laringelui și a traheei (îngustarea spațiului subglotic, edem, stenoză, eroziune, granulom).
Managementul pacienților cu GBM necesită ca neonatologul să combine cunoștințe profunde despre fiziologia vârstei, algoritmi terapie intensivăși stăpânirea artei analizei constante a dinamicii simptome clinice, simpatie, empatie pentru copil. Este necesară monitorizarea constantă a parametrilor vitali de bază și, ca feedback, ajustarea rapidă atât a ventilației mecanice, cât și a parametrilor de perfuzie. terapie medicamentoasă. Se pare că la mulți copii cu HBM, severitatea afecțiunii după prima zi de viață se datorează nu atât severității inițiale a bolii pulmonare cât leziunii acestora (cu deficiență secundară de surfactant) cu inadecvare (nu variază în funcție de răspunsul copilului) parametrii ventilației mecanice, perfuzie excesivă sau insuficientă, terapie medicamentoasă, răcire.
Diagnosticul se pune pe baza tabloului clinic și a radiografiei toracice.
Radiologic, HBM se caracterizează printr-o triadă de simptome care apar în primele 6 ore de viață:
focare simetrice difuze cu transparență redusă (simptom de sticlă șlefuită fără sau cu semne de plămâni reticulari);
bronhograma aeriana;
pneumatizarea redusă a câmpurilor pulmonare periferice.
Aceste modificări larg răspândite se disting mai bine în părțile inferioare ale plămânilor și la vârfuri. În plus, sunt vizibile o scădere a volumului pulmonar, severitatea variabilă a cardiomegaliei (creșterea indicelui cardiotoracic), modificările nodo-reticulare (diverși autori le descriu ca fiind reticulare, mozaic, granulare, cu mărgele etc., dar încă sunt în prezent). interpretată mai des ca atelectazie difuză).
Pentru sindromul edematos-hemoragic, sunt tipice o scădere a dimensiunii câmpurilor pulmonare și o imagine neclară cu raze X, care clinic este adesea combinată cu eliberarea de lichid spumant cu sânge din gură.
Dacă semnele de HD menționate nu sunt detectate pe radiografii la 3 ore după naștere, atunci diagnosticul de HD este îndoielnic. Caracteristicile radiografice ale SDR sunt nespecifice (de exemplu, sunt similare cu cele ale pneumoniei streptococice B), dar radiografiile toracice sunt încă necesare pentru a exclude alte afecțiuni care uneori necesită intervenție chirurgicală. Semnele cu raze X ale HD dispar după câteva ore sau 1 până la 3 zile, în funcție de severitatea bolii, natura terapiei, în special dacă a fost utilizat sau nu surfactant exogen.
R. J. Rodrigues şi colab. (2002) subliniază că chiar și în majoritatea centrelor de nou-născuți din Statele Unite, la diagnosticarea SDR, se bazează doar pe date clinice și radiologice, deși, desigur, pentru un diagnostic corect al SDR este important să se obțină dovezi ale deficitului de surfactant. Prin urmare, uneori astăzi este folosit termenul de insuficiență respiratorie a prematurității, atunci când tratamentul unui copil prematur necesită ventilație mecanică și oxigen suplimentar, dar nu există semne tipice LA MULȚI ANI.
Diagnosticul prenatal se bazează pe faptul că lichidul pulmonar fetal din căile respiratorii intră în lichidul amniotic, iar compoziția sa fosfolipide poate fi folosită pentru a judeca maturitatea plămânilor fetali. Lichidul amniotic se obține fie prin amniocenteză, fie prin colectarea lichidului din canalul de naștere al mamei. Dacă nivelurile de lecitină și sfingomielină, fosfatidilcolină saturată in lichid amniotic, depășesc 5 mg/l sau fosfatidilglicerol - 3 µmol/l, SDR se dezvoltă foarte rar (mai puțin de 1% din cazuri). Dacă raportul lecitină/sfingo-mielină (L/S) este mai mare de 2,0, probabilitatea de SDR este de 2%, dacă este mai mică de 2,0, dar mai mare de 1,0, - 50%, iar dacă este mai mică de 1,0, -75%. Când este întârziat dezvoltarea intrauterina raportul L/C nu reflectă întotdeauna corect maturitatea funcțională a plămânilor fetali și, prin urmare, în aceste cazuri se recomandă să ne ghidăm după nivelurile absolute menționate mai sus de fosfatidilcolină saturată și fosfatidilglicerol, precum și proteinele tensioactive A. În unele centre neonatale, pentru a evalua maturitatea plămânilor fetali, recurg la studierea activității tromboplastice a lichidului amniotic și la numărarea celulelor portocalii, dar acest lucru nu este general acceptat.
Testul spumei este cel mai simplu test pentru maturitatea pulmonară. Pentru realizarea testului se folosește lichid amniotic sau 1 ml de conținut gastric obținut cu ajutorul unui cateter de polietilenă în prima oră de viață. Testul este efectuat în felul următor: adăugați 0,5 ml etanol absolut (95%) la 0,5 ml lichid amniotic sau conținut gastric. O eprubetă de sticlă (diametrul 1 cm) se agită energic timp de 15 s, după 15 minute rezultatul testului este evaluat prin apropierea eprubetei de hârtie neagră. Testul este pozitiv dacă la suprafață există un inel simplu sau dublu de bule. Testul este negativ dacă nu există bule și slab pozitiv dacă există bule mici unice în jurul meniscului, umplând 1/3 din circumferință sau mai puțin. Când test pozitiv probabilitatea de HMD este de aproximativ 4%, slab pozitivă - 20%, negativă - 60%.
Domeniul examinării (monitorizării) la copiii cu SDR:
Monitorizarea continuă a ritmului cardiac și ABP.
Oxihemoglobinometria transcutanată sau, mai bine, determinarea transcutanată a Pao2 și Paco2 în sânge arterial. Este foarte periculos să te bazezi doar pe datele unui pulsoximetru, deoarece reflectă bine severitatea hipoxemiei, dar nu răspunde la hiperoxie și chiar și la limita inferioară a normei, oxihemoglobina Raoh este de 100%. Pericolul hiperoxiei este mare: cu acesta este asociată afectarea cronică a plămânilor și a ochilor la nou-născuți.
Este optimă determinarea Pao2 și Paco2 în sângele obținut prin cateterizarea arterei ombilicale, radiale sau tibiale și din vena centrală, cu analiza diferenței arteriovenoase a tensiunii oxigenului, i.e. consumul de oxigen al țesuturilor.
La fiecare 3 - 4 ore este necesar să se măsoare și să se înregistreze în fișa de observație temperatura pielii abdominale, tensiunea arterială, diureza, CBS, nivelul glicemic și concentrația de oxigen în aerul inspirat (Fio2).
În faza acută, SDR se efectuează zilnic sau o dată la două zile:
Raze x la piept;
determinarea indicatorului hematocritului;
test clinic de sânge;
cultura sângelui și a conținutului traheal;
determinarea nivelurilor serice de azot ureic, potasiu, sodiu, calciu și magneziu, proteine totaleși albumină;
este de dorit să se determine volumul sângelui circulant, viteza fluxului sanguin cerebral și osmolaritatea sângelui;
coagulograma cu determinarea fibrinogenului si a produselor de degradare a fibrinei (dupa indicatii);
determinarea nivelului de sodiu din sânge la început - de 2 - 4 ori pe zi, deoarece există un risc mare de hipernatremie din cauza deshidratării.
Diagnosticul diferențial se realizează cu afecțiuni respiratorii atât de origine pulmonară (pneumonie, malformații pulmonare, etc.) cât și nepulmonare (tulburări respiratorii secundare - leziune intracraniană la naștere a capului sau măduva spinării, malformații cardiace congenitale, hernie diafragmatică, policitemie, tulburări metabolice si etc.). Diagnostic diferentiat cu pneumonie este prezentată mai jos.
Agenezia coanală provoacă incapacitatea de a respira pe nas și apariția cianozei și a tulburărilor respiratorii după o primă respirație normală. Secreția mucoasă copioasă care umple nasul este tipică. Malformația devine evidentă atunci când nu este posibilă trecerea unui cateter sau a unei sonde prin nas în nazofaringe. Tratamentul este chirurgical, dar căile respiratorii se introduc imediat în gură.
Fistulele traheoesofagiene se manifestă clinic prin sufocare, accese de cianoză, tuse și apariția respirației șuierătoare în plămâni în timpul sau imediat după hrănire. Studiu de contrast esofagul (cu agent de contrast solubil în apă) și bronhoscopia vor confirma diagnosticul.
Hernia diafragmatică este detectată la naștere sau imediat după aceasta prin creștere tulburare severă respiraţie. Un abdomen navicular mic și un perete abdominal anterior retractat la naștere sunt tipice. La examinare, se atrage atenția asupra mișcărilor asincrone ale jumătăților drepte și stângi ale toracelui și o deplasare a bătăilor apexului inimii, mai des spre dreapta (deoarece hernia diafragmatică din partea stângă apare de 5-10 ori mai des decât cea dreaptă. -laterale), o scurtare accentuată a tonului de percuție în partea inferioară a plămânului și absența sunetelor respiratorii aici, cianoză bruscă când copilul este poziționat pe partea sănătoasă. De o importanță diagnostică decisivă este radiografia toracică, care arată prezența în torace a unor structuri neobișnuite pentru acesta (intestine, ficat etc.). Tratamentul este chirurgical.
La copiii cu traumatisme la naștere ale creierului și măduvei spinării, împreună cu tulburări de respirație, există și semne de afectare a sistemului nervos central. Studiile auxiliare ajută și la diagnosticarea în timp util a patologiei cerebrale: neurosonografia, radiografia coloanei vertebrale, puncția lombară etc.
Malformațiile cardiace congenitale de tip albastru și sindromul circulației fetale persistente sunt uneori dificil de distins de DFS. Cu toate acestea, în primele ore de viață, copiii cu SDD au adesea o culoare normală a pielii. Când se folosește oxigen 100% pentru respirație timp de 10-15 minute, în special cu presiune pozitivă constantă în căile respiratorii, Raoh crește la copiii cu SDR, uneori chiar peste 100 Torr, în timp ce acest lucru nu se întâmplă în cazul defectelor cardiace de tip albastru. Desigur, și datele contează. examinare clinică, auscultatie, evaluare pe scara Silverman, precum si studii suplimentare (radiografie toracica, ECG, rezultate ecocardiografie).
Pneumonia cauzată de streptococi B și alți streptococi (peptost-reptococi, enterococi) oferă un tablou clinic practic imposibil de distins de BGM, deoarece provoacă inhibarea surfactantului și, prin urmare, deficiența acestuia. Valoarea diagnosticaîn acest caz, are identificarea altor focare infecțioase (etc.), rezultatele testelor clinice de sânge, culturilor de sânge și conținutului traheal.
Tratament. Protecție la temperatură. Îngrijirea vizează în primul rând prevenirea răcirii, deoarece ajută la reducerea sau chiar oprirea (la temperatura corpului de 35°C și mai jos) sintezei surfactantului și creșterea acidoza metabolica, dezvoltarea crizelor de apnee. Imediat după naștere, copilul este înfășurat într-un scutec steril încălzit, lichidul amniotic este îndepărtat de pe piele prin tamponare atentă și plasat sub o sursă de căldură radiantă și apoi într-un incubator (temperatura din incubator depinde de greutatea corporală la naștere; pt. detalii, vezi capitolul VIII). La fiecare 1 - 2 ore, temperatura corpului copilului este înregistrată, iar dacă este sub 36 ° C, atunci temperatura aerului din incubator crește cu 1 - 2 ° C, iar dacă este peste 37 ° C, atunci este redusă. (de obicei nu ar trebui să fie mai mică de 32 ° C). Mai multe detalii în capitolul VIII.
Trebuie amintit că un copil care se află întins sub o sursă de căldură radiantă pe masa de resuscitare cheltuiește cu 5-10% mai multă energie pentru menținerea temperaturii corpului decât unul într-un incubator. Prin urmare, este indicat să plasați bebelușii prematuri cu greutate corporală foarte mică, chiar și într-un incubator, într-o cameră de plastic pentru a reduce pierderile de căldură prin convecție, precum și pierderile imperceptibile de apă. Toți copiii trebuie să-și pună o șapcă pe cap, deoarece pierderea de căldură și apă din cap este foarte mare.
Este important să preveniți fluctuațiile de temperatură Mediul extern; Când examinați un copil într-un incubator, minimizați efectele traumatice - durere etc.
Examinarea medicului trebuie să fie cât mai scurtă; este deosebit de important, dacă copilul are nevoie să se întoarcă, să-și susțină capul, reducând mișcările pasive ale coloanei cervicale.
Menținerea permeabilității căilor respiratorii. La nașterea unui copil asfixiat, prezența meconiului în lichidul amniotic sub formă de Supa de mazare sunt necesare intubarea traheală și aspirarea blândă dar viguroasă a conținutului căilor respiratorii. Aspirația se repetă în faza acută boli în mod repetat, ghidat de tabloul clinic și datele auscultatorii, dar amintindu-ne că toaleta traheală provoacă hipoxemie tranzitorie, dar semnificativă, bradicardie și hipertensiune arterială, o modificare semnificativă a intensității fluxului sanguin cerebral, care poate provoca hemoragii intracraniene, leziuni paraventriculare.
Poziția copilului cu SDD pe masă sau în incubator trebuie să fie cu capul ușor întins (poziția de strănut). Pentru a face acest lucru, așezați o pernă de 3-4 cm grosime sub partea superioară a pieptului Schimbarea periodică a poziției copilului (întoarcerea ușor într-o parte, pe burtă etc.) stimulează drenajul traheal. La sfârșitul perioadei acute, aceștia recurg la masaj cu vibrații, fizioterapie și aerosoli.
Terapie cu perfuzie și nutriție. De regulă, copiii cu SDD nu sunt hrăniți enteral în primele două până la trei zile de viață din cauza riscului de complicații cardiopulmonare și regurgitare. Cu toate acestea, încă din primele ore de viață, unui copil nu trebuie să-i fie foame sau sete. În plus, este extrem de important să previi dezvoltarea hipoglicemiei. Prin urmare, deja la 30-40 de minute după naștere, începe terapia cu perfuzie planificată. Volumul lichidului administrat în prima zi de viață este de 50-60 ml/kg cu o creștere suplimentară de 20 ml/kg pentru fiecare zi ulterioară (în a 7-a zi aproximativ 140-150 ml/kg). Mai ales cu atenție este necesar să se administreze lichid și să se extindă volumul zilnic al acestuia în caz de oligurie la un copil. Când apare diureza (mai mult de 2 mi/kg/h), volumul de lichid este crescut mai îndrăzneț (până la 40 ml/kg pe zi). În timpul fazei de oligurie, volumul de lichid în exces poate ajuta la menținerea unui canal arterial permeabil, edemul pulmonar poate fi un factor risc crescut dezvoltarea ulterioară a BPD. Restaurarea diurezei este un vestitor al începutului fazei de recuperare.
În prima zi de viață, lichidul transfuzat este soluție de glucoză 5-10%, din a doua zi i se adaugă sodiu și clor cu o rată de 2-3 mol/kg/zi. şi potasiu, calciu 2 mol/kg/zi. Compoziția soluției perfuzabile este ajustată în funcție de monograma sanguină, menținând nivelul natremiei în intervalul de 135-145 mmol/l de plasmă. Pentru a preveni tromboza cateterului și a vasului regional, în special la copiii cu nutriție parenterală totală, la soluțiile perfuzate se adaugă heparină în doză de 0,2 - 0,5 unități la 1 ml de lichid transfuzat.
În general, după cum se știe, volumul și caracterul terapie prin perfuzie determinata in functie de:
dinamica greutății corporale;
dinamica ADC și intensitatea fluxului sanguin cerebral;
stat a sistemului cardio-vascular, în special starea circulației periferice;
CBS și ionograme de ser sanguin;
condițiile de îngrijire, în special adecvarea protecției temperaturii, metodele de ventilație mecanică sau IVL.
Luând în considerare toți acești parametri și corectarea volumului - sarcini complexe, necesitând atât cunoștințele, cât și priceperea unui medic, deoarece până acum nou-născuții nu sunt atât de vindecați, cât de alăptați.
Hrănirea donatorului, laptele matern sau se începe un amestec adaptat pentru prematuri când starea se ameliorează și dificultăți de respirație scade la 60 pe minut, absența apneei prelungite, regurgitare, după o administrare controlată de apă distilată în interior. Tipul de hrănire (sondă unică sau continuă gastrică sau transpilorică, biberon) depinde de disponibilitate reflex de sugere, severitatea stării. Calculul cantității de lapte - vezi capitolul VI, unde puteți citi și despre metoda de nutriție parenterală dacă starea pacientului nu permite începerea nutriției enterale.
Normalizarea compoziției gazelor din sânge se realizează prin îmbogățirea aerului inhalat cu oxigen, diverse opțiuni crearea unei presiuni crescute în căile respiratorii în timpul respirației spontane (respirație spontană cu presiune pozitivă constantă a căilor respiratorii) prin canule nazale (pCPAP - presiune nazală pozitivă continuă) la constant tensiune arterială crescută si ventilatie mecanica.
Dacă nu există semne de SDR, atunci copilul prematur este plasat într-un incubator, unde conținutul de oxigen din aer este de aproximativ 40 - 45%. Dacă în 4 ore tensiunea arterială (sau când este determinată de un senzor de piele) rămâne peste 8 kPa (60 torr = mmHg), atunci concentrația de oxigen este redusă cu 5% pe oră până la un nivel de 30 - 35%. Când Pa o 2 este mai mic de 6,6 7 kPa (5 0 torr = mm Hg), concentrația de oxigen din aerul inhalat este crescută la maxim prin instalarea unui capac în incubator deasupra capului copilului. Dacă acest lucru nu duce la normalizarea Pao2 din sânge, atunci se începe SDPPD (optim prin canule nazale).
Alte indicații pentru începerea SDP sunt:
dificultăți persistente de respirație și zgomote de expirare;
Silverman înscrie 5 puncte sau mai mult (chiar și cu culoare normală piele);
test de spumă negativ cu lichid amniotic sau conținut stomacal obținut imediat după naștere, absența fosfatidilglicerolului în ele.
Cea mai comună metodă utilizată în prezent este pCPAP; metoda Martin (punga Martin) este folosită mult mai rar. Geanta este atașată de gâtul copilului cu bandă de spumă, astfel încât degetul mic al medicului să poată pătrunde liber între geantă și gât. Presiunea expiratorie cu CPAP este de obicei în intervalul 4-6 cm de apă. Artă. (adică tubul prin care aerul iese din pungă este scufundat la această adâncime), rareori trebuie mărit în caz de rigiditate pulmonară severă la 10 cm de apă. Artă. Dacă rigiditatea plămânilor este scăzută, atunci presiunea excesivă în timpul expirației duce la o întrerupere a fluxului de sânge din creier, o scădere a fluxului său către inimă și contribuie la dezvoltarea insuficienței cardiace și a edemului cerebral.
SDPPD începe cu furnizarea de oxigen umidificat încălzit la 32-34°C, iar apoi, sub controlul efectului clinic și al PaO2 din sânge, concentrația acestuia în amestecul inhalat este redusă treptat, realizând o PaO2 sanguină arterială de 6,67-10,67 kPa. (50-80 torr = mm Hg), iar sângele arterializat din călcâi mai mult de 8 kPa este considerat potențial toxic, necesitând o scădere a concentrației de oxigen din aerul inspirat.
Dacă copilul este extrem de agitat, ceea ce este deosebit de comun cu pCPAP, se prescrie hidroxibutirat de sodiu sau seduxen, dar nu fenobarbital, care suprimă selectiv structurile expiratorii ale centrului respirator situat în medula oblongata.
Indicațiile pentru ventilația mecanică sunt:
Incapacitatea de a realiza normalizarea sângelui Pao2 pe fondul pCPAP, scor Silverman de mai mult de 5 puncte, care nu scade pe fondul pCPAP;
Pao2 este sub 8,00 kPa (60 mm Hg) cu Fio2>0,7 (F1O2 este proporția de oxigen din amestecul oxigen-aer inhalat), dar dacă greutatea la naștere este mai mică de 1250 g, atunci cu Fio2>0,4 ;
Paco2 este mai mare de 8,79 kPa (65 mm Hg) și cu greutatea corporală mai mică de 1250 g - Paco2>8,00 kPa (60 mm Hg) și pH<7,25;
Metodologie efectuarea ventilaţiei mecanice- vezi cap. XXVI.
Oxigenarea extracorporeală cu membrană este utilizată în străinătate pentru a trata copiii cu SDR extrem de severă atunci când este ineficientă metode tradiționale Ventilația mecanică la copiii cu defecte cardiace severe. Din cauza lipsei de echipamente adecvate în Rusia, nu descriem metodele sale în acest manual.
Pericolele terapiei cu oxigen:
oxigenul uscat și rece dăunează plămânilor, promovează spasmul arteriolelor, hipertensiunea pulmonară, acidoza și inhibarea sintezei surfactantului. Incalzirea oxigenului la 32-34°C este obligatorie (cu ventilatie mecanica - pana la 36-37C), la fel si umidificarea acestuia. În absența umidificatoarelor speciale, oxigenul este trecut printr-un borcan Bobrov (înălțimea coloanei de apă este de cel puțin 15 cm). Umidificarea excesivă (100% umiditate relativă pentru mai mult de 2 ore) duce la supraîncălzirea copilului, supraîncărcarea cu apă și contribuie la edem pulmonar. efect toxic deficiența de oxigen este reală atunci când Pao2 din sângele arterial este mai mare de 10,67 kPa, care durează câteva ore, ceea ce duce la afectarea ochilor, plămânilor și sistemului nervos central. Întreținerea stației de epurare. Este necesară corectarea acidozei patologice (pH mai mic de 7,25 și BE mai mult de minus 10 mmol/l) și numai după stabilirea ventilației mecanice sau IVL Dacă patologia plămânilor a dus la o afectare atât de semnificativă a CBS, atunci aceasta este o indicație directă pentru ventilație mecanică sau IVL. Cantitatea de bicarbonat de sodiu în mmol (adică numărul de ml de soluție de 8,4%) χ (valoarea BE - 5) χ greutate corporală (kg) χ 0,4. Cantitatea adecvată de bicarbonat de sodiu se administrează prin picurare sub formă de soluție 4,2% timp de 1 oră.Este important de reținut că alcaloza provoacă hemoragii intracraniene și stop respirator la prematuri.
Combaterea anemiei și hipovolemiei, hipotensiunii arteriale. În faza acută a bolii este necesară menținerea unei valori a hematocritului de cel puțin 0,4, deoarece anemia este un factor care menține hipoxia tisulară, ceea ce înseamnă deficit de surfactant, umflarea țesuturilor etc. Masa de celule roșii din sânge este transfuzată. Pentru anemie severa si curs sever Transfuzia de sânge directă este mai indicată pentru SDR, deoarece globulele roșii proaspete conțin mai mult 2,3-difosfoglicerat, care reduce hipoxia tisulară. În plus, sângele proaspăt este mai indicat pentru corectarea defectelor de hemostază în sindromul DIC decompensat și este, de asemenea, un imunoprotector pentru infecții. În același timp, transfuziile de sânge de substituție pentru SDR au fost acum abandonate, deoarece acest lucru contribuie la creșterea frecvenței și severității retinopatiei de prematuritate. La a 2-a săptămână de viață și mai târziu, indicația pentru transfuzia de globule roșii este un hematocrit sub 0,3. În prezent, indicațiile pentru transfuzia de sânge integral sunt puternic limitate din cauza pericolului de infecții (nu numai hepatita B și C, HIV, ci și citomegalovirus, deoarece 6-12% dintre donatori au citomegalovirus în sânge), izosensibilizare.
Hipovolemie (simptom pozitiv punct alb- 3 s sau mai mult), mai ales la copiii cu anemie, cel mai indicat este corectarea prin transfuzie soluție izotonă clorură de sodiu, dar puteți și transfuza plasmă proaspătă congelată sau soluție de albumină 10%. Cantitatea de medicament transfuzată este de 10-15 ml/kg greutate corporală. Se toarnă încet în flux (1-2 ml/kg/min).
Dacă, după corectarea anemiei și hipovolemiei, arterială tensiune arteriala scăzută (presiune maximă sub 45 torr, adică mm Hg), apoi încep să administreze micro-jet de dopamină (doza inițială 5 mcg/kg/min cu o creștere suplimentară conform indicațiilor la 10-15-20 mcg/kg/min) (pentru detalii, vezi capitolul XIX).
Înlocuirea deficitului de surfactant. Din primele lucrări ale lui T. Fujiwara et al. în 1980, pentru a înlocui deficitul de surfactant la sugarii foarte prematuri, a fost stabilit efect pozitiv o astfel de terapie.
În prezent, folosesc atât surfactanți naturali obținuți din plămânii bovinelor (surfactant BL domestic, dezvoltat la Sankt Petersburg de prof. O.A. Rosenberg, străin - Survanta, Alveofact, Infrasurf), porci (Curosurf), cât și sintetici (ALEK, Exosurf). , Surfaxin, „Sfenticute”.Cei mai eficienți surfactanți naturali conțin, pe lângă fosfolipide, surfactant proteina B (Tabelele 12.3, 12.4). Trebuie subliniat faptul că medicamentul Surfaxin, dezvoltat în SUA de către laboratorul Discovery, conține o combinație de fosfolipide ( dipalmitilfosfatidilcolină - DPPC, palmitil oleil fosfatidilglicerol - POPG, acid palmitic - PA) și o peptidă recombinantă, sintetică, constând din fragmente ale aminoacizilor lizină (K) și leucină (L) în secvența KLLLLKLLLL (KLLLLKLLLL recombinată). peptida are proprietățile surfactant proteina B. Enticute conține surfactant protein C recombinant.
Numeroase studii randomizate au arătat că surfactantul exogen promovează:
creșterea complianței pulmonare și a capacității reziduale funcționale, reducând astfel munca mușchilor respiratori;
scăderea în timpul ventilației mecanice Fio2 (proporția de oxigen în aerul inspirat), PIP (presiunea inspiratorie de vârf), MAP (presiunea medie a căilor respiratorii), PEEP (presiunea finală de expirare pozitivă), îmbunătățirea indicelui de oxigenare al gradientului de oxigen alveolocapilar;
reducerea mortalității în SDR (utilizarea sa profilactică este eficientă în special la copiii cu o perioadă de gestație mai mică de 30 de săptămâni atunci când sunt combinate
cu utilizarea prenatală a corticosteroizilor), sindrom de aspirație de meconiu, SDR de tip adult;
scurtarea timpului de ventilație mecanică și reducerea frecvenței efectelor secundare ale ventilației mecanice (sindroame de scurgeri de aer etc.);
reducerea incidenței MDD, IVH, retinopatie;
Nu inhibă sinteza surfactantului endogen.
Trebuie remarcat faptul că surfactanții naturali sunt mai eficienți decât cei sintetici, dar pot fi antigenici; în plus, ele sunt mai puțin stabile ca compoziție, necesită condiții de depozitare mai stricte și au o perioadă de valabilitate mai limitată și pot conține agenți prionici.
Avem experiență în utilizarea medicamentelor Curosurf și Exosurf în Spitalul de Copii nr. 1 (Sankt Petersburg). Ambele medicamente au avut efectele de mai sus. Cu toate acestea, după introducerea Curosurf, Fio2, PIP, MAP ar putea fi reduse cu aproximativ 30% după 3-3,5 ore, în timp ce după introducerea Exosurf- numai după 6 ore. După administrarea Curosurf, s-a observat o scădere a rezistenței vasculare pulmonare, o scădere a postîncărcării ventriculului drept și o creștere a preîncărcării ventriculare stângi. În același timp, s-a înregistrat o scădere a diferenței alveolo-capilare a tensiunii oxigenului și o îmbunătățire a indicelui de oxigenare. Din păcate, randomizat studii comparative Nu există nicio utilizare a surfactantului BL intern și nu avem experiență în utilizarea acestuia, dar știm de la colegii noștri că este mult mai puțin eficient pentru SDR sever decât Curosurf.
Potrivit profesorului J. Gadzinowski (2003), în studiile multicentre europene comparative randomizate (la ele participă și neonatologi din Sankt Petersburg, dar studiul este dublu-orb și nu cunoaștem încă rezultatele noastre) utilizare profilactică Surfaxin, Exosurf și S u r v a n t a la copiii cu o greutate la naștere mai mică de 1 2 5 0 g, primul medicament a fost mai eficient, ceea ce, în opinia sa, se poate datora unei îmbunătățiri mai devreme a oxigenării ( deja după câteva minute, în timp ce după utilizarea altor preparate tensioactive acest lucru se observă după 3-6 ore), un efect de durată mai lungă datorită rezistenței medicamentului sintetic Surfaxin la inhibarea de către componentele serice și oxidanți.
Efectele secundare și complicațiile terapiei cu surfactant sunt în mare parte iatrogenice. În absența monitorizării și variației adecvate a parametrilor ventilației mecanice, se pot dezvolta barotraumatism și volutraumatism pulmonar, sindroame de scurgeri de aer, hemoragie pulmonară, hiperoxie și, prin urmare, retinopatie de prematuritate, hemoragie pulmonară, IVH. Poate singurul lucru care a fost remarcat de mulți cercetători în aproape toate centrele este o creștere a frecvenței de funcționare a ductusului arterios și a atacurilor de apnee după utilizarea surfactantului exogen. Frecvența unui canal arterial funcțional la copiii tratați cu Curosurf în observațiile noastre a fost de 7,6%.
Cea mai eficientă administrare profilactică de surfactant este la naștere sau în primele 15 - 30 de minute de viață. Doza destinată administrării este preîncălzită (în decurs de 1 oră la 37°C) și turnată prin tubul endotraheal în trahee prin împingeri în 4 doze timp de 1 0 - 1 5 minute sau micro-jet folosind un infuzor peste 2 0 - 3 0 minute, cu urmatoarea m infuzie se schimba pozitia copilului. Dacă este necesar, perfuziile se repetă după 12 ore.Nu au fost observate efecte secundare severe. Se consideră extrem de importantă oprirea cât mai devreme a ventilației mecanice și transferul copilului la p SRA R. Ca urmare a acestei terapii în general preventive, frecvența și severitatea SDR sunt semnificativ reduse. Tratamentul cu surfactant al SDR deja dezvoltate sau al pneumoniei este mult mai puțin eficient decât tratamentul preventiv. În același timp, este extrem de important înainte de administrarea oricărui medicament surfactant pentru a stabiliza starea copilului și, dacă este posibil, a corecta parametrii vitali de bază. După administrarea medicamentului, este necesară o monitorizare atentă, inclusiv: parametrii ventilației mecanice, Fio2, analiza vizuală a participării mușchilor auxiliari la actul respirației, analiza transcutanată a saturației (Brog), ritmul cardiac, ADC, CBS, piept. radiografie înainte și la 3 - 6 ore după administrare. Din nou, este necesar să se varieze în mod flexibil parametrii I V L și F 1 0 2, evitând barotraumele și traumatismele volumetrice ale plămânilor și hiperoxia. S p o 2 trebuie menținută în intervalul 9 0 - 9 4%, ceea ce previne hiperoxia. Este recomandabil să nu aspirați conținutul traheei timp de 3 până la 6 ore după administrarea surfactantului.
Închiderea canalului arterial permeabil este considerată medical la copiii cu SDR conform ecocardiografiei și studiilor Doppler în a 4-a-5-a zi de viață. Tacticile de utilizare a indometacinei sau brufenului sunt prezentate în capitolul XIX.
Terapia cu antibiotice. Când se pune un diagnostic de SDR și chiar dacă este suspectat, ampicilina este prescrisă în combinație cu unul dintre aminoglicozide (de obicei gentamicina). Acest lucru se datorează, pe de o parte, faptului că infecția cu streptococ B se manifestă prin afectarea plămânilor, care nu diferă (chiar adesea din punct de vedere radiologic) de SDR și, pe de altă parte, prin transferarea pacientului la ventilație mecanică, care este adesea însoțită de infecție. Cu toate acestea, la 3 zile de la primirea rezultatelor culturilor de sânge și a testelor clinice de sânge în timp, este necesar să se decidă asupra prezenței infecției și, dacă nu există, întreruperea antibioticelor.
Terapia cu vitamine. Opinia că administrarea profilactică a vitaminei E reduce incidența displaziei bronhopulmonare nu a fost confirmată. Și totuși, este indicată administrarea intramusculară a vitaminei E la 10 mg/kg zilnic la utilizarea unui amestec oxigen-aer cu Fio2 mai mare de 0,4, deoarece aceasta reduce incidența și severitatea retinopatiei de prematuritate. Curs 7 - 1 0 injecții. Vitamina A, administrată enteral la 2000 de unități o dată la două zile, trebuie prescrisă tuturor copiilor înainte de alimentația enterală, deoarece aceasta reduce incidența enterocolitei necrozante și a displaziei bronhopulmonare.
Diuretice. Deși administrarea de furosemid crește diureza și îmbunătățește starea plămânilor, crește frecvența canalului arterial permeabil, calcificări la rinichi și diselectrolitemie și, prin urmare, nu poate fi considerată de rutină. Furosemidul este prescris numai pentru edem pulmonar și sindrom edematos.
Glucocorticoizi. Administrarea planificată a glucocorticoizilor și a derivaților acestora (dexametazona a fost folosită cel mai des pentru că are efectul tisular maxim) pentru a stimula sinteza surfactantului la toți copiii cu SDD a fost abandonată. Acest lucru se datorează introducerii în terapie și prevenire secundară SDR a preparatelor tensioactive, îmbunătățirea metodelor de suport respirator, ventilație mecanică, precum și efecte secundare terapia cu glucocorticoizi, dintre care principalele, chiar și cu un curs scurt, sunt: hiperglicemia, hipertensiune arteriala, sângerare gastrointestinală, entero necrozant și alte infecții. Glucocorticoizii sunt prescriși pacienților cu SDR care, conform datelor clinice și de laborator, au insuficiență suprarenală.
Mulți neonatologi din străinătate au ajuns la concluzia că administrarea de dexametazonă pentru laringita edematoasă postintubare sau traheita cu stenoză severă are un efect pozitiv. Formularul Neonatal (BMJ, 2000) recomandă administrarea a 4 doze de 200 mcg la intervale de 8 ore, prima doză administrată cu 4 ore înainte de extubare la copiii cu edem sau traumatism laringian.
Hormonii tiroidieni pentru tratamentul copiilor cu SDD au început să fie utilizați activ în unele clinici de nou-născuți, pe baza detectării frecvente. nivel scăzut hormonii tiroidieni la copiii foarte prematuri cu GBM. Cu toate acestea, nu există date general acceptate bazate pe rezultatele studiilor randomizate care dovedesc indiscutabil beneficiul unei astfel de prescripții și, prin urmare, este o terapie investigațională. Utilizarea intraamniotică a L-tiroxinei la gravidele cu risc ridicat este mai justificată naștere prematură, dar nici aici nu există scheme general acceptate și rezultate general acceptate.
Riboxină și inozitol, prescrise intragastric la fiecare 6 ore în doză de 40 mg/kg de la sfârșitul primei zile până în a 10-a zi de viață, conform lui M. Hallman al. (1986-1989), reduc severitatea SDR, cresc sinteza surfactantului și reduc incidența displaziei bronhopulmonare. Cu toate acestea, această metodă, precum și administrarea planificată de plasminogen la copiii prematuri, este o metodă de investigație pentru tratamentul copiilor cu SDD.
Prognosticul SDR depinde de severitatea și prezența acestuia patologie concomitentă, complicații ale terapiei. Rata mortalității copiilor cu greutatea la naștere mai mare de 1 0 0 0 g cu management rațional nu depășește 5 - 1 0 %. În primul an de viață, copiii care au suferit de SDR suferă adesea de pneumonie, iar incidența sepsisului este, de asemenea, crescută. Encefalopatia (posthipoxică) este una dintre afecțiunile (sau complicațiile) concomitente caracteristice la copiii cu SDD, iar la unii copii sunt identificate clar doar în preșcolar și varsta scolara sub formă de disfuncții cerebrale minime, tulburări de comportament și dificultăți de învățare. În acest sens, în sistemul de măsuri de reabilitare a copiilor cu SDD, este necesar să se prevadă administrarea precoce (din a 3-a - a 4-a zi) a medicamentelor care îmbunătățesc trofismul cerebral (gliatilină 1 0 - 1 5 mg/kg/zi, nootropil 50 mg/kg intravenos sau oral de 2-3 ori pe zi), observație de către un neurolog.
Prevenirea. Terapia hormonală antenatală. Administrare intramuscular sau orală mamei în caz de amenințare cu nașterea prematură la vârsta gestațională 2 4 - 3 4
betametazonă în doză de 12 mg (de 2 ori cu un interval de 24 de ore) sau
Dexametazonă 6 mg de 4 ori cu un interval de 12 ore.
Este optim ca perioada dintre încheierea terapiei hormonale și naștere să fie mai mare de 24 de ore.Efectul unei astfel de prescripții durează 10 zile, iar dacă travaliul nu are loc, atunci o singură administrare de dexametazonă în doză de 6- este indicat 12 mg.
O cursă antenatală de corticosteroizi duce nu numai la o scădere a frecvenței și severității DR, dar și reduce riscul de a dezvolta sindrom de ductus arteriosus permeabil, hemoragii intraventriculare, leucomalacie periventriculară, enterocolită necrozantă, durata și costul alăptării unui nou-născut foarte prematur. .
Studii de urmărire pe termen lung au arătat că cursul prenatal terapie hormonală nu crește frecvența boli infecțioase la nou-născuți, nu afectează dezvoltarea fizică și psihomotorie ulterioară (inclusiv rata de creștere a circumferinței capului), precum și creșterea plămânilor, nu provoacă disfuncția glandelor suprarenale, a vederii sau a auzului.
În prezent, se testează pentru aplicație practică scheme de introducere a triiodotironinei în lichidul amniotic și în mod optim - hormonul de eliberare a tirotropinei (TRH). Preparate TRH atât experimental, cât și în condiții limitate studii clinice s-a dovedit a fi foarte eficient în prevenirea SDR. Cu toate acestea, două studii mari multicentrice efectuate în SUA nu au arătat niciun beneficiu din combinație. utilizare profilactică corticosteroizi gravide în combinație cu hormoni tiroidieni și/sau TRH (Ballard R.A. și colab., 1998).
Întârzierea travaliului este utilă, deoarece dacă intervalul anhidru durează mai mult de 2 zile, SDR de obicei nu se dezvoltă, deși la astfel de copii se observă mai des sepsis și, probabil, hemoragii intracraniene.
Terapia de substituție cu surfactanți exogeni în primele 30 de minute de viață (vezi mai sus) este o metodă foarte eficientă de prevenire a SDR severă.
Termenii „sindrom de detresă respiratorie” (RDS), „sindrom de detresă respiratorie” (RDS) și „boala membranei hialine” (HMD) sunt sinonimi în literatura străină. De exemplu, în cele mai populare manuale de neonatologie din Statele Unite, termenii sunt utilizați pentru a descrie aceeași afecțiune (boală): în a 7-a ediție a Avery's Diseases of the Newborn (1998) - boala membranei hialine, iar în a 7-a ediție a Medicină Neonatală -Perinatală (Ed. A.A.Fanaroff și R.J.Martin, 2002) - sindrom de detresă respiratorie Preferăm termenul de „sindrom de detresă respiratorie”.
Frecvența dezvoltării SDR în medie depinde de gradul de prematuritate al nou-născutului și este în medie de 82-88% pentru nașterea unui copil la o perioadă de gestație mai mică de 27 de săptămâni, 78-80% - la o perioadă de 27-28 săptămâni, 70% - la o perioadă de 29 -30 săptămâni, 50-55% - pentru o perioadă de 31-32 săptămâni, 20-22% - pentru o perioadă de 33-34 săptămâni, 5-10% - pe o perioadă de 35-36 săptămâni. și mai puțin de 1-2% - la o vârstă gestațională de 37 de săptămâni. și altele.
HDM (tip I SDR, RDS) și consecințele sale sunt cauza a 30-50% din decesele neonatale.
Etiologie. Factorii cauzali ai dezvoltării HD sunt:
deficiența formării și eliberării surfactantului;
defect de calitate al surfactantului;
inhibarea și distrugerea surfactantului; "
imaturitatea structurii țesutului pulmonar.
Toate aceste procese sunt facilitate de:
prematuritate;
infecții intrauterine;
hipoxie perinatală, asfixie și ischemie pulmonară cauzate de acestea
și acidoză;
diabetul matern;
pierderea acută de sânge în timpul nașterii.
În plus, incidența HD este crescută la copiii cu:
hemoragii intraventriculare și, în general, leziuni periventriculare care au apărut înainte și în timpul nașterii;
hipofuncție tranzitorie a glandei tiroide și a glandelor suprarenale;
hipovolemie;
hiperoxie;
răcire (atât în timpul răcirii generale, cât și la respirația unui amestec oxigen-aer neîncălzit);
născut cu ajutorul Cezariana;
în al doilea geamăn de gemeni.
Stresul perinatal acut, în special prelungirea timpului de travaliu, poate reduce incidența și/sau severitatea BGM. Acest lucru arată clar de ce un factor de risc pentru dezvoltarea HD este cezariană electivă, iar creșterea duratei intervalului anhidru reduce riscul de HD.
Patogeneza. Veriga principală în patogeneza tipului SDRI (HD) este deficiența cantitativă și defectul calitativ al surfactantului.
Surfactantul este un surfactant sintetizat de alveolocitele de tip II (acoperind aproximativ 3% din suprafața alveolelor) și celulele bronșiolare fără păr (celule Clara). Este format din 90% lipide, dintre care 80% sunt fosfolipide: fosfatidilcolină (lecitină) - 70% (45-50% - oxidată, saturată și 20-25% - nesaturată), fosfatidilglicerol - 6% și alte fosfolipide - 6%; 8% - lipide neutre. 8-10% din greutatea uscată a surfactantului sunt proteine: proteine A, B, C, D.
Surfactantul are următoarele funcții principale:
previne prăbușirea alveolelor în timpul expirației;
protejează epiteliul alveolar de deteriorare și promovează clearance-ul mucociliar;
are activitate bactericidă împotriva microbilor gram-pozitivi și stimulează reacția macrofagelor din plămâni;
participă la reglarea microcirculației în plămâni și la permeabilitatea pereților alveolelor, previne dezvoltarea edemului pulmonar.
Un rol important în îndeplinirea acestor funcții de surfactant îl au proteinele, dintre care A (SpA) și D (SpD) - hidrofile - sunt implicate în mecanismele de protecție ale corpului copilului (nu sunt conținute în surfactanții pulmonari animale), și proteinele. B (SpB) și C (SpC) - hidrofob - reduc tensiunea superficială a alveolelor prin stimularea absorbției fosfolipidelor la suprafața barierei aeropurtate și favorizează distribuția uniformă a surfactantului pe suprafața alveolelor (conținut în surfactanții obținuți). din plămânii animalelor). Genele care determină sinteza proteinelor surfactante SpA și SpD sunt situate pe al 10-lea cromozom, SpB pe al 2-lea și SpC pe al 8-lea. SpA apare în lichidul amniotic uman în a 19-a săptămână de gestație, iar SpB în a 31-a; în viitor, nivelul lor crește continuu.
Mai mult, conform conceptelor moderne, cea mai importantă dintre aceste proteine este proteina surfactant B, deoarece deficiența sa ereditară sau congenitală este letală pentru om (de Mello D.E. et al., 1994; Nogee L.M., 1995; Chetcuti PAJ., Ball R.J., 1995). Deficiența SpB este moștenită într-o manieră aytozomal recesivă și se manifestă la sugarii născuți cu tabloul clinic de SDD tipic de prematuritate cu o nevoie pe termen lung de ventilație mecanică. Terapia de substituție cu surfactanți animale are doar un efect tranzitoriu. Tratamentul posibil este transplantul pulmonar.
Sinteza proteinelor surfactante este stimulată de glucocorticoizi, hormoni tiroidieni, estrogeni, adrenalină și norepinefrină și inhibată de insulină.
Surfactantul începe să fie produs la făt din săptămâna 20-24 de dezvoltare intrauterină de către celulele alveolare de tip II. Se acumulează în ele sub formă de granule osmiofile care migrează la suprafața alveolelor, unde formează o peliculă subțire în hipofază. O eliberare deosebit de intensă de surfactant are loc în momentul nașterii, ceea ce contribuie la procesul de expansiune primară a plămânilor. Timpul de înjumătățire al agentului tensioactiv este de 10-20 ore.
Există două căi pentru sinteza principalului component fosfolipidic - fosfatidilcolina (lecitină): 1) metilarea fosfatidiletanolaminei (kefalinei) folosind metiltransferaza (sursa grupării metil este metionina); 2) sinteza din citidin difosfat colină în prezența fosfocolin transferazei, care reacționează cu diglicerida. S-a stabilit că până în săptămâna 33-35 de dezvoltare intrauterină, sinteza surfactantului se realizează în principal prin metilarea etanolaminei, iar mai târziu prin fosfatidilcolin transferază.
Prima cale de sinteză a surfactanților este ușor epuizată sub influența hipoxiei, acidozei și hipotermiei. Prin urmare, se crede că sistemul surfactant se maturizează complet până în a 35-36-a săptămână de dezvoltare intrauterină. La un copil născut înainte de această perioadă, rezervele disponibile de surfactant asigură începutul respirației și formarea capacității pulmonare reziduale funcționale, dar din cauza întârzierii sintezei surfactantului din rata de descompunere a acestuia, apare o deficiență a acestei substanțe. , ceea ce duce la prăbușirea alveolelor în timpul expirației, o creștere bruscă a muncii mușchilor respiratori , deoarece datorită capacității funcționale reziduale instabile a plămânilor și a „rigidității” lor crescute, eforturile necesare pentru fiecare inflație ulterioară a plămânii ar trebui să fie la fel ca pentru prima respirație. În plus, din cauza colapsului alveolelor, nu are loc schimbul continuu de gaze în plămâni, ceea ce provoacă dezvoltarea hipoxemiei și hipercapniei.
Să lămurim că, împreună cu fosfatidilcolina pt functionare normala surfactant, celelalte componente ale sale sunt de asemenea importante, în special fosfatidilglicerolul și fosfatidilinozitol. De exemplu, în spălările din plămâni ale copiilor care au murit din cauza SDR și s-au născut din mame cu diabet zaharat, cantitatea de lecitină și sfingomielină și raportul dintre ele sunt normale, dar există un deficit de gluten fosfatidil. Pe de altă parte, la un copil foarte prematur cu un nivel scăzut de lecitină în lichidul amniotic, dar cu un conținut normal de fosfatidilglicerol, SDR nu se dezvoltă. În SDR, pe lângă dispariția fosfatidilglicerolului din surfactant, cantitatea de fosfatidilcolină saturată din acesta este redusă și crește conținutul de fosfatidilserina și sfingomielină.
Reduce sinteza surfactantului:
„rănire la rece, inclusiv utilizarea amestecului de oxigen-aer neîncălzit în timpul ventilației mecanice;
acidoză patologică;
hipovolemie;
policitemie;
hipoxemie;
hiperoxie;
barotraumatism și volutraumatism pulmonar;
infecții, atât ante, intra, cât și postnatale. Factorii enumerați deteriorează alveolele, activează sinteza citokinelor proinflamatorii, sistemul complementului și chemokinele (anafilotoxine, bradikinină etc.), ceea ce duce la creșterea permeabilității endoteliale și a edemului alveolar.
Inactivarea surfactantului și distrugerea acestuia sunt promovate de:
infecții (în special gram-negative, micoplasme);
proteine plasmatice care „s-au scurs” în alveole;
acidoză patologică;
exces de oxidanți, compuși peroxidici, citokine proinflamatorii.
Un factor predispozant important la dezvoltarea SDR este imaturitatea plămânilor la fetuși care s-au dezvoltat în condiții nefavorabile. Histologic, imaturitatea plămânilor se manifestă prin straturi largi de țesut interstițial în acini, scăderea numărului de canale alveolare și alveole, diferențierea incompletă a acinilor și o potrivire liberă a capilarelor la alveole. În plămânii copiilor care au murit din cauza SDR, pot exista atelectazie, membrane hialine și modificări edemato-hemoragice în diferite zone în același timp.
Membranele hialine constau dintr-o matrice de fibrină și resturi celulare - produsul final al fragmentelor de celule sanguine și al epiteliului deteriorat. Perioada de îmbunătățire a SDR este caracterizată prin regenerarea pereților alveolelor, alveolocitelor, inclusiv pneumocitelor de tip II și, ca urmare, o creștere a sintezei surfactantului. Membranele hialine prin ele însele nu provoacă dezvoltarea atelectaziei. La unii copii, atât clinic, cât și patomorfologic (în caz de deces), sunt puternic dominante manifestările de boală a membranei hialine, sau atelectazia primară și sindromul edemato-hemoragic. Prin urmare, termenul „sindrom de detresă respiratorie” este probabil mai popular în străinătate decât „boala membranei hialine”.
Factorii care provoacă manifestarea deficienței de surfactant sub formă de BHM sunt:
aspirarea lichidului amniotic cu meconiu (copii din mame care au suferit de lungă durată - mai mult de 4 săptămâni - gestoză);
sindromul pulmonar edemato-hemoragic (factorii de risc crescut sunt hipoxia perinatală, în special de origine mixtă, insuficiența cardiacă, deficitul de procoagulante, a cărui sinteză depinde de vitamina K, fibrinogen, defectul cantitativ și calitativ al componentei trombocite a hemostazei);
deficit de plasminogen și, prin urmare, activitate scăzută de fibrinoliză;
activitate insuficientă a antiproteazelor (oc-antitripsină și ag-macroglobulină, antitrombina III etc.);
sindromul DIC decompensat.
Pacienții cu SDR dezvoltă:
scăderea complianței, a complianței pulmonare și a capacității reziduale funcționale;
scăderea ventilației pulmonare minute și a utilizării (transportului) oxigenului în plămâni;
creșterea efortului respirator;
hipoxemie severă și hipoxie; hipercapnie;
acidoză mixtă (respirator-metabolică);
scăderea sintezei fosfolipidelor și a proteinelor tensioactive;
pronunţat hipertensiune pulmonarași hipotensiune arterială sistemică;
scăderea fluxului sanguin pulmonar eficient;
hipovolemie, tulburări de microcirculație, edem periferic, i.e. fenomene de șoc;
coagulare intravasculară difuză compensată sau decompensată (sindrom DIC compensat sau decompensat);
tulburări metabolice (hipoproteinemie, tendință la hipoglicemie, hipocalcemie, dar hiperkaliemie etc.);
hipotensiune musculară;
tulburări ale stării funcționale a creierului datorate în primul rând HIE;
disfuncție miocardică cu insuficiență cardiacă (în principal de tip ventricular drept cu șunturi de la dreapta la stânga);
instabilitate de temperatură cu tendință de răcire, în special datorită hipotiroxinemiei lor tranzitorii caracteristice;
perfuzie renală și periferică deficitară cu oligurie, edem;
obstrucție intestinală funcțională (diagrama 12.1).
Tabloul clinic. Primul semn al dezvoltării SDR de tip I (DMS)
este scurtarea respirației (mai mult de 60 de respirații pe minut), care în cazul bolii membranei hialine și a sindromului edemato-hemoragic se manifestă de obicei în prima oră după naștere, iar în cazul atelectaziei primare - în primele minute de viață. Apariția dificultății de respirație la 3 ore după naștere și mai târziu nu este tipică pentru BGM. Culoarea pielii copilului atunci când apare scurtarea respirației este normală. Motivul pentru care respirația scurtă în SDR apare pe fundalul pielii roz este afinitatea mai mare a hemoglobinei fetale pentru oxigen. Hipoxemia este considerată a fi o scădere a Pao2 din sânge la 8,67 kPa (65 torr, sau mm Hg). Cianoza la nou-născuți apare la un nivel sanguin Pao2 de 4,27-5,87 kPa (32-44 mm Hg), iar la adulți - 5,6-6,93 kPa (42-52 mm Hg). În consecință, cu hipoxemie ușoară, culoarea pielii nou-născutului poate fi roz, dar din cauza iritației chemoreceptorilor vasculari, copilul dezvoltă deja dificultăți de respirație.
Următorul simptom sunt zgomotele expiratorii numite „exhalare mârâit”. Zgomotele expiratorii sunt cauzate de faptul că, în stadiile inițiale ale SDR, un spasm al glotei la expirație se dezvoltă ca mecanism compensator (respirație de tip gâfâit), care ajută la creșterea capacității funcționale reziduale a plămânilor și previne colapsul alveolele. Cu o relaxare bruscă a epiglotei, trecerea aerului sub presiune crescută în tractul respirator sub corzile vocale provoacă zgomot expirator.
Retragerea toracelui în timpul inspirației (retracție procesul xifoid sternul, regiunea epigastrică, spațiile intercostale, fosele supraclaviculare) este al treilea semn al SDR din punct de vedere al timpului de apariție.
(l
eu
eu si
Schema 12.1. Patogenia sindromului de detresă respiratorie: IUI - infecții intrauterine; DIC - coagulare intravasculară diseminată. În același timp sau oarecum mai târziu, tensiunea aripilor nasului, atacuri de apnee, cianoză (periorală, iar mai târziu acrocianoză sau generalizată) pe fondul paloarei pielii, umflarea obrajilor (respirație „trâmbiță”), ritm cardiac rigid, respirație paradoxală (retracția anterioară perete abdominal la inspiratie), spuma la nivelul gurii (la jumatate dintre pacienti), umflarea mainilor si picioarelor. Un cufăr plat (în formă de cutie de chibrituri) este tipic.
Auscultarea în primele ore de viață, respirația puternic slăbită se aude peste plămâni, apoi, pe fondul ventilației mecanice, se aud sunete respiratorii obișnuite, normale și abia mai târziu apar rafale uscate înalte la inhalare și expirare, crepitare și râuri fine clocotite.
Simptomele comune tipice sunt:
instabilitate de temperatură cu tendință la hipotermie;
letargie, lipsă de mișcare, semne de depresie a sistemului nervos central până la adinamie, letargie și chiar comă (rețineți posibilitatea de hipoglicemie, hiperamoniemie!);
edem periferic al țesutului subcutanat;
hiporeflexie și hipotonie musculară;
hipovolemie și hipotensiune arterială;
oligurie;
regurgitare, balonare și chiar semne de obstrucție intestinală;
pierderi mari ale greutății corporale inițiale;
Extremitățile inferioare sunt adesea într-o „poziție de broască” (ca într-o leziune a coloanei vertebrale lombare).
Adesea, un copil bolnav este diagnosticat cu hemoragie intraventriculară (IVH), de obicei gradele I-II, sau semne ecografice de leucomalacie periventriculară (PVL). La un anumit copil, uneori este dificil să decideți ce este primar - afectarea plămânilor (SDR) sau a creierului (IVH, PVL). Pe măsură ce SDR progresează, în ciuda terapiei intensive, se dezvoltă semne de șoc și DIC decompensat, inclusiv sângerare de la locurile de injectare, hemoragie pulmonară etc.
Silverman a propus o scară pentru evaluarea severității tulburărilor respiratorii la nou-născuți (Tabelul 12.1).
Fiecare simptom din coloana „Stadiul I” primește 1 punct, în coloana „Stadiul II” - 2 puncte. O caracteristică specială a scalei este că nu ia în considerare semnele de insuficiență respiratorie, cum ar fi dificultățile respiratorii și cianoza, deoarece apariția acestor simptome la un nou-născut se poate datora și unor cauze non-pulmonare ale tulburărilor respiratorii. Potrivit lui Silverman, cu un scor total de 10 puncte, un nou-născut are un SDR extrem de sever, 6-9 puncte - grav, 5 puncte - severitate moderată, sub 5 - SDR de pornire.
Datele auscultatorii și de percuție în perioada inițială a SDR nu sunt demonstrative, dar mai târziu, pe fondul respirației slăbite, apar rafale împrăștiate și silențioase cu bule fine.
Tulburările cardiovasculare sunt foarte tipice pentru SDR. Inițial, se dezvoltă tahicardie și zgomote cardiace înfundate. Modificările ulterioare sunt determinate de severitatea hipertensiunii pulmonare și a tulburărilor hemoreologice. Scara Silverman Etapa 0 Etapa I Etapa II Top parte pieptul (cu copilul poziționat pe spate) și peretele abdominal anterior participă sincron la actul de respirație Lipsa sincroniei sau coborârea minimă a pieptului superior atunci când peretele abdominal anterior se ridică în timpul inspirației Depresie vizibilă a pieptului superior în timpul ridicării a peretelui abdominal anterior la inspirație Fără retracție a coastelor intercostale pe inhalare Plămân retracția spațiilor intercostale în timpul inspirației Retracția vizibilă a spațiilor intercostale în timpul inspirației Lipsa retracției procesului xifoid al sternului în timpul inspirației Retracție ușoară a procesului xifoid al sternului în timpul inspirației Retracția vizibilă a procesului xifoid al sternului în timpul inspirației Absența de mișcare a bărbiei în timpul respirației Coborârea bărbiei la inhalare, gura închisă Căderea bărbiei la inhalare, gura deschisă Nu se aud zgomote la expirare. atunci când fonendoscopul este adus la gură sau chiar fără fonendoscop Hipertensiunea pulmonară duce la persistența șunturilor fetale și a șunturilor de la dreapta la stânga. canalul arterial si foramen oval.
Datorită permeabilității vasculare crescute, se observă hipovolemie, îngroșarea sângelui și creșterea numărului de hematocrit și a concentrației de hemoglobină. Când mecanismele compensatorii sunt epuizate, tensiunea arterială scade și se dezvoltă stadiul 3 de șoc.
O altă complicație a SDR poate fi un șunt de la stânga la dreapta (prin intermediul unui ductus arteriosus patent), care este o consecință a expansiunii prea rapide a plămânilor după naștere sau a ventilației mecanice. De obicei, astfel de copii prezintă semne de hipoxie și congestionareîn plămâni la sfârșitul primei - începutul celei de-a doua săptămâni de viață, presiunea pulsului crește, se aude murmurul sistolico-diastolic pe vase.
Diagnosticul diferențial al sindromului circulației fetale persistente și al canalului arterial permeabil este prezentat în Tabelul 12.2.
Stratificarea infecției secundare reprezintă un pericol grav pentru copiii cu SDD; pneumonia se dezvoltă la 40-50% dintre pacienți.
SDR actual. Cu SDR de severitate moderată și cursul său necomplicat, severitatea maximă a afecțiunii este observată în prima zi de viață, apoi intensitatea retragerii sternului, retragerea spațiilor intercostale, precum și atacuri de apnee, umflături. , iar oliguria scade treptat. Diureza, tonusul muscular si activitatea motorie spontana cresc, starea neurologica se imbunatateste, iar necesarul de oxigen si ventilatie mecanica scade. Dacă boala nu este complicată de hemoragie intraventriculară, leucomalacie periventriculară, emfizem interstițial și alte tipuri de „scurgere de aer”, pulmonar persistent
Tabelul 12.2
Semne diagnostice diferențiale ale sindroamelor secundare cauzate de un ductus arteriosus funcțional Semn Sindrom de circulație fetală persistentă (șunt dreapta-stânga) Sindrom de ductus arteriosus patent (șunt stânga-dreapta) Asfixie și aspirație în timpul nașterii Tipic Nu tipic Ventilație mecanică în primele ore de viață Mai fi Atelectazie tipică plămânilor Tipic Rareori Apnee recurentă la sfârșitul primei - începutul celei de-a doua săptămâni de viață Poate fi Tipic Cianoză generalizată În primele zile de viață cu o nuanță de cireș La sfârșitul primei - în a doua săptămână de viață, cu o nuanță de marmură Cianoză diferențiată (în principal a picioarelor) Tipic Nu tipic Răspuns la respirație 100% oxigen Îmbunătățirea, de regulă, nu se observă, Pao2 rămâne sub 9,33 kPa Îmbunătățire, Pao devine mai mare de 10,67 kPa În capilar Sângele mâinilor, Pao este de 1,33 kPa, iar pH-ul este cu 0,02 mai mare decât în sângele picioarelor Tipic Necaracteristic Abundență de râuri creponate la inspirație, spumă roz Nu este tipic, dar poate apărea în primele zile de viață Tipic pentru sfârșitul primei zile Săptămâna de viață și mai mult Puls Slab și mic Mare și rapid, galopant Tensiune arterială Creștere sau scăzută Puls crescut cu diastolic scăzut Marginea inimii Moderat extins, predominant la dreapta Dilatată, predominant la stânga, dunga lui Herhart Dimensiunile ficatului De obicei nu crescut brusc Creșterea bruscă cu raze X a organelor toracice Atelectazie, pneumonie, rețea nodo-reticulară, inima extinsă în primul rând spre dreapta, conturează denivelările sale, sărăcirea circulației pulmonare. În stadiul III - edem pulmonar Inițial, alimentarea cu sânge a plămânilor este crescută, umflarea câmpurilor centrale și apoi periferice ale plămânilor. Inima este mărită predominant la stânga și în sus.Suflul în regiunea inimii este adesea absent sau sistolic în al doilea spațiu intercostal din stânga sternului.Sunt tipice semnele electrocardiografice de suprasolicitare a părților drepte ale inimii. Suflu sistolic și diastolic este tipic, suflu sistolic poate fi prezent sau absent.
Pe ECG, mai întâi există o suprasolicitare a părților stângi ale inimii, apoi a celor drepte
Tabelul 12.2 (continuare)
Semn Sindrom de circulație fetală persistentă (șunt dreapta-stânga) Sindromul canalului arterios patent (șunt stânga-dreapta) Examinarea cu ultrasunete a inimii (indice: atriul stâng - aortă) Mai puțin de 1,0 Mai mult de 1,3 Efectul clinic al tratamentului Glicozidele cardiace Poate fi agravare hemodinamică Tolazolină pozitivă (în vena capului) Îmbunătățire Înrăutățire Indometacin Fără modificări Îmbunătățire Droperidol O oarecare îmbunătățire Zgomot crescut
hipertensiune arterială, apoi, la mijlocul primei săptămâni de viață, copilul este mai întâi transferat la IVL (canule nazale), apoi respiră independent, este hrănit enteral,
Dar.
La copiii cu greutatea la naștere mai mică de 1500 g, SDR apare de obicei cu complicațiile enumerate mai jos (una sau mai multe), iar apoi ventilația mecanică este întârziată, uneori cu câteva săptămâni. Complicații tipice la copiii cu SDD. Sistem:
acidoză severă decompensată, șoc de origine mixtă, sindrom DIC decompensat;
hemoragii intraventriculare;
ductul arterial permeabil;
sindromul circulației fetale persistente;
sindromul ductus arteriosus permeabil;
hiperamoniemie tranzitorie;
hipoglicemie;
enterocolită necrozantă;
retinopatie a prematurității;
insuficiență renală. Local, pulmonar:
sindroame de scurgeri de aer;
edem pulmonar;
pneumonie;
hemoragii în plămâni;
displazie bronhopulmonară;
tulburări asociate cu poziția incorectă sau blocarea tuburilor respiratorii, leziuni ale laringelui și traheei (îngustarea spațiului subglotic, edem, stenoză, eroziune, granulom).
Managementul pacienților cu GBM necesită ca un medic neonatolog să combine cunoștințele profunde ale fiziologiei legate de vârstă, algoritmii de terapie intensivă și stăpânirea artei analizei constante a dinamicii simptomelor clinice, simpatia și empatia pentru copil. Sunt necesare monitorizarea constantă a parametrilor vitali de bază și, ca feedback, ajustarea rapidă atât a parametrilor ventilației mecanice, cât și a terapiei prin perfuzie și medicamente. Se pare că la mulți copii cu HBM, severitatea afecțiunii după prima zi de viață se datorează nu atât severității inițiale a bolii pulmonare cât leziunii acestora (cu deficiență secundară de surfactant) cu inadecvare (nu variază în funcție de „răspunsul” copilului) parametrii ventilației mecanice, perfuzie excesivă sau insuficientă, terapie medicamentoasă, răcire.
Diagnosticul se pune pe baza tabloului clinic și a radiografiei toracice.
Radiologic, HBM se caracterizează printr-o triadă de simptome care apar în primele 6 ore de viață:
focare simetrice difuze cu transparență redusă (simptom de sticlă șlefuită fără sau cu semne de „plămâni reticulari”);
bronhograma aeriana;
pneumatizarea redusă a câmpurilor pulmonare periferice.
Aceste modificări larg răspândite se disting mai bine în părțile inferioare ale plămânilor și la vârfuri. În plus, sunt vizibile o scădere a volumului pulmonar, severitatea variabilă a cardiomegaliei (creșterea indicelui cardiotoracic), modificările nodo-reticulare (diverși autori le descriu ca fiind reticulare, mozaic, granulare, cu mărgele etc., dar încă sunt în prezent). interpretată mai des ca atelectazie difuză).
Pentru sindromul edematos-hemoragic, sunt tipice o scădere a dimensiunii câmpurilor pulmonare și o imagine cu raze X „încețoșată”, care din punct de vedere clinic este adesea combinată cu eliberarea de lichid spumos cu sânge din gură.
Dacă semnele de HD menționate nu sunt detectate pe radiografii la 3 ore după naștere, atunci diagnosticul de HD este îndoielnic. Caracteristicile radiografice ale SDR sunt nespecifice (de exemplu, sunt similare cu cele ale pneumoniei streptococice B), dar radiografiile toracice sunt încă necesare pentru a exclude alte afecțiuni care uneori necesită intervenție chirurgicală. Semnele cu raze X ale HD dispar după câteva ore sau 1-3 zile, în funcție de severitatea bolii, de natura terapiei, în special dacă s-a folosit sau nu surfactant exogen.
RJ Rodrigues et al. (2002) subliniază că chiar și în majoritatea centrelor de nou-născuți din Statele Unite, la diagnosticarea SDR, se bazează doar pe date clinice și radiologice, deși, desigur, pentru un diagnostic corect al SDR este important să se obțină dovezi ale deficitului de surfactant. Prin urmare, uneori astăzi este folosit termenul „insuficiență respiratorie a prematurității”, atunci când tratamentul unui copil prematur necesită ventilație mecanică și oxigen suplimentar, dar radiografia toracică nu arată semnele tipice ale RDD.
Diagnosticul prenatal se bazează pe faptul că lichidul pulmonar fetal din căile respiratorii intră în lichidul amniotic, iar compoziția sa fosfolipide poate fi folosită pentru a judeca maturitatea plămânilor fetali. Lichidul amniotic se obține fie prin amniocenteză, fie prin colectarea lichidului din canalul de naștere al mamei. Dacă nivelurile de lecitină și sfingomielină, fosfatidilcolină saturată din lichidul amniotic depășesc 5 mg/l sau fosfatidilglicerol - 3 µmol/l, SDR se dezvoltă foarte rar (mai puțin de 1% din cazuri). Dacă raportul lecitină/sfingomielină (L/S) este mai mare de 2,0, probabilitatea SDR este de 2%, dacă este mai mică de 2,0 dar mai mare de 1,0, este de 50%, iar dacă este mai mică de 1,0, este -75%. În cazurile de întârziere a creșterii intrauterine, raportul L/C nu reflectă întotdeauna corect maturitatea funcțională a plămânilor fetali și, prin urmare, în aceste cazuri se recomandă să ne ghidăm după nivelurile absolute menționate mai sus de fosfatidilcolină saturată și fosfatidilglicerol, ca precum și proteinele tensioactive A. În unele centre de nou-născuți, studiile sunt utilizate pentru a evalua maturitatea plămânilor fetali, activitatea tromboplastică a lichidului amniotic și numărarea „celulelor portocalii”, dar acest lucru nu este în general acceptat.
„Testul spumei” este cel mai simplu test pentru maturitatea pulmonară. Pentru realizarea testului se folosește lichid amniotic sau 1 ml de conținut gastric obținut cu ajutorul unui cateter de polietilenă în prima oră de viață. Testul se efectuează astfel: la 0,5 ml de lichid amniotic sau conținut gastric se adaugă 0,5 ml etanol absolut (95%). O eprubetă de sticlă (diametrul 1 cm) se agită energic timp de 15 s, după 15 minute rezultatul testului este evaluat prin apropierea eprubetei de hârtie neagră. Testul este pozitiv dacă la suprafață există un inel simplu sau dublu de bule. Testul este negativ dacă nu există bule și slab pozitiv dacă există bule mici unice în jurul meniscului, umplând 1/3 din circumferință sau mai puțin. În cazul unui test pozitiv, probabilitatea HDM este de aproximativ 4%, slab pozitiv - 20%, negativ - 60%.
Domeniul examinării (monitorizării) la copiii cu SDR:
Monitorizarea continuă a ritmului cardiac și ABP.
Oxihemoglobinometria transcutanată sau, mai bine, determinarea transcutanată a Pao2 și Paco2 în sângele arterial. Este foarte periculos să te bazezi doar pe datele unui pulsoximetru, deoarece reflectă bine severitatea hipoxemiei, dar nu răspunde la hiperoxie și chiar și la limita inferioară a normalului, oxihemoglobina Raoh este de 100%. Pericolul hiperoxiei este mare: cu acesta este asociată afectarea cronică a plămânilor și a ochilor la nou-născuți.
Este optimă determinarea Pao2 și Paco2 în sângele obținut prin cateterizarea arterei ombilicale, radiale sau tibiale și din vena centrală, cu analiza diferenței arteriovenoase a tensiunii oxigenului, i.e. consumul de oxigen al țesuturilor.
La fiecare 3-4 ore este necesar să se măsoare și să se înregistreze în fișa de observație temperatura pielii abdominale, tensiunea arterială, diureza, CBS, nivelul glicemic și concentrația de oxigen în aerul inspirat (Fio2).
În faza acută, SDR se efectuează zilnic sau o dată la două zile:
Raze x la piept;
determinarea indicatorului hematocritului;
ECG;
test clinic de sânge;
cultura sângelui și a conținutului traheal;
determinarea nivelurilor serice de azot ureic, potasiu, sodiu, calciu și magneziu, proteine totale și albumină;
este de dorit să se determine volumul sângelui circulant, viteza fluxului sanguin cerebral și osmolaritatea sângelui;
coagulograma cu determinarea fibrinogenului si a produselor de degradare a fibrinei (dupa indicatii);
determinarea nivelului de sodiu din sânge la început - de 2-4 ori pe zi, deoarece există un risc mare de hipernatremie din cauza deshidratării.
Diagnosticul diferențial se realizează cu afecțiuni respiratorii atât de origine pulmonară (pneumonie, malformații pulmonare etc.), cât și nepulmonare (tulburări respiratorii secundare - leziune intracraniană la naștere a creierului sau măduvei spinării, malformații cardiace congenitale, hernie diafragmatică, policitemie, metabolice). tulburări etc.). Diagnosticul diferențial cu pneumonie este prezentat mai jos.
Agenezia coanală provoacă incapacitatea de a respira pe nas și apariția cianozei și a tulburărilor respiratorii după o primă respirație normală. Secreția mucoasă copioasă care umple nasul este tipică. Malformația devine evidentă atunci când nu este posibilă trecerea unui cateter sau a unei sonde prin nas în nazofaringe. Tratamentul este chirurgical, dar conducta de aer se introduce imediat în gură.
Fistulele traheoesofagiene se manifestă clinic prin sufocare, accese de cianoză, tuse și apariția respirației șuierătoare în plămâni în timpul sau imediat după hrănire. Un studiu de contrast al esofagului (cu un agent de contrast solubil în apă) și bronhoscopia vor confirma diagnosticul.
O hernie diafragmatică este detectată la naștere sau la scurt timp după o tulburare de respirație din ce în ce mai severă. Un abdomen navicular mic și un perete abdominal anterior retractat la naștere sunt tipice. În timpul examinării, se atrage atenția asupra mișcărilor asincrone ale jumătății drepte și stângi a toracelui și o deplasare a bătăilor apexului inimii, mai des spre dreapta (deoarece hernia diafragmatică din partea stângă apare de 5-10 ori mai des decât cea dreaptă. -laterale), o scurtare accentuată a tonului de percuție în partea inferioară a plămânului și absența sunetelor respiratorii, cianoză bruscă când copilul este poziționat pe partea sănătoasă. De o importanță diagnostică decisivă este radiografia toracică, care arată prezența în torace a unor structuri neobișnuite pentru acesta (intestine, ficat etc.). Tratamentul este chirurgical.
La copiii cu traumatisme la naștere ale creierului și măduvei spinării, împreună cu tulburări de respirație, există și semne de afectare a sistemului nervos central. Studiile auxiliare ajută și la diagnosticarea în timp util a patologiei cerebrale: neurosonografia, radiografia coloanei vertebrale, puncția lombară etc.
Malformațiile cardiace congenitale de tip albastru și sindromul circulației fetale persistente sunt uneori dificil de distins de DFS. Cu toate acestea, în primele ore de viață, copiii cu SDD au adesea o culoare normală a pielii. Când se folosește oxigen 100% pentru respirație timp de 10-15 minute, în special cu presiune pozitivă constantă în căile respiratorii, Raoh crește la copiii cu SDR, uneori chiar peste 100 Torr, în timp ce acest lucru nu se întâmplă în cazul defectelor cardiace de tip albastru. Desigur, sunt importante și datele de la un examen clinic, auscultare, evaluare pe scara Silverman, precum și studii suplimentare (radiografie toracică, ECG, rezultate ecocardiografice).
Pneumonia cauzată de streptococi B și alți streptococi (peptost-reptococi, enterococi) oferă un tablou clinic practic imposibil de distins de BGM, deoarece provoacă inhibarea surfactantului și, prin urmare, deficiența acestuia. Semnificația diagnostică în acest caz este identificarea altor focare infecțioase (meningită etc.), rezultatele testelor clinice de sânge, culturilor de sânge și conținutului traheal.
Tratament. Protecție la temperatură. Îngrijirea vizează în primul rând prevenirea răcirii, deoarece ajută la reducerea sau chiar oprirea (la o temperatură corporală de 35°C și mai jos) sintezei surfactantului și creșterea acidozei metabolice, dezvoltarea crizelor de apnee. Imediat după naștere, copilul este înfășurat într-un scutec steril încălzit, lichidul amniotic este îndepărtat de pe piele prin tamponare atentă și plasat sub o sursă de căldură radiantă și apoi într-un incubator (temperatura din incubator depinde de greutatea corporală la naștere; pt. detalii, vezi capitolul VIII). La fiecare 1-2 ore se înregistrează temperatura corpului copilului, iar dacă este sub 36 °C, atunci temperatura aerului din incubator crește cu 1-2 °C, iar dacă este peste 37 °C, atunci este redusă. (de obicei nu ar trebui să fie mai mică de 32 ° C). Mai multe detalii în capitolul VIII.
Trebuie amintit că un copil care se află întins sub o sursă de căldură radiantă pe masa de resuscitare cheltuiește cu 5-10% mai multă energie pentru menținerea temperaturii corpului decât unul într-un incubator. Prin urmare, este indicat să plasați bebelușii prematuri cu greutate corporală foarte mică, chiar și într-un incubator, într-o cameră de plastic pentru a reduce pierderile de căldură prin convecție, precum și pierderile imperceptibile de apă. Toți copiii trebuie să-și pună o șapcă pe cap, deoarece pierderea de căldură și apă din cap este foarte mare.
Este important să se prevină fluctuațiile temperaturii ambientale; Când examinați un copil într-un incubator, minimizați efectele traumatice - durere etc.
Examinarea medicului trebuie să fie cât mai scurtă; este deosebit de important, dacă copilul are nevoie să se întoarcă, să-și susțină capul, reducând mișcările pasive ale coloanei cervicale.
Menținerea permeabilității căilor respiratorii. Când un copil se naște în asfixie, prezența meconiului în lichidul amniotic sub formă de „supă de mazăre” necesită intubarea traheală și aspirarea blândă, dar viguroasă a conținutului tractului respirator. Aspirația se repetă de mai multe ori în faza acută a bolii, ghidată de tabloul clinic și de datele auscultatorii, dar amintindu-ne că toaleta traheală provoacă hipoxemie tranzitorie, dar semnificativă, bradicardie și hipertensiune arterială, o modificare semnificativă a intensității fluxului sanguin cerebral, care poate provoacă hemoragii intracraniene, leziuni paraventriculare.
Poziția unui copil cu SDD pe o masă sau într-un incubator ar trebui să fie cu capul ușor întins („poziție de strănut”). Pentru a face acest lucru, așezați o pernă de 3-4 cm grosime sub partea superioară a pieptului Schimbarea periodică a poziției copilului (întoarcerea ușor într-o parte, pe burtă etc.) stimulează drenajul traheal. La sfârșitul perioadei acute, aceștia recurg la masaj cu vibrații, fizioterapie și aerosoli.
Terapie cu perfuzie și nutriție. De regulă, copiii cu SDD nu sunt hrăniți enteral în primele două până la trei zile de viață din cauza riscului de complicații cardiopulmonare și regurgitare. Cu toate acestea, încă din primele ore de viață, unui copil nu trebuie să-i fie foame sau sete. În plus, este extrem de important să previi dezvoltarea hipoglicemiei. Prin urmare, deja la 30-40 de minute după naștere, începe terapia cu perfuzie planificată. Volumul lichidului administrat în prima zi de viață este de 50-60 ml/kg cu o creștere suplimentară de 20 ml/kg pentru fiecare zi ulterioară (în a 7-a zi aproximativ 140-150 ml/kg). Este necesar să se administreze lichid cu deosebită atenție și să se extindă volumul zilnic al acestuia în caz de oligurie la un copil. Când apare diureza (mai mult de 2 mi/kg/h), volumul de lichid este crescut mai îndrăzneț (până la 40 ml/kg pe zi). În timpul fazei de oligurie, excesul de volum de lichid poate contribui la menținerea unui canal arterial permeabil, edem pulmonar și poate fi un factor în riscul crescut de dezvoltare ulterioară a BPD. Restaurarea diurezei este un vestitor al începutului fazei de recuperare.
În prima zi de viață, lichidul transfuzat este o soluție de glucoză de 5-10%; din a doua zi, se adaugă sodiu și clor cu o rată de 2-3 mol/kg/zi. şi potasiu, calciu 2 mol/kg/zi. Compoziția soluției perfuzabile este ajustată în funcție de monograma sanguină, menținând nivelul natremiei în intervalul de 135-145 mmol/l de plasmă. Pentru a preveni tromboza cateterului și a vasului regional, în special la copiii cu nutriție parenterală totală, la soluțiile perfuzate se adaugă heparină în doză de 0,2-0,5 unități la 1 ml de lichid transfuzat.
În general, după cum se știe, volumul și natura terapiei cu perfuzie sunt determinate în funcție de:
OCC;
diureza;
dinamica greutății corporale;
dinamica ADC și intensitatea fluxului sanguin cerebral;
starea sistemului cardiovascular, în special starea circulației periferice;
CBS și ionograme de ser sanguin;
condițiile de îngrijire, în special adecvarea protecției temperaturii, metodele de ventilație mecanică sau IVL.
Luarea în considerare a tuturor acestor parametri și corectarea volumului sunt sarcini complexe care necesită atât cunoștințele, cât și priceperea unui medic, deoarece până acum nou-născuții nu sunt atât de vindecați, cât de alăptați.
Hranirea cu lapte de donator, lapte matern sau formula adaptata bebelusilor prematuri incepe in momentul in care starea se amelioreaza si dispneea scade la 60 pe minut, absenta apneei prelungite, regurgitarea, dupa o administrare controlata de apa distilata. Tipul de hrănire (tube gastrice sau transpilorice unice sau constante, dintr-un biberon) depinde de prezența unui reflex de sugere și de severitatea afecțiunii. Calculul cantității de lapte - vezi capitolul VI, unde puteți citi și despre metoda de nutriție parenterală dacă starea pacientului nu permite începerea nutriției enterale.
Normalizarea compoziției gazoase a sângelui se realizează prin îmbogățirea aerului inhalat cu oxigen, diverse opțiuni de creare a presiunii crescute în căile respiratorii în timpul respirației spontane (respirație spontană cu presiune pozitivă constantă în căile respiratorii) prin canule nazale (sCPAP - nazal continuous positive). presiunea căilor respiratorii).presiunea căilor respiratorii) cu presiune ridicată constantă și ventilație mecanică.
Dacă nu există semne de SDR, atunci copilul prematur este plasat într-un incubator, unde conținutul de oxigen din aer este de aproximativ 40-45%. Dacă în 4 ore Rao din sângele arterial (sau când este determinat de un senzor de piele) rămâne peste 8 kPa (60 torr = mmHg), atunci concentrația de oxigen este redusă cu 5% pe oră până la un nivel de 30-35%. Când Pao2 este mai mică de 6,67 kPa (50 torr = mmHg), concentrația de oxigen din aerul inhalat este crescută la maxim prin instalarea unui capac în incubator deasupra capului copilului. Dacă acest lucru nu duce la normalizarea Pao2 din sânge, atunci se începe SDPPD (optim prin canule nazale).
Alte indicații pentru începerea SDP sunt:
dificultăți persistente de respirație și zgomote de expirare;
Silverman înscrie 5 puncte sau mai mult (chiar și cu culoarea normală a pielii);
„testul spumei” negativ cu lichidul amniotic sau conținutul stomacului obținut imediat după naștere, absența fosfatidilglicerolului în acestea.
Cea mai comună metodă utilizată în prezent este pCPAP; metoda Martin (punga Martin) este folosită mult mai rar. Geanta este atașată de gâtul copilului cu bandă de spumă, astfel încât degetul mic al medicului să poată pătrunde liber între geantă și gât. Presiunea expiratorie cu CPAP este de obicei în intervalul 4-6 cm de apă. Artă. (adică tubul prin care aerul iese din pungă este scufundat la această adâncime), rareori trebuie mărit în caz de rigiditate pulmonară severă la 10 cm de apă. Artă. Dacă rigiditatea plămânilor este scăzută, atunci presiunea excesivă în timpul expirației duce la o întrerupere a fluxului de sânge din creier, o scădere a fluxului său către inimă și contribuie la dezvoltarea insuficienței cardiace și a edemului cerebral.
SDPPD începe cu furnizarea de oxigen umidificat încălzit la 32-34°C, iar apoi, sub controlul efectului clinic și al PaO2 din sânge, concentrația acestuia în amestecul inhalat este redusă treptat, realizând o PaO2 sanguină arterială de 6,67-10,67 kPa. (50-80 torr = mm Hg), iar sângele arterializat din călcâi mai mult de 8 kPa este considerat potențial toxic, necesitând o scădere a concentrației de oxigen din aerul inhalat.
Dacă copilul este sever agitat, ceea ce se observă mai ales des în prezența pCPAP, se prescrie hidroxibutirat de sodiu sau seduxen, dar nu fenobarbital, care suprimă selectiv structurile expiratorii ale centrului respirator situat în medula oblongata.
Indicațiile pentru ventilația mecanică sunt:
incapacitatea de a realiza normalizarea sângelui Pao2 pe fondul pCPAP, scor Silverman de mai mult de 5 puncte, care nu scade pe fondul pCPAP;
Pao2 este sub 8,00 kPa (60 mm Hg) cu Fio2>0,7 (F1O2 este proporția de oxigen din amestecul oxigen-aer inhalat), dar dacă greutatea la naștere este mai mică de 1250 g, atunci cu Fio2>0,4 ;
Paco2 este mai mare de 8,79 kPa (65 mm Hg), iar cu o greutate corporală mai mică de 1250 g - Paco2>8,00 kPa (60 mm Hg) și pH pH Pentru metoda de efectuare a ventilației mecanice, vezi Capitolul. XXVI.
Oxigenarea extracorporeală cu membrană este utilizată în străinătate pentru a trata copiii cu SDR extrem de severă atunci când metodele tradiționale de ventilație mecanică sunt ineficiente și la copiii cu defecte cardiace severe. Din cauza lipsei de echipamente adecvate în Rusia, nu descriem metodele sale în acest manual.
Pericolele terapiei cu oxigen:
oxigenul uscat și rece dăunează plămânilor, promovează spasmul arteriolelor, hipertensiunea pulmonară, acidoza și inhibarea sintezei surfactantului. Incalzi
oxigenul pana la 32-34°C este obligatoriu (cu ventilatie mecanica - pana la 36-37°C), precum si umidificarea acestuia. În absența umidificatoarelor speciale, oxigenul este trecut printr-un borcan Bobrov (înălțimea coloanei de apă este de cel puțin 15 cm). Umiditatea excesivă (100% umiditate relativă pentru mai mult de 2 ore) duce la supraîncălzirea copilului, supraîncărcarea cu apă și contribuie la edem pulmonar; pericolul toxicității oxigenului este real atunci când Pao2 din sângele arterial este mai mare de 10,67 kPa, care durează câteva ore, ceea ce duce la afectarea ochilor, plămânilor și sistemului nervos central.
Întreținerea stației de epurare. Este necesară corectarea acidozei patologice (pH mai mic de 7,25 și BE mai mare de minus 10 mmol/l) și numai după stabilirea ventilației mecanice sau IVL. Dacă patologia plămânilor a dus la o afectare atât de semnificativă a CBS, atunci aceasta este o indicație directă pentru ventilația mecanică sau IVL. Cantitatea de bicarbonat de sodiu în mmol (adică numărul de ml de soluție de 8,4%) x (valoarea BE - 5) x greutatea corporală (kg) x 0,4. Cantitatea adecvată de bicarbonat de sodiu se administrează prin picurare sub formă de soluție 4,2% timp de 1 oră.Este important de reținut că alcaloza provoacă hemoragii intracraniene și stop respirator la prematuri.
Combaterea anemiei și hipovolemiei, hipotensiunii arteriale. În faza acută a bolii este necesară menținerea unei valori a hematocritului de cel puțin 0,4, deoarece anemia este un factor care menține hipoxia tisulară, ceea ce înseamnă deficit de surfactant, umflarea țesuturilor etc. Masa de celule roșii din sânge este transfuzată. În anemia severă și SDR severă, transfuzia directă de sânge este mai indicată, deoarece globulele roșii proaspete conțin mai mult 2,3-difosfoglicerat, care reduce hipoxia tisulară. În plus, sângele proaspăt este mai indicat pentru corectarea defectelor de hemostază în sindromul DIC decompensat și este, de asemenea, un imunoprotector pentru infecții. În același timp, transfuziile de sânge de substituție pentru SDR au fost acum abandonate, deoarece acest lucru contribuie la creșterea frecvenței și severității retinopatiei de prematuritate. La a 2-a săptămână de viață și mai târziu, indicația pentru transfuzia de globule roșii este un hematocrit sub 0,3. În prezent, indicațiile pentru transfuzia de sânge integral sunt puternic limitate din cauza pericolului de infecții (nu numai hepatita B și C, HIV, ci și citomegalovirus, deoarece 6-12% dintre donatori au citomegalovirus în sânge), izosensibilizare.
Hipovolemia („simptomul punctului alb” pozitiv - 3 s sau mai mult), în special la copiii cu anemie, este cel mai indicat să se corecteze prin transfuzie de soluție izotonică de clorură de sodiu, dar se poate transfuza și plasmă proaspătă congelată sau soluție de albumină 10%. Cantitatea de medicament transfuzată este de 10-15 ml/kg greutate corporală. Se toarnă încet în flux (1-2 ml/kg/min).
Dacă, după corectarea anemiei și hipovolemiei, tensiunea arterială este scăzută (presiunea maximă sub 45 torr, adică mm Hg), atunci se administrează dopamină micro-jet (doza inițială 5 mcg/kg/min cu o creștere suplimentară conform indicațiilor) până la 10-15-20 mcg/kg/min) (pentru detalii, vezi capitolul XIX).
Înlocuirea deficitului de surfactant. Din primele lucrări ale lui T. Fujiwara et al. în 1980, pentru a înlocui deficitul de surfactant la sugarii foarte prematuri, a fost stabilit efectul pozitiv al unei astfel de terapii.
În prezent, se folosesc atât surfactanți naturali obținuți din plămânii bovinelor (domestic BL-surfactant, dezvoltat la Sankt Petersburg de Prof. OARozenberg, străin - Survanta, Alveofact, Infrasurf), porci (Curosurf), cât și sintetici (ALEK, Exosurf). , Surfaxin, „Sfenticute”.Cei mai eficienți surfactanți naturali conțin, pe lângă fosfolipide, surfactant proteina B (Tabelele 12.3, 12.4). Trebuie subliniat faptul că medicamentul Surfaxin, dezvoltat în SUA de către laboratorul Discovery, conține o combinație de fosfolipide (dipalmitilfosfatidilcolină - DPPC, palmitil oleil fosfatidilglicerol - POPG, acid palmitic - PA) și o peptidă recombinantă, sintetică, constând din fragmente din aminoacizii lizină (K) și leucină (L) în secvența KLLLLKLLLLKLLCLLKLLLLKLL (recombinant). peptida are proprietățile surfactantului proteinei B. Medicamentul \enticute conține proteina C surfactant recombinant.
Numeroase studii randomizate au arătat că surfactantul exogen promovează:
creșterea complianței pulmonare și a capacității reziduale funcționale, reducând astfel munca mușchilor respiratori;
scăderea în timpul ventilației mecanice Fio2 (proporția de oxigen în aerul inspirat), PIP (presiunea inspiratorie de vârf), MAP (presiunea medie a căilor respiratorii), PEEP (presiunea finală de expirare pozitivă), îmbunătățirea indicelui de oxigenare al gradientului de oxigen alveolocapilar;
reducerea mortalității în SDR (utilizarea sa profilactică este eficientă în special la copiii cu o perioadă de gestație mai mică de 30 de săptămâni atunci când sunt combinate
Tabelul 12.3
Compoziția unor agenți tensioactivi
(Gadzinowski J., 2003) Compoziția Surfaxin Survanta Curosurf Protein/peptide 0,8+2 mg/ml SpB și SpC Tabelul 12.4
Compoziția proteică a unor agenți tensioactivi
(Gadzinowski J., 2003)
Drug Raportul SpB în mg și fosfolipidele în mmol Raportul SpC în mg și fosfolipidele în mmol Alveofact 2.7+0.8 1.4+0.5 Curosurf 2.4+2.2 5.2+5.6 Surfaxin 19, 8 * 1 Acidul palmitic păstrează funcția SpC.
cu utilizarea prenatală a corticosteroizilor), sindrom de aspirație de meconiu, SDR de tip adult;
scurtarea timpului de ventilație mecanică și reducerea frecvenței efectelor secundare ale ventilației mecanice (sindroame de scurgeri de aer etc.);
reducerea incidenței MDD, IVH, retinopatie;
nu inhibă sinteza surfactantului endogen.
Trebuie remarcat faptul că surfactanții naturali sunt mai eficienți decât cei sintetici, dar pot fi antigenici; în plus, ele sunt mai puțin stabile ca compoziție, necesită condiții de depozitare mai stricte și au o perioadă de valabilitate mai limitată și pot conține agenți prionici.
Avem experiență în utilizarea medicamentelor Curosurf și Exosurf în Spitalul de Copii nr. 1 (Sankt Petersburg). Ambele medicamente au avut efectele de mai sus. Cu toate acestea, după introducerea Curosurf, Fio2, PIP, MAP ar putea fi reduse cu aproximativ 30% după 3-3,5 ore, în timp ce după introducerea Exosurf- numai după 6 ore. După administrarea Curosurf, s-a observat o scădere a rezistenței vasculare pulmonare, o scădere a postîncărcării ventriculului drept și o creștere a preîncărcării ventriculare stângi. În același timp, s-a înregistrat o scădere a diferenței alveolo-capilare a tensiunii oxigenului și o îmbunătățire a indicelui de oxigenare. Din păcate, nu există studii comparative randomizate privind utilizarea surfactantului BL domestic și nu avem experiență în utilizarea acestuia, dar știm de la colegii noștri că este mult mai puțin eficient în SDR sever decât Curosurf.
Potrivit profesorului J. Gadzinowski (2003), în studiile multicentre europene comparative randomizate (la ele participă și neonatologi din Sankt Petersburg, dar studiul este dublu-orb și nu ne cunoaștem încă rezultatele) privind utilizarea profilactică a Surfaxin, Exosurf și Survanta la copiii cu o greutate la naștere mai mică de 1250 g, primul medicament a fost mai eficient, ceea ce, în opinia sa, se poate datora unei îmbunătățiri mai timpurii a oxigenării (în câteva minute, în timp ce după utilizarea alte medicamente tensioactive acest lucru se observă după 3-6 ore), un efect de durată mai lungă datorită rezistenței medicamentului sintetic Surfaxin la inhibarea de către componentele serice și oxidanți.
Efectele secundare și complicațiile terapiei cu surfactant sunt în mare parte iatrogenice. În absența monitorizării și variației adecvate a parametrilor ventilației mecanice, se pot dezvolta barotraumatism și volutraumatism pulmonar, sindroame de scurgeri de aer, hemoragie pulmonară, hiperoxie și, prin urmare, retinopatie de prematuritate, hemoragie pulmonară, IVH. Poate singurul lucru care a fost remarcat de mulți cercetători în aproape toate centrele este o creștere a frecvenței de funcționare a ductusului arterios și a atacurilor de apnee după utilizarea surfactantului exogen. Frecvența unui canal arterial funcțional la copiii tratați cu Curosurf în observațiile noastre a fost de 7,6%.
Cea mai eficientă administrare profilactică de surfactant este la naștere sau în primele 15-30 de minute de viață. Doza destinată administrării este preîncălzită (în decurs de 1 oră la 37°C) și infuzată prin tubul endotraheal în trahee prin împingeri în 4 doze timp de 10-15 minute sau micro-jet folosind un infuzor timp de 20-30 minute, cu următoarea perfuzie se schimbă poziția copilului. Dacă este necesar, perfuziile se repetă după 12 ore.Nu au fost observate efecte secundare severe. Se consideră extrem de importantă oprirea cât mai devreme a ventilației mecanice și transferul copilului la pCPAP. Ca rezultat al acestei terapii în general preventive, frecvența și severitatea SDR sunt reduse semnificativ.
Tratamentul cu surfactant al SDR deja dezvoltate sau al pneumoniei este mult mai puțin eficient decât tratamentul preventiv. În același timp, este extrem de important înainte de administrarea oricărui medicament surfactant pentru a stabiliza starea copilului și, dacă este posibil, a corecta parametrii vitali de bază. După administrarea medicamentului, este necesară o monitorizare atentă, inclusiv: parametrii ventilației mecanice, Fio2, analiza vizuală a participării mușchilor auxiliari la actul respirației, analiza transcutanată a saturației (Brog), ritmul cardiac, ADC, CBS, piept. radiografie inainte si 3-6 ore dupa administrare. Din nou, este necesar să se varieze în mod flexibil parametrii ventilației mecanice și F102, evitând barotrauma și volutrauma plămânilor și hiperoxia. Spo2 trebuie menținută între 90-94% pentru a preveni hiperoxia. Este indicat să nu aspirați conținutul traheei timp de 3-6 ore după administrarea surfactantului.
Închiderea canalului arterios este considerată medical la copiii cu SDR conform ecocardiografiei și studiilor Doppler în a 4-5-a zi de viață. Tacticile de utilizare a indometacinei sau brufenului sunt prezentate în capitolul XIX.
Terapia cu antibiotice. Când se pune un diagnostic de SDR și chiar dacă este suspectat, ampicilina este prescrisă în combinație cu unul dintre aminoglicozide (de obicei gentamicina). Acest lucru se datorează, pe de o parte, faptului că infecția cu streptococ B se manifestă prin afectarea plămânilor, care nu diferă (chiar adesea din punct de vedere radiologic) de SDR și, pe de altă parte, prin transferarea pacientului la ventilație mecanică, care este adesea însoțită de infecție. Cu toate acestea, la 3 zile de la primirea rezultatelor culturilor de sânge și a testelor clinice de sânge în timp, este necesar să se decidă asupra prezenței infecției și, dacă nu există, întreruperea antibioticelor.
Terapia cu vitamine. Opinia că administrarea profilactică a vitaminei E reduce incidența displaziei bronhopulmonare nu a fost confirmată. Și totuși, este indicată administrarea intramusculară a vitaminei E la 10 mg/kg zilnic la utilizarea unui amestec oxigen-aer cu Fio2 mai mare de 0,4, deoarece aceasta reduce incidența și severitatea retinopatiei de prematuritate. Curs de 7-10 injecții. Vitamina A, administrată enteral la 2000 de unități o dată la două zile, trebuie prescrisă tuturor copiilor înainte de a intra în alimentația enterală, deoarece aceasta reduce incidența enterocolitei necrozante și a displaziei bronhopulmonare.
Diuretice. Deși administrarea de furosemid crește diureza și îmbunătățește starea plămânilor, crește frecvența canalului arterial permeabil, calcificări la rinichi și diselectrolitemie și, prin urmare, nu poate fi considerată de rutină. Furosemidul este prescris numai pentru edem pulmonar și sindrom edematos.
Glucocorticoizi. Administrarea planificată a glucocorticoizilor și a derivaților acestora (dexametazona a fost folosită cel mai des pentru că are efectul tisular maxim) pentru a stimula sinteza surfactantului la toți copiii cu SDD a fost abandonată. Acest lucru se datorează introducerii preparatelor de surfactant în terapia și prevenirea secundară a SDR, îmbunătățirea metodelor de suport respirator, ventilație mecanică, precum și efectele secundare ale terapiei cu glucocorticoizi, principalele cărora, chiar și cu un curs scurt, sunt: hiperglicemie, hipertensiune arterială, sângerări gastrointestinale, enterocolită necrozantă și alte infecții. Glucocorticoizii sunt prescriși pacienților cu SDR care, conform datelor clinice și de laborator, au insuficiență suprarenală.
Mulți neonatologi din străinătate au ajuns la concluzia că administrarea de dexametazonă pentru laringita edematoasă postintubare sau traheita cu stenoză severă are un efect pozitiv. Formularul Neonatal (BMJ, 2000) recomandă administrarea a 4 doze de 200 mcg la intervale de 8 ore, prima doză administrată cu 4 ore înainte de extubare la copiii cu edem sau traumatism laringian.
Hormonii tiroidieni pentru tratamentul copiilor cu SDD au început să fie utilizați activ în unele clinici de nou-născuți, pe baza detectării frecvente a unor niveluri scăzute de hormoni tiroidieni la copiii foarte prematuri cu GBM. Cu toate acestea, nu există date general acceptate bazate pe rezultatele studiilor randomizate care dovedesc indiscutabil beneficiul unei astfel de prescripții și, prin urmare, este o terapie investigațională. Utilizarea intraamniotică a L-tiroxinei pentru gravidele cu risc crescut de naștere prematură este mai justificată, dar nici aici nu există scheme general acceptate și rezultate general acceptate.
Riboxină și inozitol, prescrise intragastric la fiecare 6 ore în doză de 40 mg/kg de la sfârșitul primei zile până în a 10-a zi de viață, conform lui M. Hallman și colab. (1986-1989), reduc severitatea SDR, cresc sinteza surfactantului și reduc incidența displaziei bronhopulmonare. Cu toate acestea, această metodă, precum și administrarea planificată de plasminogen la copiii prematuri, este o metodă de investigație pentru tratamentul copiilor cu SDD.
Prognosticul SDR depinde de gradul de severitate și de prezența patologiei concomitente și a complicațiilor terapiei. Rata mortalității copiilor cu greutatea la naștere mai mare de 1000 g cu management rațional nu depășește 5-10%. În primul an de viață, copiii care au suferit de SDR suferă adesea de pneumonie, iar incidența sepsisului este, de asemenea, crescută. Encefalopatia (posthipoxică) este una dintre afecțiunile concomitente (sau complicațiile) caracteristice la copiii cu SDD, iar la unii copii sunt identificate clar doar la vârsta preșcolară și școlară sub formă de disfuncție cerebrală minimă, tulburări de comportament și dificultăți de învățare. În acest sens, în sistemul de măsuri de reabilitare a copiilor cu SDD este necesar să se prevadă administrarea precoce (din a 3-4-a zi) a medicamentelor care îmbunătățesc trofismul cerebral (gliatilină 10-15 mg/kg/zi, nootropil 50). mg/kg intravenos sau oral de 2-3 ori pe zi), observatie de catre un neurolog.
Prevenirea. Terapia hormonală antenatală. Administrare intramuscular sau orală mamei în caz de amenințare cu nașterea prematură la 24-34 săptămâni:
betametazonă în doză de 12 mg (de 2 ori cu un interval de 24 de ore) sau
Dexametazonă 6 mg de 4 ori cu un interval de 12 ore.
Este optim ca perioada dintre terminarea terapiei hormonale și naștere să fie mai mare de 24 de ore.Efectul acestei prescripții durează 10 zile, iar dacă nu apare travaliul, atunci o singură administrare de dexametazonă în doză de 6-12 mg este indicat.
O cursă antenatală de corticosteroizi duce nu numai la o reducere a frecvenței și severității SDR, dar reduce și riscul de a dezvolta sindrom de ductus arteriosus permeabil, hemoragie intraventriculară, leucomalacie periventriculară, enterocolită necrozantă, durata și costul alăptării unui nou-născut foarte prematur. .
Studiile de urmărire pe termen lung au arătat că un curs de terapie hormonală prenatală nu crește incidența bolilor infecțioase la nou-născuți, nu afectează dezvoltarea fizică și psihomotorie ulterioară (inclusiv rata de creștere a circumferinței capului), precum și a plămânilor. creștere și nu provoacă disfuncție a glandelor suprarenale sau a vederii sau a auzului.
În prezent, cea mai promițătoare este considerată a fi dezvoltarea pentru aplicarea practică a unei scheme de introducere a triiodotironinei în lichidul amniotic și în mod optim - hormonul de eliberare a tirotropinei (TRH). Medicamentele TRH, atât experimental, cât și în studii clinice limitate, s-au dovedit a fi foarte eficiente în prevenirea SDR. Cu toate acestea, două studii mari multicentrice efectuate în SUA nu au arătat beneficiul combinării corticosteroizilor profilactici la femeile gravide în combinație cu hormoni tiroidieni și/sau TRH (Ballard RA și colab., 1998).
Este utilă „întârzierea” travaliului, deoarece, dacă intervalul anhidru durează mai mult de 2 zile, SDR de obicei nu se dezvoltă, deși la astfel de copii se observă mai des sepsis și, probabil, hemoragii intracraniene.
Terapia de substituție cu surfactanți exogeni în primele 30 de minute de viață (vezi mai sus) este o metodă foarte eficientă de prevenire a SDR severă.
Sindromul de detresă respiratorie (SDR) se referă la oricare modificări patologiceîn plămâni, care apar la făt sau nou-născut în primele 2-3 zile de viață, manifestată clinic prin insuficiență respiratorie severă.
SDR este observată mai des la copiii prematuri, în special la gemeni, în principal la băieți. Cauzele principale ale apariţiei sale sunt: a) pneumopatia - plămâni, membrane hialine, sindrom edemato-hemoragic, hemoragie la plămâni, malformaţii pulmonare; ) intrauterin - , sepsis; hemoragii intracraniene.
Maturitatea anatomică și funcțională a plămânilor depinde de cantitatea de surfactant care căptușește suprafața interioară a alveolelor, creând un film alveolar superficial care previne colapsul alveolelor și dezvoltarea atelectaziei. Pentru funcționarea normală a plămânilor, până în a 35-a săptămână se obține o cantitate suficientă de surfactant. conținutul său în țesutul pulmonar fetal poate fi determinat de nivelul de lecitină din lichidul amniotic. În acest scop se utilizează testul spumei Clements. Esența sa este următoarea.
Testul „spumei” se efectuează și cu conținutul stomacului nou-născutului. SDR este cel mai evident în primele 2 zile de viață și dispare treptat în a 12-14-a zi. Severitatea acestuia este evaluată pe scara Silverman la 30 de minute după nașterea copilului, apoi după 3-6-12 ore timp de 2-3 zile. iar scorurile indică prezența sindromului. Cu un scor de 10, starea copilului este extrem de gravă.
Scara Silverman
|
Clinic simptome |
|||
|
Neuniformă |
Paradoxal |
||
|
Retracția spațiului intercostal |
Absent |
Moderat |
Ascuțit exprimat |
|
Retragerea sternului |
Absent. |
Moderați în inspirație |
Constant, pronunțat |
Semnele de SDD sunt observate în prima viață a unui copil. Acestea includ: respirație crescută (peste 60-70 pe minut), retragerea spațiilor intercostale și a procesului xifoid la inhalare, deschiderea aripilor nasului, dificultăți de expirare, starea funcțională a sistemului nervos central.
Atelectazia primară poate fi mică, împrăștiată în ambii plămâni sau grupată în conglomerate mari care ocupă mai multe segmente (atelectazie polisegmentară).
Copiii devin letargici, există o scădere a tonusului muscular și a adinamiei. Apare un sentiment ascuțit, respirația devine rapidă și dificilă, paradoxală, ca un „leagăn”. Pieptul este în formă de butoi și rigid la palpare. Există o tonalitate sau o scurtare a sunetului de percuție și o respirație slăbită pe partea afectată, o respirație grea, crescută pe părțile rămase ale plămânilor. Se pot auzi zgomote unice, intermitente. Necomplicat proces patologicțesutul pulmonar colaps se îndreaptă în 4-5 zile. Atelectazia diseminată împrăștiată este mai des primară și se observă la copiii cu greutate mică și țesut pulmonar imatur. nascut adesea in stare de asfixie, flasc, cu tonus muscular redus, cianoza pronuntata. Sindromul tulburării respiratorii este inițial ușor exprimat, pe 2-4 puncte pe scara Silverman, dar până la sfârșitul a 2-3 zile apare înălțimea bolii. devine mai frecventă, nările se erup, apar suspine convulsive. Pieptul este „alubit” la atingere. Sunetul de percuție este scurtat în toată sau în anumite zone ale plămânilor. expirație sonoră grea, dificilă, pe fondul căreia se aud șuierături intermitente, izolate, crepitatoare. Dacă cursul este favorabil, simptomele încep în a 5-a săptămână și dispar treptat până la sfârșitul celei de-a 2-a săptămâni. O afecțiune bruscă în a 5-6-a zi este un semn de pneumonie.
Copiii cu sindromul membranei hialine se pot naște într-o stare satisfăcătoare. intervalul durează uneori până la 12 ore, după care se dezvoltă insuficiență respiratorie severă, respirația devine mai frecventă și apare cianoza pielii, care nu dispare odată cu inhalarea de oxigen. Se observă atacuri repetate de asfixie; dens, mărit în dimensiune; baza subcutanată crește. La auscultare, plămânii sunt slăbiți și se aud mici șuierătoare. Ulterior, se notează funcțiile de oprire centrală, completă și frecventă a respirației. palid cu o tentă cenușie-cianotică.
Sindromul edem-hemoragic- una dintre cele mai forme severe pneumopatie. Este o manifestare locală a hidratării patologice a întregului organism al unui nou-născut, care apare ca urmare a unor tulburări metabolice și asfixie intrauterina. O trăsătură caracteristică sindromul este evacuarea din gură a lichidului spumos cu sânge. Respiratorii și semnele SDR apar la naștere. Hemoragiile extinse apar adesea pe piele și țesutul subcutanat. La plămâni se observă edem sever: la percuție, sunetul este scurtat și slăbit, în special în secțiunile inferioare, și se aud un număr mare de bubuituri fine.
Sindromul edem-hemoragic este aproape întotdeauna combinat cu atelectazia pulmonară diseminată, în special la prematuri.
Hemoragii în poate fi alveolară, interstițială și mixtă. În 50% din cazuri se notează
Sindromul de detresă respiratorie
V.F. Demin, A.A. Mihaiva
Departamentul de boli ale copilăriei nr. 3, Universitatea Medicală de Stat din Rusia.
Terminologie
Termenii sindrom de detresă respiratorie (RDS), sindrom de detresă respiratorie (RDS) și boală a membranei hialine (HMD) sunt adesea folosiți pentru a descrie aceeași patologie. Anul trecut Mulți autori nu folosesc termenii SDR și RDS ca sinonime pentru BGM, deoarece Există și alte afecțiuni patologice în care are loc formarea membranelor hialine. În literatura internă, atât termenii sindrom de detresă respiratorie, cât și sindrom de detresă respiratorie sunt folosiți în relație cu aceeași afecțiune.
Etiologie și patogeneză
Sindromul de detresă respiratorie se dezvoltă la aproximativ 20% dintre sugarii prematuri, dar incidența sa este foarte dependentă de vârsta gestațională și poate varia de la 5-10% la copiii născuți la 35-36 săptămâni și până la 80-88% la copiii născuți în perioada gestațională. varsta.mai putin de 27 saptamani. Sindromul de detresă respiratorie apare la 1-2% dintre sugarii la termen și este asociat în principal cu imaturitatea morfo-funcțională, asfixia la naștere și alte afecțiuni.
Dezvoltarea sindromului de detresă respiratorie se bazează pe imaturitatea structurală și funcțională a plămânilor și pe lipsa asociată a formării surfactantului. În plus, cauza dezvoltării SDR poate fi o încălcare a structurii surfactantului, distrugerea sau inhibarea sa crescută.
Caracteristicile anatomice și fiziologice ale sistemului respirator al nou-născutului predispun la mai mult dezvoltare rapida insuficiență respiratorie decât la copiii mai mari și la adulți. Laringele este situat mai sus decât cel al adulți și respiratorii căile sunt foarte înguste, spațiul subglotic fiind locul cel mai îngust, unde îngroșarea mucoasei chiar și cu 1 mm duce la o îngustare a lumenului cu 75%. Plămânii sunt mai plini de sânge și mai puțin elastici decât cei ai unui adult. Numărul de alveole la un nou-născut este de 10-15 ori mai mic decât la un adult, ceea ce duce la posibilități limitate de schimb de gaze pulmonare. Pieptul unui nou-născut se află într-o poziție de inhalare, cauzată de poziția coastelor perpendicular pe coloana vertebrală, astfel încât creșterea volumului de ventilație se produce în principal din cauza frecvenței respiratorii.
După ce copilul trece prin canal de nastere plămânii nu se extind niciodată singuri sub influența tracțiunii elastice. Forțele de tensiune superficială din stratul de lichid dintre alveolele aderente împiedică acest lucru. Pentru a îndrepta alveolele, este necesar un vid în piept, iar presiunea transpulmonară trebuie să fie de până la -40 cm H2O. Primul strigăt al unui nou-născut reprezintă un mecanism adaptativ important. Volumul primei inspirații este mai mare decât volumul expirației; cu cât țipătul este mai puternic, cu atât mai multa diferenta. Astfel, se creează un regim pozitiv de presiune finală expiratorie, care ajută la extinderea plămânilor și la crearea presiunii intrapulmonare crescute, datorită căreia căile respiratorii deschise se închid mai repede. fereastra ovalași ductus arteriosus permeabil, iar fluxul sanguin pulmonar crește, direcționat prin țesutul alveolar. Producția de surfactant devine suficientă, plămânii se extind normal.
Când există o deficiență sau o perturbare în producția de surfactant, tensiunea superficială în alveole devine foarte mare. Dacă în timpul primei respirații presiunea transpulmonară ar trebui să fie de până la –40 cmH2O, atunci pentru inhalările ulterioare (surfactantul este deja în vigoare) este de –5 cmH2O. Dacă există o deficiență de surfactant, presiunea pentru deschiderea alveolelor rămâne ca ridicat ca în timpul primei inhalări, fluxul sanguin pulmonar este redus, ceea ce perturbă producția de surfactant, țesutul ischemic devine mai permeabil, plasma este transudată în alveole prin membrana capilară alveolară și chiar și cantitatea mică de surfactant conținută în acestea este inactivată. cu formarea unui film - membrana hialina. În 1959 Avery și Meed au fost primii care au demonstrat deficiența de surfactant la nou-născuții care au murit din cauza BGM.
Surfactantul este un strat monomolecular la interfața dintre epiteliul alveolar și aer. Previne colapsul alveolelor în timpul expirației și dezvoltarea edemului în plămâni (prin reglarea permeabilității pereților alveolelor și a microcirculației în plămâni), protejează epiteliul alveolar de deteriorare și, de asemenea, participă la reacțiile imunologice locale. Din punct de vedere chimic, surfactantul este o lipoproteină - amestecul este format din 90-95% lipide și 5-10% fracție proteică, reprezentată de patru proteine specifice - SP-A, SP-B, SP-C, SP-D . Compoziția lipidică a surfactantului include fosfolipide (80%), a căror parte principală este fosfatidilcolina și lipide neutre.
Surfactantul este sintetizat de către alveolocitele de tip II începând cu 25-26 săptămâni de gestație, cea mai activă sinteză se observă începând cu 34 de săptămâni de gestație. Moleculele de surfactant, pe de o parte, sunt hidrofile, fixate în faza apoasă, iar pe de altă parte, lipofile, proeminente în faza gazoasă, ceea ce determină acțiunea activă de suprafață (datorită forțelor intermoleculare repulsive ale părților lipofile).
În perioada prenatală, maturarea sistemului surfactant are loc sub influența a numeroși factori. Rolul important este bine cunoscut hormoni steroiziîn acest proces s-a stabilit un efect sinergic al cortizolului și hormonilor tiroidieni și agenților β-adrenergici. Există mai multe mecanisme prin care glucocorticoizii influențează maturarea plămânilor. Glucocorticoizii endogeni afectează sistemul adrenergic, care joacă un rol important în pregătirea plămânilor pentru funcția lor extrauterină, stimulează receptorii adrenergici și secreția de adrenalină în glandele suprarenale fetale. Glucocorticoizii afectează direct fibroblastele țesutului interstițial, care la rândul lor secretă „factorul fibroblast-pneumocite” - o oligopeptidă care stimulează sinteza fosfolipidelor în alveolocitele de tip 2.
Factorii care contribuie la dezvoltarea SDR sunt:
- prematuritate și imaturitate morfo-funcțională
- infectii intrauterine
- hipoxie intrauterină și asfixie în timpul nașterii
- pierderea acută de sânge în timpul nașterii
- diabet matern (insulina reduce producția de surfactant)
- nastere prin cezariana
- născut al doilea din gemeni
- răcirea copilului, hiperoxie, hipovolemie.
Veragă principală în patogeneza SDR este atât deficiența primară a sistemului surfactant, cât și patologia, cum ar fi aspirația de lichid amniotic meconiu, deficiența de plasminogen, sindromul pulmonar edematos-hemoragic, sindromul DIC decompensat, scăderea activității antiproteazelor, ceea ce duce la scăderea sintezei. sau degradarea crescută a fosfatidilcolinelor.
Hipoventilația și oxigenarea inadecvată asociate cu deficiența surfactantului, complianța toracică, scăderea volumului curent, complianța pulmonară scăzută și dificultăți de respirație duc la tulburări severe functii vitale.
Cu oxigenare insuficientă a țesuturilor procesele metabolice La nou-născuți, aceștia trec mai ușor pe calea de oxidare anaerobă decât la adulți, ceea ce duce la acumularea de produse metabolice sub-oxidate în organism.
Hipoxia hepatică contribuie la pierderea capacității sale de a utiliza glucoza, ceea ce duce la întreruperea resintezei carbohidraților din acidul lactic. O creștere a nivelului de acid lactic din sânge în timpul hipoxiei ajunge la 9,4-9,9 mmol/l (în mod normal 2,0-2,4 mmol/l), pH-ul sângelui scade și se dezvoltă acidoza. O creștere a catabolismului carbohidraților și o scădere corespunzătoare a aprovizionării acestora promovează utilizarea proteinelor ca substrat energetic. Caracterizat prin prezența hipoglicemiei, hipoproteinemiei, excreției crescute de azot și scăderea greutății corporale.
Pe fondul hipoxiei, permeabilitatea capilară crește, ceea ce duce la eliberarea de proteine în spațiul interstițial, presiunea oncotică scade și resorbția fluidelor este limitată. Hipoxia și hipoxemia afectează centralul sistem nervos, crescând permeabilitatea vaselor cerebrale și favorizând apariția hemoragiilor.
Tulburările hemodinamice care decurg din sindromul de detresă respiratorie sunt foarte periculoase. Hipercapnia duce la spasm al vaselor pulmonare, ceea ce duce la o deteriorare a fluxului sanguin pulmonar, creșterea presiunii în cercul pulmonar și creșterea șuntării sângelui prin foramen oval permeabil și canalul arterios. Lichid seros atunci când presiunea crește, transpiră în alveole, agravând fluxul sanguin regional și ventilația.
Metabolismul anaerob afectează negativ schimbul de energie în miocard, reducând contractilitatea inimii, debitul cardiac, creșterea congestiei în cercul mic, ceea ce duce la rândul său la creșterea hipoxiei și hipercapniei; acidoza metabolică continuă să crească. Alimente acre schimbul interferează cu utilizarea oxigenului de către țesuturi și perturbă respirația tisulară.
Acumularea de produse metabolice intermediare contribuie la scăderea tonusului sfincterelor precapilare. Sângele pătrunde liber în capilare, dar tonusul sfincterelor venelor postcapilare este mai rezistent la acidoză, ceea ce complică scurgerea sângelui. Se acumulează în patul microcapilar, crescând coagularea intravasculară. Pe măsură ce insuficiența respiratorie se agravează, se dezvoltă un deficit al volumului sanguin circulant, care este facilitat și de extravazarea lichidelor. Structurale și tulburări funcționale apare endoteliu vascular, transpirație plasmatică, edem.
Clinica.
Primul semn dezvoltarea sindromului tulburarea respiratorie este scurtarea respirației. Deși mușchii respiratori dezvoltă un efort mare, iar traheea și bronhiile sunt patente, volumul curent scade după primele respirații. Creșterea respirației se observă imediat după naștere, iar la prima dificultăți de respirație (mai mult de 60, la copiii foarte prematuri - mai mult de 80 pe minut) nu este însoțită de cianoză a pielii, deoarece este asociată cu iritarea chemoreceptorilor.
Complexul de simptome al sindromului de detresă respiratorie include:
- Dificultăți de respirație crescute
- Aruncarea nasului
- Retracția zonelor compliante ale toracelui
- Participarea la actul de respirație a mușchilor auxiliari
- Cianoza, care apare când PaCO 2 este mai mare de 30-40 mm Hg, este inițial perioral, apoi acrocianoză și cianoză generalizată.
- Piele palida
- Zgomote de expirare cauzate de un spasm compensator al glotei în timpul expirației, împiedicând colapsul alveolelor stadiul inițial dezvoltarea sindromului de detresă respiratorie.
- La auscultare, la plămâni se aude slăbirea respirației, iar mai târziu apar rafale ascuțite, uscate, cu barbotare fine și crepitatoare.
Severitatea insuficienței respiratorii la nou-născuții prematuri este determinată folosind scala Silverman (Tabelul 1)
Tabelul 1. Scara Silverman.
|
Etapa 0 |
Etapa 1 |
Etapa 2 |
|
Partea superioară a pieptului atunci când copilul este poziționat pe spate și peretele abdominal anterior participă sincron la actul de respirație |
Lipsa sincroniei sau coborârea minimă a pieptului superior la ridicarea peretelui abdominal anterior în timpul inspirației |
Depresie vizibilă a toracelui în timpul ridicării peretelui abdominal anterior în timpul inspirației |
|
Fără retragere a spațiilor intercostale în timpul inspirației |
Ușoară retragere a spațiilor intercostale în timpul inspirației |
Retragerea vizibilă a spațiilor intercostale în timpul inspirației |
|
Fără retragere a procesului xifoid al sternului în timpul inspirației |
Ușoară retracție a procesului xifoid al sternului în timpul inspirației |
Retracție vizibilă a procesului xifoid în timpul inspirației |
|
Fără mișcare a bărbiei atunci când respiră |
Coborând bărbia în timp ce inhalați, gura închisă |
Coborând bărbia în timp ce inhalați, gura deschisă |
|
Fără zgomot la expirare |
Sunete expiratorie auzite la auscultarea toracelui |
Zgomotele expiratorii se aud atunci când fonendoscopul este adus la gură sau fără fonendoscop |
Dacă scorul total este mai mic de 5 - început SDR, 5 puncte - SDR moderat, 6-9 puncte - sever și 10 puncte - SDR extrem de sever.
Simptomele tulburărilor sistemului circulator sunt tipice pentru SDR: scăderea tensiunii arteriale, tulburări de microcirculație, tahicardie. Auscultarea dezvăluie tonuri atenuate.
Ficatul poate crește în dimensiune.Datorită leziunii hipoxice a endoteliului capilar, se dezvoltă hipovolemie, care duce adesea la edem periferic și retenție de lichide. Depresia sistemului nervos central este caracteristică, iar hemoragiile periventriculare sunt adesea detectate la copil. Întrebarea a ceea ce este primar - afectarea creierului sau a plămânilor rămâne deschisă. Odată cu progresia ulterioară a sindromului de detresă respiratorie, se dezvoltă sindromul DIC decompensat. De asemenea este si Risc ridicat adăugarea unei infecții secundare - pneumonia se dezvoltă la aproape fiecare al doilea copil cu sindrom de detresă respiratorie.
Cursul SDR: cea mai mare severitate a afecțiunii se observă în prima zi de viață, în viitor severitatea manifestărilor clinice depinde de complicațiile care apar (hemoragii intraventriculare, sindroame „scurgeri de aer”, hipertensiune pulmonară severă, sindrom DIC decompensat , enterocolită necrozantă etc.)
Diagnosticare.
Diagnosticul SDR se face în mod tradițional pe baza istoricului, a simptomelor clinice și radiologice. Triada de semne caracteristice SDR este determinată de raze X, care apar deja în primele ore ale bolii:
- scăderea difuză a transparenței câmpurilor pulmonare
- reticulogranular reticularis
- prezența dungilor de defrișare în zonă rădăcină pulmonară(bronhograma aeriana)
ÎN cazuri severe este posibilă o întunecare totală a câmpurilor pulmonare; marginile inimii pot să nu fie diferențiate.
ÎN În ultima vremeÎn arsenalul medicilor au apărut metode care determină gradul de maturitate atât al țesutului pulmonar în sine, cât și al sistemului surfactant. Cel mai frecvent și mai informativ test este determinarea raportului dintre lecitină și sfingomielină în lichidul amniotic, lichidul traheal sau aspiratul gastric la naștere. Dacă acest indicator este mai mare de 3, atunci plămânii sunt maturi, iar dacă este mai mic de 2, riscul de a dezvolta SDR este foarte mare (50-75%).
Se folosește și un test de „spumă”: adăugarea de etanol într-un lichid care conține surfactant și agitarea acestuia produce spumă. Aceleași metode pot fi folosite și pentru diagnosticul prenatal, dar problema amniocentezei trebuie decisă individual și la o vârstă gestațională de cel puțin 32 de săptămâni, deoarece în mai multe întâlniri timpurii gestație, imaturitatea plămânilor este dincolo de orice îndoială, iar managementul sarcinii necesită un minim de studii invazive.
Diagnostic diferentiat efectuat cu pneumonie, alte pneumopatii, defecte de dezvoltare sistemul respiratorși alte afecțiuni respiratorii de origine atât pulmonară, cât și extrapulmonară (CHD, traumatisme la naștere, tulburări metabolice etc.). De exemplu, când Atrezie coanală tulburări de respirație se observă după prima inhalare, atacuri de cianoză și lipsa respirației nazale. Diagnosticul se pune atunci când este imposibil să treceți un cateter din nas în nazofaringe, dar cel mai precis este examinare cu raze X cu un agent de contrast.
La hernie diafragmatică se observă tulburări respiratorii de diferite tipuri gradul de severitate, asociate cu dimensiunea herniei, atacuri de cianoză, atât spontane, cât și după hrănire sau când se schimbă poziția copilului. Examenul cu raze X are valoare diagnostică când cavitatea toracică organele abdominale sunt dezvăluite.
Pneumonie, care s-a dezvoltat în primele ore după naștere, practic nu se distinge de SDR; diagnosticul se pune pe baza rezultatelor analiza clinica sânge, hemoculturi și conținut traheal, radiografie toracică; pot fi prezente alte focare inflamatorii.
Dacă copilul are leziunea la naștere a sistemului nervos central cianoza este adesea de natură paroxistică, se notează simptome neurologice ( o scădere bruscă reflexe, convulsii etc.), radiografia toracică nu evidențiază modificări caracteristice SDR. Pentru clarificarea diagnosticului se efectuează neurosonografia, puncția lombară, iar pentru simptomele leziunii măduvei spinării se efectuează radiografia coloanei vertebrale.
Simptome defect cardiac congenital Tipul „albastru” este uneori dificil de distins de tabloul clinic al SDR; în acest caz, cianoza cu boală cardiacă congenitală este observată cu momentul nasterii, iar atunci când respiră oxigen 100%, copilul nu experimentează o creștere a PaO2. Diagnosticul este confirmat prin radiografie toracică, ECG și ecocardiografie.
Tratament.
Metoda etiologică tratamentul este introducerea surfactanți exogeni . Utilizarea lor este posibilă atât în scop preventiv, cât și în scop terapeutic.
Preparatele de surfactant se împart în patru categorii:
1. preparate naturale obtinute din lichid amniotic persoană (dacă sarcina la termen este rezolvată prin operație cezariană)
2. preparate naturale obţinute din plămânii zdrobiţi de purcei şi viţei
3. amestecuri semisintetice de plămâni măcinați de vițel cu dipalmitoilfosfatidilcolină (DPPC)
4. preparate tensioactive complet sintetice.
Când se folosesc surfactanți naturali, debutul are loc mai rapid efect clinic, dar rezultatele finale ale tratamentului nu diferă de cele la prescrierea agenților tensioactivi artificiali. Se presupune că surfactantul izolat din plămânii vițeilor și purceilor poate provoca o reacție imunologică la o proteină străină, dar nu s-au obținut date convingătoare. Cel mai natural surfactant pentru un copil, fabricat din lichid amniotic, nu poate fi utilizat pe scară largă, deoarece tratamentul unui copil necesită utilizarea lichidului amniotic din 10 operații cezariane. În plus, există un risc infecție cu HIV, infecție cu citomegalovirus, herpes.
În țara noastră să aplicare clinică permis și destul de utilizat pe scară largă: exosurf neonatal - drog de sintezăși Kurosurf, un surfactant natural din plămânii de porc.
Prevenirea SDR se realizează în primele 2 ore de viață:
1. nou-născuți cu greutatea la naștere mai mică de 1250g
2. nou-născuți cu o greutate mai mare de 1250 g cu imaturitate pulmonară confirmată (de exemplu, raportul dintre lecitină și sfingomielină din lichidul amniotic)
Tratamentul SDR se efectuează între 2 și 24 de ore la copiii cu diagnostic de SDR confirmat clinic și radiologic, intubați și sub ventilație mecanică.
Nu există contraindicații pentru utilizarea surfactantului.În caz de asfixie severă este necesară stabilizarea prealabilă a circulației centrale și pulmonare.
De mare importanță în tratamentul sindromului de detresă respiratorie este furnizarea de îngrijire adecvată . Baza este tehnica „atingere minimă”. Examinarea medicului nu trebuie să fie lungă; efectele traumatice trebuie reduse la minimum. Este important să se mențină optim regim de temperatură, deoarece răcirea ajută la reducerea sau oprirea sintezei surfactantului. Cu cât greutatea la naștere este mai mică și vârstă mai tânără copil, cu atât temperatura din incubator ar trebui să fie mai mare. Este important să se mențină nu doar temperatura optimă, ci și umiditatea pentru a preveni pierderea de lichide prin piele, în special la copiii cu greutate extrem de mică la naștere (Tabelul 2).
|
Vârstă /greutate |
<1000г |
1000-1500g |
1501-2500g |
|||
|
temperatura |
umiditate |
temperatura |
umiditate |
temperatura |
umiditate |
|
|
0-24 ore |
35-37 |
75-85 |
34-36 |
70-75 |
33-35 |
|
|
24-96 ore |
34-36 |
33-35 |
60-65 |
31-33 |
||
|
4-14 zile |
33-35 |
32-34 |
31-33 |
|||
|
2-4 saptamani |
32-34 |
50-60 |
31-33 |
30-32 |
40-50 |
|
Copiii cu sindrom de detresă respiratorie necesită continuu obligatoriu monitorizarea indicatori precum ritmul cardiac, ritmul respirator. La fiecare 4 ore, se determină tensiunea arterială, temperatura, starea acido-bazică, PaO2, PaCO2, nivelurile de glucoză și sodiu din sânge,
ÎN perioada acuta sindrom de detresă respiratorie, este necesar să se efectueze un test clinic de sânge, radiografie toracică, ECG, test biochimic de sânge, dacă este posibil, o coagulogramă, determinarea volumului de sânge cel puțin o dată la 2 zile. De asemenea, este necesar să se efectueze frecvent hemoculturi și conținut traheal și neurosonografie.
Incearca sa nu foloseasca nutritia enterala in primele 2 zile de viata din cauza riscului de regurgitare si complicatii cardiopulmonare. Deja în prima oră de viață încep planificate alimentatie parenterala . Indicațiile absolute pentru utilizarea sa sunt tulburările hemodinamice și hipoxemia (PaO2 din sângele arterial sub 50 mmHg). În prima zi de viață, volumul de lichid administrat este de 30-40 ml/kg, apoi se crește treptat la 70-100 ml/kg până în a 7-a zi de viață și la 150-180 până în luna 1. Volumul de lichid trebuie determinat individual, ținând cont de vârsta copilului, vârsta gestațională, diureza, bcc, dinamica greutății corporale, starea sistemului cardiovascular, circulația periferică, starea acido-bazică, metoda de alăptare a copilului și ventilația mecanică. modul.
Trebuie avut în vedere faptul că o cantitate în exces de lichid poate duce la edem, inclusiv edem pulmonar, și persistența unui canal arterial permeabil. În prima zi de viață se administrează o soluție de glucoză 10% (la copiii cu greutatea la naștere mai mică de 1000 g - o soluție de glucoză 5%). Aminoacizii pot fi utilizați de la sfârșitul primei - începutul celei de-a doua zile de viață, în prima zi de administrare cantitatea de proteine nu trebuie să depășească 1,5 g/kg, apoi se crește treptat la 2,5-3 g/kg. , iar la copiii cu greutatea la naștere mai mică de 1000 g – până la 4 g/kg. Se folosesc soluții standard de aminoacizi, dacă este posibil care conțin aminoacidul taurină (aminovenoză), deoarece o scădere a nivelului său poate duce la deteriorarea creierului și a retinei.
Prezența patologiei pulmonare este o contraindicație pentru administrarea parenterală a grăsimilor până la 7 zile de viață; dacă la această vârstă se menţine alimentaţia parenterală, grăsimile se administrează începând de la 0,5 g/kg, crescând treptat până la 2 g/kg. Infuzia de emulsii de grăsime se efectuează într-un ritm foarte scăzut pe tot parcursul zilei. Cerințele pentru minerale sunt: sodiu - 1,2 mmol/kg, potasiu - 0,8 mmol/kg, cloruri - 0,86 mmol/kg, calciu - 3,2 mol/kg, magneziu - 0,16 mmol/kg . Se folosesc cloruri de sodiu, cloruri de potasiu, gluconat de calciu etc.. Trebuie avut in vedere ca introducerea numai a sarurilor de acid clorhidric poate duce la acidoza metabolica hipercloremica, si de aceea se folosesc si lactati, fosfati si alte saruri.
Momentul de administrare a nutriției enterale este individual, dar trebuie menționat că administrarea sa precoce stimulează maturarea tractului gastrointestinal, reduce incidența colestazei, iar la hrănirea cu lapte matern nativ, reduce riscul de apariție a ulcerului necrozant. colita, iar pentru aceasta este suficient sa se administreze 0,5 ml/kg/ora. Nevoile rămase pot fi satisfăcute prin nutriție parenterală. Este indicată utilizarea laptelui matern nativ sau a formulelor specializate pentru prematuri. Se administrează o doză de probă de 5 ml lapte printr-o sondă nazogastrică și, în absența balonării abdominale, regurgitației sau apneei, volumul de nutriție enterală este crescut treptat.
O parte importantă a terapiei SDR este furnizarea și întreținerea căile aeriene libere . Când un copil se naște în asfixie sau cu aspirație de meconiu, este necesar să se efectueze intubarea și aspirarea conținutului tractului respirator. Dacă este necesar, aspirația se repetă în cursul bolii (ținând cont de tabloul clinic și radiologic), dar nu trebuie să uităm că în timpul acestei manipulări apar hipoxemie, bradicardie și hipertensiune arterială și se provoacă și dezvoltarea hemoragiilor intracraniene. Drenajul traheal se îmbunătățește cu modificări periodice ale poziției copilului (întoarcerea pe o parte, pe burtă).
În patogeneza SDR, hipoxia și hipoxemia au o importanță primordială și, prin urmare, cel mai important rol în tratamentul sindromului de detresă respiratorie îl joacă oxigenoterapie. Atunci când alegeți metoda de introducere a oxigenului și concentrația acestuia în amestecul respirator, este necesar să se țină seama de faptul că presiunea parțială a oxigenului din sânge peste 50 mmHg oferă deja o oxigenare suficientă, iar când PaO 2 este peste 80 mmHg, toxicul apar proprietățile oxigenului, care vor fi precizate mai jos. Monitorizarea presiunii parțiale a oxigenului din sângele arterial și a concentrației fracționale de oxigen în amestec de respirație permite medicului să asigure o oxigenare suficientă a copilului și să evite eventualele complicații ale oxigenoterapiei. De asemenea, este necesar să se controleze temperatura amestecului de respirație și umiditatea acestuia. Când se respiră un amestec rece, se dezvoltă clinica de răcire a copilului. Umidificarea amestecului respirator este necesară atunci când concentrația de oxigen este mai mare de 40%, deoarece este posibilă pierderea de lichid din cauza transpirației.
În terapia cu oxigen, cateterele nazale, măștile, corturile de oxigen și incubatoarele cu alimentare cu oxigen sunt utilizate pe scară largă. Cu aceeași concentrație de oxigen în amestec, concentrația maximă în tractul respirator se observă într-un cort sau incubator cu oxigen, dar consumul de oxigen cu aceste metode de oxigenoterapie este mare. Cateterele nazale nu permit crearea unei concentrații mari de oxigen și, în plus, îngreunează respirația nazală și irită mucoasa nazală. Măștile de față pot menține concentrații de oxigen stabile și destul de ridicate; dezavantajele lor includ dificultăți de fixare și etanșare.
Respirația spontană cu presiune pozitivă continuă (CPBP) previne închiderea expiratoare a căilor respiratorii, compensând nivelul redus de surfactant și previne lipirea alveolelor. Schimbul gazos crește, umflarea membranei capilare alveolare scade și presiunea parțială a oxigenului din sângele arterial crește, în timp ce concentrația din amestecul respirator rămâne neschimbată. Se remarcă adesea o scădere a PaCO2. Indicațiile pentru CPAP sunt hipoxemia (PaO2 mai mică de 50 mmHg) atunci când se utilizează un amestec respirator de 50%, asociată cu raporturi ventilație-perfuzie afectate, șunt intrapulmonar ridicat, complianță pulmonară redusă, precum și dificultăți persistente de respirație, scor Silverman 5 puncte și Mai mult. Contraindicații: fistule bronhopleurale, pneumotorax și alte sindroame de „scurgere de aer”.
În prezent, cea mai comună metodă pentru CPAP este utilizarea canulelor nazale. SDPPD cu o pungă Martin este folosit mai rar. Procedura începe cu inhalarea unui amestec respirator încălzit la 32-34 0 C și umezit la 80-100%.Apoi, sub controlul PaO2, concentrația amestecului este redusă la 50%. Presiunea pozitivă inițială este de 4 cm coloană de apă. Pentru bebelușii prematuri cu o greutate la naștere mai mică de 1500 g, presiunea ar trebui să fie de 2-3 cm de coloană de apă. Indicațiile pentru oprirea SDPPD sunt stabilizarea PaO2 peste 60 mm Hg la respirația unui amestec de 50% și o presiune egală cu cea atmosferică. După încetarea CPAP, copilul este de obicei plasat într-un cort de oxigen.
Dacă la presiunea maximă posibilă (până la 8-10 cmH2O) și la concentrația maximă de oxigen (100%) nu există efect terapeutic, atunci copilul trebuie transferat la ventilatie pulmonara artificiala (ALV) . Sunt utilizate diferite moduri de ventilație - ventilație forțată, ventilație forțată cu presiune finală de expirare pozitivă constantă, ventilație asistată și de înaltă frecvență.
Ventilația mecanică adecvată duce la eliminarea hipercapniei și hipoxiei, care este asociată cu o creștere a volumului ventilației, o îmbunătățire a raporturilor ventilație-perfuzie și o scădere a șunturilor intrapulmonare. Eliminarea acidozei respiratorii și normalizarea treptată a pH-ului contribuie la restabilirea proceselor metabolice. Microcirculația se îmbunătățește, hemodinamica se normalizează.
Cu toate acestea, este necesar să se menționeze posibile modificări patofiziologice nefavorabile - se modifică mecanica respirației, scade complianța pulmonară, crește rezistența aerodinamică a tractului respirator, se înrăutățește drenajul sputei, ceea ce, cu scăderea tensioactivului, duce la dezvoltarea microatelectaziei. Creșterea presiunii în tractul pulmonar duce la întreruperea fluxului sanguin pulmonar - dezvoltarea edemului, extravazarea lichidului în alveole. Caracteristicile care complică ventilația mecanică la nou-născuți includ volume curente mici, debite mari de gaz și rezistență ridicată a căilor respiratorii.
Indicațiile absolute pentru ventilația artificială sunt absența respirației spontane și a ritmurilor respiratorii patologice (afectarea sistemului nervos central, intoxicație severă). Cu hipoventilație constant progresivă, semnele clinice ale necesității ventilației mecanice sunt: creșterea cianozei, creșterea frecvenței respiratorii de 2 ori mai mare decât bradicardia normală sau severă, participarea mușchilor auxiliari, echilibrul acido-bazic (PaCO2 peste 60 mm Hg sau un creștere cu peste 10 mm Hg Art., PaO 2 sub 50 la 50% amestec respirator, acidoză - pH sub 7,2 (în ciuda introducerii de sifon în doză de 2-4 mmol pe kg).
Parametrii inițiali ai ventilației mecanice: frecvența respiratorie 30-40 pe minut și un volum curent astfel încât presiunea inspiratorie maximă să ajungă la 20-25 cm H2O. Concentrația de oxigen este setată la 70-80%, raportul dintre inhalare și expirare este de 1:1. După 10-15 minute se analizează echilibrul acido-bazic și gazele din sânge. Ventilația mecanică poate fi considerată adecvată dacă presiunea parțială a oxigenului în sângele arterial este de 50-80 mmHg, saturația de oxigen a hemoglobinei este de 91-96%, tensiunea transcutanată a oxigenului este de 60-90 mmHg, presiunea parțială a dioxidului de carbon în sângele arterial - 35- 45 mmHg, tensiune CO 2 transcutanată -35-50 mmHg. Pe măsură ce starea se îmbunătățește, primul pas este reducerea cât mai rapidă a concentrației de oxigen la un nivel netoxic - sub 50%. Apoi presiunea pozitivă la final de expirare este redusă treptat, raportul inhalare-exhalare este redus și numai atunci frecvența respirației este redusă.
După ventilație mecanică, copilul este transferat într-un ventilator cu o presiune de 3-5 cm H2O și o concentrație de oxigen cu 10% mai mare decât în cazul ventilației mecanice. Dacă semnele de insuficiență respiratorie nu cresc în 12 ore, copilul este extubat.
Corectarea acidozei se efectuează folosind o soluție 4% de bicarbonat de sodiu, a cărei cantitate (în ml) este determinată de formula BE x greutate în kg / 4.
KKB se mai foloseste in doza de 5-8 mg/kg. Cocarboxilaza ajută la normalizarea pH-ului celular, la îmbunătățirea sintezei ATP și la utilizarea glucozei.
Terapie antibacteriană. Se prescrie din momentul diagnosticării SDR. Indicat datorita riscului de dezvoltare a infectiei intrauterine si adaosului unei infectii secundare, mai ales in timpul ventilatiei artificiale Medicamente peniciline (ampicilina in doza de 150-300 mii U/kg/zi in 3-4 doze) sau cefalosporine (claforan 50). ) se prescriu de obicei mg/kg/zi în 2-3 prize, Fortum 30-50 mg/kg/zi în 2 prize, Longacef sau Rocephin 50 mg/kg o dată pe zi etc.) în asociere cu aminoglicozide (amikacină sau selemicină). în doză zilnică de 10-15 mg/kg, împărțită în 2 prize). Durata și natura terapiei antibacteriene sunt determinate după examinarea pentru infecție și primirea rezultatelor clinice. test de sangeîn dinamică.
Terapia folosește și vitamina E (α-tocoferol), care stimulează sinteza citocromului și are un efect de economisire a surfactantului. α-tocoferolul se prescrie în doză de 10-15 mg/zi, pe cale orală sau parenterală (sub formă de soluție 5%).
Administrarea de glucocorticoizi la copiii cu sindrom de detresă respiratorie este indicată pentru insuficiența suprarenală secundară. Anterior, aceste medicamente au fost utilizate în tratamentul SDR într-o manieră planificată cu scopul de a accelera maturarea țesutului pulmonar. Utilizarea pe scară largă a agenților tensioactivi exogeni în practică a făcut posibilă evitarea efectelor secundare ale terapiei cu glucocorticoizi (hipertensiune arterială, sângerare gastrointestinală, enterocolită necrozantă, hiperglicemie)
Complicațiile SDR și ale terapiei cu oxigen: fibroplazie retrolentală a nou-născuților, displazie bronhopulmonară, sindroame de scurgeri de aer din plămâni (pneumotorax, pneumomediastin, pneumopericard).
Fibroplazia retrolentală (RLF) se dezvoltă pe fondul hiperoxemiei și al vascularizației insuficiente. La valori ridicate ale PaO 2 (> 100 mmHg), apare o îngustare persistentă a vaselor retiniene, care este singura manifestare clinică a stadiului inițial al bolii. La 1-2 luni de la terminarea oxigenoterapiei, vasele retiniene se dilată și începe proliferarea și edemul retinian. Cu modificări minore, se observă adesea recuperarea spontană a retinei. În 25% din cazuri apare dezinserție retiniană, cicatrici și orbire. Eficient în mai mult de jumătate din cazuri pentru dezlipirea retinei intervenție chirurgicală. Dacă diagnosticul este târziu și leziunea este semnificativă, tratamentul este ineficient. Prin urmare, este necesar să se efectueze o monitorizare strictă a PaO 2 în timpul terapiei cu oxigen și o examinare obligatorie a fundului de ochi la externarea din spital.
Displazia bronhopulmonară (BPD) - boala pulmonara cronica progresiva, rezultatul efectelor toxice ale oxigenului asupra tesutului pulmonar. Principalele motive pentru dezvoltarea sa sunt concentrațiile de oxigen de peste 50% în amestecul respirator și nivelurile ridicate de presiune pozitivă (mai mult de 30 cm de coloană de apă) în timpul ventilației mecanice. Un rol important joaca si durata ventilatiei mecanice (peste 72 de ore) si gradul de prematuritate al copilului. Cu BPD, aproape toate structurile pulmonare sunt deteriorate, complianța pulmonară scade, iar rezistența aerodinamică a căilor respiratorii și munca respiratorie crește. Se dezvoltă hipoperfuzia pulmonară și hipertensiunea pulmonară și, ulterior, hipertrofia ventriculară dreaptă și cor pulmonale. Rata mortalității pentru BPD este de 30-50%.
Sindroame de scurgeri de aer pulmonar. Acest grup de complicații include:
1. emfizem interstițial, în care aerul se acumulează în spațiul interstițial. Clinic, este puțin exprimată, dar poate fi însoțită de o creștere a necesarului de oxigen și o creștere a PaCO 2. Progresia emfizemului interstițial în jumătate din cazuri duce la pneumotorax. Diagnosticat numai cu raze X. În acest caz, pe radiografie apar limpeziri în formă de pensulă și liniare. Afectarea plămânilor este de obicei bilaterală. Odată cu dezvoltarea emfizemului, se efectuează modificări ale parametrilor ventilației mecanice (scăderea presiunii inspiratorii de vârf și a presiunii pozitive la final de expirare).
2. pneumotoraxul poate fi fie spontan, asociat cu imaturitatea sistemului respirator și SDR, fie ca rezultat al suportului respirator (ventilator, suport ventilator). Se crede că pneumotoraxul apare la 30-50% dintre copiii cu SDD și cei aflați în ventilație mecanică. Cel mai adesea acesta este un pneumotorax sever, care necesită intervenție imediată. Diagnosticul se face pe baza manifestărilor clinice: o deteriorare bruscă a stării copilului, slăbirea respirației, lipsa sincroniei respirației, cianoză, tahicardie; confirmat prin radiografie: acumulare de aer în cavitatea pleurală, deplasarea mediastinului, colaps pulmonar. Necesită drenajul cavității pleurale.
3. Pneumomediastin. Apare rar, poate fi spontan. De obicei, se manifestă prin tonalitatea zgomotelor inimii, dificultăți de respirație și posibilă cianoză. Diagnosticul este confirmat prin radiografie: o radiografie laterală a toracelui arată o zonă de degajare situată în spatele sternului sau în partea superioară a mediastinului. La o radiografie directă, uneori aerul acumulat separă umbra inimii de glanda timus(„aripă de fluture” sau „velă”). Aerul se dizolvă de la sine, tratament special această complicație nu este necesară.
4. pneumopericardul este rar. Cu un ciot-pericard tensionat, poate apărea tamponada cardiacă. Manifeste deteriorare accentuată stare, cianoză, zgomot sever al inimii. Tratament: puncție pericardică.
Hemoragia periventriculară (PVH). Acestea sunt cele mai frecvente la copiii cu greutate mică la naștere și sunt foarte probabil să provoace deces (la 40% dintre pacienți). PVC-urile pot apărea până la manifestare clinică SDR, și pe fondul sindromului de detresă respiratorie din cauza hipoxiei, hipercapniei, disfuncției cardiace, acidozei respiratorii și metabolice etc. Cu cât este mai sever sindromul de detresă respiratorie, cu atât este mai mare riscul de a dezvolta hemoragii periventriculare. De asemenea, nu trebuie să uităm de PVC-urile iatrogenice care apar în timpul modurilor de ventilație mecanică dure, injectarea cu jet de soluții hiperosmolare, manipularea brută, care este asociată cu o creștere sau fluctuație bruscă a presiunii sistemice. Unul dintre mecanismele comune pentru apariția PVC-ului iatrogen este transportul la altul institutie medicala un copil cu SDD în perioada acută, mai ales în primele trei zile de viață.
Prevenirea SDR.
Metoda principală este prevenirea avortului spontan. Cele mai frecvente cauze ale nașterii premature sunt infecțiile urogenitale, tulburările neuro-hormonale și expunerea la factori exogeni. Este doar posibil soluție cuprinzătoare această problemă, inclusiv pregătirea unei femei pentru sarcină, igienizarea posibilelor focare de infecție, gestionarea adecvată a sarcinii și a nașterii. De asemenea, nu trebuie să uităm de necesitatea protecției sociale a femeilor însărcinate. Pentru alții metoda importanta este utilizarea de medicamente care accelerează maturarea țesutului pulmonar la făt, cum ar fi glucocorticoizii, aminofilina, tiroxina, în absența contraindicațiilor la utilizarea lor la o femeie însărcinată. Terapia cu glucocorticoizi pentru nașterea prematură amenințată a devenit larg răspândită. În prezent, se utilizează în principal dexametazona (6 mg x 4 ori cu un interval de 12 ore) sau betametazona (12 mg x 2 ori cu un interval de 24 de ore).
Articole similare
-
Ce este asigurarea de titlu pentru tranzacțiile imobiliare și cât costă?
Asigurarea titlului este un tip foarte comun de asigurare în zilele noastre. Acest lucru se datorează faptului că marea majoritate a instituțiilor bancare sunt extrem de reticente în a acorda împrumuturi garantate cu imobiliare sau, într-un cuvânt,...
-
Colecționari - ar trebui să vă fie frică de ei?
Agențiile de colectare nu sunt cea mai plăcută activitate din lume. Ei cumpără datorii aproape neperformante de la bănci/organizații de credit și încearcă să le recupereze, folosind adesea metode destul de controversate. Până recent...
-
Colecționarii au intentat un proces. Ar trebui să ne fie frică? Cum să scapi de recuperatorii de datorii: cele mai bune sfaturi De ce se tem agențiile de colectare
Este de remarcat faptul că în condițiile cesiunii, adică a cesiunii dreptului de creanță, o condiție obligatorie este notificarea debitorului. Prin lege, clientul trebuie să primească de la bancă o hârtie prin care să-l informeze că datoria lui a fost transferată la o agenție de colectare...
-
Director - coduri de tipuri de documente pentru impozit
Pentru a eficientiza fluxul de documente și pentru a reduce sarcina asupra personalului, inspectoratele fiscale folosesc o codificare specială. Este necesar să-l cunoaștem nu numai pentru angajații serviciilor, ci și pentru cetățeni. Acest lucru se explică prin faptul că în unele...
-
Director - coduri de tipuri de documente pentru impozit
Situația economică obligă oamenii să se mute în căutarea unui loc de muncă. Pentru a obține un loc de muncă în mod legal, trebuie să solicitați un brevet sau să încheiați un contract de muncă. Cetăţeni ai Rusiei, muncitori angajaţi - migranţi care au ajuns pe teritoriu...
-
Care este codul pentru permisul de ședere?
La transmiterea rapoartelor și certificatelor către Serviciul Fiscal Federal, care necesită indicarea tipului de document de identificare a unei persoane, devine necesar să se noteze codul tipului documentului corespunzător. De unde pot obține aceste coduri și ce cod...
