Megoldások és oldhatóság. Nagy olaj- és gázlexikon
Asztali só benne tiszta megjelenés e, vagy a nátrium-klorid 39,34 nátriumot, 60,66% klórt tartalmaz.
A természetben só megtalálható a tengerek, óceánok, egyes tavak és földalatti források vizében, valamint kristályos üledékrétegek formájában. A lerakódások jellegétől és a kitermelési módszerektől függően megkülönböztetik a kősót, önsót, ketrecben vagy medencében, és elpárologtatják.
A kősót a föld alatt változó mélységű rétegekből bányászják. A legközelebbi nagy kősó lelőhelyek a Chkalov régióban lévő Sol-Iletsk város és az ukrajnai Lugansk régió Artemovsk városának területén találhatók. A Szovjetunió összeomlása után Oroszország továbbra is sót vásárolt Ukrajnából. Az önülepedett sót a tavak alján megtelepedett sórétegekből vonják ki. A sókristályosodás nyáron történik a tóvíz természetes párolgása következtében. Különbséget tesznek a jelenlegi és a régi (gyökös) kristályosodás között.
Jelentős mennyiségű üledékes sót bányásznak a Baskunchak-tóban, a Kuuli-tóban és a Pavlodar régió tavaiban.
A ketrec- vagy medencesót speciális medencékben nyert üledékből vonják ki a torkolatok vagy egyes, a tengertől keskeny partsávokkal elválasztott tavak víz természetes elpárolgása következtében. A szomorúsót főként a krími régió torkolatainak vagy sós tavainak vizéből nyerik ki. Az elpárologtatott sót úgy nyerik, hogy természetes vagy mesterséges sóoldatból vizet párologtatnak el speciális párologtató egységekben vagy vákuum elpárologtatókban. Az elpárologtatott só extrakcióját az irkutszki régióban található Szlavjanszkban, Usolye-ben és néhány más lelőhelyen koncentrálják.
Az asztali só tulajdonságai. Tiszta nátrium-kloridot kristályosítás után kapunk színtelen, szabályos köbös kristályok formájában, amelyek fajsúlya 2,167, olvadáspontja 800°.
A természetes só fajsúlya 1,95 és 2,2 között van a kristályok méretétől és a só típusától függően. A kristályosodás (kicsapódás) során a sóoldat egy része a kristályok belsejében marad, annál több nagyobb méretek hulló kristályok. A sóoldat fajsúlya kisebb, mint a tiszta kristályok fajsúlya, ezért a természetes só kristályainak ez utóbbi értéke kissé csökkent. A kősókristályokban kevesebb sóoldat-zárvány található, mint a jelenlegi ketrec önültető és medencesójában, ezért a kősó fajsúlya nagyobb, mint az önülepedett és medencesó fajsúlya. A gyakorlati számításokhoz a fajsúly 2,2-nek tekinthető.
A nátrium-klorid kristályok 75,5% feletti relatív páratartalom mellett felszívják (elnyelik) a nedvességet, 75,5% alatti relatív páratartalomnál pedig elveszítik azt. Ez a tulajdonság magyarázza a só nedvességtartalmának változását, ha zárt csomagolás nélkül, levegőn tárolják. A természetes sók, különösen az önülepedő és a medencesók, amelyek kalcium- és magnézium-sók szennyeződéseit tartalmazzák, megnövelt higroszkópossággal rendelkeznek a tiszta nátrium-kloridhoz képest. Nyirkos helyiségben vagy szabad levegőn történő tárolás esetén a só nedvességtartalma észrevehető kioldódás nélkül elérheti,
a nedvesség további felszívódása a só részleges feloldódásához vezet. A higroszkóposság nagyrészt a só raktározás közbeni csomósodásának, vagyis az egyes kristályok egymáshoz tapadásának köszönhető, melynek eredményeként a só szilárd, homogén masszává tömörül.
A nedves só a kristályok erősebb kölcsönös adhéziója miatt, amelyet a kristályokon lévő telített oldat filmje okoz, rosszul diszpergálódik; egyenletesen elosztani úgy, hogy egy spatulával szétszórjuk a kádakban lévő halréteg felületén, sokkal nehezebb, mint a száraz só.
De a nedves (4-5%-nál több nedvességet tartalmazó) só a száraz sóval összekeverve sűrű, nem szóródó csomókat képez, amelyek erősebben és nagyobb mennyiségben tapadnak a halhoz. Ezért a hal sózásakor, előzetes sóval keverve, jobb, ha nedves sót használunk, míg ha a sót a halrétegekre szórjuk, akkor jobb a száraz sót használni.
Sót hóval vagy finomra tört jéggel keverve az utóbbi megolvad, mivel -21,2° feletti hőmérsékleten só és hó (jég) nem lehet egyszerre jelen. Amikor a jég (hó) elolvad, ha környezet elnyelt nagyszámú hő, és ezen a tulajdonságon alapul a hűtőkeverékek készítése. A legalacsonyabb, -21,2°-os hőmérsékletet úgy érjük el, hogy 100 tömegrész jeget (hót) 33 rész sóval összekeverünk (a keverék összetétele: 24,4% só és 75,6% hó vagy jég).
Szennyeződések a sóban. A természetes konyhasó a nátrium-kloridon, mint fő vegyületen kívül más sószerű vegyületek szennyeződéseit, leggyakrabban alkáliföldfémek (kalcium, magnézium) sóit, oldhatatlan szennyeződéseket és vizet tartalmaz. A víztartalom a tárolási körülményektől, míg a sószerű szennyeződések mennyisége a só fajtájától és kivonásának módjától függ. táblázatban Az 1. táblázat az Orosz Föderációban leggyakrabban előforduló konyhasó összetételét mutatja be.
A magnézium- és kalcium-sók szennyeződése a hal sózásakor nem kívánatos. Jelentős mennyiségű ilyen szennyeződés jelenlétében a hal felülete erősen kiszárad, a száraz sózás késlelteti a sós víz képződését és a só bejutását a halba, ill. sós hal keserű ízt kap. Megállapítást nyert, hogy ha a konyhasó magnézium- és kalciumsó-tartalma meghaladja a 2%-ot, az utóbbi alkalmatlanná válik a halak sózására. A sóban egyéb oldható szennyeződések mellett kálium-klorid és nátrium-szulfát is előfordulhat, de általában olyan kis mennyiségben, hogy a sózás sebességére és a hal minőségére semmilyen hatással nem lehet.
Az oldhatatlan anyagokat sóval keverik mind az extrakció során, mind a csomagolás nélküli tárolás és szállítás során. A betakarítás, a szállítás és a tárolás helytelen megszervezése esetén az oldhatatlan szennyeződések mennyisége akkora lehet, hogy a sózás során beborítja a hal felszínét, és alapos mosással is nehezen távolítható el.
Az oldhatatlan szennyeződések közé tartoznak a szerves és szervetlen vegyületek egyaránt. A szervetlenek között lehet homok, agyag, szén, amelyek főleg tárolás és szállítás során esnek le, valamint vas-oxidok, alumínium, alkáliföldfémek szén-dioxid sói. A vas- és alumínium-oxidok mindig jelen vannak a kősóban, míg a kalcium-karbonát-sók a tengervízből nyert sóban.
Önkicsapó és ketrec sók, amellett, hogy a szennyeződés szerves és ásványi eredetű, olyan mikroorganizmusokat tartalmaz, amelyek a tavak és uszodák sós vizéből, valamint a szántóföldi tárolás, szállítás és fogyasztási helyeken kívülről kerülnek be. A sós sóba kerülő mikroorganizmusok legnagyobb száma a friss sóban található; tárolás (öregedés) során mennyiségük csökken. Ezen mikroorganizmusok között legmagasabb érték a mikrococcusok csoportjába tartozó mikroorganizmusok pigmentképző képességgel rendelkeznek. Ha az ilyen sóval sózott hal tárolása során a levegő hőmérséklete megemelkedik, a húson vörös szín jelenik meg, amely nyálkahártya megjelenésével és fehérjebomlási termékek szagával jár. A sóval a halászati vállalkozásokba kerülve pigmentképző baktériumok fertőzik meg a raktárakat, a sótároló helyeket és a raktárban található elpárolgott sót és kősót.
A só minőségi követelményei. Állami szabvány Az asztali só esetében megengedett: legalacsonyabb tartalom nátrium-klorid és a legnagyobb mennyiségű szennyeződés (2. táblázat).
A nátrium-szulfát szárazanyag-tartalma megengedett:
a) extra só esetén - legfeljebb 0,2%;
b) más fajták esetében - legfeljebb 0,5%;
A sóban lévő szennyeződések sózott késztermékek minőségére gyakorolt hatását tanulmányozták, ben más idő, valamint a sózási gyakorlat, megállapították, hogy a különböző utakés sózási módok esetén a só maximális szennyezőanyag-tartalma a következő legyen (3. táblázat).
Az extra (kaviár speciális sózása) és az I. fokozatig terjedő sófajták nagyon alkalmasak a sózásra.
Sót őrölni. Az asztali só az őrléstől (a kristályok méretétől) függően több számra oszlik: 0,1,2,3. Az extra só őrlési száma 0; legmagasabb és I. fokozat - 0-tól 3-ig: II. osztályú só - I-től 3-ig. Az őrlési jellemzőket a táblázat tartalmazza. 4.
A só őrlésének vagy más szóval a sókristályok méretének nagyon fontos halak sózásához: a sóoldódás sebessége a méretétől függ, ömlesztett tömeg diszpergálhatósága, higroszkópossága.
A kristályok felületének és térfogatuknak az aránya, a nagy kristályok úgynevezett fajlagos felülete kisebb, mint a kicsiké. Feloldódáskor minden felületegységről ugyanannyi só jut az oldatba. De ha ez a mennyiség a kristályok térfogat- vagy tömegegységéhez kapcsolódik, akkor ugyanazon idő alatt sokkal több só oldódik fel a kis kristályokban, mint a nagyokban, mivel az előbbiek teljes felülete sokkal nagyobb, mint az utóbbié. . Ha szükséges, hogy a só gyorsan feloldódjon, finomabb sót kell használni.
Ezenkívül az egyenletes sózáshoz a sókristályok legsűrűbb eloszlására van szükség, hogy az általuk elfoglalt felület közel legyen a hal felületéhez. Ez csak úgy valósítható meg, ha a sókristályok méretének meghatározásakor a hal felszínét, pontosabban annak fajlagos felületét (a felület és a hal tömegének arányát) figyelembe vesszük. Például egy 200 g tömegű csendes-óceáni hering felülete 280 cm2, míg a 22 g tömegű csendes-óceáni hering felülete 74 cm2. Telített sózáshoz az első 60 g sót igényel, a második pedig 6 g; 1 cm2 felületre 0,21, illetve 0,08 g-ot kell elosztani, azonos méretű kristályok esetén az érintkezési felületük aránya közös felület a nagy hering 2,5-szerese lesz, mint a kis hering, mivel a só mennyisége 1 cm3 halfelületre számítva az első esetben 2,5-szer nagyobb, mint a második esetben. Ebből kifolyólag, hogy a hal érintkezési felületének a teljes felületéhez viszonyított aránya azonos legyen, a kis heringek sózásához finomabb sót kell használni, amely azonos súly mellett nagyobb felülettel rendelkezik, mint a nagyok.
Ezzel kapcsolatban egy második következtetés is levonható: minél kisebb a só adagolása a sózás során, annál kisebb a sókristályok mérete és annál kisebb az őrlési szám, hogy a só és a só között minél nagyobb érintkezési felület legyen. hal
A nagyon finom só (0. és 1. őrlemény) nagy mennyiségben történő sózás során történő használata nemkívánatos eredményekhez vezethet. A finom só, amely a nagyobb kristályokhoz képest megnövekedett higroszkópossággal rendelkezik, amikor nincs elegendő víz a halon a sóoldat első adagjainak kialakításához, erősen kiszárítja a belső szöveteket, és ezáltal lelassítja a só bejutását a húsba. Ez a jelenség hasonló a halak felszínének kiszáradásához, amely a sóban lévő nagy mennyiségű magnézium- és kalciumsó miatt következik be. Annak érdekében, hogy elkerüljék a hal felületének intenzív kiszáradását, amikor a száraz sóval telített sózást végeznek, inkább különböző méretű - legfeljebb 3-4 mm-es - kristályok keverékéből álló asztali sót használnak (2. őrlés). Egy ilyen keverékben elegendő mennyiségű 1 mm-es vagy kisebb méretű kristályok vannak, amelyek növelik a só és a hal érintkezési felületét, és gyorsan feloldódnak, és a szövetek súlyos kiszáradása nélkül képezik a sóoldat első adagjait. A sóoldat ezt követő részei a nagy felületű kristályok feloldódása miatt képződnek; A megfigyelések azt mutatják, hogy ha a sóban különböző méretű kristályok keveréke van, akkor az oldódás a halsózó edényben normálisan megy végbe, ha a sózási folyamat megkezdődött.
A só térfogatsúlya. A sómennyiség elszámolására a sótárolókban és áramáramlás Hasznos tudni a só tömegét. Az ömlesztett termékek ömlesztett tömege térfogategység (1 m3) tömege tonnában vagy kilogrammban. A térfogatsűrűség a termék fajsúlyától, a részecskék méretétől és különböző méreteinek arányától, a páratartalomtól és a fedőrétegek rá nehezedő nyomásától függ. Mert különféle típusok a halászati iparban használt sók ömlesztett tömege 1038-1365 kg (5. táblázat). Az azonos típusú és bányászati területű só térfogatsűrűsége a kis sóknál nagyobb, mint a nagyoknál.
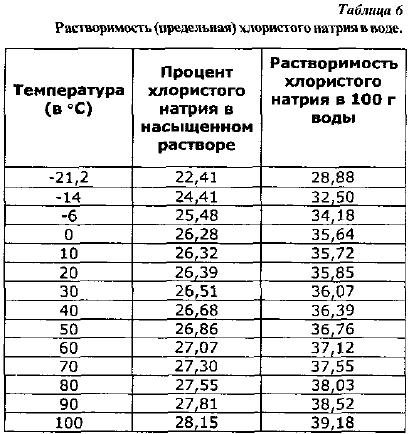
A konyhasó oldatok tulajdonságai. A nátrium-klorid vízben oldódik, és az oldhatósága, azaz a telített oldat előállításához szükséges maximális mennyiség a hőmérséklet emelkedésével kissé változik (6. táblázat).
DI. Mengyelejev a 0 és 108° közötti hőmérsékleti tartományra a következő képletet vezette le a só 100 g vízben való limitáló oldódásának meghatározására
ahol t a hőmérséklet Celsius-fokban
Az oldhatóságot gramm nátrium-klorid/100 g oldatban vagy gramm/100 g víz mennyiségben lehet kifejezni. Ezen értékek között elég sok van egyszerű függőség. Jelöljük c-vel a 100 g oldat sótartalmát (g-ban), a 100 g vízben oldott só mennyiségét (g-ban) a megadott sótartalmú oldathoz a-val. Nyilvánvalóan 100 g vízben oldott gramm sóból 100 g vízben feloldódik:
![]()
A ismeretében a c-t a következő képlet segítségével számíthatja ki:
![]()
A nátrium-klorid oldhatósága 100 g vízben, a (2) képlet alapján számítva, a táblázatban látható. 6.
A sózás gyakorlata szempontjából fontos a nátrium-klorid közel azonos oldhatósága a 0 és 20° közötti hőmérséklet-tartományban, mivel ezeken a határokon belül nem szükséges a só adagolását megváltoztatni a hőmérséklet változásával.
A nátrium-klorid oldatok nehezebbek, mint a víz, és fajsúlyuk nagyobb, mint az egység. 15°-os hőmérsékleten az oldat fajsúlya a víz 4°-os fajsúlyához viszonyítva a következő képlettel számítható ki D. I. Mengyelejev által:
ahol c a só koncentrációja az oldatban a tömegszázalékban A fajsúly meghatározásához hidrométereket vagy sűrűségmérőket használnak, amelyek skáláján a fajsúly értékét 20°-ban a a víz fajsúlya 4°-on, egységnyire felvetve. Hagyományos hidrométerek (sűrűségmérők) alkalmazásakor a fajsúly meghatározása 0,0 pontossággal történik! és csak speciális hidrométerekkel növelhető a meghatározás pontossága 0,001-re.
A fajsúly meghatározására a közelmúltban a hidrométerek és sűrűségmérők mellett hagyományos Baume-fokozatú hidrométereket is alkalmaztak. A skála 0°-a a bemerülés mélységének felel meg tiszta víz, és 10° - 10%-os nátrium-klorid oldatban. A Baume-fok fajsúlyra való konvertálásához használja a következő képletet:
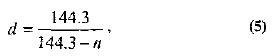
ahol n a Baume-hidrométer indexe.
táblázatban A 7. ábra a sóoldatok fajsúlyát mutatja 0°, 10°, 20°-on és a sókoncentráció megfelelő értékeit az oldat tömegének százalékában.
Olyan oldat fajsúlyának meghatározásakor, amelynek hőmérséklete nem esik egybe az ariométer kalibrációs hőmérsékletével, a következő képlettel lehet a talált fajsúly értéket 20°-os hőmérsékletre hozni:
ahol: d4в20 - fajsúly 20°-on;
d4в1 - ugyanaz a t mérési hőmérsékleten;
0,0004 a sóoldat tölthetőségének hőmérsékletváltozási együtthatója.
A nátrium-klorid oldatok forráspontja és fagyáspontja az utóbbi koncentrációjától függ: minél töményebb az oldat, annál magasabb a forráspont és annál alacsonyabb a fagyáspont (8. táblázat).
A telített oldat 0° alá hűtésekor először feleslegben oldott só válik ki, aminek következtében az oldat sókoncentrációja csökken, majd 24,4%-ra csökken az oldat -21,2°-os hőmérsékleten megfagy. A 0 °C alatti hőmérsékleten kicsapódó só NaCl 2H20 összetételű. azaz két vízmolekulával kristályosodik. A koncentráció további növelésével a fagyáspont nem csökken, hanem nő, és nem víz, hanem só szabadul fel szilárd formában. A -21,2°-os hőmérséklet a legalacsonyabb az összes közül lehetséges hőmérsékletek asztali só oldatának fagyasztása.
A nátrium-klorid és a természetes sók oldatainak reakciója szinte semleges. A konyhasóra vonatkozó szabvány szerint ételreakció vizesoldat A lakmuszpapír legyen semleges vagy közel legyen hozzá.
A telített sóoldat 75,5%-os relatív páratartalom mellett nem veszít párolgás következtében nedvességet és nem szívja fel a levegőből. Ezt az egyensúlyi relatív páratartalmat a telített sóoldat higroszkópos pontjának nevezzük, és megközelítőleg megegyezik a szilárd só higroszkópos pontjával.
Sólé-koncentrátorok. A sózás a kristályos só mellett nagy mennyiségű sóoldat vagy mesterséges sóoldat vizes oldatát is felhasználja. Elkészítésükhöz célszerű speciális berendezéseket - sóoldat-sűrítőket - alkalmazni, amelyek termelékenysége igen változó lehet A kis kapacitású sóoldat-sűrítő egy hengeres vagy kúpos alakú, körülbelül 60-70 cm magas faedény, amelyben rostély található. ruhával (zsákvászon) vagy tiszta hálóval letakarva, legalább 50-40 cm magas réteget helyeznek rá.
Közvetlenül a sóoldat-koncentrátor aljának közelében van egy lefolyócső. A víz belép felső rész perforált csővezetéken vagy perforált felületen keresztül, és egyenletesen oszlik el a sóréteg teljes keresztmetszetében a sóoldat-sűrítőben. A víz áramlási sebességének és a sóréteg magasságának beállításával könnyen elérhető 1,2 fajsúlyú telített sóoldat áramlása.
Nagy mennyiségű sóoldat gyors beszerzéséhez sóoldat sűrítőt kínálunk, amelybe egy szivattyú szállítja a vizet alsó rész nyomás alatt, és sólé folyik ki a tetejéről.
Ebben az esetben a sóréteget legalább 1 m magasságban tartják, így a teljes telítettség egyetlen vízmozgással történik a sórétegen keresztül.
"Az összes sók közül a legfontosabb és legalapvetőbb az, amelyet egyszerűen sónak nevezünk."
Ha felé fordulsz enciklopédikus szótár, akkor az alábbi információkat tudhatja meg a konyhasóról.
Nátrium-klorid (nátrium-klorid, konyhasó, kősó), NaCl, színtelen kristályos anyag, olvadáspont 801 0C, forráspont 1465 0C Oldhatóság 26,4 g 100 g vízben 20 fokon; Ezenkívül folyékony ammóniában, etilénglikolban, hangyasavban és metanolban oldódik. A természetben a nátrium-klorid széles körben elterjedt kősó (halit) formájában, amely a következő helyen található: tengervíz(1,5 tömeg%) és óceánok (2,72%), sós sós tavak, őrölt sós vízben. Fontos ételízesítők; elmegy marónátron, klór, szóda előállítására. Világtermelés – 175 millió tonna/év.
Megszoktuk, hogy minden nap asztali sót látunk az asztalunkon, de azt hiszem, sokan nem is gondolunk arra, hogy milyen jelentősége van az életünkben, és só nélkül, ahogy mondani szokás, még szappant sem lehet főzni!
A só olyan anyag, amely még a tűzben sem változik, nem romolható el, hanem éppen ellenkezőleg, megvédi az ételt a romlástól. Régóta az állandóság szimbólumaként szolgált. Őseink a törhetetlen barátság jeléül „kenyérrel és sóval” köszöntötték a vendégeket.
BAN BEN különböző országokó emberek esznek különféle termékek. És csak egy termék mindenhol ugyanaz - konyhasó (NaCl). Az ásványtanban halitnak vagy kősónak, a technikában és a mindennapi életben - asztali ill asztali só, kémiában – NaCl (nátrium-klorid).
Szinte minden étel elkészítéséhez szükséges. Még édes süteményeket is! És ha nekünk úgy tűnik, hogy nincs elég belőle az ételben, akkor „nincs elég só az asztalon”. Az emberek nem tudnak só nélkül élni.
Az asztali só a legősibb gyógyszerek része volt, ennek tulajdonították gyógyító tulajdonságait, tisztító és fertőtlenítő hatású. Különböző időkben a sót univerzális ellenszernek tartották. „Sószórót kell elhelyeznünk az evéssel elfoglaltak előtt. A só szabályozza a mérget, az íztelent pedig ízletessé teszi” – Arnaldo Vilanovából.
Érdekesség, hogy ősidők óta sok népnél kereskedelmi tárgy volt a só (1 kg sóért 1 kg aranyhomokot fizettek).
Speciális medencékben a meleg országok part menti régióinak lakói nyerték ki a tengervízből, és a bányászok fejlesztették ki azokat a lelőhelyeket, amelyek könnyen hozzáférhetők voltak. Évszázadokon át a sóoldatokat (sóoldatokat) nagy mélységből szivattyúzták ki, és sóművekben dolgozták fel konyhasóvá.
A nátrium-klorid nemcsak fontos élelmiszer termék. A sók azok a legfontosabb alapanyag Mert vegyipar.
1. Asztali só a természetben. (Sófajták).
Az asztali só kémiailag aktív vegyület, amely az alkálifém-nátrium rendkívül mérgező klórral történő óvatos kezelését igényli. Ezt a vegyületet úgy kaphatjuk meg, hogy a nátriumdarabokat nátrium-klórgázzal hosszú ideig tesszük ki egy jól zárható edényben. Mint tudjuk, a kereskedelmi forgalomba kerülő konyhasó nem mérgező, hiszen az anyagok egymással kombinálásakor nem jelennek meg eredeti tulajdonságaik. Mint minden egyszerű só, fémionból és savmaradékból áll.
A konyhasó olvadáspontja 800 C fok, sűrűsége 2,16 g/cm3.
A tiszta konyhasó NaCl színtelen és köbös kristályokat képez. A „csemege” vagy „királyi” konyhasó lágy rózsaszín színű és kellemes aromájú. Mikroszkopikus méretű algákat tartalmaz, amelyek egy sós tó vizéből kristályosodás során kerültek bele.
Kiderült, hogy kék konyhasót is találnak. A természetben az ilyen színű kősó nagyon ritka. És a laboratóriumban nem nehéz beszerezni a kék nátrium-kloridot. Ehhez fémnátrium és nátrium-klorid keverékét egy szorosan lezárt edényben hevítik. A fém feloldódhat sóban. Ebben az esetben a nátriumatomok behatolnak kristályrács, amely Na+-ból és Cl- ionokból áll, és „teljesíti”, nátrium-kationokká alakul. A felszabaduló elektronok pedig a kristályrács azon csomópontjaiban helyezkednek el, ahol a klorid-anionoknak kell elhelyezkedniük. Az ilyen szokatlan, elektronok által elfoglalt rácshelyeket üres helyeknek vagy F-központoknak nevezik (a német Farbe szóból - szín). Amikor a kristályt lehűtik, néhány F-centrum 10-1000 nátriumatomot tartalmazó asszociációkat képez. Ez az oka a kék festék megjelenésének. A természetes ásványi halitban (kősóban) a radioaktív átalakulásokat kísérő sugárzás hatására F-centrumok képződnek. Érdekes módon, amikor a kék kősót feloldják vízben, színtelen nátrium-klorid oldat képződik.
2. Só Ruszban (történelmi háttér).
BAN BEN Kijevi Rusz használt sót a Kárpátok vidékéről, valamint sós tavakból és torkolatokból a Fekete és Azovi tengerei. Sudakban vásárolták és északra szállították. A só olyan drága volt, hogy az ünnepi lakomákon csak a nemesi vendégek asztalára szolgálták fel, míg mások „só kortyolgatása nélkül” távoztak az ünneplésről.
Az oroszországi sóbányászat első említése a 12. századi kéziratokban található. A termelés akkoriban primitív volt. Azokon a helyeken, ahol sóforrások jelentek meg, lyukakat ástak - kutakat és sós vizet gyűjtöttek. Itt gazdagodott: nyáron párologtatással, télen fagyasztással. A 16. század elejére. A sókitermelési technika megváltozott: a mély sós vizeket fúrások – „csövek” segítségével kezdték kitermelni.
Az Asztrahán Terület annektálása után fontos források a Kaszpi-tenger acéltavainak sói. Itt először nem kellett sót „főzni” a sóiparosoknak, egyszerűen csak kikanalazták a tavak fenekéből, és hajókon küldték fel a Volgán. És mégsem volt kielégítve a sószükséglet. A lakosság legszegényebb rétegei szenvedtek leginkább a hiánytól és a magas áraktól. A sóadó emelése elégedetlenséget váltott ki a lakosság alsóbb rétegeiben, amelyet „sólázadásnak” neveznek.
1711-ben I. Péter rendeletet adott ki a sómonopólium bevezetéséről. A sókereskedelem az állam kizárólagos joga lett. A sómonopólium több mint százötven évig létezett, de megszűnt.
BAN BEN A cári Oroszország, a gazdag természetes sókészletek ellenére a primitív kitermelési és szállítási módszerek miatt nem volt belőle elég. A só sok évszázadon át gazdagodási és haszonforrás volt a kereskedők és vállalkozók számára. Ezért a szovjet kormány egyik első rendelete a sót, a föld altalaj más gazdagságához hasonlóan, a népállam tulajdonává tette. A 20-as években a lapátot, a csákányt és a kosarat felváltották a sókombájnok, vágógépek és vákuumpárologtatók. A bányászat gépesítése lehetővé tette hazánknak, hogy az egyik első helyet foglalja el a megtermelt só mennyiségében. Most annyi konyhasót gyártunk egy év alatt, amennyit a forradalom előtti Oroszország 10-12 év alatt.
3. A Föld sós furcsaságai.
A föld alatti sóhegyek mérete nem alacsonyabb, mint a legtöbb magas csúcsok Pamír és Kaukázus. Alapjaik 5-8 km mélységben fekszenek, csúcsaik a földfelszínre emelkednek, olykor ki is emelkednek belőle. Az ilyen óriási felhalmozódásokat sókupolának nevezik.
Nál nél magas nyomásokés a hőmérséklet, a föld belsejében lévő só képlékenysé válik. És mivel a hőtágulási együtthatója nagyobb, mint a többi kőzeté, hevítéskor kitágul és felfelé nyomódik. Hatalmas sótömegek szakadhatnak ki a kontinentális rétegből és emelkedhetnek fel a föld felszínére, közben megemelve, olykor átütve a fent heverő sziklákat. Természetesen a sókupolák növekedése hosszú folyamat.
Tádzsikisztánban a Sóhegynek közel 900 m magas kupolája van, alulról nézve úgy tűnik, hogy frissen hullott hó borítja: a só olyan fényesen csillog a nap sugarai alatt.
A sókupolák azonban gyakoribbak, nem emelkednek olyan magasra a föld felszíne fölé, és nem is borítják talajjal. Az egyik ilyen, több mint egy kilométer mélyen a földbe nyúló, csaknem 100 km-es alapkerületű kupola tetején fekszik a jól ismert Baskunchak-tó. Ezt a tavat a természet csodájának nevezik. Ítélje meg maga Az Astrakhan sztyeppék között van egy tó, amelynek területe több mint 100 km2. A tó mélysége pedig nem több fél méternél, és akkor is csak télen-tavasszal. Nyáron és ősszel egy vékony vízréteg elpárolog, így a tó teljes felületén vakítóan fehér só szikrázik a napon. Tartalékai gyakorlatilag kimeríthetetlenek. A sóhegy tetején található tó évszázadok óta első osztályú terméket biztosít számunkra - a nátrium-klorid tartalma eléri a 98%-ot.
Két azonos kupola tó ismert. Az Iletsk sókupola tetején található Razval-tó szokatlanul nagy mélységű - több mint 22 m. magas koncentráció Ez a tó még a legzordabb télen sem fagy be. Az erősen túlhűtött sós víz a tó fenekére süllyed, és hidrohalit kristályosodik ki belőle, melynek lerakódásai nyáron sem tűnnek el. Ez azzal magyarázható, hogy az édesvízi testeknél szokásos keveredés hiányzik a telített sűrű sóoldatban, a felső, felmelegített vízrétegek hője nem kerül át az alsóbbakba. A hideg Razval-tótól mindössze 150 méterre található az antipódja - a forró Tuzluchnoye-tó. Mélysége 0,2-0,3 m. Ez biztosítja a tó intenzív nyári felmelegedését és vékony rétegét. friss víz a sűrűbb sós vízen átfolyva egyfajta üvegházhatást kelt.
A konyhasó kinyerése évszázadok óta folyik. A régi stílusú sóbányák a szénbányákhoz hasonlítanak. Amikor a kősót felemelték a hegyre, a bányászok a föld alatt hagyták hosszú folyosók sodródások, mély kutak adits. Manapság ezeket a földalatti tereket széles körben használják gáz- és olajtermékek tárolására. A cseppfolyósított gáz tárolásának költsége a bányákban 2-4-szer, a sórétegekben pedig 20-40-szer olcsóbb, mint a föld feletti tartályokban: a párolgásból származó veszteségek szinte teljesen megszűnnek.
De nem minden sóbányát használnak ilyen célokra. Hét évszázada például a Krakkó melletti lengyelországi Wieliczka városában sólelőhelyeket alakítottak ki. Ha majdnem fél kilométer mélyre ereszkedik a földbe, a só bizarr birodalmában találja magát. Lengyel bányászok és művészek igazi földalatti múzeumot hoztak létre a bánya kiásott emeletein. Kősó – eléggé puha anyag, könnyen feldolgozható és megvilágítva rendkívül szépnek tűnik.
A sóbarlangoknak van másik csodálatos ingatlan: Szokatlan hanghatásokat keltenek. Azokban a barlangokban, ahol a falakat és a boltozatokat sócseppkő borítja, a levegő vibrációja gyönyörű, dallamos hangokat kelt.
Vannak úgynevezett „sós” nevek. A világ számos városának és településének neve említi a sót: Solvychegodsk, Solikamsk, Sol-Iletsk, Soligalich, Soligorsk, Usolye-Sibirskoye, Soloneshnoye, Salt Creek, Salttó, Saltkots, Salzburg, Salzgitter, Marseille ( tengeri só), végül csak a Salt, a Solyanka és még a Saltcellar is. És ez a lista folytatódik.
Ezeknek a városoknak azért van ilyen neve, mert a sótermelés, a sóbányászat és a sófeldolgozás régóta a legfontosabb iparágak lakóik számára.
4. A só használata a mindennapi életben.
A só egyedülálló tulajdonságai lehetővé teszik a mindennapi életben való felhasználását. Ezt a csodálatos anyagot befőzéshez, festéshez, foltok eltávolításához és az edények szilárdságának növelésére használják.
A különféle élelmiszerek sózással történő tartósítása: hús, hal, zöldség, gomba stb. az asztali só úgynevezett antiszeptikus vagy rothadásgátló tulajdonságain alapul, vagyis azon a képességén, hogy elpusztítja az anyagok rothadását okozó baktériumokat vagy mikrobákat. növényi és állati eredetű.
Vajon mit borsóleves főzés után sózni kell. Sós víz rosszul behatol a borsóba. Ezért ha főzés előtt sót ad a leveshez, a borsó nem fog sokáig főni.
Az edények tartósságának növelése. Az üvegedények szilárdságának növelése érdekében forralással „keményíthető”. Ehhez tegye egy serpenyőbe, amelynek az alját egy réteg mosott homok borítja (1 cm vastag), és öntse hideg víz. Forraljuk fel a vizet, és forraljuk 15 percig. Ezután adjunk hozzá 2-3 evőkanál konyhasót, és forraljuk még 30 percig, majd hagyjuk lehűlni, az edényeket eltávolítjuk és alaposan leöblítjük.
Ahhoz, hogy a zománcozott serpenyő tovább tartson, sós vizet kell forralnia egy új serpenyőben (5 teáskanál literenként).
Foltok eltávolítása. A felsőruházati gallérról a zsírfoltok letörlésével eltávolíthatók fültisztító pálcika, konyhasó oldattal megnedvesítve (fél teáskanál) in ammónia(három evőkanál).
Festés. A festés sebességét növeli a konyhasó hatása a pamut és a kapcsolódó szálak festésekor.
A szövetet a festékoldatba merítjük, és felforraljuk. 15-20 perc elteltével öntsön 2 liter konyhasó-oldatot (egy evőkanál liter vízhez) egy alacsony forráspontú festékoldatba, amelyről először eltávolítja a szövetet. Ezután engedje le az anyagot, és folytassa a festést enyhén forrásban lévő oldatban további 30-40 percig. Ezt követően a tartályt levesszük a tűzről, és a szövetet további 30 percig hűtőoldatban tartjuk. Ez idő alatt a szövet megfordul. Ha világos színűre festjük, a só mennyisége felére csökken. Száraz sót is adhatunk a festékoldathoz, de ehhez 3-5 percig ki kell venni, sózzuk, keverjük, és csak miután teljesen feloldódott, engedjük le ismét az anyagot.
5. Mindig meg kell egyen egy kiló sót, hogy jó életet éljen?
Miért mondják, hogy „A só és a zabkása az ételünk?”
A só részt vesz a legfontosabbban élettani folyamatok az emberek és állatok szervezetében. A nyálban, a gyomornedvben, az epében és a nyirokokban található. A nátrium-klorid jelenléte a vérben biztosítja a szükséges ozmotikus nyomás, amitől függ normál működés sejteket. A felnőtt emberi szervezet körülbelül 200 g sót tartalmaz.
Az orvostudományban fiziológiás oldatokat (olyan sók vizes oldatait, amelyek sóösszetételében közel állnak a vérplazmához) használják. Például egyes betegségek esetén az emberi szervezet sok vizet veszít. Ez halálhoz vezethet. Ilyen esetekben sóoldatot fecskendeznek a beteg vérébe.
Kiderült, hogy a hosszú menetelő katonák és a forró műhelyek dolgozói sós vizet kapnak inni. Mert ennek eredményeként sóanyagcsere Az emberi szervezet folyamatosan elveszíti a számára szükséges sókat, beleértve a nátrium-kloridot is, és az izzadással felszabadul. Ezeket a veszteségeket az élelmiszerben és a vízben található sók pótolják. A nátrium-klorid hiányának gyors pótlására, vizet inni adjunk hozzá asztali sót.
Szinte az összes ásványi só, amelyre szervezetünknek szüksége van, elegendő mennyiségben megtalálható a szokásos élelmiszerekben. Csak a nátrium-klorid hiányzik belőle. Ezért kell étkezési sót adnunk ételeinkhez. Egy ember évente 6-8 kg sót fogyaszt. Talán egyetlen élelmiszert sem használnak ilyen kis mennyiségben, és olyan nagy jelentőséggel bír, mint az asztali só.
A nátriumionok szabályozzák a szervezet víztartalmát, transzmisszióját ingerület. Hiánya fejfájáshoz, gyengeséghez, gyenge memória, étvágytalanság, és a felesleg fokozott vérnyomás, magas vérnyomás, szívbetegség. A táplálkozási szakértők azt javasolják, hogy felnőttenként legfeljebb 5 g (1 teáskanál) konyhasót (NaCl) fogyasszunk naponta, de az emberek általában kétszer annyit fogyasztanak, mint amennyi szükséges. Ezért szenvednek az emberek ettől. Például Japán, ahol minden lakos körülbelül 30 g sót fogyaszt naponta, vezet a magas vérnyomásban szenvedők számában. Nemcsak az emberek, hanem a növények és az állatok is szenvednek a sóhiánytól vagy feleslegtől.
asztal 1 A fémionok hiányának és feleslegének hatása a növények és állatok állapotára
Túlzott nátriumhiány
állatokban - izom fájdalom, gyengeség. Növényekben - képződés gátlása; emberekben - magas vérnyomás. A növényekben a klorofill fejlődése. halofita formák.
Vizsgálatot végeztem, hogy meggyőződjek arról, hogy a túlzott sófogyasztás káros.
A Leninsky kerület 12. számú klinikáján 183, 50 éves vagy annál idősebb beteg bevonásával végeztek felmérést. A felmérés kimutatta, hogy az emberek 30%-a szenved magas vérnyomásban. A hipertóniások körében az emberek több mint 70%-a a szükségesnél több sót fogyaszt, a többiek véleményük szerint normálisan fogyasztanak sót. Megállapíthatjuk, hogy a sóval való visszaélés valóban magas vérnyomás kialakulásához vezethet.
6. NaCl kémiai szempontból.
Ha a nátrium-kloridot úgy elemzi Vegyi anyag, akkor azt mondjuk, hogy ez egy összetett vegyület ionos kristályrácstal, ionos kötéssel. Szilárd állapotban, a NaCl kristályban a nátriumion 6 klórionnal szomszédos.
Gőzállapotában a konyhasó egyedi molekulákból áll. Ebben az esetben egy nátriumkationt egy klóranionnal kombinálunk.
A nátrium-klorid vízben oldódik, oldhatósága gyakorlatilag független a hőmérséklettől (20 C-on 35,7 g, 100 C-on kb. 40 g). Vízben oldva ez az anyag ionokká disszociál. Ezt az oldott anyag és az oldószer kölcsönhatása okozza. Mivel a nátrium-klorid kristályban nincsenek nátrium-klorid molekulák, feloldódáskor a kristályszerkezet tönkremegy, és a hidrogénezett ionok oldatba mennek. Az oldatban nincsenek molekulák. Ezért erős elektrolitok oldataiban csak feltételesen beszélhetünk nem disszociált molekulákról.
Figyelembe kell venni, hogy NaOH, HCl, MgCl2, CaCl2 jelenlétében a nátrium-klorid vízben való oldhatósága nagymértékben lecsökken.
A nátrium-klorid előállításának módszerei
A reakció eredményeként nátrium-klorid állítható elő:
1. bázikus oxid – nátrium-oxid sósavval
Na2O + 2HCl = 2NaCl + H2O;
2. amikor a nátrium klórban ég: 2Na + Cl2 = 2NaCl;
3. nátrium-hidroxid és sósav kölcsönhatása esetén:
NaOH + HCl = NaCl + H2O;
4. sósav sóval, például nátrium-szilikáttal való reakciója eredményeként: 2HCl + Na2SiO3 = 2NaCl + H2SiO3;
5. amikor a nátrium-hidroxid reagál egy sóval, például réz(II)-kloriddal: 2NaOH + CuCl2 = Cu (OH)2 + 2NaCl;
6. két só kölcsönhatása révén:
Na2SiO3 + CaCl2 = 2NaCl + CaSiO3;
7. ha a fém-nátrium sósavval reagál:
2Na + 2HCl = 2NaCl + H2.
Paradox hidrolízis
A nátrium-klorid egy erős bázis és egy erős sav által alkotott só. Mint ismeretes, az ilyen sók nem hidrolízisen mennek keresztül. De ha az ilyen sót durva körülmények között dolgozzák fel (500 ° C hőmérsékleten és 1 MPa nyomáson, víz felhasználásával túlhevített gőz formájában), akkor a NaCl hidrolizál. A hidrogén-kloridot gőzzel kezdik eltávolítani, és a paradox hidrolízis valósággá válik:
NaCl + H2O = NaOH + HCl.
Sósav beszerzése
Az alkimisták szilárd konyhasóból is szereztek sósav. Basil Valentinus szerzetes-alkimista (15. század), akit sok kémiatörténész mitikus alaknak tart, írásaiban azt javasolták, hogy kősó és kősó keverékének kalcinálásával nyerjenek „sókból szellemet” – „spiritus salis”. vas-szulfát. Ezzel egy időben olyan folyadékot desztilláltak le, amely ámulatba ejtette a vegyészek fantáziáját: füstölt a levegőben, köhögést okozott, korrodált a szövet, papír, fém A kősó a nátrium-klorid NaCl, a vas-szulfát a vas kristályos hidrátja (II) szulfát FeSO4 x 7H2O. Ezen anyagok keverékének kalcinálásával az alkimisták sósav-HCl-t kaptak:
2NaCl + 2(FeSO4 x 7H2O) = 2HCl +Fe2O3 + Na2SO4 + SO2 + 13H2O.
Valamivel később az alkimisták egy új módszerrel álltak elő a HCl előállítására, amelyet ma is használnak a sósav laboratóriumi előállítására.
Laboratóriumi körülmények között a HCl előállításához egy régi, alkimisták által kifejlesztett módszert alkalmaznak, amely az erős kénsav konyhasóra gyakorolt hatásából áll:
NaCl+H2SO4 (tömény) = NaHS04+HCl.
A hidrogén-klorid tökéletesen elhagyja a reakciószférát, és az egyensúly jobbra tolódik el. 550 C feletti hőmérsékleten és nátrium-klorid feleslegben kölcsönhatás lehetséges
NaCl + NaHS04= Na2SO4+HCl.
Minőségi reakció
A nátrium-kloridot kvalitatív reakciók segítségével ismerhetjük fel más sók között. Oldatban NaCl = Na- + Cl+, a nátrium-klorid ionokká disszociál.
A kloridion AgNO3 segítségével határozható meg. A reakció eredményeként fehér ezüst-klorid csapadék válik ki
NaCl + AgNO3 = AgCl + NaNO3.
A nátriumiont az égő lángjának élénksárga színűre változása határozza meg.
Csodálatos tulajdonságok
A só tulajdonságait alacsony hőmérséklet elérésére használják. Ha 1 rész nátrium-kloridot és 3 rész zúzott jeget vagy havat összekeverünk, olyan keveréket kaphatunk, amely -22 fokra hűl.
A só a kéményben meggyulladt korom oltására is használható. Mivel a só magához vonzza a nedvességet a levegőből. Ezen túlmenően, egy közönséges kemencében a nátrium-klorid nem olvad meg, hanem kristályai megrepednek és szétszóródnak az anyalúg zárványainak gőzzé alakulása miatt, amelyek mindig vannak bennük. Magas hőmérsékleten a só észrevehetően párologni kezd, és nátrium-klorid molekulákból és részben nátriumionokból és kloridionokból álló gőzzé alakul. Ezek a gőzök segítenek elkülöníteni a meggyulladt kormot a levegő oxigénjétől, amely nélkül az égés lehetetlen.
7. NaCl felhasználása a vegyiparban.
Az asztali só szükséges a hús előállításához és konzerv hal, a kohászatban, szőrmék, nyersbőr feldolgozásban, gyógyszerészetben, szappankészítésben, gyógyászatban. A só a fő alapanyag a szóda előállításához, az egyik nélkülözhetetlen termékek vegyipar. De az asztali só fő fogyasztója a vegyipar. Nemcsak magát a sót használja, hanem mindkét alkotóelemet. Az asztali sót általában vizes oldat elektrolízisével bontják alkotóelemeire. Ebben az esetben klór, hidrogén és nátronlúg (oldatban) egyszerre keletkezik. Bepárlás után a nátronlúgból szilárd lúgot (lúgot) nyernek. A hidrogén és a klór kombinálásával sósavat kapunk.
7. 1. Nátrium-klorid elektrolízise
Fémnátrium és klórgáz előállításához az olvadt nátrium-klorid elektrolízisét alkalmazzák. Az olvadt NaCl elektrolízise során a következő folyamatok mennek végbe: a katódon - a nátriumionok semleges atomokká redukálódnak, azaz fémes nátrium képződik; az anódnál a kloridionok semleges atomokká oxidálódnak, és ez utóbbiakból klórmolekulák képződnek.
Katód: Na+ + e - Na0 I 2 redukció
Anód: 2Cl- - 2e - Cl20 I 1 oxidáció
7. 2. Szódát kapni.
Előállításához nátrium-kloridot használnak szódabikarbóna. A szóda előállításának technológiája: először az ammónium-hidrogén-karbonát NH4CO3-at ammóniából, szén-dioxidból és vízből nyerik, amely konyhasó-oldattal reagálva nátrium-hidrogén-karbonát NaHCO3-at és ammónium-klorid NH4Cl-t eredményez.
NaCl+NHCO3=NaHCO3+NH4Cl
7. 3. Szappan készítés.
Miért mondják, hogy só nélkül még szappant sem lehet főzni? Kiderült, hogy a szokásos mosó szappan A zsírok lúgos hidrolízisének reakcióját alkalmazzák.
Ez a folyamat magas hőmérsékleten, ásványi savak és lúgok jelenlétében megy végbe:
H2C – O –OC – C17H35 H2C – OH
HC – O – OC – C17H35 + 3NaOH – HC – OH + 3C17H35 – COONa
H2C – O –OC – C17H35 H2C – OH szappan
Trisztearin (zsír) glicerin
A hidrolízis reakciót glicerin, karbonsavak és szappanok zsírokból történő előállítására szolgáló technológiában használják.
Glicerin és savak keletkeznek, amikor a zsírt vízzel hevítik autoklávokban.
Szappan előállításához a savakat nátrium-karbonát oldattal melegítik. A szappan extrahálásához nátrium-kloridot adnak az oldathoz, és a szappan sűrű réteg - a mag - formájában lebeg a tetejére. Ebből a masszából úgynevezett magszappant készítenek - a mosószappan szokásos fajtáit.
Végezzük el a következő kísérletet: készítsünk szappant sóval és anélkül.
1. Tegyünk 3 g margarint egy porcelánpohárba ( használhatunk zsírt ill vaj) és adjunk hozzá 7-8 ml oldatot tömeghányad nátrium-hidroxid 0,2. A reakció felgyorsítása érdekében adjon hozzá vizet az eredeti szintre. Annak ellenőrzésére, hogy maradt-e el nem reagált zsír, a forró keverékből egy keveset öntök egy kémcsőbe forró víz. Ha a hűtés során nem úsznak fel zsírcseppek a víz felszínére, akkor az elszappanosítási folyamat befejeződött. Ha zsírcseppek úsznak a felszínre, tovább forralom a keveréket.
Az elszappanosítási reakció befejeződése után 3,5 ml 20%-os konyhasóoldatot adok a kapott masszához, és ismét melegítem, amíg a szappan teljesen el nem válik. nem úgy mint forró víz, a szappan konyhasó oldatában szinte nem oldódik. Ezért kisózva elválik az oldattól és felúszik.
A szappan sózása után visszamaradt vizes réteg a konyhasóval együtt glicerint tartalmaz, amely a zsír elszappanosítása során keletkezik. Ezt az oldatot elpárologtathatja, és ezáltal glicerinnel dúsíthatja. A glicerint a konyhasótól csökkentett nyomáson történő desztillációval lehet a legjobban elválasztani.
A kísérlet eredményeként szappant kaptam.
2. Amikor a kísérletet só hozzáadása nélkül végezték, a szappan nem működött.
Következtetés.
Tehát a sót, amelyet a múltban főként étkezési célokra használtak, ma már sokféle felhasználásra került. És nehéz megjósolni, mely új iparágak nemzetgazdaság akkor is szükség lesz rá. De a nátrium-klorid még most is részt vesz a nukleáris tengeralattjárók mozgásában, az űrhajók repülésében, és hatalmas mennyiségű új anyag létrejöttében körülöttünk. Ennek a csodálatos anyagnak a felhasználását és óriási jelentőségét elemezve nem lehet választani, mi a fontosabb: a só felhasználása a mindennapi életben vagy a vegyiparban, a szervezetre gyakorolt hatása, vagy a szükséges anyagok nátriumból történő előállítása. klorid. Csak magabiztosan állapíthatjuk meg, hogy a konyhasó az első számú só, nem ok nélkül nevezik a „Föld sójának”.
Nátrium-klorid NaCl. Vízben mérsékelten oldódik, az oldhatóság kevéssé függ a hőmérséklettől: a NaCl oldhatósági együtthatója (g/100 g víz) 35,9 20 °C-on és 38,1 80 °C-on. A nátrium-klorid oldhatósága jelentősen csökken hidrogén-klorid, nátrium-hidroxid, sók fém-kloridok. Folyékony ammóniában oldódik és cserereakciókba lép. NaCl sűrűsége 2,165 g/cm 3, olvadáspontja 800,8°C, forráspontja 1465°C.
Szokták mondani: „A só mindennek feje, só nélkül fű”; „Egyik szeme a rendőrségen (ahol a kenyér van), a másik a szolonicsán (sótartó)”, és még: „Kenyér nélkül nem jó, só nélkül nem édes”... Burját népi bölcsességígy szól: „Ha teát akarsz inni, tegyél bele egy csipet sót; gyorsabbá teszi az étel emésztését, és megszűnnek a gyomorbetegségek.”
Nem valószínű, hogy megtudjuk, mikor kóstolták meg távoli őseink először a sót: tíz-tizenötezer év választ el tőlük. Akkoriban nem voltak edények a főzéshez, minden növényi termékek az embereket vízbe áztatták és parázsló parázson sütötték, a pálcákra feszített húst pedig tűz lángjában sütötték. "közönséges só" primitív emberek valószínűleg hamu volt, ami elkerülhetetlenül az ételbe került az elkészítése során. A hamu kálium-karbonát K 2 CO 3 -ot tartalmaz, amely a tengerektől és sós tavaktól távol eső helyeken hosszú idejeételízesítőként szolgált.
Talán egy nap édesvíz hiányában sós tenger- vagy tóvízbe áztatták a növények húsát vagy gyökereit, leveleit, és az étel finomabbnak bizonyult a szokásosnál. Talán az emberek tengervízbe rejtették a betakarított húst, hogy megvédjék a ragadozó madaraktól és a rovaroktól, majd felfedezték, hogy kellemes ízű. A primitív törzsek figyelmes vadászai észrevették, hogy az állatok előszeretettel nyalogatják a sónyalást - a kősó fehér kristályait, amelyek itt-ott kilógnak a földből, és megpróbálták sót adni az ételeikhez. Lehetnek más esetek is, amikor az emberek először ismerkednek meg ezzel a csodálatos anyaggal.
A tiszta konyhasó vagy nátrium-klorid NaCl színtelen, nem higroszkópos (a levegőből nem szívja fel a nedvességet) kristályos anyag, vízben oldódik és 801 °C-on olvad. A természetben a nátrium-klorid ásványi anyag formájában fordul elő. halite kősó. A „halite” szó a görög „halos” szóból származik, ami „sót” és „tengert” is jelent. A halit nagy része leggyakrabban a Föld felszíne alatt 5 km-es mélységben található. A sóréteg felett elhelyezkedő kőzetréteg nyomása azonban viszkózus, képlékeny masszává változtatja. Helyenként felbukkan alacsony vérnyomás fedősziklákat, a sóréteg só „kupolákat” képez, amelyek számos helyen kilépnek.
A természetes halit ritkán tiszta fehér. Gyakrabban barnás vagy sárgás színű a vasvegyületek szennyeződései miatt. Halit kristályok találhatók, de nagyon ritkán. kék szín. Ez azt jelenti, hogy a föld mélyén hosszú ideig uránt tartalmazó kőzetek közelében voltak, és radioaktív sugárzásnak voltak kitéve.
A laboratóriumban kék színű nátrium-klorid kristályokat is kaphat. Ez nem igényel sugárzást; csak egy szorosan lezárt edényben kell felmelegíteni a konyhasó NaCl és kis mennyiségű nátrium-fém Na keverékét. A fém feloldódhat sóban. Amikor a nátriumatomok behatolnak egy Na + kationokból és Cl-anionokból álló kristályba, akkor „teljesítik” a kristályrácsot, megfelelő helyeket foglalnak el és Na + kationokká alakulnak. A felszabaduló elektronok a kristály azon helyein helyezkednek el, ahol a Cl ? . Ilyen szokatlan helyek A kristály belsejében azokat, amelyeket ionok helyett elektronok foglalnak el, „üres helyeknek” nevezik.
Amikor a kristály lehűl, néhány üresedés egyesül, ez okozza a kék szín megjelenését. Egyébként, ha egy kék sókristályt vízben oldunk, színtelen oldat keletkezik, akárcsak a közönséges sóból.
Homérosz görög költő (Kr. e. 8. század), aki írt IliászÉs Odüsszeia, amelyet „isteni” asztali sónak neveznek. Akkoriban többre értékelték, mint az aranyat: végül is, ahogy a közmondás tartja: „arany nélkül lehet élni, de só nélkül nem”. Katonai összecsapások zajlottak a kősólelőhelyek miatt, és néha a sóhiány „sólázadásokat” okozott.
Császárok, királyok, királyok és sahok asztalain aranyból készült sótartók álltak, és egy különösen megbízható személy – a sótartó – irányítása alatt álltak. A katonák fizetését gyakran sóval, a tisztviselők pedig sóadagot kaptak. A sóforrások általában az uralkodók és a koronás fejek tulajdonát képezték. A Bibliában van egy kifejezés: „sót iszik a király palotájából”, ami azt jelenti, hogy valaki támogatást kap a királytól.
A só régóta a tisztaság és a barátság szimbóluma. „Ti vagytok a föld sója” – mondta Krisztus tanítványainak, utalva magas erkölcsi tulajdonságaikra. Az ókori zsidóknál sót használtak, sóval szórták meg az újszülött gyerekeket, katolikus templomok A keresztelés során egy sókristályt helyeztek a baba szájába.
Az arabok szokása volt az ünnepélyes megállapodások jóváhagyásakor sóval felszolgálni egy edényt, amelyből az állandó barátság bizonyítékaként és garanciájaként a „sószövetség” egyezményt kötő személyek több szem sót ettek. azt. „Egy csipet sót együtt enni” a szlávoknál azt jelenti, hogy jól ismerkednek és barátkoznak. Az orosz szokások szerint, ha kenyeret és sót visznek a vendégeknek, ezzel kívánnak nekik egészséget.
Az asztali só nemcsak élelmiszeripari termék, hanem régóta elterjedt tartósítószer, bőr- és szőrmealapanyagok feldolgozásában használták. A technológiában pedig még mindig szinte minden nátriumvegyület, köztük a szóda előállításának kiindulási anyaga.
A konyhasó a legősibb gyógyszerek közé is tartozott, gyógyító, tisztító és fertőtlenítő hatását tulajdonították neki, és régóta jegyezték, hogy a különböző lerakódásokból származó konyhasó különböző tulajdonságokkal rendelkezik. biológiai tulajdonságait: a leghasznosabb ebből a szempontból a tengeri. BAN BEN Növénygyűjtő században megjelent Oroszországban, ezt írják: „Két sóesszenciát, az egyiket a hegyből ásták ki, a másikat a tengerben találták, és ami a tengerből van, az a lutchi, és a tengeri só mellett, az a lutchi, ami fehér.”
A só fogyasztása során azonban figyelni kell a mértékletességet. Köztudott, hogy egy átlagos európai napi 15 g sót szív fel étellel, míg a japánok átlagosan 40 g sót fogyasztanak el.A japánok a világbajnokságot a magas vérnyomásban szenvedők számában - ez a betegség, az egyik Ennek oka az, hogy a szervezetben több folyadékot tart vissza, mint amennyire szüksége van. Feleslegétől a sejtek megduzzadnak és összezsugorodnak véredény, ezért növekszik vérnyomás, amitől a szív túlterheltséggel kezd dolgozni. A vesék számára is nehézzé válik, amelyek megtisztítják a szervezetet a felesleges nátriumkationoktól.
Sóval borított talajon egyetlen növény sem nőhet, a szikes mocsarak mindig is a kopár és lakatlan föld jelképei voltak. Amikor a Szent Római Birodalom uralkodója, I. Barbarossa Frigyes 1155-ben elpusztította Milánót Olaszországban, elrendelte, hogy a legyőzött város romjait hintsék be sóval a teljes pusztulásának jeleként... különböző nemzetek A só kiöntése mindenkor bajt és egészségvesztést jelentett.
Az ókorban az emberek többféle módszert is alkalmaztak a konyhasó kinyerésére: a tengervíz természetes elpárologtatását „sós tavakban”, ahol nátrium-klorid NaCl „tengeri” só csapódott ki, sós tavakból forrásban lévő vizet, hogy „elpárolgott” sót nyerjenek, és kősó a földalatti bányákban. Mindezek a módszerek magnézium-klorid MgCl 2 6 H 2 O, kálium-szulfátok K 2 SO 4 és magnézium MgSO 4 7H 2 O és magnézium-bromid MgBr 2 6H 2 O szennyeződéseivel sót állítanak elő, amelynek tartalma eléri a 8-10%-ot.
A tengervízben 1 liter átlagosan 30 g különféle sókat tartalmaz, a konyhasó 24 g. A nátrium-klorid NaCl tenger- és tóvízből történő előállításának technológiája mindig is meglehetősen primitív volt.
Például a „bronzkor” végén, ie három-három és fél ezer évvel az ősi sókészítők rönköket öntöttek ki. tengervíz, majd elégették őket és sót szedtek a hamuból. Később a sós vizet elpárologtatták nagy tepsikön, és állati vért adtak hozzá, hogy eltávolítsák a szennyeződéseket, összegyűjtve a keletkező habot. század vége körül. A sóoldatokat szalmával és bokorágakkal teli tornyokon való áthaladással tisztították és koncentrálták. A sóoldat levegőben történő elpárologtatása is nagyon primitív módon történt, a sóoldatot egy kefe- és szalmakötegekből álló falra öntötték.
A sókészítés, a vegyipar legrégebbi mestersége, a jelek szerint a 7. század elején jelent meg Ruszban. A sóbányák a szerzeteseké voltak, akiket az orosz cárok kedveltek, az eladott só után még adót sem róttak ki. A sóforralás hatalmas nyereséget hozott a kolostoroknak. A sóoldatot nemcsak tavakból, hanem földalatti sóforrásokból is kitermelték; században erre a célra épített fúrások. hossza elérte a 6070 m. A kutakba tömörfából készült csöveket engedtek le, a sóoldatot vasserpenyőkben, fatüzelésű tűzhelyen párologtatták el. 1780-ban Oroszországban több mint százezer tonna sót főztek így...
Jelenleg a konyhasót sós tavak, valamint kősó- és halit lelőhelyekből nyerik ki.
A konyhasó nemcsak fontos ételízesítő, hanem vegyi alapanyag is: nátrium-hidroxidot, szódát, klórt nyernek belőle.
Stepin B.D., Alikberova L.Yu. Kémiai könyv otthoni olvasáshoz, 2. kiadás M., Chemistry, 1995
Lidin R.A. satöbbi. Kémiai tulajdonságok szervetlen anyagok
: Tankönyv. kézikönyv egyetemeknek / R.A. Lidin, V.A. Molochko, L. L. Andreeva; szerkesztette R.A.Lidina. M., Chemistry, 1996
Alikberova L.Yu. Szórakoztató kémia: Könyv diákoknak, tanároknak és szülőknek. M., AST-PRESS, 1999
Stepin B.D., Alikberova L.Yu., Rukk N.S. Háztartási vegyszerek. Kémia a mindennapokban és a mindennapokban. M., RET, 2001
ESZKÖZI SÓ – nátrium-klorid NaCl. Vízben mérsékelten oldódik, az oldhatóság kevéssé függ a hőmérséklettől: a NaCl oldhatósági együtthatója (g/100 g víz) 35,9 20 °C-on és 38,1 80 °C-on. A nátrium-klorid oldhatósága jelentősen csökken hidrogén-klorid, nátrium-hidroxid, sók – fém-kloridok. Folyékony ammóniában oldódik és cserereakciókba lép. A NaCl sűrűsége 2,165 g/cm3, olvadáspontja 800,8°C, forráspontja 1465°C.
Szokták mondani: „A só mindennek feje, só nélkül fű”; „Egyik szeme a rendőrségen (ahol a kenyér), a másik a sótartón (sótartó)” és még: „Kenyér nélkül nem jó, só nélkül nem édes”... A burját népi bölcsesség azt mondja: „ Ha teát fogsz inni, tegyél bele egy csipet sót; gyorsabbá teszi az étel emésztését, és megszűnnek a gyomorbetegségek.”
Nem valószínű, hogy megtudjuk, mikor kóstolták meg távoli őseink először a sót: tíz-tizenötezer év választ el tőlük. Akkoriban még nem voltak edények a főzéshez, az emberek minden növényi terméket vízbe áztattak és parázsló parázson sütöttek, a húst pedig pálcikára szúrva sütötték a tűz lángjában. A primitív emberek „étkezési sója” valószínűleg hamu volt, amely elkerülhetetlenül bekerült az élelmiszerekbe az elkészítése során. A hamu hamuzsírt – K2CO3 kálium-karbonátot tartalmaz, amely a tengerektől és a sós tavaktól távol eső helyeken régóta ételízesítőként szolgál.
Talán egy nap édesvíz hiányában sós tenger- vagy tóvízbe áztatták a növények húsát vagy gyökereit, leveleit, és az étel finomabbnak bizonyult a szokásosnál. Talán az emberek tengervízbe rejtették az általuk betakarított húst, hogy később felhasználják, hogy megvédjék a ragadozó madaraktól és a rovaroktól, majd felfedezték, hogy kellemes ízt kapott. A primitív törzsek figyelmes vadászai észrevették, hogy az állatok előszeretettel nyalogatják a sónyalást - a kősó fehér kristályait, amelyek itt-ott kilógnak a földből, és megpróbálták sót adni az ételeikhez. Lehetnek más esetek is, amikor az emberek először ismerkednek meg ezzel a csodálatos anyaggal.
A tiszta konyhasó vagy nátrium-klorid NaCl színtelen, nem higroszkópos (a levegőből nem szívja fel a nedvességet) kristályos anyag, vízben oldódik és 801 °C-on olvad. A természetben a nátrium-klorid ásványi halit – kősó. A „halite” szó a görög „halos” szóból származik, ami „sót” és „tengert” is jelent. A halit nagy része leggyakrabban a Föld felszíne alatt 5 km-es mélységben található. A sóréteg felett elhelyezkedő kőzetréteg nyomása azonban viszkózus, képlékeny masszává változtatja. A fedő kőzetek alacsony nyomású helyén „felúszva” a sóréteg só „kupolákat” képez, amelyek több helyen kilépnek.
A természetes halit ritkán tiszta fehér. Gyakrabban barnás vagy sárgás színű a vasvegyületek szennyeződései miatt. Kék halit kristályok találhatók, de nagyon ritkán. Ez azt jelenti, hogy a föld mélyén hosszú ideig uránt tartalmazó kőzetek közelében voltak, és radioaktív sugárzásnak voltak kitéve.
A laboratóriumban kék színű nátrium-klorid kristályokat is kaphat. Ez nem igényel sugárzást; csak egy szorosan lezárt edényben kell felmelegíteni a konyhasó NaCl és kis mennyiségű nátrium-fém Na keverékét. A fém feloldódhat sóban. Amikor a nátriumatomok behatolnak egy Na+ kationokból és Cl– anionokból álló kristályba, akkor „teljesítik” a kristályrácsot, megfelelő helyeket foglalnak el és Na+ kationokká alakulnak. A felszabaduló elektronok a kristály azon helyein helyezkednek el, ahol a Cl–2-klorid anionok lennének. Az ilyen szokatlan helyeket a kristályon belül, amelyeket ionok helyett elektronok foglalnak el, „üres helyeknek” nevezzük.
Amikor a kristály lehűl, néhány üresedés egyesül, ez okozza a kék szín megjelenését. Mellesleg, amikor egy kék sókristályt vízben oldunk, színtelen oldat képződik - akárcsak a közönséges só.
A görög költő, Homérosz (Kr. e. 8. század), aki az Iliászt és az Odüsszeiát írta, a konyhasót „isteninek” nevezte. Akkoriban magasabbra értékelték, mint az aranyat: végül is, ahogy mondták
Cikk innen: " Nagy Enciklopédia"szerkesztette S.N. Juzsakova, 1904
Só (étkezési só, nátrium-klorid), NaCl, egy kémiai vegyület, amely 39,32 rész nátriumból és 60,68 rész klórból áll, amikor a nátrium klórban ég, vagy amikor a nátrium-karbonát (szóda) sósavval (hidrogén-klorid) bomlik. A konyhasó kevés anyalúgot tartalmazó vízmentes kockákban kristályosodik, aminek következtében hevítéskor megrepednek. 10°-os hőmérsékleten a konyhasó nagy, hatoldalas tablettákban kristályosodik ki, amelyek hevítéskor vízre és kockákra bomlanak. A tiszta só nem nedvesedik meg a levegőben, 772°-on megolvad és elpárolog legmagasabb hőmérséklet, különösen légáramlással; keményedéskor kockákban kristályosodik. Teljes fajlagos értéke 2,15. Forrásponton a só valamivel jobban oldódik, mint közönséges hőmérsékleten; 100 rész víz feloldódik:
|
Só tömegmennyisége |
Só tömeg%-a oldatban |
Az oldat fajsúlya |
Gram só 1 literben |
|
1 rész só oldja:
|
A víz részei |
A 26%-os sótartalmú oldat csak -18,43°-on fagy meg. A telített oldat közönséges nyomáson 109,7°-on forr, és 28,75% sót tartalmaz. A telített sóoldatok fagyasztással koncentrálhatók, és a víz alacsony hőmérsékleten jég formájában szabadul fel. Jégképződés akkor következik be legalacsonyabb hőmérséklet, minél fagyosabb a víz és minél alacsonyabb az oldat, annál erősebb az oldat, és a jég mindig tartalmaz egy kis sót. Amikor a sót feloldjuk vízben, az oldat térfogata kisebb lesz (a szilárd só térfogatának 24,5%-ával), mint a két test térfogata az egyesülés előtt.
Sóoldatok fajsúlya 15°-on
|
Fajsúly |
Fajsúly |
Fajsúly |
|||
15°-on különböző erősségű alkoholok oldódnak:
Só kivonás.
A só természetesen feloldódva található óceánok, tengerek és sós tavak vizében (Kaszpi-tenger, Aral-tenger, Holt-tenger, Utah), sós forrásokban és folyókban (Karizakha, amely az Elton-tóba ömlik, Rio ensalado Chilében, amely legfeljebb 32%-ban tartalmaz kloridkötéseket). Szilárd állapotban kősó, falsó formájában és a sivatagokban található. A kősó jelentős szerepet játszik az oktatásban földkéreg. Számos országban hatalmas tiszta kősó-, anhidrit-, dolomit-, márga- és sótartalmú gipszlerakódások és készletek találhatók. A tiszta sórétegeket gyakran sótartalmú agyagréteg borítja, sok helyen pedig tiszta kősórétegek vannak egymáson, váltakozva agyagrétegekkel. Oxenius a kősólerakódások kialakulását a megközelítőleg vízszintes szorossal rendelkező mélytengeri öblök létével magyarázza, amelyek csak olyan mértékben engedik be a tengervizet, amennyire az öböl felszínéről egy bizonyos idő alatt el tud párologni.
Száraz és meleg éghajlat, erős párolgás mellett a szorosban tömény és ezért nehezebb sóoldat képződik, amely folyamatosan az öböl mélyére ömlik. A kapott tömény oldatból a só kristályok formájában szabadul fel. Miután így kialakult egy sólerakódás, amelyet felül az anyalúg oldhatóbb sói borítanak be, körkörös folyamatnak kell kialakulnia, amikor a tengerszorosban felülről a tengervíz az öbölbe, alulról pedig az anyalúg kiáramlik. . Az első tömény oldattal keverve gipszet és polihalitet csap ki, és minél tovább tart ez az időszak, annál nagyobbak lesznek a gipsz vagy anhidrit fedőrétegei. Ha ezalatt az öböl elválik a tengertől, az anyalúg gipsz- és anhidritrétegek tetején kristályosodik ki. Egyes sólerakódásokat (Stasfurt, Kaluets) a kikristályosodott anyalúgból (Abraumsalze) vastag sóréteg borítja, bár nagyon gyakran újra lemosódnak, és csak nyomai maradnak meg.
ábrán. Az 1. ábra két nagyon eltérő kősó-lelőhely fejlődési profilját mutatja be; a máig ismeretlen vastagságú alsó régi réteget más ásványok anhidrit, polihalit és kizerit keverékével a felsőtől az újabb lelőhelyből származó értékes káliumsó-, sóagyag-, anhidrit- és gipszréteg választja el. Ez utóbbi az I. bányában eléri a 60 méter vastagságot, gipsszel van borítva, és egy tarka homokkő képződmény rétege fokozatosan felfelé ékelődik, és képviseli. tiszta só, amely bányászott.
Németországban nagy, 1500 méter vastagságú sólelőhelyek találhatók, amelyek Helgolandtól Inowraclavig húzódnak, és Stasfurt, Erfurt stb. lelőhelyeket alkotnak. Ezen kívül Württembergben, Elzászban, Lotaringiában, Salzburgban stb. vannak lerakódások. Ausztria-Magyarországon , lelőhelyek Tirolban, Salzkamergutban, Wieliczkában, Boszniában, Stebnikben és Zlaninában, Sugatage és Siebenbürgenben találhatók. Romániának vannak lelőhelyei az Erdélyi Alpokban. Ezenkívül Spanyolországban Katalóniában és Cordobában, Olaszországban (Szicília), Svájcban (Bex), Franciaországban (Meurthe et-Moselle, Jura, Ariens, Bas-Pyrenees), Angliában (Bleshiere, Middler borough on Tees) vannak lelőhelyek. ). Oroszország nagyon gazdag kősó-lelőhelyekben, a legfontosabbak a Brjanszki lelőhelyek, Jekatyerinoslav tartomány, az Orenburg tartomány Iletszki lelőhelyei, Kulpinszkij, Nahicseván lelőhelyek, Kars régió lelőhelyei, Perm tartomány, Asztrahán tartomány. és Szibéria különböző területein.
A kősó szinte minden képződményben előfordul (a csillámpalától a harmadidőszaki lerakódásokig), általában anhidrit és gipsz kíséretében. Sok lerakódás közvetlenül a föld felszínére kerül, másokat a fúrási műveleteknek köszönhetően fedeznek fel. A tiszta kősólerakódások kialakulása általában sodródással történik, amint az az ábrán látható. 2. és 4. táblázat, I. Különbségek vannak a Romániában és Magyarországon alkalmazott palack alakú ásatások és a Stassfurtban és a Brjanszki bányákban alkalmazott pillér jellegű ásatások között is. A fejlesztést megkönnyíti, hogy a kősó nagyon tartós anyag, és lehetővé teszi a rögzítőelemek nélküli munkát. A kősó gyakran teljesen színtelen és könnyen szétesik fényes kockákra, vagy sárgás, vöröses és zöldesbarna kristályos masszákat képez, amelyek vas-oxidot, agyagot, csillósót stb.
|
Nátrium-klorid |
Kálium klorid |
Kalcium-klorid |
Magnézium-klorid |
Nátrium-szulfát |
Kálium-szulfát |
Kalcium-szulfát |
Magnézium szulfát |
Oldhatatlan anyagok |
||
|
Stassfurt |
||||||||||
|
Stassfurt |
||||||||||
|
Inowraclav |
||||||||||
|
Sumbakovaya |
||||||||||
|
Bahmutskaya |
||||||||||
|
perm |
||||||||||
|
perm |
Ezeken kívül alkatrészek A kősó vas(III)-kloridot, brómot, jód- és fluorvegyületeket, ammóniát, foszfátokat, borátokat stb. tartalmaz. Egyes sóminták erősen sűrített gázokat (metán, szén-dioxid, levegő) tartalmaznak, amelyek hevítéskor elpusztítják a kristályokat. A kősót tömb, darab vagy por formájában árusítják, és közvetlenül használják fel. A sólerakódások helyein és általában a természetben a kősón kívül számos sós sóvíz és forrás található, amelyek a föld felszínére jönnek, vagy speciálisan erre a célra kialakított bányákat töltenek be, ahonnan a sóoldatot kiszivattyúzzák. Az ilyen források nagyon ritkán telítettek, és 2-24% konyhasót tartalmaznak egyéb fémek szulfát- és kloridsóinak, vasnak, szilícium-dioxidnak stb. keverékével. Ezen kívül a források vize tartalmaz: jodidokat, bromidokat, rubídium, cézium, derék, szerves anyag, szénsav stb. Az erős sóoldatokat elpárologtatják, a gyenge sóoldatokat fagyasztással (Ohotsk, Irkutszk) vagy normál hőmérsékleten történő bepárlással koncentrálják). A gyenge sóoldatot először hűtőtornyokban dolgozzák fel (lásd a táblázatot), tisztítják, 15-20%-os koncentrációra állítják be, majd bepárolják. A hűtőtornyokkal való munkához jobb az év legmelegebb időszakát használni, Németországban az év 200-260 napja van.
A kellően tömény és tisztított sóoldatot forralva melegítéssel vagy bepárlással kondenzálják sógyárakban (lásd a táblázatot), ahol finoman vagy durván kristályos sót kapnak. Az első általában egy üres, süllyesztett piramisból áll, amelynek lépcsőzetes oldalai egyedi kockákból állnak. A párologtató kádak vagy tartályok általában laposak, vasból készülnek, és vagy egyszerűen szénnel vagy gőzzel, vagy forró gázok felszabadulásával az oldat felületére melegítenek. A kazánok mérete 45 és 335 négyzetméter között mozog. m) A művelet kezdetén a sóoldatot erősen felforraljuk, miközben a keletkező habot és iszapot eltávolítjuk, és új sóoldatot adunk hozzá, amíg az oldat forralással telítődik, hagyjuk kitisztulni és áttöltjük más kádakba, amelyekben só kezdődik. alkotnak. A keletkező só általában fehér színű, de folyamatos munkával beszennyeződik, ennek elkerülése érdekében az anyalúgot ki kell engedni, majd speciális helyiségekben, vagy alulról fűtött vaskazánokban szárítják (lásd táblázat). A legjobb konyhasót centrifugálják és ónozott rézedényekben forró levegő fújásával szárítják.
Angliában a forró, tömény sóoldatot faformákba öntik, amelyekben tömbökké keményedik, amelyeket szárítókban fokozatosan szárítanak.
Tengervizek 1 köbméterben. méter átlagosan 26-31 kg-ot tartalmaznak. nátrium-klorid, 3-7 kg. magnézium-klorid, 0,5-6 kg. magnézium-szulfát, 0,14-6 kg. mész-szulfát, 0,0111 kg. kálium klorid. Sok sós tavat ostromolnak a forró évszakban Nagy mennyiségű sók klaszterek formájában, amelyek könnyen bányászhatók (Lake Elton, Utakh, Kara-Bugaz). Oroszország déli részén természetes öblöket és torkolatokat használnak a tengervíz elpárologtatására, amíg 2-30 cm vastag sóréteg képződik. Meleg éghajlaton a tengerparton nagy mennyiségű sót vonnak ki a tengervízből, például Portugáliában, Spanyolországban és Franciaországban a tengerparton. Földközi-tenger(Languedoc) és Atlanti-óceán, Olaszországban, Dalmáciában, Isztriában és az Egyesült Államokban. Ennek érdekében agyaggal bélelt kerítéseket építenek nagy párolgási felülettel, lapos medencék rendszerét alkotva, amelyeket szivattyúk töltenek meg tengervízzel, vagy elkerítik az öblöket. Először vas-oxid rakódik le bennük, majd gipsz, ezt követi a konyhasó kristályosodása. Az elsőként kicsapódó só a legtisztább, és az asztalhoz használják. Nyár végén a kristályosító medencéket kiszárítják, a sót felhalmozzák és levegőnedvességnek teszik ki, ami megtisztítja az anyalúgtól, és ha teljesen tiszta formában akarják hozzájutni, átkristályosítják. Általában az eredmény 80-85% só található a tengervízben. Nagyobb bepárlással nátrium-klorid és magnézium-szulfát keverékét kapjuk, 2NaCl + MgS0 4 összetételűvé alakítva, vízben feloldva és jéggépekkel -6 °C-ra hűtve, a Glauber-só Na2SO4 kristályosodni kényszerül. Az utolsó anyalúg télen MgSO 4 keserűsót ad. Nyáron további bepárlással konyhasót, magnézium-szulfátot és kainitot kapunk, és a maradék oldatot brómmá dolgozzuk fel.
Az asztali só szinte mindig tartalmaz kis mennyiségben nátrium-, kalcium-, magnézium- és kálium-szulfát- és kloridvegyületek, ritkábban és csak nyomokban vas-oxid és kálium- és nátrium-bromid-vegyületek. A tartalom miatt kalcium-kloridés magnézium, a levegőben nedvesedik. A víztartalom nem haladhatja meg a 6%-ot.
A konyhasó nagyon gyakori az állati szervezetekben és ez utóbbiak folyadékaiban a többihez képest túlnyomó mennyiségben ásványok. Tartalma a vérben általában állandó, és nem függ a táplálkozástól. Különösen gazdag benne a nyál, a gyomornedv, a nyálka, a genny és a gyulladásos váladék. Az összes konyhasó az élelmiszerekből származik, és vizelettel, ürülékkel, szájon, orron és verejtéken keresztül távozik a szervezetből. Normális ember súlya 64 kg. napi 11,9 gramm konyhasót választ ki a vizelettel, egy részét átadva a szervezet más vegyületeinek. A só hat a szervezetben, először is a diffúziós folyamatokra gyakorolt hatása révén fő tényező folyadékok mozgását, és forrásként szolgál a sósav képződéséhez gyomornedv. Hozzáadása az élelmiszerekhez fokozza az emésztést, és az emberi ösztönök szükségszerűnek ismerik fel, ami minden népnél kialakult.
Figyelemre méltó, hogy az asztali só szükséges olyan állatok számára, amelyek növényi táplálékot esznek, és nem esznek húst. VAL VEL kémiai oldal A konyhasó a szervezetben sósavat termel a gyomornedvben; lehetséges, hogy szorosan összefügg a sejtek képződésével. A számítások szerint egy személy számára évente 7,5 kg konyhasó szükséges. A konyhasó hatásáról in növényvilág keveset tudunk biztosan, de feleslege károsítja a magvakat és terméketlen talajt képez. Egyes esetekben hasznos, mert a növények számára szükséges kalcium-sókat, foszfátokat stb. oldható vegyületekké alakítja, amelyeket műtrágyaként használnak fel.
A technológiában konyhasót használnak szóda, klór, ammónia előállítására, kohászatban ezüstércek és szegényréz klórozására, alumínium előállítására, nátrium előállítására, szappan előállítására, dohány előállítására. , ásványvizek, fürdők, agyagtermékek üvegezésére, hajók és talpfák tartósítására, hal, hús, vaj sózására. BAN BEN mezőgazdaság az asztali sót műtrágyához és állati takarmányhoz használják.
Só kivonás a utóbbi évek különböző országokban a táblázat millió pudban mutatja:
|
1891 |
1894 |
1898 |
1899 |
1900 |
|
|
Nagy-Britannia |
|||||
|
Németország |
|||||
|
Egyesült Államok |
|||||
10 év alatt az oroszországi sótermelést a következő táblázat mutatja be pudokban:
|
Az év ... ja |
Kő |
Önüledékes |
Párolgás |
Teljes |
Lásd Karsten, „Salinonkunde” (Berl., 1846-47, 2 köt.); Kerl, "Salinenkunde"; Hehn, "Das Salz" (1873); Moeller: „Das Salinen in seiner kulturgeschichtlichen und naturwissenschaftlichen Bedeutung” (1874); Schwarz: „Vorkommen und Bildung des Steinsalzes” (Halle, 1885); Wagner, "Kémiai technológia"; Dammer, Chemische Technologie.
„Só” cikk a „Big Encyclopedia”-ból, szerk. S.N. Juzsakova, Szentpétervár, „Felvilágosodás”, 1904, 17. kötet, 654-657.
Hasonló cikkek
-
A nyári szünet remek időszak!
A nagyok a költészetről: A költészet olyan, mint a festészet: egyes alkotások jobban rabul ejtik, ha közelebbről megnézed, mások pedig, ha távolabb lépsz. A kis aranyos versek jobban irritálják az idegeidet, mint a festetlenek csikorgása...
-
„Victory” csatahajó – Legendás vitorlás hajók
Amióta az ember megtanult tengeren utazni, a tengeri államok a gazdagságot és a hatalmat a területükön túl is keresték. A 18. századra Spanyolország, Portugália, Franciaország, Hollandia és Nagy-Britannia kiterjedt gyarmati...
-
Az oroszországi rendkívüli helyzetek minisztériumának Bajkál kutató- és mentőcsoportja
Julija Krupeneva, a GorodIrkutsk.ru újságírója ellátogatott a Bajkál kutató-mentő csapatának Nikola faluban található bázisára, és megnézte, hol és hogyan válnak belőlük megmentők. Julia Krupeneva a Bajkál bázisán...
-
A Vészhelyzetek Minisztériumának egyetemei (intézetek és egyetemek)
Az oroszországi rendkívüli helyzetek minisztériumának Állami Tűzoltóságának Akadémiája olyan fiatalok tanulmányozására hív, akik készen állnak arra, hogy életüket annak a nemes célnak szenteljék, hogy megvédjék az emberek életét, egészségét és anyagi értékeit az egyik legsúlyosabb katasztrófától. Föld -...
-
Az Orosz Föderáció köztisztviselőinek jövedelmi nyilatkozatai
A képviselők templomok és nyilvános illemhelyek birtokában voltak, a kormány egyik tagjának édesanyja pedig félmilliárd rubelt kapott.Orosz tisztviselők 2017-re vonatkozó jövedelemnyilatkozatokat tettek közzé. Szegények nem voltak a listán....
-
Pavel Ivanovics Miscsenko A birodalom peremén
Pavel Ivanovics Miscsenko (január 22. (18530122), Temir-Khan-Shura - Temir-Khan-Shura) - orosz katonai vezető és államférfi, a turkesztáni hadjáratok résztvevője, turkesztáni főkormányzó, a turkesztáni katonai körzet parancsnoka...
