Tejsav kémiai és fizikai tulajdonságok Tejsav kémiai kézikönyv
Tejsav
TEJSAV(2-hidroxi-propionsav) CH 3 CH (OH) COOH, mol. m.: 90,1; színtelen kristályok. Ismeretes a D (+)-tej ahhoz, a D (-)-tej (hús-tej) to-ta és a racém. A tejsav az erjedés tejsavja. A D,L- és D-tejsav esetében olvadáspont: 100-100 °C. ill. 18 °С és 53 °С; t. kip. ill. 85°C/1 Hgmm és 103 °C/2 Hgmm; D-tejsavra [a] D 20 -2,26 (koncentráció 1,24% vízben). D,L-tejsav esetén DH 0 arr - 682,45 kJ / mol; DH 0 pl 11,35 kJ/mol; DH spanyol 110,95kJ/mol (25 °C), 65,73 kJ/mol (150 °C). L-tejsav esetén DH 0 égett - 1344,8 kJ / mol; DH 0 arr -694,54 kJ/mol; DH 0 pl 16,87 kJ/mol.
A tejsav nagy higroszkópossága miatt általában sűrítőjét használják. víz p-ry-syropobraznye bestsv. szagtalan folyadékok. Tejsav d 20 4 vizes oldataira 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 és 28,5 MPa. s (25 0 C) ill. 45,48 és 85,32%-os oldatokhoz; g 46,0. 10 -3 N / m (25 °C) 1 M oldathoz; e 22 (17 °C). Tejsav szol. vízben, etanolban, rosszul benzolban, kloroformban és más halogénezett szénhidrogénekben; pKa 3,862 (25 °C); A vizes oldatok pH-ja 1,23 (37,3%), 0,2 (84,0%).
A tejsav oxidációját általában bomlás kíséri. HNO 3 vagy O 2 levegő hatására, jelenlétében. A Сu vagy Fe HCOOH-t, CH 3 COOH-t, (COOH) 2-t, CH 3 CHO-t, CO 2 -t és piroszőlősavat képez. A HI tejsav helyreállítása propionsavhoz vezet, és jelenlétben visszanyerődik. Re-black - propilénglikollá.
A tejsav hő hatására akrillá válik. HBr-vel 2-bróm-propionsavat képez, kölcsönhatásban. Ca-sók PCl 5-tel vagy SOCl 2 -2-klór-propionil-kloriddal. Jelenlétében bányász. a tejsav to-t önészterezése lakton f-ly I, valamint lineáris poliészterek képződésével megy végbe. Interakció közben tejsav alkoholokkal, hidroxisavak RCH 2 CH (OH) COOH képződnek, és a kölcsönhatás során. tejsav sóialkoholok és éterek. A tejsav sói és észterei ún. laktátok (lásd a táblázatot).
A tejsav tejsavas erjedés eredményeként keletkezik (tej savanyítása, savanyú káposzta, zöldségek savanyítása, sajt érlelése, takarmány silózása során); A D-tejsav megtalálható az állatok, növények szöveteiben és mikroorganizmusokban is.
Az iparban a tejsavat 2-klór-propionsav és sói (100 °C) vagy laktonitril CH 3 CH (OH) CN (100 ° C, H 2 SO 4) hidrolízisével állítják elő. az észterek képződése, az izolálás és a hidrolízis to-rykh kiváló minőségű terméket eredményez. A tejsav előállításának egyéb ismert módszerei: propilén oxidációja nitrogén-oxiddal (15-20°C) ez utóbbival. H 2 SO 4 kölcsönhatás feldolgozása. CH3CHO CO-val (200 °C, 20 MPa).
EGYES LAKTÁTOK TULAJDONSÁGAI

M a tejsavat élelmiszerekben használják. prom-sti, marófestésben, bőrgyártásban, fermentációs műhelyekben baktériumölő szerként, lek előállítására. Sze, lágyítók. Az etil- és butil-laktátokat cellulóz-éterek, szárítóolajok és termesztések oldószereként használják. olajok; butil-laktát, egyes szintetikus anyagok p-oldójaként is. polimerek.
Hidroxi savak (alkoholsavak) a karbonsavak származékai, amelyek a karboxilcsoporthoz kapcsolódó gyökben egy, két vagy több hidroxilcsoportot tartalmaznak.
A karboxilcsoportok számától függően a hidroxisavakat egybázisú, kétbázisú stb. attól függően, hogy teljes A hidroxisavak hidroxilcsoportjait egy- vagy többértékű csoportokra osztják.
A gyök természetétől függően a hidroxisavak telítettek és telítetlenek, aciklusosak, ciklusosak vagy aromásak.
A hidroxisavakban a következő típusú izoméria fordul elő:
szerkezeti(gyökös lánc izoméria, karboxil és hidroxil kölcsönös helyzetének izomériája);
optikai(tükör) aszimmetrikus szénatomok jelenléte miatt.
A hidroxisavak nevét a sav neve adja, "hidroxi" vagy "dioxi" stb. hozzáadásával. A triviális nómenklatúrát is széles körben használják.
HO–CH 2 –COOH
glikolsav (oxi-ecetsav)
tejtermékek (α-hidroxi-propionsav)
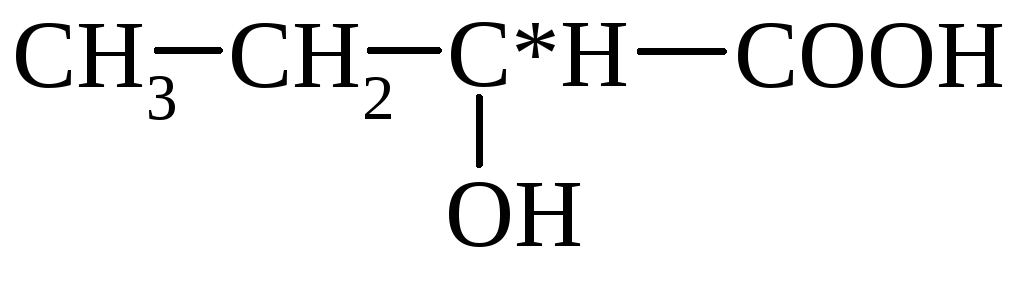

α-hidroxi-vajsav β-hidroxi-vajsav
(2-hidroxi-butánsav) (3-hidroxi-butánsav)
fizikai tulajdonságok. Az alsóbbrendű hidroxisavak leggyakrabban sűrű, szirupos anyagok. A hidroxisavak bármilyen arányban elegyednek vízzel, és a molekulatömeg növekedésével az oldhatóság csökken.
Kémiai tulajdonságok.
1. Savas tulajdonságok- a hidroxisavak a karboxilra jellemző összes reakciót adják: sók, észterek, amidok, savhalogenidek képződését stb. A hidroxisavak erősebb elektrolitok, mint a megfelelő karbonsavak (a hidroxilcsoport hatása).

2. Az alkohol tulajdonságai– a hidroxilcsoport hidrogénszubsztitúciós reakciói, éterek és észterek képződése, –OH halogén helyettesítése, intramolekuláris dehidratáció, oxidáció.
klór-ecetsav-glikolos glioxál
sav sav sav
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
glikolsav és metil-alkohol észtere
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glikol-metil-metil-éter
savas alkohol metoxi-ecetsav
(teljes adás)
3. A hidroxisavak és a melegítés aránya - hevítéskor az α-hidroxisavak leválasztják a vizet, és egy ciklikus észter keletkezik, amely két α-hidroxisav molekula azonosítójaként épül fel:

α-hidroxi-propionsav laktid
A β-hidroxisavak azonos körülmények között könnyen veszítenek vizet telítetlen savak képződésével.
NO–CH 2 –CH 2 –COOH 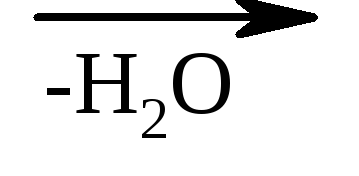 CH 2 \u003d CH - COOH
CH 2 \u003d CH - COOH
β-hidroxi-propion-akrilsav
A γ-hidroxisavak is elveszíthetnek egy vízmolekulát intramolekuláris észterek - laktonok képződésével.

NO–CH2–CH2–CH2–COOH
γ-hidroxi-vajsav
γ-butirolakton
Egyes hidroxisavakat természetes termékekből nyerik. Tehát a tejsavat a cukros anyagok tejsavas fermentációjával nyerik. A szintetikus gyártási módszerek a következő reakciókon alapulnak:
1) Cl–CH 2 –COOH + HOH  HO–CH2–COOH;
HO–CH2–COOH;
monoklór-ecetsav glikol
savas sav
2) CH 2 \u003d CH - COOH + HOH  NO-CH2-CH2-COOH.
NO-CH2-CH2-COOH.
akrilsav β-hidroxi-propionsav
a hidroxisavak képviselői.
glikolos (hidroxi-ecetsav) egy kristályos anyag, amely éretlen gyümölcsökben, céklában, fehérrépában és más növényekben található. Az iparban az oxálsav redukciójával nyerik. Festésre (kalikónyomtatás) használják.
Tejsav (α-hidroxi-propionos) - sűrű folyékony vagy alacsony olvadáspontú kristályos tömeg. A tejsav a cukrok tejsavas fermentációja során képződik, tejsavbaktériumok hatására. Erjesztett tejtermékekben, savanyú káposztában, szilázsban található. Használják marófestésben, bőrgyártásban, gyógyászatban.
A hús-tejsav az állatok izomlevében és a húskivonatokban található.
kétatomos glicerinsav részt vesz a növények és állatok életfolyamataiban.

C-vitamin (C-vitamin) – kristályos anyag, amely friss gyümölcsben, citromban, fekete ribizliben található, friss zöldségek- káposzta, bab. Szintetikusan a C-vitamint a többértékű alkohol szorbit oxidációjával nyerik.
 α-aszkorbinsav
α-aszkorbinsav
Az aszkorbinsav könnyen lebomlik a légköri oxigén hatására, különösen melegítés közben.
Aciklikus kettő-és hárombázisú hidroxisavak.
alma A (hidroxi-borostyánkő-)sav (HOOS-CHOH-CH 2 -COOH) egy kristályos anyag, amely vízben jól oldódik; gyógyászatban használják, éretlen berkenye, borbolya, rebarbara, szőlőlében, borban található.
Bor (borkő, dioxiborostyánkő)sav (HOOC–*CHOH–*CHOH–COOH) 2 aszimmetrikus szénatomot tartalmaz, ezért 4 optikai izomerje van. Savat képez káliumsók, amelyek vízben rosszul oldódnak és kicsapódnak. A borban (tartárban) sókristályok figyelhetők meg. A vegyes kálium-nátriumsót Rochelle-sónak nevezik. A borkősav sóit tartarátoknak nevezzük.


tartár, rochelle só
A borkősav gyakori a növényekben (hegyi kőris, szőlő stb.).
Citromsav
 megtalálható a citrusfélékben. Iparilag citromgyümölcsből, cukrok oxidálásával nyerik formák, a fenyő tűk feldolgozásakor.
megtalálható a citrusfélékben. Iparilag citromgyümölcsből, cukrok oxidálásával nyerik formák, a fenyő tűk feldolgozásakor.
A citromsav biológiailag fontos vegyület, amely részt vesz az anyagcserében. A gyógyászatban, élelmiszeriparban, textiliparban használják színezékek adalékaként.
A ciklikus egybázisú többértékű hidroxisavak az epesavak és más fiziológiailag fontos vegyületek részét képezik; például az auxin fokozza a növények növekedését.
Aromás hidroxisavak fenolsavakra és aromás zsírsavakra osztva, amelyek oldalláncában hidroxilt tartalmaznak.


o-hidroxi-benzoe mandulasav
(szalicil sav
Szalicil sav egyes növényekben szabad formában (calendula), de gyakrabban észterek formájában találhatók meg. Az iparban nátrium-fenolát szén-dioxiddal történő hevítésével nyerik. Fertőtlenítőszerként és színezékek szintézisében használják. A szalicilsav számos származékát gyógyszerként használják (aszpirin, szalol).


aszpirin-szalol (fenil-éter
(acetilszalicilsav) szalicilsav)
Galluszsav (3,4,5-trioxi-benzoesav).

Tealevelekben, tölgy kéregben, gránátalmafában található. Az iparban tanninból nyerik híg savakkal forralva. Tintagyártáshoz, fotózáshoz, gyógyászatban antiszeptikumként használják. A gallusavat és származékait sokak számára széles körben használják tartósítószerként élelmiszer termékek(zsírok, kiváló minőségű szappanok, tejtermékek), cserző tulajdonságokkal rendelkezik, és különösen fontos a bőrgyártásban és a foltfestésben.
mandulasav aromás zsírsavakra utal (C 6 H 5 -CH (OH) -COOH), megtalálható az amygdalinban, mustárban, bodzában stb.
Tanninok gyakran többértékű fenolok származékai. A növények részei, és kéreg-, fa-, levelek, gyökerek, gyümölcsök vagy növedékek (epe) kivonataiból nyerik.
A tanninok a legfontosabb tanninok. Ez a különféle keverékek keveréke kémiai vegyületek, amelyek közül főként gallusz- és digallusavak, valamint glükóz vagy többértékű alkoholok észterei.

Dg-digallic sav

m-digallinsav
A tannin fenolok és észterek tulajdonságait mutatja. Vas-klorid oldatával fekete komplex vegyületet képez. A tanninokat széles körben használják cserző kivonatként, pamutszövetek festésére szolgáló maróanyagként, összehúzó anyagként a gyógyászatban (baktericid, vérzéscsillapító tulajdonságokkal rendelkeznek), tartósítószerek.
A lipidek közé tartoznak a szerves anyagok, amelyek közül sok makromolekuláris zsírsavak és többértékű alkoholok észterei – ezek zsírok, foszfatidok, viaszok, szteroidok, makromolekuláris zsírsavak stb.
A lipidek elsősorban a növényi magvakban, a diómagokban és az állati szervezetekben - a zsír- és idegszövetekben, különösen az állatok és az emberek agyában találhatók.
A természetes zsírok a háromértékű alkohol-glicerin és a magasabb szénatomszámú karbonsavak észtereinek keverékei, pl. e savak gliceridjeinek keverékei.
RÓL RŐL 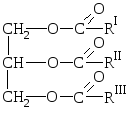 Általános zsírképlet:
Általános zsírképlet:
ahol R I R II R III magasabb szénatomszámú zsírsavak szénhidrogéncsoportjai normál szerkezet páros számú szénatommal. A zsírok telített és telítetlen savak maradékait is tartalmazhatják.
Telített savak:
С 15 H 31 COOH – palmitin;
C17H35COOH - sztearinsav;
C 3 H 7 COOH - olaj (tartalmazza vaj) satöbbi.
Telítetlen savak:
C17H33COOH - olajsav;
C17H31COOH - linolsav;
C 17 H 29 COOH - linolén stb.
Szerezzen be zsírokat természetes állati és növényi eredetű forrásokból.
Fizikai tulajdonságok a zsírok savasak. A túlnyomórészt telített savmaradékokat tartalmazó zsírok szilárd vagy kenőcsszerű anyagok (birka-, marhahús-zsír stb.) A főként telítetlen savmaradékokat tartalmazó zsírok folyékony állagú szobahőmérsékleten és olajoknak nevezzük. A zsírok nem oldódnak vízben, de jól oldódnak szerves oldószerekben: éterben, benzolban, kloroformban stb.
Kémiai tulajdonságok. Mint minden észter, a zsírok is hidrolízisen mennek keresztül. A hidrolízis savas, semleges vagy lúgos környezetben mehet végbe.
1. Savas hidrolízis.

A tejsav katalógusszáma: CAS 50-21-5
A tejsav leírása:
Szinte átlátszó, enyhén sárgás higroszkópos szirupszerű folyadék enyhén savanyú szaga, a joghurt illatára emlékeztet. Vízben, etanolban, rosszul oldódik - benzolban, kloroformban és más halogénezett szénhidrogénekben. Különféle optikailag aktív D és L izomerek léteznek. Valamint D és L optikailag inaktív keveréke. Ez utóbbit kémiai szintézissel nyerik, és aktív formák bakteriálissal. (enzimatikus módszer) Az emberi szervezetben az optikailag aktív L forma vesz részt a Kreps-ciklusban, ezért adalékanyagként javasolt (tejsav, E270), más iparágakban nem játszik különleges szerepet.
A tejsav világszerte ismert elnevezés Oroszországban nem honosodott meg, de laktátsóinak neve mindenhol megtalálható, a kalcium-laktátnál sokkal gyakrabban vágjuk a kalcium-laktátot.
80%-os tejsavra vonatkozó előírás.
Forráspont (100%-os oldat) 122 °C (115 Hgmm)
Fajsúly (20 °C) 1.22
Vízben való oldhatóság Teljesen oldódik
Sűrűség (20°C-on) 1,18-1,20 g/ml
Nehéz fémek, legfeljebb 0,001%
Vastartalom, legfeljebb 0,001%
Arzéntartalom, legfeljebb 0,0001%
Kloridtartalom legfeljebb 0,002% (valójában 0,0015%)
Szulfáttartalom legfeljebb 0,01% (valójában 0,004%)
A kalcinálás utáni maradék legfeljebb 0,1% (valójában 0,06%)
Gyártó: Kína
Csomagolás: hordó 25 kg vagy kocka 1200 kg
A tejsav főbb fizikai tulajdonságai:
Olvadáspont: 17°C Optikailag inaktív (racematikus),
25-26 °C optikailag aktív + vagy - forma
(Az olvadási hőmérséklet különbségei lehetővé teszik a drágább optikailag aktív formák minőségi és gyors megkülönböztetését az olcsóbb inaktívaktól!!)
Relatív sűrűség(víz = 1): 1.2
Vízben való oldhatóság: elegyedik
Molekulatömeg: 90,08 g/mol
Lobbanáspont: 110°C c.c.
Oktanol/víz megoszlási hányados lg Pow-ban: -0,6
Robbanás- és tűzveszély:
Támogatja az égést normál körülmények között. spontán égés nem valószínűNe engedje nyílt láng füstölését.
Tűzoltás: por, alkoholnak ellenálló hab, vízpermet,
szén-dioxid.
Kémiai stabilitás: Stabil at normál hőmérsékletekés nyomás.
Kerülendő körülmények: Porképződés, túlzott hőség.
Összeférhetetlenség más anyagokkal: Erős oxidálószerek, ásványi savak.
Veszélyes bomlástermékek: Nitrogén-oxidok, szén-monoxid, szén-dioxid, párok
cianid.
Veszélyes polimerizáció: Nincs megjelölve.
Veszély az emberre:
A szervezetbe jutás módjai: Az anyag bejuthat a szervezetbe aeroszol belégzésével és lenyeléssel.
Az MPC-t meghaladó koncentrációknak való rövid távú expozíció esetén: Az anyag irritálja a bőrt és Légutak, valamint maró hatású
hatás a szemre. Lenyelve maró hatású.
Szembe kerülés esetén: Vörösség. Fájdalom. Súlyos mély égési sérülések. Szemüveg-maszk, ill
védőmaszk. Először öblítse le nagy mennyiség vizet többnek
perc (eltávolítani kontaktlencse ha nem nehéz), akkor menj orvoshoz.
A munkaterület szabványai:
A TLV-t (maximális küszöbkoncentráció, USA) nem állapították meg.
Rákkeltő hatás: Az ACGIH, az IARC, az NTP vagy a CA Prop 65 nem tartalmazza.
Járványtan: Nincs információ.
Tetragenitás: Nincs információ.
reproduktív hatások: Nincs információ.
Mutagenitás: nincs információ
Neurotoxicitás: Nincs információ.
Az állatkísérletek kimutatták:
LD50/LC50:
Draize-teszt, nyúl, szemek: 100 mg Súlyos;
Draize teszt, nyúl, bőr: 500 mg/24H Enyhe;
Belégzés, patkány: LC50 = >26 mg/m(cc)/1H;
Orális, egér: LD50 = 1940 mg/kg;
Orális, patkány: LD50 = 1700 mg/kg;
Bőr, nyúl: LD50 = >10 g/kg;
Figyelem. Információt adnak az anyag koncentrátumáról, in kis mennyiségbenés a tejsav koncentrációja, a rendelkezésre álló adatok szerint Ebben a pillanatban az adatok ártalmatlanok!
Tejsav(2-hidroxi-propionsav) CH 3 CH(OH)COOH, molekulatömeg 90,1; színtelen. Ismeretes az L(+)-tejsav, a D(-)-tejsav (hús-tejsav) és a racém tejsavas fermentációs tejsav. D,L- és D-tejsav esetében az olvadáspont 18 °C és 53 °C; t. kip. ill. 85°C/1 Hgmm és 103 °C/2 Hgmm; D-tejsavhoz [α] D 20 -2,26 (koncentráció 1,24% in. D,L-tejsav D esetén H 0 arr - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H teszt 110,95 kJ/mol (25 °C), 65,73 kJ/mol (150 °C). Az L-tejsav D esetében H 0 égés - 1344,8 kJ/mol; D H 0 arr -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
A tejsav nagy higroszkópossága miatt általában tömény vizes oldatait használják - szirupos, színtelen, szagtalan. Mert vizes oldatok tejsav d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 és 28,5 MPa. s (25 0 C) ill. 45,48 és 85,32%-os oldatokhoz; g 46,0. 10-3 N/m (25°C) 1 M oldatra; e 22 (17 °C). A tejsav oldódik más halogénezett szénhidrogénekben, rosszul oldódik; R K a 3,862 (25 °C); A vizes oldatok pH-ja 1,23 (37,3%), 0,2 (84,0%).
Tejsav akrilsavvá dehidratálódik, HBr-mal hevítve 2-bróm-propionsav keletkezik, amikor a Ca-só reagál PCl 5-tel vagy SOCl 2 -2-klór-propionil-kloriddal. Ásványi savak jelenlétében a tejsav önészterezése megtörténik az (I) általános képletű vegyület, valamint a lineáris poliészterek képződésével. A tejsav kölcsönhatásba lépésekor RCH 2 CH (OH) COOH hidroxisavak képződnek, ha pedig a tejsav alkoholokkal lép kölcsönhatásba, észterek képződnek. A tejsav sóit és észtereit laktátoknak nevezzük (lásd a táblázatot).
tejsav keletkezik a tejsav hatására (savanyú tej, káposzta savanyítása, zöldségek savanyítása, sajt érlelése, takarmány silózása során); A D-tejsav megtalálható az állatok, növények szöveteiben és mikroorganizmusokban is.
Az iparban a tejsavat 2-klór-propionsavból és annak (100 °C) vagy laktonitril CH 3 CH (OH) CN-ből (100 °C, H 2 SO 4) nyerik, majd észterek képzése, izolálása és hidrolízise következik be. ami kiváló minőségű termékhez vezet. Más módszerek is ismertek a tejsav előállítására: propilén oxidációja nitrogén-oxidokkal (15-20 °C), majd H 2 SO 4-gyel, CH 3 CHO kölcsönhatása CO-val (200 ° C, 20 MPa).
EGYES LAKTÁTOK TULAJDONSÁGAI

tejsavat használnak Élelmiszeripar, pácoló festésben, bőriparban, fermentációs üzletekben as baktericid szer, megszerzéséért gyógyszerek, lágyítók. Az etil- és butil-laktátokat cellulóz-éterek, szárítóolajok oldószereként használják, növényi olajok; butil-laktát – egyes szintetikus polimerek oldószereként is.
A világ tejsavtermelése 40 ezer tonna (1983).
Megvilágított.: Holten C.H., Tejsav. tulajdonságait és kémiáját. Tejsav és származékai, Weisheim, 1971. Yu. A. Treger.
Válassza ki a cikk címének első betűjét:
Tejsav (laktát)- α-hidroxi-propionsav (2-hidroxi-propánsav).
- t pl 25-26 °C optikailag aktív (+)- vagy (-)-forma.
- t pl 18 °C racém forma.
- Kémiai képlet: CH 3 CH(OH)COOH
- Racémiai képlet: C 3 H 6 O 3

Tejsav keletkezik, amikor tejsavas fermentáció cukrok, különösen a savanyú tejben, a bor és a sör erjesztése során. A vegyiparban és az élelmiszeriparban egyaránt használják tartósítószerként. Az emberi szervezetben a glükóz lebontásából tejsav (laktát) képződik.
Tehát van különbség a tejsav és a laktát között? Nem. A szerves kémiában a tejsavat gyakran nevezik, a biokémiában laktátnak.
Laktát, körülveszi talán a legtöbbet nagyszámú különféle mítoszok, a legtöbb amelyek közül nem igazak. És bár elég megbízható anyag van a laktátról oroszul, számos amatőr sportoló (és néhány profi) makacsul továbbra is hiszi és ismétli a múlt század mítoszait.
Foglaljuk össze röviden és tömören a laktáttal kapcsolatos alapvető tényeket.
A laktát mindig a szervezet energiatermelése során képződik.
Az energia sejtekbe való bejutásának fő módja a glükóz lebontása. A glükózmolekula 10 egymást követő reakción megy keresztül, hogy piruvátot állítson elő a glikolízis nevű folyamat során. Ezenkívül a piruvát egy része részlegesen oxidálódik, és szén-dioxiddá és vízzé alakul. A másik rész a laktát-dehidrogenáz enzim szabályozása alatt laktáttá alakul.
Ez a reakció visszafordítható.

A laktát egy részét energiaszintézisre használják fel.
A glükoneogenezis során a teljes laktát 15-20 százaléka alakul glikogénné.
A laktát univerzális energiahordozó.
Olyan körülmények között magas termelés energia anaerob üzemmódban, a laktát energiahordozó azokról a helyekről, ahol lehetetlen az energiaátalakítás végrehajtása, mivel túlsavasodás, azokra a helyekre, ahol energiává alakítható (szív, légzőizmok, lassan csökken izomrostok, egyéb izomcsoportok).
A laktátszint emelkedése nem az oxigénhiány következménye.
Állatkísérletek azt mutatják, hogy az izolált izom intracelluláris oxigénhiánya nem mutat semmilyen korlátozást a mitokondriális légzési lánc aktivitásában még maximális edzés során sem. Mindig lesz elég oxigénünk az izmokban.
A laktát az anaerob glikolízis terhelés indikátora.
Amikor piruvát képződik, végtermék glükóz metabolizmus a glikolízis folyamatában, laktát képződik. A laktát egyszerűen azért halmozódik fel, mert az anaerob és az aerob gyakorlatok energiaátalakulásának sebessége eltérő.
Minél nagyobb a munka intenzitása, annál több laktát termelődik.
A vér laktátszintje szorosan összefügg az edzés intenzitásával. A laktát felhalmozódik az anaerob és aerob gyakorlatok energiaátalakítási sebességének különbsége miatt. Az energia átalakulás sebessége az anaerob energiaanyagcserében gyorsabb, mint az aerobban.
A laktát nem hoz létre savasságot, hanem kíséri.
Energiatermeléssel egyidejűleg savasságot is termelünk. Testünkben az energiareakciók az elektronok, mint energiahordozók részvételével mennek végbe. A glükolízis termékei a laktát és a hidrogén proton H+. Az oldatban lévő hidrogénionok (H+) aktivitásának (koncentrációjának) mértéke az oldat savasságát fejezi ki.
A laktát csak átmenetileg vesz fel savas szert (H +) a reakció végrehajtásához, majd visszahelyezi semleges környezetbe.
A laktát 90%-át a szervezet az edzés utáni első órában hasznosítja.
A szervezetben lévő laktát 60%-a teljesen CO2-vé és vízzé oxidálódik. Körülbelül 20%-a átalakul glikogénné a glükoneogenezis folyamatában, egy része pedig az új aminosavak képzésére szolgál. Csak kis része(kevesebb, mint 5%) laktát az izzadsággal és a vizelettel ürül.
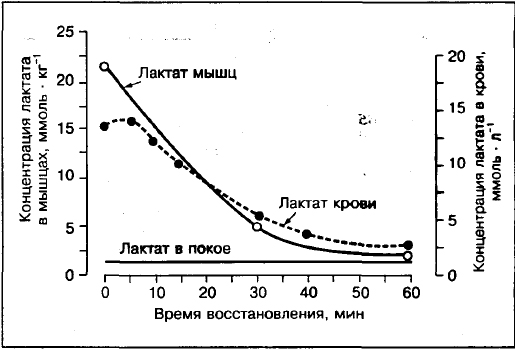
A vér laktátja nem tükrözi szisztematikusan a laktát jelenlétét az izmokban.
Az izom és a vér laktátkoncentrációjának összehasonlítása azt mutatja, hogy ha az erőfeszítés meghaladja a 75-80% VO2max értéket, akkor a laktát koncentrációja az izmokban (a comb elülső felszínének izombiopsziája) magasabb, mint a vérben. Ellentétben a közepes intenzitású edzéssel 30%, 50%, 70% VO2max, ahol a laktát koncentrációja artériás vér magasabb, mint az izmokban.
A laktát nem okoz fájdalmat és izomgörcsöt.
Az intenzív edzést követő napon az izomfájdalmat az izomkárosodás és az edzés után fellépő szöveti gyulladás okozza. Többség izomgörcsök idegreceptorok váltják ki az izmokban, amelyek túlzottan izgatják a fáradtságot az izmokban.
A cmtscience.com-ról (2016) adaptálva.
Hasonló cikkek
-
Amikor a férj ellene van egy gyereknek, hogyan eshet teherbe a tudta nélkül?
Néha gondatlanságból teherbe eshet. Hogy ez ne forduljon elő, fontos tudni, hogyan lehet véletlenül gyermeket foganni, és milyen eszközökkel kerülheti el a nem kívánt terhességet. Ebben a cikkben további információkat találhat a...
-
Milyen kövek és amulettek alkalmasak a Bika számára a horoszkóp és a születési dátum szerint? Elefánt talizmán a Bika számára
Április-május A Bika (április 21. - május 20.) kimért, nem nyűgös és kolosszálisan termékeny! Irigylésre méltó makacsságuk másokat is a markolatba tud hozni, de pontosan tudják, mit csinálnak, és miért van rá szükségük. A pozitívumok között...
-
Az adatokhoz való hozzáférés korlátozása a szerepkörökben 1c
A jelen cikk keretein belül elvégzendő összes felhasználói jogosultsági beállítás az 1C 8.3 „Adminisztráció” - „Felhasználói és jogosultsági beállítások” részben található. Ez az algoritmus a legtöbb konfigurációban hasonló a ...
-
Az 1c egy vékony klienst indít el vastag helyett
Platformok: 1C: Enterprise 8.3, 1C: Enterprise 8.2, 1C: Enterprise 8.1 Konfigurációk: Minden konfiguráció2012-11-16 21362 Elindításuk speciális...
-
Bizonyíték az áramlopás ismert módjairól Hogyan lehet megtudni, ki lopja az áramot
Az energiatarifák emelkedése az egyre mélyülő gazdasági válság egyik szembeötlő vonása. Ebben az összefüggésben az áramlopás és a felderítésével kapcsolatos problémák kiemelten fontosak. A lopás felderítésének módjai ...
-
Az aljzatok és kapcsolók különféle felületekre történő felszerelésének jellemzői
Üdvözlöm blogunk minden olvasóját.Ma kedves olvasók, szeretném kiemelni az aljzatok beszerelésének témáját. Ez az eljárás nagyon gyakran igényes, amikor egy régi konnektort egy újra cserélnek meghibásodás esetén, amikor ...
