Roztwory i rozpuszczalność. Wielka encyklopedia ropy i gazu
Sól kuchenna w czysty wygląd e, czyli chlorek sodu zawiera sód 39,34, chlor 60,66%,
W naturze sól występuje w wodach mórz, oceanów, niektórych jezior i źródeł podziemnych, a także w postaci warstw osadów krystalicznych. W zależności od charakteru złóż i metod wydobycia wyróżnia się sól kamienną, samosolną, klatkową lub basenową, którą odparowuje się.
Sól kamienną wydobywa się z warstw znajdujących się na różnych głębokościach pod ziemią. Najbliższe duże złoża soli kamiennej znajdują się na terenie miasta Sol-Iletsk w obwodzie czałowskim i mieście Artemowsk w obwodzie ługańskim na Ukrainie. Po rozpadzie ZSRR Rosja kontynuowała zakupy soli z Ukrainy. Sól samosedymentacyjna wydobywana jest z warstw soli, które osiadły na dnie jezior. Krystalizacja soli następuje latem w wyniku naturalnego odparowania wody z jeziora. Rozróżnia się krystalizację obecną i krystalizację starą (rodnikową).
Znaczne ilości soli osadowej wydobywa się w jeziorach Baskunchak, Kuuli i jeziorach regionu Pawłodarskiego.
Sól klatkowa lub basenowa pozyskiwana jest z osadów powstałych w specjalnych basenach w wyniku naturalnego odparowania wody z ujść rzek lub niektórych jezior oddzielonych od morza wąskimi pasami brzegu. Sól smutna wydobywana jest głównie z wód ujścia rzek lub słonych jezior na obszarze Krymu. Sól warzona otrzymywana jest poprzez odparowanie wody z solanek naturalnych lub sztucznych w specjalnych jednostkach wyparnych lub wyparkach próżniowych. Wydobycie soli warzonej koncentruje się w Słowiańsku, Usolje w obwodzie irkuckim i kilku innych złożach.
Właściwości soli kuchennej. Czysty chlorek sodu po krystalizacji otrzymuje się w postaci bezbarwnych, regularnych sześciennych kryształów o ciężarze właściwym 2,167 i temperaturze topnienia 800°.
Ciężar właściwy soli naturalnej waha się od 1,95 do 2,2 w zależności od wielkości kryształów i rodzaju soli. Podczas krystalizacji (wytrącania) część solanki zostaje zatrzymana wewnątrz kryształów, tym bardziej większe rozmiary spadające kryształy. Ciężar właściwy solanki jest mniejszy niż ciężar właściwy czystych kryształów, dlatego kryształy soli naturalnej mają nieco obniżoną wartość tego ostatniego. W kryształach soli kamiennej znajduje się mniej wtrąceń solankowych niż w soli samosedytowanej i basenowej z obecnej klatki, dlatego też ciężar właściwy soli kamiennej jest większy niż ciężar właściwy soli samosedytowanej i basenowej. Do obliczeń praktycznych można przyjąć ciężar właściwy równy 2,2.
Kryształy chlorku sodu przy wilgotności względnej powyżej 75,5% pochłaniają (absorbują) wilgoć, a przy wilgotności względnej poniżej 75,5% ją tracą. Ta właściwość wyjaśnia zmianę zawartości wilgoci w soli podczas przechowywania na powietrzu bez szczelnego opakowania. Sole naturalne, zwłaszcza samoosiadające i basenowe, zawierające zanieczyszczenia w postaci soli wapnia i magnezu, charakteryzują się zwiększoną higroskopijnością w porównaniu do czystego chlorku sodu. W przypadku przechowywania w wilgotnym pomieszczeniu lub na świeżym powietrzu zawartość wilgoci w soli może osiągnąć poziom bez zauważalnego rozpuszczenia,
dalsze wchłanianie wilgoci prowadzi do częściowego rozpuszczenia soli. Higroskopijność wynika w dużej mierze ze zbrylania się soli podczas przechowywania, czyli adhezji poszczególnych kryształów do siebie, w wyniku czego sól zostaje zagęszczona w stałą, jednorodną masę.
Sól mokra ze względu na silniejsze wzajemne przyleganie kryształów spowodowane obecnością na kryształach filmu nasyconego roztworu jest słabo zdyspergowana; równomierne rozprowadzenie jej poprzez rozsypanie szpatułką po powierzchni warstwy ryb w kadziach jest znacznie trudniejsze niż w przypadku soli suchej.
Jednak sól mokra (zawierająca wilgoć powyżej 4-5%) w porównaniu z solą suchą po zmieszaniu tworzy gęste, nierozsypujące się grudki, które mocniej i w większych ilościach przylegają do ryby. Dlatego przy soleniu ryby ze wstępnym wymieszaniem jej z solą lepiej jest użyć soli mokrej, natomiast przy soleniu z rozsypaniem soli po warstwach ryby lepiej jest użyć soli suchej.
Podczas mieszania soli ze śniegiem lub drobno pokruszonym lodem ten ostatni topi się, ponieważ w temperaturach powyżej -21,2° sól i śnieg (lód) nie mogą występować jednocześnie. Kiedy lód (śnieg) topnieje, ha środowisko zaabsorbowany duża liczba ciepło i na tej właściwości opiera się przygotowywanie mieszanin chłodzących. Najniższą temperaturę, wynoszącą -21,2°, uzyskuje się mieszając 100 części wagowych lodu (śniegu) z 33 częściami soli (skład mieszanki: 24,4% soli i 75,6% śniegu lub lodu).
Zanieczyszczenia w soli. Naturalna sól kuchenna, oprócz chlorku sodu jako głównego związku, zawiera zanieczyszczenia innymi związkami solopodobnymi, najczęściej sole metali ziem alkalicznych (wapń, magnez), zanieczyszczenia nierozpuszczalne oraz wodę. Zawartość wody zależy od warunków przechowywania, natomiast zawartość zanieczyszczeń solnych zależy od rodzaju soli i metod jej ekstrakcji. W tabeli Tabela 1 przedstawia skład najpopularniejszych rodzajów soli kuchennej w Federacji Rosyjskiej.
Zanieczyszczenia solami magnezu i wapnia podczas solenia ryb są niepożądane. W obecności znacznej ilości tych zanieczyszczeń powierzchnia ryb ulega silnemu odwodnieniu; solenie na sucho opóźnia powstawanie solanki i wnikanie soli do wnętrza ryb, oraz słona ryba nabiera gorzkiego smaku. Ustalono, że gdy zawartość soli magnezu i wapnia w soli kuchennej przekracza 2%, ta ostatnia staje się nieodpowiednia do solenia ryb. Wśród innych rozpuszczalnych zanieczyszczeń w soli mogą znajdować się chlorek potasu i siarczan sodu, ale zwykle w tak małych ilościach, że nie mają one żadnego wpływu na szybkość solenia i jakość ryby.
Substancje nierozpuszczalne mieszają się z solą zarówno podczas jej ekstrakcji, jak i podczas przechowywania i transportu bez opakowania. Jeśli zbiór, transport i przechowywanie nie zostaną odpowiednio zorganizowane, ilość nierozpuszczalnych zanieczyszczeń może być tak duża, że podczas solenia otulą powierzchnię ryby i będą trudne do usunięcia nawet po dokładnym umyciu.
Do nierozpuszczalnych zanieczyszczeń zaliczają się zarówno związki organiczne, jak i nieorganiczne. Do nieorganicznych można zaliczyć piasek, glinę, węgiel, które opadają głównie podczas przechowywania i transportu, a także tlenki żelaza, glinu, sole dwutlenku węgla i metali ziem alkalicznych. W soli kamiennej zawsze obecne są tlenki żelaza i glinu, natomiast sole węglanu wapnia występują w soli otrzymywanej z wody morskiej.
Sole samostrącające się i klatkowe, oprócz zanieczyszczeń organicznych i pochodzenie mineralne, zawierają mikroorganizmy, które dostają się do niego z solanek jezior i basenów, a także z zewnątrz podczas przechowywania na polach, transportu i w miejscach spożycia. Najwięcej mikroorganizmów przedostających się do soli solankowej występuje w soli świeżej; podczas przechowywania (starzenia) ich ilość maleje. Wśród tych mikroorganizmów najwyższa wartość mają mikroorganizmy z grupy mikrokoków, które mają zdolność pigmentowania. Kiedy w czasie przechowywania ryb solonych taką solą wzrasta temperatura powietrza, na mięsie pojawia się czerwona barwa, której towarzyszy pojawienie się śluzu i zapach produktów rozkładu białek. Dostając się wraz z solą do przedsiębiorstw przemysłu rybnego, bakterie pigmentotwórcze infekują magazyny, miejsca składowania soli oraz sól warzoną i sól kamienną znajdującą się w magazynie.
Wymagania jakościowe soli. Norma państwowa W przypadku soli kuchennej dozwolone są: najniższa zawartość chlorek sodu i największą ilość zanieczyszczeń (tab. 2).
Dopuszczalna zawartość siarczanu sodu w suchej masie:
a) dla dodatkowej soli - nie więcej niż 0,2%;
b) dla pozostałych odmian - nie więcej niż 0,5%;
Badania mające na celu zbadanie wpływu zanieczyszczeń zawartych w soli na jakość gotowych produktów solonych, przeprowadzone w r inny czas, a także praktykę solenia, ustalono, że dla różne sposoby i rodzaje solenia, maksymalna zawartość zanieczyszczeń w soli powinna być następująca (tabela 3).
Do solenia nadają się gatunki soli od ekstra (specjalne solenie kawioru) do klasy I włącznie.
Zmiel sól. Sól kuchenna, w zależności od stopnia zmielenia (wielkości kryształków), dzieli się na kilka liczb: 0,1,2,3. Dodatkowa sól ma stopień mielenia 0; najwyższa i klasa I - od nr 0 do 3: sól klasy II - od nr I do 3. Charakterystyki mielenia podano w tabeli. 4.
Mielenie soli, czyli innymi słowy wielkość kryształków soli ma bardzo duże znaczenie ważny do solenia ryb: szybkość rozpuszczania soli zależy od ich wielkości, waga zbiorcza jego dyspergowalność, higroskopijność.
Stosunek powierzchni kryształów do ich objętości, tzw. powierzchnia właściwa dużych kryształów, jest mniejsza niż w przypadku małych. Po rozpuszczeniu taka sama ilość soli przechodzi do roztworu z każdej jednostki powierzchni. Ale jeśli tę ilość przypisać jednostce objętości lub masy kryształów, to w tym samym czasie znacznie więcej soli rozpuści się w małych kryształach niż w dużych, ponieważ całkowita powierzchnia pierwszego jest znacznie większa niż drugiego . Jeśli wymagane jest szybkie rozpuszczenie soli, konieczne jest użycie drobniejszej soli.
Ponadto, dla równomiernego solenia, konieczne jest najgęstsze rozmieszczenie kryształków soli, aby zajmowana przez nie powierzchnia znajdowała się blisko powierzchni ryby. Można to osiągnąć tylko wtedy, gdy przy określaniu wielkości kryształków soli weźmie się pod uwagę powierzchnię ryby, a dokładniej jej powierzchnię właściwą (stosunek powierzchni do masy ryby). Przykładowo śledź pacyficzny o masie 200 g ma powierzchnię 280 cm2, natomiast śledź pacyficzny o masie 22 g ma powierzchnię 74 cm2. Do solenia nasyconego pierwszy wymaga 60 g soli, a drugi - 6 g; na 1 cm2 powierzchni należy rozmieścić odpowiednio 0,21 i 0,08 g. Przy tej samej wielkości kryształów stosunek ich powierzchni styku do powierzchnia wspólna duży śledź będzie 2,5 razy większy niż mały śledź, ponieważ ilość soli na 1 cm3 powierzchni ryby jest w pierwszym przypadku 2,5 razy większa niż w drugim. W związku z tym, aby stosunek powierzchni styku do całkowitej powierzchni ryby był taki sam, do solenia małych śledzi należy stosować sól drobniejszą, która przy tej samej wadze ma większą powierzchnię niż duże śledzie.
W związku z tym można wyciągnąć drugi wniosek: im mniejsza jest dawka soli podczas solenia, tym mniejsza jest wielkość kryształów soli i im mniejszy należy zastosować stopień mielenia, aby uzyskać jak największą powierzchnię styku soli z solą. ryba
Użycie bardzo drobnej soli (ziarno nr 0 i 1) w dużych ilościach podczas solenia może prowadzić do niepożądanych skutków. Drobna sól, mająca zwiększoną higroskopijność w porównaniu do większych kryształów, gdy na rybie nie ma wystarczającej ilości wody do uformowania pierwszych porcji solanki, silnie odwadnia tkankę powłokową, a tym samym spowalnia przenikanie soli do mięsa. Zjawisko to przypomina odwodnienie powierzchni ryb na skutek obecności w soli dużych ilości soli magnezu i wapnia. Aby uniknąć intensywnego odwodnienia powierzchni ryb podczas nasycania solą suchą, wolą stosować sól kuchenną składającą się z mieszanin kryształów o różnej wielkości - do 3-4 mm włącznie (mielenie nr 2). W takiej mieszance znajduje się wystarczająca ilość kryształów o wielkości 1 mm lub mniejszych, które zwiększają powierzchnię kontaktu soli z rybą i szybko rozpuszczając się, tworzą pierwsze porcje solanki bez silnego odwodnienia tkanek. Kolejne porcje solanki powstają w wyniku rozpuszczenia kryształów o dużej powierzchni; Z obserwacji wynika, że jeśli w soli znajduje się mieszanina kryształów o różnej wielkości, to rozpuszczanie w pojemniku do solenia ryb przebiega normalnie, jeśli rozpoczął się proces solenia.
Masa objętościowa soli. Rozliczanie ilości soli w magazynach soli oraz obecny przepływ Warto znać masę nasypową soli. Masa nasypowa produktów sypkich to masa jednostki objętości (1 m3) wyrażona w tonach lub kilogramach. Gęstość nasypowa zależy od ciężaru właściwego produktu, wielkości jego cząstek i stosunku ich różnych rozmiarów, wilgotności i stopnia nacisku na niego ze strony leżących na nim warstw. Dla różne rodzaje sole stosowane w rybołówstwie, masa nasypowa waha się od 1038 do 1365 kg (tab. 5). Gęstość nasypowa soli tego samego rodzaju i obszaru wydobycia jest większa w przypadku soli małych niż dużych.
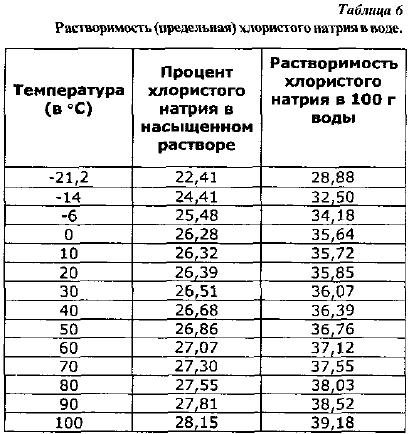
Właściwości roztworów soli kuchennej. Chlorek sodu jest rozpuszczalny w wodzie, a rozpuszczalność, czyli maksymalna jego ilość potrzebna do uzyskania roztworu nasyconego, zmienia się nieznacznie wraz ze wzrostem temperatury (tab. 6).
DI. Mendelejew dla zakresu temperatur od 0 do 108° wyprowadził następujący wzór na określenie granicznego rozpuszczania się soli w 100 g wody
gdzie t to temperatura w stopniach Celsjusza
Rozpuszczalność można wyrazić w gramach chlorku sodu na 100 g roztworu lub w gramach na 100 g wody. Pomiędzy tymi wartościami jest dość prosta zależność. Oznaczmy zawartość soli (w g) w 100 g roztworu przez c, a ilość soli (w g) rozpuszczonej w 100 g wody, aby otrzymać roztwór o określonej zawartości soli przez a. Oczywiście z gramów soli rozpuszczonej w (100-c) g wody w 100 g wody rozpuści się:
![]()
Znając a, możesz obliczyć c korzystając ze wzoru:
![]()
Rozpuszczalność chlorku sodu w 100 g wody, obliczoną ze wzoru (2), podano w tabeli. 6.
Prawie identyczna rozpuszczalność chlorku sodu w zakresie temperatur od 0 do 20°C jest ważna w praktyce solenia, ponieważ nie jest konieczna zmiana dawki soli przy zmianie temperatury w tych granicach.
Roztwory chlorku sodu są cięższe od wody, a ich ciężar właściwy jest większy od jedności. Dla temperatury 15° ciężar właściwy roztworu odniesiony do ciężaru właściwego wody w temperaturze 4° można obliczyć za pomocą następującego wzoru D. I. Mendelejewa:
gdzie c to stężenie soli w roztworze wyrażone w procentach jego masy.Do określenia ciężaru właściwego stosuje się areometry lub gęstościomierze, na których skali znajdują się liczby pokazujące wartość ciężaru właściwego pod kątem 20° w stosunku do ciężar właściwy wody pod kątem 4°, przyjmowany jako równy jedności. Przy zastosowaniu konwencjonalnych areometrów (densymetrów) ciężar właściwy określa się z dokładnością do 0,0! i tylko za pomocą specjalnych areometrów dokładność pomiaru można zwiększyć do 0,001.
Oprócz areometrów i gęstościomierzy, w niedawnej przeszłości do określania ciężaru właściwego stosowano areometry z konwencjonalną skalą stopni Baume'a. 0° tej skali odpowiada głębokości zanurzenia czysta woda i 10° - w 10% roztworze chlorku sodu. Aby przeliczyć stopnie Baume'a na ciężar właściwy, użyj następującego wzoru:
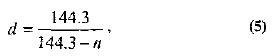
gdzie n jest indeksem areometru Baume.
W tabeli 7 pokazuje ciężar właściwy roztworów soli w temperaturach 0°, 10°, 20° i odpowiadające im wartości stężenia soli jako procent masy roztworu.
Przy wyznaczaniu ciężaru właściwego roztworu, którego temperatura nie pokrywa się z temperaturą kalibracji ariometru, można skorzystać z poniższego wzoru, aby znalezioną wartość ciężaru właściwego doprowadzić do temperatury 20°:
gdzie: d4в20 – ciężar właściwy w 20°;
d4в1 - \u200b\u200bto samo w temperaturze pomiaru t;
0,0004 to współczynnik zmiany temperatury w zakresie ładowalności roztworu soli.
Temperatury wrzenia i zamarzania roztworów chlorku sodu zależą od stężenia tego ostatniego: im bardziej stężony roztwór, tym wyższa temperatura wrzenia i niższa temperatura zamarzania (Tabela 8).
Po ochłodzeniu nasyconego roztworu poniżej 0°C najpierw wytrąca się nadmiar rozpuszczonej soli, w wyniku czego stężenie soli w roztworze spada, a po obniżeniu się do 24,4% roztwór zamarza w temperaturze -21,2°. Sól, która wytrąca się w temperaturach poniżej 0°, ma skład NaCl · 2H2O. tj. krystalizuje z dwiema cząsteczkami wody. Wraz z dalszym wzrostem stężenia temperatura zamarzania nie spada, ale wzrasta, a nie woda, ale sól jest uwalniana w postaci stałej. Temperatura -21,2° jest najniższa ze wszystkich możliwe temperatury zamrażanie roztworu soli kuchennej.
Reakcja roztworów chlorku sodu i soli naturalnych jest prawie obojętna. Zgodnie z normą dla soli kuchennej reakcja na jedzenie roztwór wodny test lakmusowy powinien być neutralny lub zbliżony do niego.
Nasycony roztwór soli o względnej wilgotności powietrza 75,5% nie traci wilgoci przez parowanie i nie wchłania jej z powietrza. Ta równowagowa wilgotność względna nazywana jest punktem higroskopijnym nasyconego roztworu soli i jest w przybliżeniu równa punktowi higroskopijnej soli stałej.
Zagęszczacze solanki. Oprócz soli krystalicznej, solenie zużywa dużą ilość wodnych roztworów jej solanki lub sztucznej solanki. Do ich przygotowania zaleca się stosowanie specjalnych instalacji - zagęszczaczy solanki, których wydajność może być bardzo zróżnicowana.Zagęszczacz solanki o małej pojemności to drewniane naczynie o kształcie cylindrycznym lub stożkowym o wysokości około 60-70 cm, w którym znajduje się ruszt przykryte płótnem (płótnem) lub czystą siatką, na którą należy ułożyć warstwę o wysokości co najmniej 50-40 cm.
Bezpośrednio przy dnie koncentratora solanki znajduje się rura spustowa. Woda wchodzi Górna część przez perforowany rurociąg lub przez perforowaną powierzchnię i jest równomiernie rozłożony na całym przekroju poprzecznym warstwy soli w zagęszczaczu solanki. Regulując natężenie przepływu wody i wysokość warstwy soli, łatwo jest uzyskać przepływ nasyconej solanki o ciężarze właściwym 1,2.
Aby szybko uzyskać duże ilości solanki oferujemy zagęszczarkę solanki, do której woda dostarczana jest za pomocą pompy o godz Dolna część pod ciśnieniem, a solanka wypływa od góry.
W tym przypadku warstwę soli utrzymuje się na wysokości co najmniej 1 m, tak aby całkowite nasycenie nastąpiło już przy jednorazowym ruchu wody przez warstwę soli.
„Wśród wszystkich soli najważniejsza i podstawowa jest ta, którą nazywamy po prostu solą”.
Jeśli zwrócisz się do słownik encyklopedyczny, to możesz znaleźć następujące informacje na temat soli kuchennej.
Chlorek sodu (chlorek sodu, sól kuchenna, sól kamienna), NaCl, substancja krystaliczna bezbarwna, temperatura topnienia 801 0C, temperatura wrzenia 1465 0C Rozpuszczalność 26,4 g w 100 g wody o temperaturze 20 stopni; Ponadto jest rozpuszczalny w ciekłym amoniaku, glikolu etylenowym, kwasie mrówkowym i metanolu. W naturze chlorek sodu jest szeroko rozpowszechniony w postaci soli kamiennej (halitu), występującej m.in woda morska(1,5% wag.) i oceanów (2,72%), słone jeziora solankowe, w solankach mielonych. Ważna przyprawa do potraw; idzie do produkcji sody kaustycznej, chloru, sody. Produkcja światowa – 175 mln ton/rok.
Przyzwyczailiśmy się, że na co dzień widzimy na stole sól kuchenną, ale myślę, że wielu z nas nawet nie zastanawia się, jakie znaczenie ma ona w naszym życiu, a bez soli, jak mówią, nie da się nawet zrobić mydła!
Sól jest substancją, która nie zmienia się nawet w ogniu, nie ulega zepsuciu, a wręcz przeciwnie, chroni żywność przed zepsuciem. Od dawna służy jako symbol stałości. Nasi przodkowie witali gości „chlebem i solą” na znak nierozerwalnej przyjaźni.
W różne kraje ach, ludzie jedzą różne produkty. I tylko jeden produkt jest wszędzie taki sam – sól kuchenna (NaCl). W mineralogii nazywa się to halitem lub solą kamienną, w technologii i życiu codziennym - stołową lub sól kuchenna, w chemii – NaCl (chlorek sodu).
Jest niezbędny do przygotowania prawie wszystkich potraw. Nawet słodkie ciasta! A jeśli wydaje nam się, że w jedzeniu jest jej za mało, to „na stole nie ma wystarczającej ilości soli”. Ludzie nie mogą żyć bez soli.
Sól kuchenna była częścią najstarszych leków, przypisywano jej m.in właściwości lecznicze, działanie oczyszczające i dezynfekujące. W różnych okresach uważano, że sól jest uniwersalnym antidotum. „Musimy postawić solniczkę przed tymi, którzy są zajęci jedzeniem. Sól kontroluje truciznę i sprawia, że to, co nie ma smaku, staje się smaczne” – Arnaldo z Vilanova.
Co ciekawe, od czasów starożytnych sól była przedmiotem handlu wielu ludów (za 1 kg soli płacono 1 kg złotego piasku).
W specjalnych basenach wydobywali go z wody morskiej mieszkańcy przybrzeżnych regionów ciepłych krajów, a górnicy zagospodarowywali łatwo dostępne złoża. Przez wiele stuleci z dużych głębokości wydobywano roztwory soli (solany), które w warzelniach przetwarzano na sól kuchenną.
Chlorek sodu jest nie tylko ważny produkt spożywczy. Sole są najważniejszy surowiec Dla przemysł chemiczny.
1. Sól kuchenna w przyrodzie. (Rodzaje soli).
Sól kuchenna jest związkiem aktywnym chemicznie, który wymaga ostrożnego obchodzenia się z sodem metalu alkalicznego z wyjątkowo toksycznym chlorem. Związek ten można otrzymać przez wystawienie kawałków sodu na działanie gazowego chloru przez długi czas w dobrze zamkniętym naczyniu. Jak wiemy, sól kuchenna, która trafia do sprzedaży, nie jest trująca, ponieważ po połączeniu substancji nie pojawiają się ich pierwotne właściwości. Składa się, jak wszystkie proste sole, z jonu metalu i reszty kwasowej.
Temperatura topnienia soli kuchennej wynosi 800 stopni C, gęstość wynosi 2,16 g/cm3.
Czysta sól kuchenna NaCl jest bezbarwna i tworzy sześcienne kryształy. Sól kuchenna „Delikatna” lub „królewska” ma delikatny różowy kolor i przyjemny aromat. Zawiera mikroskopijne algi, które dostały się do niego podczas krystalizacji z wody słonego jeziora.
Okazuje się, że spotykana jest także niebieska sól kuchenna. W naturze sól kamienna tego koloru jest bardzo rzadka. A w laboratorium nie jest trudno uzyskać niebieski chlorek sodu. Aby to zrobić, mieszaninę metalicznego sodu i chlorku sodu ogrzewa się w szczelnie zamkniętym naczyniu. Metal może rozpuszczać się w soli. W tym przypadku atomy sodu wnikają sieci krystalicznej, składający się z jonów Na+ i Cl-, i „uzupełnia” go, zamieniając się w kationy sodu. A uwolnione elektrony znajdują się w tych węzłach sieci krystalicznej, w których powinny znajdować się aniony chlorkowe. Takie niezwykłe miejsca sieci zajmowane przez elektrony nazywane są wakatami, czyli centrami F (od niemieckiego słowa Farbe – kolor). Po ochłodzeniu kryształu niektóre centra F łączą się, tworząc asocjaty zawierające od 10 do 1000 atomów sodu. To jest powód pojawienia się niebieskiej farby. W naturalnym halicie mineralnym (soli kamiennej) centra F powstają pod wpływem promieniowania towarzyszącego przemianom radioaktywnym. Co ciekawe, po rozpuszczeniu błękitnej soli kamiennej w wodzie powstaje bezbarwny roztwór chlorku sodu.
2. Sól na Rusi (tło historyczne).
W Ruś Kijowska używana sól z regionu karpackiego, a także ze słonych jezior i ujść rzek Czarnej i Morza Azowskie. Kupiono go w Sudaku i przewieziono na północ. Sól była tak droga, że podczas uroczystych uczt serwowano ją jedynie na stołach szlachetnych gości, inni natomiast wychodzili z uroczystości „bez popijania soli”.
Pierwsza wzmianka o górnictwie solnym na Rusi pojawiła się w rękopisach z XII wieku. Produkcja w tamtym czasie była prymitywna. W miejscach, gdzie pojawiały się źródła solne, kopano doły – studnie i zbierano solankę. Tutaj został wzbogacony: latem przez parowanie, zimą przez zamrożenie. Na początku XVI wieku. Zmieniła się technika wydobycia soli: zaczęto wydobywać głębokie wody słone za pomocą odwiertów - „rur”.
Po aneksji terytorium Astrachania ważne źródła sole stalowych jezior Morza Kaspijskiego. Tutaj po raz pierwszy przemysłowcy solni nie musieli „gotować” soli, po prostu wydobywano ją z dna jezior i wysyłano statkami w górę Wołgi. A jednak zapotrzebowanie na sól nie zostało zaspokojone. Najuboższe grupy ludności najbardziej ucierpiały z powodu niedoborów i wysokich cen. Podwyżka podatku od soli wywołała niezadowolenie niższych warstw społeczeństwa, zwane „zamieszkami solnymi”.
W 1711 r. Piotr I wydał dekret wprowadzający monopol solny. Handel solą stał się wyłącznym prawem państwa. Monopol solny istniał przez ponad sto pięćdziesiąt lat, ale został zniesiony.
W Rosja carska mimo bogatych naturalnych zasobów soli, ze względu na prymitywne metody wydobycia i transportu, było jej za mało. Przez wiele stuleci sól była źródłem wzbogacenia i zysku handlarzy i przedsiębiorców. Dlatego jednym z pierwszych dekretów rządu radzieckiego uczyniono sól, podobnie jak inne bogactwa podziemnego gruntu, własnością państwa ludowego. W latach dwudziestych łopatę, kilof i kosz zastąpiły kombajny solne, krajarki i wyparki próżniowe. Mechanizacja górnictwa pozwoliła naszemu krajowi zająć jedno z pierwszych miejsc pod względem ilości produkowanej soli. Obecnie produkujemy w ciągu roku tyle soli kuchennej, ile przedrewolucyjna Rosja wyprodukowała w ciągu 10-12 lat.
3. Słone dziwactwa Ziemi.
Góry solne pod ziemią nie są gorsze od większości wysokie szczyty Pamir i Kaukaz. Ich podstawy leżą na głębokości 5-8 km, a ich szczyty wznoszą się do powierzchni ziemi, czasem nawet z niej wystają. Takie gigantyczne nagromadzenia nazywane są kopułami solnymi.
Na wysokie ciśnienia i temperatury, sól w wnętrznościach ziemi staje się plastyczna. A ponieważ jego współczynnik rozszerzalności cieplnej jest większy niż w przypadku innych skał, po podgrzaniu rozszerza się i jest ściskany w górę. Ogromne masy soli mogą oderwać się od warstwy kontynentalnej i unieść na powierzchnię ziemi, unosząc, a czasem przebijając leżące powyżej skały. Oczywiście wzrost wysad solnych jest długim procesem.
W Tadżykistanie Góra Słona ma kopułę wznoszącą się na prawie 900 m. Patrząc na nią z dołu, wydaje się, że jest pokryta świeżo spadłym śniegiem: sól tak jasno błyszczy w promieniach słońca.
Częściej spotykane są jednak kopuły solne, które nie są uniesione tak wysoko nad powierzchnią ziemi ani nawet nie są przykryte ziemią. Na szczycie jednej z tych kopuł, która sięga ponad kilometr w głąb ziemi i ma obwód podstawy wynoszący prawie 100 km, leży dobrze znane jezioro Baskunchak. Jezioro to nazywane jest cudem natury. Oceńcie sami. Wśród stepów Astrachania znajduje się jezioro o powierzchni ponad 100 km2. A głębokość jeziora nie przekracza pół metra, a nawet wtedy tylko zimą i wiosną. Latem i jesienią cienka warstwa wody odparowuje, pozostawiając na całej powierzchni jeziora olśniewająco białą sól mieniącą się w słońcu. Jego zasoby są praktycznie niewyczerpane. Jezioro na szczycie solnej góry od kilku stuleci dostarcza nam produktu najwyższej klasy – zawartość chlorku sodu w nim sięga 98%.
Istnieją dwa znane jeziora o tej samej kopule. Jezioro Razval, położone na szczycie kopuły solnej w Iletku, ma niezwykle dużą głębokość – ponad 22 m. Dzięki wysokie stężenie Jezioro to nie zamarza nawet podczas najcięższych zim. Silnie przechłodzona solanka opada na dno jeziora, a z niej krystalizuje hydrohalit, którego osady nie znikają nawet latem. Wyjaśnia to fakt, że w nasyconych gęstych solankach nie ma mieszania, zwykłego dla zbiorników słodkiej wody, ciepło górnych, podgrzanych warstw wody nie jest przenoszone na dolne. Zaledwie 150 m od zimnego jeziora Razval znajduje się jego antypod - gorące jezioro Tuzluchnoye. Jego głębokość wynosi 0,2 - 0,3 m. Zapewnia to intensywne nagrzewanie jeziora latem i cienką warstwę świeża woda przepływając przez gęstszą solankę powstaje swego rodzaju efekt cieplarniany.
Wydobycie soli kuchennej trwa od kilku stuleci. Kopalnie soli w starym stylu przypominają kopalnie węgla. Podczas wydobywania soli kamiennej w górę górnicy pozostawili ją pod ziemią długie korytarze sztolnie, sztolnie głębinowe. Obecnie te podziemne przestrzenie są szeroko wykorzystywane do przechowywania produktów gazowych i naftowych. Koszt magazynowania gazu skroplonego w kopalniach jest 2–4 razy tańszy, a w warstwach solnych 20–40 razy tańszy niż w zbiornikach naziemnych: straty spowodowane parowaniem są prawie całkowicie wyeliminowane.
Ale nie wszystkie kopalnie soli są wykorzystywane do takich celów. Na przykład w polskiej Wieliczce niedaleko Krakowa od siedmiu wieków zagospodarowywane są złoża soli. Jeśli zejdziesz prawie pół kilometra w głąb ziemi, znajdziesz się w przedziwnym królestwie soli. W wyeksploatowanych podziemiach kopalni polscy górnicy i artyści stworzyli prawdziwe podziemne muzeum. Sól kamienna – całkiem miękki materiał, jest łatwy w obróbce, a po oświetleniu wygląda wyjątkowo pięknie.
Jaskinie solne mają jeszcze jedną cudowna nieruchomość: Dają początek niezwykłym efektom dźwiękowym. W jaskiniach, których ściany i sklepienia pokryte są solnymi stalaktytami, wibracje powietrza wytwarzają piękne, melodyjne dźwięki.
Istnieją tak zwane nazwy „słone”. Nazwy wielu miast i miasteczek na całym świecie wspominają o soli: Solvychegodsk, Solikamsk, Sol-Iletsk, Soligalich, Soligorsk, Usolye-Sibirskoye, Soloneshnoye, Salt Creek, Saltpond, Saltkots, Salzburg, Salzgitter, Marsylia ( sól morska), wreszcie tylko Sól, Solanka i nawet Solniczka. I ta lista jest długa.
Miasta te noszą takie nazwy, ponieważ produkcja soli, wydobycie soli i przetwórstwo soli od dawna są najważniejszymi gałęziami przemysłu dla ich mieszkańców.
4. Zastosowanie soli w życiu codziennym.
Unikalne właściwości soli pozwalają na jej wykorzystanie w życiu codziennym. Tę niesamowitą substancję wykorzystuje się do konserwowania, barwienia, usuwania plam i zwiększania wytrzymałości naczyń.
Konserwowanie różnych produktów spożywczych poprzez solenie: mięsa, ryb, warzyw, grzybów itp. opiera się na tzw. właściwościach antyseptycznych lub przeciwgnilnych soli kuchennej, czyli na jej zdolności do zabijania bakterii lub drobnoustrojów powodujących gnicie substancji pochodzenia roślinnego i zwierzęcego.
zastanawiam się, co grochówka należy posolić po ugotowaniu. Słona woda słabo wnika w groch. Dlatego jeśli dodasz sól do zupy przed gotowaniem, groszek nie będzie długo gotował.
Zwiększenie trwałości naczyń kuchennych. Aby zwiększyć wytrzymałość wyrobów szklanych, można je „utwardzić” przez gotowanie. Aby to zrobić, umieść go na patelni, której dno pokryte jest warstwą umytego piasku (o grubości 1 cm) i zalej zimna woda. Doprowadź wodę do wrzenia i gotuj przez 15 minut. Następnie dodaj 2-3 łyżki soli kuchennej i kontynuuj gotowanie przez kolejne 30 minut, po czym pozostawia się je do ostygnięcia, naczynia wyjmuje się i dokładnie płucze.
Aby emaliowana patelnia trwała dłużej, należy zagotować osoloną wodę na nowej patelni (5 łyżeczek na litr wody).
Usuwanie plam. Tłuste plamy z kołnierzyków odzieży wierzchniej można usunąć poprzez ich wytarcie wacik, zwilżony roztworem soli kuchennej (pół łyżeczki) w amoniak(trzy łyżki).
Barwiący. Szybkość barwienia zwiększa się pod wpływem soli kuchennej podczas barwienia bawełny i włókien pokrewnych.
Tkaninę zanurza się w roztworze barwnika i podgrzewa do wrzenia. Po 15-20 minutach wlać 2 litry roztworu soli kuchennej (łyżka stołowa na litr wody) do niskowrzącego roztworu barwnika, z którego najpierw usuwa się tkaninę. Następnie opuść tkaninę i kontynuuj barwienie w lekko wrzącym roztworze przez kolejne 30-40 minut. Następnie zdejmuje się zbiornik z źródła ciepła i tkaninę utrzymuje się w roztworze chłodzącym przez kolejne 30 minut. Przez cały ten czas tkanina jest odwrócona. W przypadku malowania na jasne kolory ilość soli zmniejsza się o połowę. Do roztworu barwnika można również dodać suchą sól, ale w tym celu należy ją wyjąć na 3-5 minut, dodać sól, wymieszać i dopiero po całkowitym rozpuszczeniu ponownie obniżyć tkaninę.
5. Czy zawsze musisz zjeść funt soli, aby żyć dobrze?
Dlaczego mówią, że „naszym pożywieniem jest sól i owsianka?”
Sól zajmuje się najważniejszym procesy fizjologiczne w organizmie ludzi i zwierząt. Występuje w ślinie, soku żołądkowym, żółci i limfie. Obecność chlorku sodu we krwi zapewnia niezbędne ciśnienie osmotyczne, od czego to zależy normalne funkcjonowanie komórki. Organizm dorosłego człowieka zawiera około 200 g soli.
W medycynie stosowane są roztwory fizjologiczne (wodne roztwory soli o składzie zbliżonym do osocza krwi). Na przykład przy niektórych chorobach organizm ludzki traci dużo wody. Może to prowadzić do śmierci. W takich przypadkach do krwi pacjenta wstrzykuje się roztwór soli fizjologicznej.
Okazuje się, że żołnierzom podczas długich marszów i pracownikom gorących sklepów podaje się do picia osoloną wodę. Ponieważ w rezultacie metabolizm soli Organizm ludzki stale traci potrzebne mu sole, w tym chlorek sodu, uwalniając je wraz z potem. Straty te uzupełniają sole zawarte w pożywieniu i wodzie. Aby szybko uzupełnić braki chlorku sodu, woda pitna dodać sól kuchenną.
Prawie wszystkie sole mineralne, których potrzebuje nasz organizm, znajdują się w wystarczającej ilości w zwykłej żywności. Tylko brakuje mu chlorku sodu. Dlatego musimy dodawać sól kuchenną do naszej żywności. Każda osoba spożywa rocznie 6-8 kg soli. Chyba żaden produkt spożywczy nie jest stosowany w tak małych ilościach i nie ma tak wielkiego znaczenia jak sól kuchenna.
Jony sodu regulują zawartość wody w organizmie, transmisję impuls nerwowy. Jej niedobór powoduje bóle głowy, osłabienie, słaba pamięć, utrata apetytu, a nadmiar prowadzi do wzrostu ciśnienie krwi, nadciśnienie, choroby serca. Eksperci od żywienia zalecają spożywanie nie więcej niż 5 g (1 łyżeczka) soli kuchennej (NaCl) na osobę dorosłą dziennie, ale ludzie zazwyczaj spożywają dwa razy więcej niż potrzeba. Dlatego ludzie na to cierpią. Na przykład Japonia, gdzie każdy mieszkaniec spożywa około 30 g soli dziennie, przoduje pod względem liczby pacjentów z nadciśnieniem tętniczym. Na niedobór lub nadmiar soli cierpią nie tylko ludzie, ale także rośliny i zwierzęta.
Tabela 1 Wpływ niedoboru i nadmiaru jonów metali na kondycję roślin i zwierząt
Nadmiar niedoboru sodu
U zwierząt - ból w mięśniach, słabość. U roślin - hamowanie powstawania, u ludzi - nadciśnienie. W roślinach rozwój chlorofilu. formy halofityczne.
Przeprowadziłem badanie, aby upewnić się, że nadmierne spożycie soli jest szkodliwe.
W klinice nr 12 obwodu leninskiego przeprowadzono badanie wśród 183 pacjentów w wieku 50 lat i więcej. Z badania wynika, że na nadciśnienie tętnicze cierpi 30% osób. Wśród osób z nadciśnieniem ponad 70% osób spożywa więcej soli niż to konieczne, a reszta, ich zdaniem, spożywa ją normalnie. Możemy stwierdzić, że rzeczywiście nadużywanie soli może prowadzić do rozwoju nadciśnienia.
6. NaCl z chemicznego punktu widzenia.
Jeśli przeanalizujesz chlorek sodu jako Substancja chemiczna, wtedy mówimy, że jest to złożony związek z jonową siecią krystaliczną, wiązaniem jonowym. W stanie stałym, krysztale NaCl, jon sodu ma jako sąsiadów 6 jonów chloru.
W stanie pary sól kuchenna składa się z pojedynczych cząsteczek. W tym przypadku jeden kation sodu łączy się z jednym anionem chloru.
Chlorek sodu jest rozpuszczalny w wodzie, jego rozpuszczalność jest praktycznie niezależna od temperatury (w 20 stopniach C rozpuszczalność wynosi 35,7 g, w 100 stopniach C to około 40 g). Po rozpuszczeniu w wodzie substancja ta dysocjuje na jony. Jest to spowodowane oddziaływaniem substancji rozpuszczonej z rozpuszczalnikiem. Ponieważ w krysztale chlorku sodu nie ma cząsteczek chlorku sodu, po rozpuszczeniu struktura krystaliczna ulega zniszczeniu, a uwodornione jony przechodzą do roztworu. W roztworze nie ma cząsteczek. Dlatego w roztworach mocnych elektrolitów możemy mówić jedynie warunkowo o cząsteczkach niezdysocjowanych.
Należy wziąć pod uwagę, że w obecności NaOH, HCl, MgCl2, CaCl2 rozpuszczalność chlorku sodu w wodzie jest znacznie zmniejszona.
Metody otrzymywania chlorku sodu
Chlorek sodu można otrzymać w wyniku reakcji:
1. tlenek zasadowy – tlenek sodu z kwasem solnym
Na2O + 2HCl = 2NaCl + H2O;
2. gdy sód spala się w chlorze: 2Na + Cl2 = 2NaCl;
3. po interakcji wodorotlenku sodu z kwasem solnym:
NaOH + HCl = NaCl + H2O;
4. w wyniku reakcji kwasu solnego z solą, np. z krzemianem sodu: 2HCl + Na2SiO3 = 2NaCl + H2SiO3;
5. gdy wodorotlenek sodu reaguje z solą, np. z chlorkiem miedzi (II): 2NaOH + CuCl2 = Cu (OH)2 + 2NaCl;
6. poprzez wzajemne oddziaływanie dwóch soli:
Na2SiO3 + CaCl2 = 2NaCl + CaSiO3;
7. gdy metaliczny sód reaguje z kwasem solnym:
2Na + 2HCl = 2NaCl + H2.
Hydroliza paradoksalna
Chlorek sodu to sól utworzona przez mocną zasadę i mocny kwas. Jak wiadomo, sole takie nie ulegają hydrolizie. Jeśli jednak taką sól przetwarza się w trudnych warunkach (w temperaturze 500 stopni C i pod ciśnieniem 1 MPa, przy użyciu wody w postaci przegrzanej pary), wówczas NaCl ulega hydrolizie. Chlorowodór zaczyna być usuwany parą wodną i paradoksalna hydroliza staje się rzeczywistością:
NaCl + H2O = NaOH + HCl.
Otrzymywanie kwasu solnego
Alchemicy pozyskiwali także stałą sól kuchenną kwas chlorowodorowy. W pismach mnicha-alchemika Bazylego Walentyna (XV w.), którego wielu historyków chemii uważa za postać mityczną, zalecano otrzymywanie „spirytusu z soli” – „spiritus salis” – poprzez kalcynację mieszaniny soli kamiennej i siarczan żelaza. W tym samym czasie oddestylowano ciecz, która zadziwiła wyobraźnię chemików: dymiła w powietrzu, powodowała kaszel, korodowała tkaniny, papier, metal.Sól kamienna to chlorek sodu NaCl, siarczan żelaza to krystaliczny hydrat żelaza(II) siarczan FeSO4 x 7H2O. Kalcynując mieszaninę tych substancji, alchemicy otrzymywali kwas solny HCl:
2NaCl + 2(FeSO4 x 7H2O) = 2HCl +Fe2O3 + Na2SO4 + SO2 + 13H2O.
Nieco później alchemicy wymyślili nową metodę wytwarzania HCl, która do dziś jest stosowana do laboratoryjnej produkcji kwasu solnego.
W warunkach laboratoryjnych do otrzymania HCl stosuje się starą metodę opracowaną przez alchemików, która polega na działaniu mocnego kwasu siarkowego na sól kuchenną:
NaCl+H2SO4 (stężony) = NaHSO4+HCl.
Chlorowodór doskonale opuszcza sferę reakcyjną, a równowaga przesuwa się w prawo. W temperaturach powyżej 550 stopni C i nadmiarze chlorku sodu możliwa jest interakcja
NaCl + NaHSO4 = Na2SO4 + HCl.
Reakcja jakościowa
Chlorek sodu można rozpoznać wśród innych soli za pomocą reakcji jakościowych. W roztworze NaCl = Na- + Cl+ chlorek sodu dysocjuje na jony.
Jon chlorkowy można oznaczyć za pomocą AgNO3. W wyniku reakcji wytrąca się biały osad chlorku srebra
NaCl + AgNO3 = AgCl + NaNO3.
Jon sodu jest określany poprzez zmianę płomienia palnika na jasnożółty kolor.
Niesamowite właściwości
Właściwości soli wykorzystywane są do uzyskiwania niskich temperatur. Jeśli zmieszasz 1 część chlorku sodu i 3 części pokruszonego lodu lub śniegu, możesz otrzymać mieszaninę, która ochładza się do -22 stopni.
Sól można także stosować do gaszenia sadzy zapalającej się w kominie. Ponieważ sól przyciąga wilgoć z powietrza. A poza tym w zwykłym piecu chlorek sodu nie topi się, ale jego kryształy pękają i rozpraszają się w wyniku przemiany w parę wtrąceń ługu macierzystego, które zawsze są w nich zawarte. W wysokich temperaturach sól zaczyna zauważalnie parować, zamieniając się w parę składającą się z cząsteczek chlorku sodu i częściowo z jonów sodu i jonów chlorkowych. To właśnie te opary pomagają odizolować zapaloną sadzę od tlenu zawartego w powietrzu, bez którego spalanie nie jest możliwe.
7. Zastosowanie NaCl w przemyśle chemicznym.
Sól kuchenna jest niezbędna przy produkcji mięsa i mięsa ryba w puszce, w przemyśle metalurgicznym, w przetwórstwie futer, skór surowych, w farmacji, w mydlarstwie, w medycynie. Sól jest głównym surowcem wyjściowym do produkcji sody kalcynowanej, jednej z niezbędne produkty przemysł chemiczny. Jednak głównym konsumentem soli kuchennej jest przemysł chemiczny. Wykorzystuje nie tylko samą sól, ale także oba elementy, które ją tworzą. Sól kuchenną zwykle rozkłada się na pierwiastki składowe poprzez elektrolizę roztworu wodnego. W tym przypadku jednocześnie wytwarzany jest chlor, wodór i soda kaustyczna (w roztworze). Po odparowaniu z sody kaustycznej otrzymuje się stałą zasadę (ług). Łącząc wodór i chlor, otrzymuje się kwas solny.
7. 1. Elektroliza chlorku sodu
Do produkcji sodu metalicznego i chloru gazowego stosuje się proces elektrolizy stopionego chlorku sodu. Podczas elektrolizy stopionego NaCl zachodzą następujące procesy: na katodzie – jony sodu ulegają redukcji do atomów obojętnych, czyli powstaje metaliczny sód; na anodzie - jony chlorkowe utleniają się do obojętnych atomów, z których powstają cząsteczki chloru.
Katoda: Na+ + e - redukcja Na0 I 2
Anoda: 2Cl- - 2e - Cl20 I 1 utlenianie
7. 2. Zdobywanie napoju gazowanego.
Do produkcji wykorzystuje się chlorek sodu proszek do pieczenia. Technologia produkcji sody: w pierwszej kolejności z amoniaku, dwutlenku węgla i wody otrzymuje się wodorowęglan amonu NH4CO3, który po reakcji z roztworem soli kuchennej daje wodorowęglan sodu NaHCO3 i chlorek amonu NH4Cl
NaCl+NHCO3=NaHCO3+NH4Cl
7. 3. Wytwarzanie mydła.
Dlaczego mówią, że bez soli nie da się nawet zrobić mydła? Okazuje się, że aby uzyskać to, co zwykle mydło do prania Wykorzystuje się reakcję zasadowej hydrolizy tłuszczów.
Proces ten zachodzi w wysokich temperaturach, w obecności kwasów mineralnych i zasad:
H2C – O –OC – C17H35 H2C – OH
HC – O – OC - C17H35 + 3NaOH - HC – OH + 3C17H35 - COONa
H2C – O –OC – C17H35 H2C – Mydło OH
Tristearyna (tłuszcz) gliceryna
Reakcję hydrolizy wykorzystuje się w technologii do wytwarzania gliceryny, kwasów karboksylowych i mydła z tłuszczów.
Gliceryna i kwasy powstają podczas podgrzewania tłuszczu z wodą w autoklawach.
Aby wyprodukować mydło, kwasy podgrzewa się z roztworem węglanu sodu. Aby wyekstrahować mydło, do roztworu dodaje się chlorek sodu, a mydło wypływa na wierzch w postaci gęstej warstwy - rdzenia. Z tej masy przygotowuje się tzw. mydło rdzeniowe – zwykłe odmiany mydła do prania.
Przeprowadźmy następujący eksperyment: zrób mydło z solą i bez.
1. Do porcelanowego kubka włóż 3 g margaryny (możesz użyć tłuszczu lub masło) i dodać 7-8 ml roztworu za pomocą ułamek masowy wodorotlenek sodu 0,2. Aby przyspieszyć reakcję, dodaj wodę do pierwotnego poziomu. Aby sprawdzić, czy zostało jeszcze trochę nieprzereagowanego tłuszczu, wlewam do probówki odrobinę gorącej mieszanki gorąca woda. Jeśli podczas chłodzenia nie wypłyną na powierzchnię wody żadne kropelki tłuszczu, oznacza to, że proces zmydlania jest zakończony. Jeśli kropelki tłuszczu wypłyną na powierzchnię, kontynuuję gotowanie mieszaniny.
Po zakończeniu reakcji zmydlania do powstałej masy dodaję 3,5 ml 20% roztworu soli kuchennej i ponownie podgrzewam do całkowitego oddzielenia się mydła. w odróżnieniu gorąca woda, mydło jest prawie nierozpuszczalne w roztworze soli kuchennej. Dlatego po wysoleniu oddziela się od roztworu i unosi się w górę.
Warstwa wodna pozostająca po posoleniu mydła wraz z solą kuchenną zawiera glicerynę, która powstaje podczas zmydlania tłuszczu. Roztwór ten można odparować i w ten sposób wzbogacić go w glicerol. Glicerynę najlepiej oddzielić od soli kuchennej poprzez destylację pod zmniejszonym ciśnieniem.
W wyniku tego eksperymentu otrzymałem mydło.
2. Podczas przeprowadzania doświadczenia bez dodatku soli mydło nie zadziałało.
Wniosek.
Tak więc sól, używana w przeszłości głównie do celów spożywczych, zyskała obecnie szerokie zastosowanie. I trudno przewidzieć, jakie nowe branże Gospodarka narodowa nadal będzie potrzebna. Ale nawet teraz chlorek sodu bierze udział w ruchu nuklearnych łodzi podwodnych, lotach statków kosmicznych i tworzeniu wokół nas ogromnej ilości nowych materiałów. Analizując zastosowanie i ogromne znaczenie tej niesamowitej substancji, nie sposób dokonać wyboru, co jest ważniejsze: zastosowanie soli w życiu codziennym czy w przemyśle chemicznym, jej wpływ na organizm, czy też produkcja niezbędnych substancji z sodu chlorek. Możemy jedynie śmiało stwierdzić, że sól kuchenna jest solą nr 1 i nie bez powodu nazywana jest „solą ziemi”.
Chlorek sodu NaCl. Umiarkowanie rozpuszczalny w wodzie, rozpuszczalność w niewielkim stopniu zależy od temperatury: współczynnik rozpuszczalności NaCl (w g na 100 g wody) wynosi 35,9 w 20 ° C i 38,1 w 80 ° C. Rozpuszczalność chlorku sodu jest znacznie zmniejszona w obecności chlorowodór, wodorotlenek sodu, sole, chlorki metali. Rozpuszcza się w ciekłym amoniaku i wchodzi w reakcje wymiany. Gęstość NaCl 2,165 g/cm 3, temperatura topnienia 800,8° C, temperatura wrzenia 1465° C.
Mówili: „Sól jest głową wszystkiego, bez soli życie jest trawą”; „Jedno oko na policję (gdzie jest chleb), drugie na solonicę”, a także: „Bez chleba nie ma sytości, bez soli nie jest słodko”... Buriat mądrość ludowa mówi: „Jeśli będziesz pić herbatę, dodaj do niej szczyptę soli; sprawia, że jedzenie trawi się szybciej, a choroby żołądka znikają.”
Jest mało prawdopodobne, że dowiemy się, kiedy nasi odlegli przodkowie po raz pierwszy spróbowali soli: dzieli nas od nich dziesięć do piętnastu tysięcy lat. W tamtych czasach nie było przyborów do gotowania, wszystkiego produkty ziołowe ludzi moczono w wodzie i pieczono na tlących się węglach, a mięso nabijane na patyki smażono w płomieniach ognia. „Sól zwyczajna” prymitywni ludzie prawdopodobnie był to popiół, który nieuchronnie dostał się do potrawy podczas jej przygotowywania. Popiół zawiera potas, węglan potasu K 2 CO 3, który w miejscach oddalonych od mórz i słonych jezior, przez długi czas podawane jako przyprawa do potraw.
Być może pewnego dnia, z braku świeżej wody, mięso lub korzenie i liście roślin moczono w słonej wodzie morskiej lub jeziornej, a jedzenie okazało się smaczniejsze niż zwykle. Być może ludzie ukrywali zebrane mięso w celu przyszłego wykorzystania w wodzie morskiej, aby chronić je przed ptakami drapieżnymi i owadami, a następnie odkryli, że nabyło ono przyjemny smak. Uważni myśliwi prymitywnych plemion zauważyli, że zwierzęta uwielbiają lizać lizawki solne – białe kryształki soli kamiennej wystające tu i ówdzie z ziemi i próbowali dodawać sól do swojego pożywienia. Mogą istnieć inne przypadki pierwszego kontaktu ludzi z tą niesamowitą substancją.
Czysta sól kuchenna, czyli chlorek sodu NaCl to bezbarwna, niehigroskopijna (nie wchłania wilgoci z powietrza) substancja krystaliczna, rozpuszczalna w wodzie i topiąca się w temperaturze 801°C. W przyrodzie chlorek sodu występuje w postaci minerału halit sól kamienna. Słowo „halit” pochodzi od greckiego słowa „halos”, oznaczającego zarówno „sól”, jak i „morze”. Większość halitu występuje najczęściej na głębokości 5 km pod powierzchnią ziemi. Jednak ciśnienie warstwy skalnej znajdującej się nad warstwą soli powoduje, że staje się ona lepką, plastyczną masą. Pojawiające się w niektórych miejscach niskie ciśnienie krwi pokrywa skały, warstwa soli tworzy „kopuły” solne, które wychodzą w wielu miejscach.
Naturalny halit rzadko jest czysty biały. Częściej jest brązowawy lub żółtawy z powodu zanieczyszczeń związkami żelaza. Kryształy halitu można znaleźć, ale bardzo rzadko. niebieski kolor. Oznacza to, że przez długi czas w głębi ziemi znajdowały się w pobliżu skał zawierających uran i były narażone na promieniowanie radioaktywne.
W laboratorium można również otrzymać niebieskie kryształy chlorku sodu. Nie wymaga to promieniowania; wystarczy podgrzać mieszaninę soli kuchennej NaCl i niewielkiej ilości metalicznego sodu Na w szczelnie zamkniętym naczyniu. Metal może rozpuszczać się w soli. Kiedy atomy sodu wnikają w kryształ składający się z kationów Na+ i anionów Cl, „uzupełniają” sieć krystaliczną, zajmując odpowiednie miejsca i zamieniając się w kationy Na+. Uwolnione elektrony znajdują się w tych miejscach kryształu, gdzie Cl ? . Taki niezwykłe miejsca wewnątrz kryształu miejsca zajmowane przez elektrony zamiast jonów nazywane są „wakacjami”.
Kiedy kryształ ostygnie, niektóre wolne miejsca łączą się, co powoduje pojawienie się niebieskiego koloru. Nawiasem mówiąc, gdy niebieski kryształ soli zostanie rozpuszczony w wodzie, powstaje bezbarwny roztwór, zupełnie jak ze zwykłej soli.
Grecki poeta Homer (VIII w. p.n.e.), który pisał Iliada I Odyseja, zwana solą kuchenną „boską”. W tamtych czasach ceniono je bardziej niż złoto: w końcu, jak głosi przysłowie, „bez złota można żyć, ale bez soli nie można żyć”. O złoża soli kamiennej dochodziło do starć militarnych, a czasami niedobory soli wywoływały „zamieszki solne”.
Na stołach cesarzy, królów, królów i szachów znajdowały się solniczki wykonane ze złota, a na ich czele stała osoba szczególnie zaufana – solniczka. Żołnierzom często płacono solą, a urzędnicy otrzymywali racje soli. Z reguły źródła solne były własnością władców i głów koronowanych. W Biblii występuje wyrażenie „picie soli z pałacu królewskiego”, oznaczające osobę otrzymującą wsparcie od króla.
Sól od dawna jest symbolem czystości i przyjaźni. „Wy jesteście solą ziemi” – powiedział Chrystus do swoich uczniów, zwracając uwagę na ich wysokie przymioty moralne. Podczas składania ofiar używano soli, posypywano solą nowo narodzone dzieci wśród starożytnych Żydów kościoły katolickie Podczas chrztu do ust dziecka wkładano kryształ soli.
Arabowie mieli w zwyczaju, że przy zatwierdzaniu uroczystych porozumień podawali naczynie z solą, z której na znak dowodu i rękojmię nieustannej przyjaźni osoby zawierające „przymierze soli” zjadały po kilka ziarenek soli. To. „Wspólne zjedzenie szczypty soli” wśród Słowian oznacza dobre poznanie się i zawarcie przyjaźni. Zgodnie z rosyjskim zwyczajem, przynosząc gościom chleb i sól, życzą im w ten sposób zdrowia.
Sól kuchenna to nie tylko produkt spożywczy, ale od dawna jest powszechnym środkiem konserwującym, wykorzystywano ją w przetwórstwie surowców skórzanych i futerkowych. A w technologii nadal jest materiałem wyjściowym do produkcji niemal wszystkich związków sodu, w tym także sody.
Sól kuchenna należała także do najstarszych leków, przypisywano jej właściwości lecznicze, oczyszczające i dezynfekujące, a od dawna zauważono, że sól kuchenna z różnych złóż ma odmienne działanie właściwości biologiczne: najbardziej przydatny pod tym względem jest morski. W Zielarz, opublikowanym w Rosji w XVII wieku, jest napisane: „Dwie esencje soli, jedna została wykopana z góry, a druga znaleziona w morzu, a która jest z morza, to lutchi, a oprócz soli morskiej, to lutchi, które jest białe.
Jednak w spożywaniu soli należy zachować umiar. Wiadomo, że przeciętny Europejczyk dziennie wchłania z pożywieniem do 15 g soli, podczas gdy przeciętny Japończyk spożywa około 40 g. To właśnie Japończycy są mistrzami świata w liczbie chorych na nadciśnienie tętnicze – chorobę, jedną z najcięższych Dzieje się tak dlatego, że w organizmie zatrzymuje się więcej płynów, niż potrzebuje. Komórki od jego nadmiaru puchną i kurczą się naczynia krwionośne, zatem wzrasta ciśnienie krwi, od którego serce zaczyna pracować z przeciążeniem. Utrudnione staje się to także dla nerek, które oczyszczają organizm z nadmiaru kationów sodu.
Żadna roślina nie może rosnąć na zasolonej glebie, słone bagna zawsze były symbolem jałowej i niezamieszkanej ziemi. Kiedy władca Świętego Cesarstwa Rzymskiego, Fryderyk I Barbarossa, w 1155 roku zniszczył Mediolan we Włoszech, nakazał posypanie solą ruin pokonanego miasta na znak jego całkowitego zniszczenia... różne narody Rozsypywanie soli zawsze oznaczało ściąganie kłopotów i utratę zdrowia.
W starożytności ludzie stosowali kilka metod wydobywania soli kuchennej: naturalne odparowywanie wody morskiej w „stawach solnych”, gdzie wytrącał się chlorek sodu NaCl „sól morska”, gotowanie wody ze słonych jezior w celu uzyskania „odparowanej” soli i wydobywanie „ sól kamienna w kopalniach podziemnych. Wszystkie te metody dają sól z zanieczyszczeniami chlorkiem magnezu MgCl 2 6 H 2 O, siarczanami potasu K 2 SO 4 i magnezem MgSO 4 7H 2 O oraz bromkiem magnezu MgBr 2 6H 2 O, których zawartość sięga 8-10%.
W wodzie morskiej średnio 1 litr zawiera do 30 g różnych soli, sól kuchenna to 24 g. Technologia wytwarzania chlorku sodu NaCl z wody morskiej i jeziornej zawsze była dość prymitywna.
Na przykład pod koniec „epoki brązu” trzy, trzy i pół tysiąca lat przed naszą erą starożytni wytwórcy soli oblali kłody drewna woda morska, a potem je spalili i z popiołów wzięli sól. Później na dużych blachach do pieczenia odparowywano słoną wodę i dodawano krew zwierzęcą w celu usunięcia zanieczyszczeń, zbierając powstałą pianę. Około końca XVI w. Roztwory soli oczyszczano i zatężano przepuszczając przez wieże wypełnione słomą i gałęziami krzewów. Odparowanie roztworu soli w powietrzu prowadzono także w bardzo prymitywny sposób, poprzez polewanie solanką muru z wiązek chrustu i słomy.
Solnictwo, najstarsze z rzemiosł chemicznych, powstało na Rusi prawdopodobnie na początku VII wieku. Kopalnie soli należały do mnichów, których faworyzowali carowie rosyjscy, nie płacono im nawet podatku od sprzedawanej soli. Gotowanie soli przynosiło klasztorom ogromne zyski. Solanki wydobywano nie tylko z jezior, ale także z podziemnych źródeł solnych; otwory wiertnicze, które zbudowano w tym celu w XV wieku. osiągnął długość 6070 m. Do studni opuszczano rury z litego drewna, a solanki odparowywano w żelaznych patelniach na drewnianym palenisku. W 1780 roku w ten sposób ugotowano w Rosji ponad sto tysięcy ton soli...
Obecnie sól kuchenną wydobywa się ze złóż słonych jezior oraz złóż soli kamiennej i halitu.
Sól kuchenna to nie tylko ważna przyprawa spożywcza, ale także surowiec chemiczny: otrzymuje się z niej wodorotlenek sodu, sodę i chlor.
Stepin B.D., Alikberova L.Yu. Książka do chemii do czytania w domu, wyd. 2. M., Chemia, 1995
Lidin RA itd. Właściwości chemiczne substancje nieorganiczne
: Podręcznik. podręcznik dla uniwersytetów / R.A. Lidin, VA Molochko, L.L. Andreeva; edytowany przez R.A.Lidina. M., Chemia, 1996
Alikberova L.Yu. Zabawna chemia: książka dla uczniów, nauczycieli i rodziców. M., AST-PRESS, 1999
Stepin B.D., Alikberova L.Yu., Rukk N.S. Domowe środki chemiczne. Chemia w życiu codziennym i na każdy dzień. M., RET, 2001
SÓL STOŁOWA – chlorek sodu NaCl. Umiarkowanie rozpuszczalny w wodzie, rozpuszczalność w niewielkim stopniu zależy od temperatury: współczynnik rozpuszczalności NaCl (w g na 100 g wody) wynosi 35,9 w 20 ° C i 38,1 w 80 ° C. Rozpuszczalność chlorku sodu jest znacznie zmniejszona w obecności chlorowodór, wodorotlenek sodu, sole – chlorki metali. Rozpuszcza się w ciekłym amoniaku i wchodzi w reakcje wymiany. Gęstość NaCl wynosi 2,165 g/cm3, temperatura topnienia 800,8°C, temperatura wrzenia 1465°C.
Mówili: „Sól jest głową wszystkiego, bez soli życie jest trawą”; „Jedno oko na policję (gdzie jest chleb), drugie na solniczkę (solniczkę)”, a także: „Bez chleba nie ma sytości, bez soli nie jest słodko”... Buriacka mądrość ludowa powiada: „ Kiedy będziesz pić herbatę, dodaj do niej szczyptę soli; sprawia, że jedzenie trawi się szybciej, a choroby żołądka znikają.”
Jest mało prawdopodobne, że dowiemy się, kiedy nasi odlegli przodkowie po raz pierwszy spróbowali soli: dzieli nas od nich dziesięć do piętnastu tysięcy lat. Nie było wówczas naczyń do gotowania, wszelkie produkty roślinne moczono w wodzie i pieczono na tlących się węglach, a mięso pieczone nabijano na patyki w płomieniach ognia. „Sól kuchenną” ludzi prymitywnych był prawdopodobnie popiółem, który nieuchronnie przedostawał się do żywności podczas jej przygotowywania. Popiół zawiera potas – węglan potasu K2CO3, który w miejscach oddalonych od mórz i słonych jezior od dawna służy jako przyprawa do potraw.
Być może pewnego dnia, z braku świeżej wody, mięso lub korzenie i liście roślin moczono w słonej wodzie morskiej lub jeziornej, a jedzenie okazało się smaczniejsze niż zwykle. Być może ludzie ukrywali zebrane mięso do przyszłego wykorzystania w wodzie morskiej, aby chronić je przed ptakami drapieżnymi i owadami, a potem odkryli, że nabrało przyjemnego smaku. Uważni myśliwi prymitywnych plemion zauważyli, że zwierzęta uwielbiają lizać lizawki solne – białe kryształki soli kamiennej wystające tu i ówdzie z ziemi i próbowali dodawać sól do swojego pożywienia. Mogą istnieć inne przypadki pierwszego kontaktu ludzi z tą niesamowitą substancją.
Czysta sól kuchenna, czyli chlorek sodu NaCl, jest bezbarwną, niehigroskopijną (nie wchłaniającą wilgoci z powietrza) substancją krystaliczną, rozpuszczalną w wodzie i topiącą się w temperaturze 801°C. W przyrodzie chlorek sodu występuje w postaci halit mineralny – sól kamienna. Słowo „halit” pochodzi od greckiego słowa „halos”, oznaczającego zarówno „sól”, jak i „morze”. Większość halitu występuje najczęściej na głębokości 5 km pod powierzchnią ziemi. Jednak ciśnienie warstwy skalnej znajdującej się nad warstwą soli powoduje, że staje się ona lepką, plastyczną masą. „Unosząca się” w miejscach niskiego ciśnienia skał przykrywających warstwa soli tworzy „kopuły” solne, które wychodzą w wielu miejscach.
Naturalny halit rzadko jest czysto biały. Częściej jest brązowawy lub żółtawy z powodu zanieczyszczeń związkami żelaza. Kryształy halitu niebieskiego można znaleźć, ale bardzo rzadko. Oznacza to, że przez długi czas w głębi ziemi znajdowały się w pobliżu skał zawierających uran i były narażone na promieniowanie radioaktywne.
W laboratorium można również otrzymać niebieskie kryształy chlorku sodu. Nie wymaga to promieniowania; wystarczy podgrzać mieszaninę soli kuchennej NaCl i niewielkiej ilości metalicznego sodu Na w szczelnie zamkniętym naczyniu. Metal może rozpuszczać się w soli. Kiedy atomy sodu wnikają w kryształ składający się z kationów Na+ i anionów Cl–, „uzupełniają” sieć krystaliczną, zajmując odpowiednie miejsca i zamieniając się w kationy Na+. Uwolnione elektrony znajdują się w tych miejscach kryształu, w których znajdowałyby się aniony chlorkowe Cl–β. Takie niezwykłe miejsca wewnątrz kryształu, zajęte przez elektrony zamiast jonów, nazywane są „wakantami”.
Kiedy kryształ ostygnie, niektóre wolne miejsca łączą się, co powoduje pojawienie się niebieskiego koloru. Nawiasem mówiąc, gdy niebieski kryształ soli zostanie rozpuszczony w wodzie, powstaje bezbarwny roztwór - zupełnie jak zwykła sól.
Grecki poeta Homer (VIII w. p.n.e.), autor Iliady i Odysei, nazwał sól kuchenną „boską”. W tamtych czasach ceniono go wyżej niż złoto: w końcu, jak mówili
Artykuł z „ Wielka encyklopedia"edytowany przez S.N. Jużakowa, 1904
Sól (sól kuchenna, chlorek sodu), NaCl, związek chemiczny składający się z 39,32 części sodu i 60,68 części chloru, powstaje podczas spalania sodu w chlorze lub podczas rozkładu węglanu sodu (sody) z kwasem solnym (chlorowodorem). Sól kuchenna krystalizuje w postaci bezwodnych kostek zawierających odrobinę ługu macierzystego, w wyniku czego pęka pod wpływem ogrzewania. W temperaturze 10° sól kuchenna krystalizuje w postaci dużych sześciościennych tabletek, które po podgrzaniu rozpadają się na wodę i kostki. Czysta sól nie wilgotnieje w powietrzu, topi się w temperaturze 772°C i odparowuje w temp najwyższa temperatura, szczególnie przy przepływie powietrza; po stwardnieniu krystalizuje w kostkę. Cała jego wartość właściwa wynosi 2,15. W temperaturze wrzenia sól jest nieco lepiej rozpuszczalna niż w zwykłej temperaturze; 100 części wody rozpuszcza się w:
|
Ilości wagowe soli |
% wag. soli w roztworze |
Ciężar właściwy roztworu |
Gram soli na 1 litr |
|
1 część soli rozpuszcza:
|
Części wody |
Roztwór zawierający 26% soli zamarza dopiero w temperaturze -18,43°. Nasycony roztwór wrze pod zwykłym ciśnieniem w temperaturze 109,7°C i zawiera 28,75% soli. Nasycone roztwory soli można zatężyć przez zamrożenie, a woda w niskich temperaturach zostaje uwolniona w postaci lodu. Tworzenie się lodu następuje, gdy najniższa temperatura, im bardziej zamarznięta jest woda i im niższy roztwór, tym mocniejszy roztwór, a lód zawsze zawiera trochę soli. Po rozpuszczeniu soli w wodzie objętość roztworu staje się mniejsza (o 24,5% objętości soli stałej) od objętości obu ciał przed ich połączeniem.
Ciężar właściwy roztworów soli w temperaturze 15°
|
Środek ciężkości |
Środek ciężkości |
Środek ciężkości |
|||
W temperaturze 15° rozpuszcza się alkohol o różnej mocy:
Ekstrakcja soli.
Sól występuje naturalnie rozpuszczona w wodzie oceanów, mórz i słonych jezior (Morze Kaspijskie, Morze Aralskie, Morze Martwe, Utah), w słonych źródłach i rzekach (Karizakha, która wpada do jeziora Elton, Rio ensalado w Chile, woda który zawiera do 32% połączeń chlorków). W stanie stałym występuje w postaci soli kamiennej, soli ściennej oraz na pustyniach. Sól kamienna odgrywa znaczącą rolę w edukacji skorupa Ziemska. W wielu krajach występują ogromne złoża i zapasy czystej soli kamiennej, anhydrytu, dolomitu, margla i soli zawierających gips. Czyste warstwy soli często pokrywane są warstwą gliny solnej, a w wielu miejscach występują jedna na drugiej warstwy czystej soli kamiennej, na przemian z warstwami gliny. Oxenius tłumaczy powstawanie złóż soli kamiennej istnieniem głębokich zatok morskich z w przybliżeniu poziomą cieśniną, która przepuszcza wodę morską tylko w takim stopniu, w jakim woda z powierzchni zatoki może odparować w określonym czasie.
Przy suchym i ciepłym klimacie oraz silnym parowaniu w cieśninie tworzy się stężony, a zatem cięższy roztwór soli, który stale wpływa w głąb zatoki. Z powstałego stężonego roztworu sól uwalnia się w postaci kryształów. Po utworzeniu się w ten sposób złoża soli i pokryciu go z wierzchu bardziej rozpuszczalnymi solami ługu macierzystego, powinien powstać proces okrężny, gdy woda morska wpływa do zatoki od góry w cieśninie, a ług macierzysty wypływa od dołu . Pierwsza, po zmieszaniu ze stężonym roztworem, wytrąca gips i polihalit, a im dłużej ten okres trwa, tym większe będą pokrywające warstwy gipsu lub anhydrytu. Jeżeli w tym okresie zatoka oddzieli się od morza, ług macierzysty wykrystalizuje się na warstwach gipsu i anhydrytu. Niektóre złoża soli (Stasfurt, Kaluets) pokrywają się grubą warstwą soli z wykrystalizowanego ługu macierzystego (Abraumsalze), choć bardzo często są one ponownie zmywane i pozostają po nich jedynie ślady.
Na ryc. Rycina 1 przedstawia profil zagospodarowania dwóch bardzo różnych złóż soli kamiennej; stara dolna warstwa o nieznanej jeszcze grubości, z domieszką innych minerałów: anhydrytu, polihalitu i kizerytu, oddzielona jest od górnej cennymi warstwami soli potasowych, gliny solnej, anhydrytu i gipsu z nowszego złoża. Ta ostatnia w kopalni I osiąga miąższość 60 metrów, jest pokryta gipsem, a warstwa różnobarwnych piaskowców stopniowo klinuje się ku górze i stanowi czysta sól, który jest wydobywany.
W Niemczech występują duże złoża soli, dochodzące do 1500 m miąższości, rozciągające się od Helgolandu po Inowraclav i tworzące złoża Stasfurtu, Erfurtu itp. Ponadto złoża występują w Wirtembergii, Alzacji, Lotaryngii, Salzburgu itp. W Austro-Węgrzech , dostępne są złoża w Tyrolu, Salzkamergut, duże złoża w Wieliczce, Bośni, Stebniku i Zlaninie, Sugatage i Siebenbürgen. Rumunia posiada złoża w Alpach Siedmiogrodzkich. Ponadto w Hiszpanii złoża znajdują się w Katalonii i Kordobie, we Włoszech (Sycylia), w Szwajcarii (Bex), Francji (Meurthe et-Moselle, Jura, Ariens, Bas-Pyrenees), w Anglii (Bleshiere, dzielnica Middler na Tees ). Rosja jest bardzo bogata w złoża soli kamiennej, najważniejsze są złoża złóż briańskich, prowincji jekaterynosławskiej, ochrony iletskiej prowincji Orenburg, złoża Kulpinsky, złoża Nachiczewanu, złoża regionu Kars, prowincji Perm, prowincji Astrachań. i różnych obszarach Syberii.
Sól kamienna występuje niemal we wszystkich utworach (od łupków łyżkowych po osady trzeciorzędowe), zwykle w towarzystwie anhydrytu i gipsu. Wiele złóż wypływa bezpośrednio na powierzchnię ziemi, inne odkrywane są dzięki operacjom wiertniczym. Zagospodarowanie złóż czystej soli kamiennej odbywa się zwykle metodą sztolni, jak pokazano na ryc. 2 i 4, tablice I. Istnieją także różnice pomiędzy wyrobiskami butelkowymi, stosowanymi w Rumunii i na Węgrzech, a wyrobiskami filarowymi, stosowanymi w kopalniach Stassfurt i Briańsk. Rozwój ułatwia fakt, że sól kamienna jest materiałem bardzo trwałym i pozwala na pracę bez zapięć. Sól kamienna jest często całkowicie bezbarwna i łatwo rozpada się na błyszczące kostki lub tworzy żółtawe, czerwonawe i zielonkawo-brązowe krystaliczne masy zawierające tlenek żelaza, glinę, orzęski itp. W tabeli przedstawiono niektóre analizy soli kamiennej z najważniejszych złóż:
|
Chlorek sodu |
Chlorek potasu |
Chlorek wapnia |
Chlorek magnezu |
Siarczan sodu |
Siarczan potasu |
Siarczan wapnia |
Siarczan magnezu |
Substancje nierozpuszczalne |
||
|
Stassfurtu |
||||||||||
|
Stassfurtu |
||||||||||
|
Inowracław |
||||||||||
|
Sumbakowa |
||||||||||
|
Bachmucka |
||||||||||
|
Trwała ondulacja |
||||||||||
|
Trwała ondulacja |
poza tym składniki Sól kamienna zawiera chlorek żelaza, brom, związki jodu i fluoru, amoniak, fosforany, borany itp. Niektóre próbki soli zawierają silnie sprężone gazy (metan, dwutlenek węgla, powietrze), które pod wpływem ogrzewania niszczą kryształy. Sól kamienna sprzedawana jest w postaci bloków, kawałków lub proszku i jest bezpośrednio wykorzystywana. W miejscach występowania złóż soli i w ogóle w przyrodzie, oprócz soli kamiennej, występują liczne solanki i źródła solne, które wypływają na powierzchnię ziemi lub wypełniają specjalnie zbudowane w tym celu kopalnie, skąd wypompowywane są solanki. Źródła takie są bardzo rzadko nasycone i zawierają od 2% do 24% soli kuchennej z domieszką soli siarczanowych i chlorkowych innych metali, żelaza, krzemionki itp. Ponadto wody źródeł zawierają: jodki, bromki, związki rubid, cez, talia, materia organiczna, kwas węglowy itp. Silne solanki odparowuje się, słabe solanki zatęża się przez zamrożenie (Ochock, Irkuck) lub przez odparowanie w zwykłej temperaturze). Słabe solanki są najpierw przetwarzane w chłodniach kominowych (patrz tabela), oczyszczane, doprowadzane do stężenia 15-20%, a następnie odparowywane. Do pracy z wieżami chłodniczymi lepiej jest wykorzystać najcieplejszą porę roku, w Niemczech jest 200-260 dni w roku.
Wystarczająco stężona i oczyszczona solanka po zagotowaniu jest skraplana przez ogrzewanie lub odparowanie w fabrykach soli (patrz tabela), gdzie otrzymuje się drobno lub grubokrystaliczną sól. Pierwsza składa się zwykle z pustej, zagłębionej piramidy o schodkowych bokach składającej się z pojedynczych sześcianów. Kadzie lub zbiorniki odparowujące są zwykle płaskie, wykonane z żelaza i ogrzewane po prostu węglem lub parą lub poprzez uwalnianie gorących gazów na powierzchnię roztworu. Wielkość kotłów waha się od 45 do 335 metrów kwadratowych. m. Na początku operacji solankę mocno gotuje się, usuwa się powstałą pianę i szlam i dodaje nową solankę, aż roztwór zostanie nasycony przez gotowanie, pozostawia się do wyklarowania i przeniesienia do innych kadzi, w których zaczyna się sól kształtować. Powstała sól ma zwykle kolor biały, ale przy ciągłej pracy ulega zabrudzeniu, aby tego uniknąć, należy wypuścić ług macierzysty, a następnie sól suszy się w specjalnych pomieszczeniach lub w żelaznych kotłach ogrzewanych od dołu (patrz tabela). Najlepszą sól kuchenną odwirowuje się i suszy w ocynowanych naczyniach miedzianych przez przedmuch gorącego powietrza.
W Anglii gorącą, skoncentrowaną solankę wlewa się do drewnianych form, w których twardnieje w bloki, które stopniowo suszy się w suszarniach.
Wody morskie w 1 metrze sześciennym. metr zawiera średnio 26-31 kg. chlorek sodu, 3-7 kg. chlorek magnezu, 0,5-6 kg. siarczan magnezu, 0,14-6 kg. siarczan wapna, 0,0111 kg. chlorek potasu. W sezonie gorącym wiele słonych jezior jest obleganych duże ilości sole w postaci łatwo wydobywalnych klastrów (Jezioro Elton, Utakh, Kara-Bugaz). Na południu Rosji naturalne zatoki i ujścia rzek służą do odparowywania wody morskiej, aż utworzy się warstwa soli o grubości od 2 do 30 cm. W gorącym klimacie na wybrzeżach z wody morskiej wydobywa się duże ilości soli, na przykład w Portugalii, Hiszpanii i Francji na wybrzeżu Morze Śródziemne(Langwedocja) i Ocean Atlantycki we Włoszech, Dalmacji, Istrii i Stanach Zjednoczonych. W tym celu budują wyłożone gliną ogrodzenia o dużej powierzchni parowania, tworząc system płaskich basenów napełnianych wodą morską za pomocą pomp lub odgradzając zatoki. Najpierw osadza się w nich tlenek żelaza, następnie gips, a następnie krystalizuje się sól kuchenna. Sól, która wytrąca się jako pierwsza, jest najczystsza i jest używana na stół. Pod koniec lata baseny krystalizacyjne są suszone, sól jest gromadzona i wystawiana na działanie wilgoci z powietrza, która oczyszcza ją z ługu macierzystego i jeśli chcą uzyskać ją w całkowicie czystej postaci, poddaje się ją rekrystalizacji. Zwykle wynikiem jest 80-85% soli zawartej w wodzie morskiej. Przy większym odparowaniu otrzymuje się mieszaninę chlorku sodu i siarczanu magnezu, doprowadzając ją do składu 2NaCl + MgS0 4, rozpuszczając w wodzie i schładzając maszynami do lodu do -6°, sól Glaubera Na2SO4 zmusza się do krystalizacji. Ostatni ług macierzysty zimą daje gorzką sól MgSO 4. W wyniku dalszego odparowania w lecie otrzymuje się sól kuchenną, siarczan magnezu i kainit, a pozostały roztwór przetwarza się na brom.
Sól kuchenna prawie zawsze zawiera małe ilości siarczanowe i chlorkowe związki sodu, wapnia, magnezu i potasu, rzadziej i jedynie śladowe ilości tlenku żelaza i bromkowe związki potasu i sodu. Ze względu na treść chlorek wapnia i magnez, staje się wilgotny w powietrzu. Zawartość wody nie powinna przekraczać 6%.
Sól kuchenna jest bardzo powszechna w organizmach zwierzęcych oraz w płynach tych ostatnich w przeważających ilościach w porównaniu do innych minerały. Jego zawartość we krwi jest zwykle stała i nie zależy od sposobu odżywiania. Szczególnie bogate są w niego ślina, sok żołądkowy, śluz, ropa i wysięki zapalne. Cała sól kuchenna pochodzi z pożywienia i opuszcza organizm wraz z moczem, odchodami, ustami, nosem i potem. Normalna osoba waży 64 kg. wydala z moczem 11,9 gramów soli kuchennej dziennie, przekazując część tej soli innym związkom w organizmie. Sól działa na organizm przede wszystkim poprzez wpływ na procesy dyfuzyjne główny czynnik przepływ cieczy i służy jako źródło powstawania kwasu solnego sok żołądkowy. Dodawanie go do pożywienia powoduje wzmożenie trawienia, a instynkt ludzki rozpoznaje jego dodatek jako coś koniecznego, co jest rozwinięte u wszystkich ludzi przez cały czas.
Warto zauważyć, że sól kuchenna jest niezbędna zwierzętom jedzącym pokarmy roślinne i nie jedzącym mięsa. Z strona chemiczna sól kuchenna w organizmie wytwarza kwas solny w soku żołądkowym; możliwe, że jest to ściśle związane z powstawaniem komórek. Obliczana ilość soli kuchennej potrzebnej rocznie na osobę wynosi 7,5 kg. O działaniu soli kuchennej w królestwo roślin niewiele wiadomo na pewno, ale jego nadmiar szkodzi nasionom i tworzy jałową glebę. W niektórych przypadkach jest przydatny, ponieważ przekształca sole wapnia, fosforany itp., Które są potrzebne roślinom, w rozpuszczalne związki, które są wykorzystywane do nawozów.
W technologii sól kuchenna stosowana jest do wytwarzania sody, chloru, amoniaku, w metalurgii do chlorowania prażenia rud srebra i ubogiej miedzi, do przygotowania aluminium, do produkcji sodu, do mydła, do przygotowania tytoniu , wody mineralne, wanny, do glazurowania wyrobów glinianych, do konserwacji drewna statków i podkładów, do solenia ryb, mięsa, masła. W rolnictwo Sól kuchenna wykorzystywana jest do nawozów i paszy dla zwierząt gospodarskich.
Ekstrakcja soli dla ostatnie lata w różnych krajach przedstawiono w tabeli w milionach pudów:
|
1891 |
1894 |
1898 |
1899 |
1900 |
|
|
Wielka Brytania |
|||||
|
Niemcy |
|||||
|
Stany Zjednoczone |
|||||
W ciągu 10 lat produkcję soli w Rosji przedstawia poniższa tabela w pudach:
|
Roku |
Kamień |
Samoosadowy |
Odparowanie |
Całkowity |
Patrz Karsten, „Salinonkunde” (Berl., 1846-47, 2 tomy); Kerl, „Salinenkunde”; Hehna, „Das Salz” (1873); Moeller, „Das Salinen in seiner kulturgeschichtlichen und naturwissenschaftlichen Bedeutung” (1874); Schwarz, „Vorkommen und Bildung des Steinsalzes” (Halle, 1885); Wagner, „Technologia chemiczna”; Dammer, Chemische Technologie.
Artykuł „Sól” z „Wielkiej Encyklopedii” wyd. S.N. Yuzhakova, St. Petersburg, „Oświecenie”, 1904, tom 17, s. 654-657
Podobne artykuły
-
Wakacje to wspaniały czas!
Wielcy o poezji: Poezja jest jak malarstwo: niektóre prace zafascynują Cię bardziej, jeśli przyjrzysz się im bliżej, inne, jeśli odsuniesz się dalej. Małe, urocze wierszyki bardziej drażnią nerwy niż skrzypienie niepomalowanych...
-
Pancernik „Zwycięstwo” – Legendarne żaglowce
Odkąd człowiek nauczył się podróżować drogą morską, państwa morskie zaczęły szukać bogactwa i władzy poza swoim terytorium. W XVIII wieku Hiszpania, Portugalia, Francja, Holandia i Wielka Brytania utworzyły rozległe kolonie...
-
Zespół poszukiwawczo-ratowniczy Bajkału Ministerstwa Sytuacji Nadzwyczajnych Rosji
Dziennikarka GorodIrkutsk.ru Julia Krupeneva odwiedziła bazę zespołu poszukiwawczo-ratowniczego nad Bajkałem, zlokalizowaną we wsi Nikola, i zobaczyła, gdzie i jak zostają ratownikami.Julia Krupeneva odwiedziła bazę nad Bajkałem...
-
Uniwersytety Ministerstwa Sytuacji Nadzwyczajnych (instytuty i uniwersytety)
Akademia Państwowej Straży Pożarnej Ministerstwa Sytuacji Nadzwyczajnych Rosji zaprasza do studiowania młodych ludzi, którzy są gotowi poświęcić swoje życie szczytnej sprawie, jaką jest ochrona życia, zdrowia i wartości materialnych ludzi przed jedną z najpoważniejszych katastrof na świecie Ziemia -...
-
Oświadczenia o dochodach urzędników państwowych Federacji Rosyjskiej
Posłowie byli właścicielami kościołów i toalet publicznych, a jedna z członkiń rządu otrzymała od matki pół miliarda rubli. Rosyjscy urzędnicy opublikowali deklaracje dochodów za 2017 rok. Na liście nie było ludzi biednych....
-
Paweł Iwanowicz Miszczenko Na obrzeżach imperium
Paweł Iwanowicz Miszczenko (22 stycznia (18530122), Temir-Khan-Shura - Temir-Khan-Shura) – rosyjski przywódca wojskowy i mąż stanu, uczestnik kampanii turkiestańskich, generalny gubernator Turkiestanu, dowódca Turkiestanskiego Okręgu Wojskowego...
