Właściwości chemiczne i fizyczne kwasu mlekowego. Podręcznik chemiczny kwasu mlekowego
Kwas mlekowy
KWAS MLEKOWY(kwas 2-hydroksypropionowy) CH3CH(OH)COOH, mol. m. 90,1; bezbarwny kryształy. Znane są kwas D(+)-mlekowy, D(-)-mlekowy (mięso-mleko) i kwas racemiczny. Kwas mlekowy to kwas mlekowy do fermentacji. Dla kwasu D, L- i D-mlekowego t.t. odpowiednio 18°C i 53°C; t. bela odpowiednio 85°C/1 mmHg i 103°C/2mmHg; dla kwasu D-mlekowego [a] D 20 -2,26 (stężenie 1,24% w wodzie). Dla kwasu D,L-mlekowego DH 0 arr - 682,45 kJ/mol; DH 0 pl 11,35 kJ/mol; DH isp 110,95kJ/mol (25°C), 65,73 kJ/mol (150°C). Dla spalania kwasu L-mlekowego DH 0 - 1344,8 kJ/mol; DH 0 obp -694,54 kJ/mol; DH 0 pl 16,87 kJ/mol.
Ze względu na dużą higroskopijność kwasu mlekowego najczęściej stosuje się jego koncentrat. roztwory wodne, syropowate, bezbarwne. bezwonne ciecze. Dla wodnych roztworów kwasu mlekowego d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 mPa. s (25 0 C) odpowiednio dla roztworów 45,48 i 85,32%; g 46,0. 10 -3 N/m (25°C) dla 1 M roztworu; e 22 (17°C). Roztwór kwasu mlekowego w wodzie, etanolu, ubogo w benzenie, chloroformie i innych chlorowcowanych węglowodorach; рK а 3,862 (25°С); pH roztworów wodnych 1,23 (37,3%), 0,2 (84,0%).
Utlenianiu kwasu mlekowego zwykle towarzyszy rozkład. W przypadku wystawienia na działanie powietrza HNO 3 lub O 2. Cu lub Fe tworzą HCOOH, CH3COOH, (COOH)2, CH3CHO, CO2 i kwas pirogronowy. Redukcja kwasu mlekowego HI prowadzi do kwasu propionowego i następuje odbudowa. Ponownie czarne - do glikolu propylenowego.
Kwas mlekowy pod wpływem ogrzewania odwadnia się do kwasu akrylowego. z HBr tworzy po interakcji kwas 2-bromopropionowy. Sole Ca z chlorkiem PCl5 lub SOCl2-2-chloropropionylu. W obecności górnik Zatem samoestryfikacja kwasu mlekowego następuje z utworzeniem laktonu typu I, a także liniowych poliestrów. Podczas interakcji kwas mlekowy z alkoholami tworzą hydroksykwasy RCH 2 CH(OH)COOH i po interakcji. sole kwasu mlekowego zetery alkoholi. Nazywa się sole i estry kwasu mlekowego. mleczany (patrz tabela).
Kwas mlekowy powstaje w wyniku fermentacji mlekowej (podczas zakwaszania mleka, kiszonej kapusty, marynowania warzyw, serów dojrzewających, kiszenia paszy); Kwas D-mlekowy występuje w tkankach zwierząt, roślin i mikroorganizmów.
W przemyśle kwas mlekowy otrzymuje się przez hydrolizę kwasu 2-chloropropionowego i jego soli (100°C) lub laktonitrylu CH3CH(OH)CN (100°C, H2SO4) w następujący sposób. powstawanie estrów, których izolacja i hydroliza prowadzi do produktu wysokiej jakości. Znane są inne metody wytwarzania kwasu mlekowego: utlenianie propylenu tlenkami azotu (15-20°C), a następnie. traktowanie H 2 SO 4, interakcja. CH3CHO z CO (200°C, 20 MPa).
WŁAŚCIWOŚCI NIEKTÓRYCH MLECZANÓW

M kwas mlekowy jest stosowany w żywności. przemyśle, przy barwieniu zaprawowym, w garbarstwie, w fermentowniach jako środek bakteriobójczy, do otrzymywania leków. Środa, plastyfikatory. Mleczany etylu i butylu stosuje się jako roztwory eterów celulozy, olejów suszących i roślin. obrazy olejne; Mleczan butylu jest także rozpuszczalnikiem niektórych produktów syntetycznych. polimery.
Hydroksykwasy (kwasy alkoholowe) to pochodne kwasów karboksylowych zawierające jedną, dwie lub więcej grup hydroksylowych w rodniku połączonym z karboksylem.
W zależności od liczby grup karboksylowych hydroksykwasy dzielą się na jednozasadowe, dwuzasadowe itp.; w zależności od Łączna grupy hydroksylowe, hydroksykwasy dzielą się na jedno- i wieloatomowe.
W zależności od natury rodnika hydroksykwasy są nasycone i nienasycone, acykliczne, cykliczne lub aromatyczne.
W hydroksykwasach występują następujące typy izomerii:
strukturalny(izomeria łańcucha rodnikowego, izomeria względnych pozycji karboksylu i hydroksylu);
optyczny(lustro) ze względu na obecność asymetrycznych atomów węgla.
Hydroksykwasy nazywane są nazwą kwasu z dodatkiem „oksy” lub „dioksy” itp. Powszechnie stosowana jest również trywialna nomenklatura.
HO–CH2–COOH
glikolowy (hydroksyoctowy)
mleko (α-hydroksypropionowe)
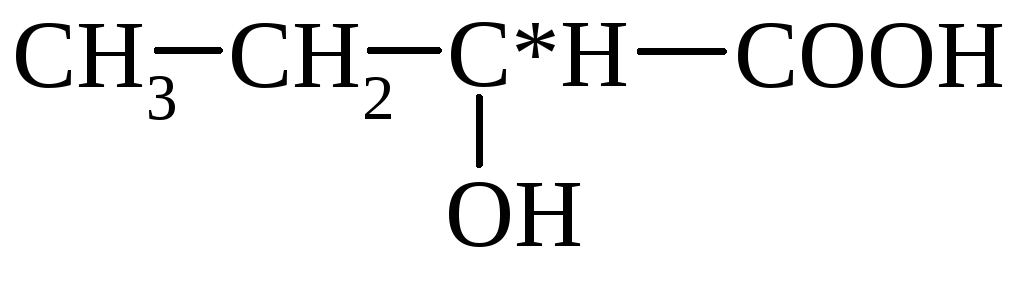

α-hydroksymasłowy β-hydroksymasłowy
(2-hydroksybutan) (3-hydroksybutan)
Właściwości fizyczne. Niższe hydroksykwasy to najczęściej gęste, syropowate substancje. Hydroksykwasy mieszają się z wodą w dowolnym stosunku, a wraz ze wzrostem masy cząsteczkowej rozpuszczalność maleje.
Właściwości chemiczne.
1. Właściwości kwasu– hydroksykwasy dają wszystkie reakcje charakterystyczne dla karboksylu: tworzenie soli, estrów, amidów, halogenków kwasowych itp. Kwasy hydroksylowe są silniejszymi elektrolitami niż odpowiadające im kwasy karboksylowe (efekt grupy hydroksylowej).

2. Właściwości alkoholu– reakcje podstawienia wodoru grupy hydroksylowej, tworzenia eterów i estrów, zastąpienia –OH halogenem, odwodnienie wewnątrzcząsteczkowe, utlenianie.
glioksal glikolu chlorooctowego
kwas kwas kwas
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
ester kwasu glikolowego i alkoholu metylowego
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
eter metylowo-glikolowy
kwas alkoholowy kwas metoksyoctowy
(pełna transmisja)
3. Związek hydroksykwasów z ogrzewaniem - po podgrzaniu α-hydroksykwasy oddzielają się od wody, tworząc cykliczny ester, zbudowany z dwóch cząsteczek α-hydroksykwasów:

laktyd kwasu α-hydroksypropionowego
β-Hydroksykwasy w tych samych warunkach łatwo tracą wodę, tworząc kwasy nienasycone.
HO–CH 2 –CH 2 –COOH 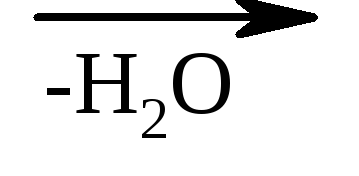 CH2 =CH–COOH
CH2 =CH–COOH
kwas β-hydroksypropionowy akrylowy
γ-hydroksykwasy mogą również tracić cząsteczkę wody, tworząc wewnątrzcząsteczkowe estry - laktony.

HO–CH 2 –CH 2 –CH 2 –COOH
Kwas γ-hydroksymasłowy
γ-butyrolakton
Niektóre hydroksykwasy otrzymywane są z produktów naturalnych. W ten sposób kwas mlekowy otrzymuje się w wyniku fermentacji kwasu mlekowego substancji cukrowych. Syntetyczne metody wytwarzania opierają się na następujących reakcjach:
1) Cl–CH2–COOH + HOH  HO–CH2–COOH;
HO–CH2–COOH;
glikol monochlorooctowy
kwaśny kwas
2) CH2 =CH–COOH + HOH  HO–CH 2 –CH 2 –COOH.
HO–CH 2 –CH 2 –COOH.
kwas akrylowy kwas β-hydroksypropionowy
Przedstawiciele hydroksykwasów.
Glikolowy Kwas (hydroksyoctowy) to substancja krystaliczna występująca w niedojrzałych owocach, soku z buraków, rzepie i innych roślinach. W przemyśle otrzymywany jest poprzez redukcję kwasu szczawiowego. Stosowany do barwienia (druk perkalowy).
Kwas mlekowy (α-hydroksypropionowy) – gęsta ciekła lub topliwa masa krystaliczna. Kwas mlekowy powstaje podczas fermentacji cukrów pod wpływem bakterii kwasu mlekowego. Zawarty w fermentowanych produktach mlecznych, kiszonej kapuście, kiszonkach. Stosowany w zaciekłym farbowaniu, garbarstwie i medycynie.
Kwas mięsno-mlekowy występuje w soku mięśniowym zwierząt i ekstraktach mięsnych.
Dwuatomowy kwas glicerynowy uczestniczy w procesach życiowych roślin i zwierząt.

Kwas askorbinowy (witamina C) to krystaliczna substancja występująca w świeżych owocach, cytrynach, czarnych porzeczkach, świeże warzywa- kapusta, fasola. Syntetycznie witaminę C otrzymuje się przez utlenianie sorbitolu w postaci alkoholu wielowodorotlenowego.
 kwas α-askorbinowy
kwas α-askorbinowy
Kwas askorbinowy łatwo ulega rozkładowi pod wpływem tlenu atmosferycznego, zwłaszcza po podgrzaniu
Acykliczne dwa-i trójzasadowe hydroksykwasy.
Jabłko kwas (hydroksybursztynowy) (HOOC–CHOH–CH 2 –COOH) jest substancją krystaliczną, dobrze rozpuszczalną w wodzie; stosowany w medycynie, występuje w niedojrzałej jarzębiny, berberysie, rabarbarze, soku winogronowym, winie.
Wino Kwas (winowy, dihydroksybursztynowy) (HOOC–*CHOH–*CHOH–COOH) ma 2 asymetryczne atomy węgla, a zatem ma 4 izomery optyczne. Tworzy kwaśny sole potasowe, które są słabo rozpuszczalne w wodzie i wytrącają się. W winie można zaobserwować kryształki soli (kamień nazębny). Mieszana sól potasowo-sodowa nazywana jest solą Rochelle. Sole kwasu winowego nazywane są winianami.


krem z kamienia nazębnego, sól seignette
Kwas winowy występuje powszechnie w roślinach (jarzębina, winogrona itp.).
Kwas cytrynowy
 występuje w owocach cytrusowych. W przemyśle otrzymywany jest z owoców cytryny poprzez utlenianie cukrów grzyby pleśniowe, podczas obróbki igieł świerkowych.
występuje w owocach cytrusowych. W przemyśle otrzymywany jest z owoców cytryny poprzez utlenianie cukrów grzyby pleśniowe, podczas obróbki igieł świerkowych.
Kwas cytrynowy jest biologicznie ważnym związkiem biorącym udział w metabolizmie. Stosowany jest w medycynie, przemyśle spożywczym i tekstylnym jako dodatek do barwników.
Cykliczne jednozasadowe wielowodorotlenowe kwasy hydroksylowe są częścią kwasów żółciowych i innych fizjologicznie ważnych związków; na przykład auksyna wspomaga wzrost roślin.
Aromatyczne hydroksykwasy dzielą się na kwasy fenolowe i aromatyczne kwasy tłuszczowe zawierające grupę hydroksylową w łańcuchu bocznym.


kwas o-hydroksybenzoesowy migdałowy
(kwas salicylowy
Kwas salicylowy występuje w niektórych roślinach w postaci wolnej (nagietek), ale częściej w postaci estrów. W przemyśle otrzymuje się go przez ogrzewanie fenolanu sodu z dwutlenkiem węgla. Stosowany jako środek dezynfekujący i do syntezy barwników. Jako leki stosuje się wiele pochodnych kwasu salicylowego (aspiryna, salol).


salol aspiryny (ester fenylowy
(kwas acetylosalicylowy) kwas salicylowy)
Kwas galusowy (3,4,5-trioksybenzoesowy).

Zawarty w liściach herbaty, korze dębu i drzewie granatu. Przemysłowo otrzymuje się go z garbników poprzez gotowanie z rozcieńczonymi kwasami. Używa się go do produkcji atramentu, w fotografii i medycynie jako środek antyseptyczny. Kwas galusowy i jego pochodne są dla wielu powszechnie stosowane jako środki konserwujące produkty żywieniowe(tłuszcze, wysokogatunkowe mydła, nabiał), ma właściwości garbujące i ma szczególne znaczenie przy produkcji skór oraz przy barwieniu zaprawowym.
Kwas migdałowy odnosi się do aromatycznych kwasów tłuszczowych (C 6 H 5 – CH (OH) – COOH), występujących w amigdalinie, musztardzie, czarnym bzie itp.
Garbniki są często pochodnymi fenoli wielowodorotlenowych. Są częścią roślin i otrzymywane są z ekstraktów z kory, drewna, liści, korzeni, owoców lub narośli (galasów).
Garbniki to najważniejsze garbniki. To mieszanka różnych związki chemiczne, z których głównymi są estry kwasu galusowego i digalowego oraz glukozy lub alkoholi wielowodorotlenowych.

Kwas Dg-digallowy

kwas m-digallowy
Tanina wykazuje właściwości fenoli i estrów. Z roztworem chlorku żelaza tworzy czarny złożony związek. Garbniki są szeroko stosowane jako ekstrakty garbnikowe, zaprawy do barwienia tkanin bawełnianych, jako środki ściągające w medycynie (posiadają właściwości bakteriobójcze i hemostatyczne) oraz są konserwantami.
Lipidy obejmują substancje organiczne, z których wiele to estry kwasów tłuszczowych o dużej masie cząsteczkowej i alkohole wielowodorotlenowe - tłuszcze, fosfatydy, woski, steroidy, kwasy tłuszczowe o dużej masie cząsteczkowej itp.
Lipidy występują głównie w nasionach roślin, jądrach orzechów oraz w organizmach zwierzęcych – w tkance tłuszczowej i nerwowej, zwłaszcza w mózgu zwierząt i ludzi.
Tłuszcze naturalne to mieszaniny estrów alkoholu trójwodorotlenowego, gliceryny i wyższych kwasów karboksylowych, tj. mieszaniny glicerydów tych kwasów.
O 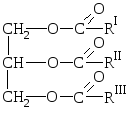 ogólna formuła tłuszczu:
ogólna formuła tłuszczu:
gdzie R I R II R III oznaczają rodniki węglowodorowe wyższych kwasów tłuszczowych normalna struktura z parzystą liczbą atomów węgla. Tłuszcze mogą zawierać pozostałości zarówno kwasów nasyconych, jak i nienasyconych.
Kwasy nasycone:
C 15 H 31 COOH – palmitynowy;
C 17 H 35 COOH – stearynowy;
C 3 H 7 COOH – olej (zawarty w masło) itd.
Kwasy nienasycone:
C 17 H 33 COOH – oleinowy;
C 17 H 31 COOH – linolowy;
C 17 H 29 COOH – linolenowy itp.
Tłuszcze pozyskiwane są z naturalnych źródeł pochodzenia zwierzęcego i roślinnego.
Właściwości fizyczne tłuszcze wynikają z ich kwaśnego składu. Tłuszcze zawierające głównie pozostałości kwasów nasyconych to substancje stałe lub o konsystencji pasty (tłuszcz jagnięcy, wołowy itp.). Tłuszcze zawierające głównie pozostałości kwasów nienasyconych mają płynna konsystencja w temperaturze pokojowej i nazywane są olejami. Tłuszcze nie rozpuszczają się w wodzie, ale dobrze rozpuszczają się w rozpuszczalnikach organicznych: eterze, benzenie, chloroformie itp.
Właściwości chemiczne. Jak wszystkie estry, tłuszcze ulegają hydrolizie. Hydroliza może zachodzić w środowisku kwaśnym, obojętnym lub zasadowym.
1. Hydroliza kwasowa.

Numer katalogowy kwasu mlekowego: CAS 50-21-5
Opis kwasu mlekowego:
Prawie przezroczysta, lekko żółtawa, higroskopijna, syropowata ciecz o lekko żółtawym zabarwieniu kwaśny zapach, przypominający zapach zsiadłego mleka. Rozpuszczalny w wodzie, etanolu, słabo rozpuszczalny w benzenie, chloroformie i innych węglowodorach halogenowanych. Istnieją różne optycznie czynne izomery D i L. A także optycznie nieaktywna mieszanina D i L. Ta ostatnia otrzymywana jest w drodze syntezy chemicznej i formy aktywne z bakteryjnym (metoda enzymatyczna) W organizmie człowieka w cyklu Krepsa bierze udział optycznie czynna forma L, dlatego zaleca się stosowanie go jako dodatku (Kwas mlekowy, E270), w innych gałęziach przemysłu nie ma to wpływu odgrywać szczególną rolę.
Globalna nazwa Kwas mlekowy nie zakorzeniła się w Rosji, ale nazwę jego soli mleczanowych można spotkać wszędzie, znacznie częściej niż kwas mlekowy wapniowy, tniemy mleczan wapnia.
Specyfikacja dla kwasu mlekowego 80%.
Temperatura wrzenia (roztwór 100%) 122 °C (115 mm Hg)
Ciężar właściwy (20 °C) 1,22
Rozpuszczalność w wodzie Całkowicie rozpuszczalny
Gęstość (w 20°C) 1,18-1,20 g/ml
Metale ciężkie, nie więcej niż 0,001%
Zawartość żelaza, nie więcej niż 0,001%
Zawartość arsenu, nie więcej niż 0,0001%
Zawartość chlorków nie więcej niż 0,002% (właściwie 0,0015%)
Zawartość siarczanów nie więcej niż 0,01% (właściwie 0,004%)
Pozostałość po kalcynacji nie więcej niż 0,1% (właściwie 0,06%)
Producent: Chiny
Uszczelka: Beczki 25 kg lub kostki 1200 kg
Podstawowe właściwości fizyczne kwasu mlekowego:
Temperatura topnienia: 17°C Dla nieaktywnych optycznie (racematycznych),
25-26°C postać optycznie czynna + lub -
(różnice temperatur topnienia pozwalają jakościowo i szybko odróżnić droższe formy optycznie aktywne od tańszych nieaktywnych!!)
Gęstość względna(woda = 1): 1,2
Rozpuszczalność w wodzie: mieszalny
Masa cząsteczkowa: 90,08 g/mol
Temperatura zapłonu: 110°C c.c.
Współczynnik podziału oktanol/woda jako log Pow: -0,6
Niebezpieczeństwo wybuchu i pożaru:
Wspomaga spalanie przy normalne warunki. samozapłon jest mało prawdopodobnyUnikaj otwartego ognia i palenia.
Gaszenie: proszkiem, pianą alkoholoodporną, wodą rozpyloną,
dwutlenek węgla.
Stabilność chemiczna: Stabilny o godz normalne temperatury i ciśnienie.
Warunki, których należy unikać: Tworzenie się pyłu, nadmierne ciepło.
Niekompatybilność z innymi materiałami: Silne utleniacze, kwasy mineralne.
Niebezpieczne produkty rozkładu: Tlenki azotu, tlenek węgla, dwutlenek węgla, pary
cyjanek.
Niebezpieczna polimeryzacja: Nie zaznaczone.
Zagrożenie dla ludzi:
Drogi wnikania do organizmu: Substancja może wchłaniać się do organizmu poprzez wdychanie aerozolu i przez usta.
Przy krótkotrwałym narażeniu na stężenia przekraczające MPC: Substancja działa(ją) drażniąco na skórę i Drogi oddechowe, a także ma działanie żrące
wpływ na oczy. Działa żrąco w przypadku połknięcia.
W przypadku kontaktu z oczami: Zaczerwienienie. Ból. Poważne, głębokie oparzenia. Okulary ochronne-maska lub
maska ochronna. Najpierw spłucz duża ilość woda na kilka
minut (usuń szkła kontaktowe, jeśli nie jest to trudne), to udaj się do lekarza.
Standardy obszaru roboczego:
TLV (amerykański TLV) nie został ustalony.
Rakotwórczość: Nie wymieniony przez ACGIH, IARC, NTP ani CA Prop 65.
Epidemiologia: Brak informacji.
Tetratogenność: Brak informacji.
Efekty reprodukcyjne: Brak informacji.
Mutagenność: brak informacji
Neurotoksyczność: Brak informacji.
Eksperymenty na zwierzętach wykazały:
LD50/LC50:
Test Draize’a, królik, oczy: 100 mg Ciężki;
Test Draize’a, królik, skóra: 500 mg/24H Łagodny;
Wdychanie, szczur: LC50 = >26 mg/m(cc)/1H;
Doustnie, mysz: LD50 = 1940 mg/kg;
Doustnie, szczur: LD50 = 1700 mg/kg;
Skóra, królik: LD50 = >10 g/kg;
Uwaga. Podano informację o koncentracie substancji, w małe ilości i stężenia kwasu mlekowego, zgodnie z dostępnymi danymi ten moment dane nieszkodliwe!
Kwas mlekowy(kwas 2-hydroksypropionowy) CH3CH(OH)COOH, masa cząsteczkowa 90,1; bezbarwny. Znane są kwasy L(+)-mlekowy, D(–)-mlekowy (mięsno-mlekowy) i racemiczny kwas mlekowy powstający podczas fermentacji. W przypadku kwasu D, L i D-mlekowego temperatura topnienia odpowiada 18 ° C i 53 ° C; t. bela odpowiednio 85°C/1 mmHg i 103°C/2mmHg; dla kwasu D-mlekowego [α] D 20 -2,26 (stężenie 1,24% w . Dla kwasu D,L-mlekowego D H 0 próbka - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H isp 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Dla kwasu L-mlekowego D H 0 spalanie - 1344,8 kJ/mol; D H 0 obp -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
Ze względu na dużą higroskopijność kwasu mlekowego najczęściej stosuje się jego stężone roztwory wodne – syropowate, bezbarwne, bezwonne. Dla roztwory wodne kwas mlekowy D 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 mPa. s (25 0 C) odpowiednio dla roztworów 45,48 i 85,32%; g 46,0. 10 -3 N/m (25°C) dla 1 M roztworu; e 22 (17°C). Kwas mlekowy jest rozpuszczalny w innych chlorowcowęglowodorach, ale słabo w nich rozpuszczalny; R Ka 3,862 (25°C); pH roztworów wodnych 1,23 (37,3%), 0,2 (84,0%).
Kwas mlekowy odwadnia się do kwasu akrylowego, po podgrzaniu z HBr tworzy kwas 2-bromopropionowy, gdy sól Ca reaguje z chlorkiem PCl 5 lub SOCl 2-2-chloropropionylu. W obecności kwasów mineralnych następuje autoestryfikacja kwasu mlekowego z utworzeniem wzoru I, a także liniowych poliestrów. Kiedy kwas mlekowy reaguje, powstają hydroksykwasy RCH 2 CH(OH)COOH, a gdy kwas mlekowy reaguje z alkoholami, tworzą się estry. Sole i estry kwasu mlekowego nazywane są mleczanami (patrz tabela).
kwas mlekowy powstaje w wyniku działania kwasu mlekowego (podczas zakwaszania mleka, kiszonej kapusty, marynowania warzyw, serów dojrzewających, kiszenia paszy); Kwas D-mlekowy występuje w tkankach zwierząt, roślin, a także w mikroorganizmach.
W przemyśle kwas mlekowy wytwarza się z kwasu 2-chloropropionowego i jego (100°C) lub laktonitrylu CH3CH(OH)CN (100°C, H2SO4) z późniejszym utworzeniem estrów, izolacją i hydrolizą co prowadzi do uzyskania produktu wysokiej jakości. Znane są inne metody wytwarzania kwasu mlekowego: utlenianie propylenu tlenkami azotu (15-20°C), a następnie obróbka H2SO4, oddziaływanie CH3CHO z CO (200°C, 20 MPa).
WŁAŚCIWOŚCI NIEKTÓRYCH MLECZANÓW

stosuje się kwas mlekowy Przemysł spożywczy, w zaciernym barwieniu, w garbarstwie, w fermentowniach jak środek bakteriobójczy, za zdobycie leki, plastyfikatory. Mleczany etylu i butylu stosuje się jako rozpuszczalniki eterów celulozy, olejów schnących, oleje roślinne; mleczan butylu – także jako rozpuszczalnik niektórych polimerów syntetycznych.
Światowa produkcja kwasu mlekowego wynosi 40 tysięcy ton (1983).
Oświetlony.: Holten C.H., Kwas mlekowy. Właściwości i chemia. Kwasy mlekowe i pochodne, Weisheim, 1971. Yu. A. Treger.
Wybierz pierwszą literę w tytule artykułu:
Kwas mlekowy (mleczan)- Kwas α-hydroksypropionowy (2-hydroksypropanowy).
- t pl 25-26 °C postać optycznie czynna (+)- lub (-).
- temperatura topnienia 18°C. Postać racemiczna.
- Wzór chemiczny: CH3CH(OH)COOH
- Wzór racemiczny: C 3 H 6 O 3

Kwas mlekowy powstaje, gdy fermentacja kwasu mlekowego cukry, w szczególności zawarte w kwaśnym mleku, podczas fermentacji wina i piwa. Znajduje zastosowanie zarówno w przemyśle chemicznym, jak i spożywczym - jako środek konserwujący. W organizmie człowieka podczas rozkładu glukozy powstaje kwas mlekowy (mleczan).
Czy istnieje różnica między kwasem mlekowym a mleczanem? NIE. W chemii organicznej często nazywany jest kwasem mlekowym, w biochemii mleczanem.
Mleczan chyba otacza najwięcej duża liczba różne mity, większość z nich nie są prawdą. I chociaż w języku rosyjskim jest wystarczająco dużo wiarygodnych materiałów na temat mleczanu, wielu sportowców amatorów (i niektórych profesjonalistów) uparcie nadal wierzy i powtarza mity ubiegłego wieku.
Przyjrzyjmy się krótko i zwięźle podstawowym faktom na temat mleczanu.
Mleczan powstaje zawsze podczas produkcji energii w organizmie.
Główną drogą przedostawania się energii do komórek jest rozkład glukozy. Cząsteczka glukozy przechodzi serię 10 kolejnych reakcji, w wyniku których powstaje pirogronian w procesie zwanym glikolizą. Następnie jedna część pirogronianu jest częściowo utleniana i przekształcana w dwutlenek węgla i wodę. Pozostała część ulega przemianie do mleczanu pod kontrolą enzymu dehydrogenazy mleczanowej.
Ta reakcja jest odwracalna.

Część mleczanu wykorzystywana jest do syntezy energii.
Około 15 do 20 procent całkowitego mleczanu przekształca się w glikogen w procesie glukoneogenezy.
Mleczan jest uniwersalnym nośnikiem energii.
W warunkach wysoka produkcja energii w trybie beztlenowym, mleczan jest nośnikiem energii z miejsc, w których nie ma możliwości przekształcenia energii, ze względu na zwiększona kwasowość, do tych miejsc, w których może zostać przekształcona w energię (serce, mięśnie oddechowe, powolne skurcze włókna mięśniowe, inne grupy mięśni).
Wzrost poziomu mleczanu nie jest konsekwencją braku tlenu.
Badania na zwierzętach wskazują, że wewnątrzkomórkowa deprywacja tlenu w izolowanych mięśniach nie powoduje żadnych ograniczeń aktywności mitochondrialnego łańcucha oddechowego nawet podczas maksymalnego wysiłku. Zawsze będziemy mieli wystarczającą ilość tlenu w naszych mięśniach.
Mleczan jest wskaźnikiem obciążenia glikolizą beztlenową.
Za każdym razem, gdy tworzy się pirogronian, produkt finalny Metabolizm glukozy podczas glikolizy prowadzi do powstania mleczanu. Mleczan gromadzi się po prostu dlatego, że tempo przemiany energii w ćwiczeniach beztlenowych i aerobowych jest różne.
Im większa intensywność pracy, tym więcej powstaje mleczanu.
Poziom mleczanu we krwi jest ściśle powiązany z intensywnością ćwiczeń. Mleczan gromadzi się w wyniku różnicy w szybkości przemiany energii podczas ćwiczeń beztlenowych i aerobowych. Tempo przemian energetycznych w beztlenowym metabolizmie energetycznym jest szybsze niż w tlenowym.
Mleczan nie powoduje kwasowości, on jej towarzyszy.
Produkując energię, jednocześnie wytwarzamy kwasowość. Reakcje energetyczne w naszym organizmie zachodzą z udziałem elektronów jako nośników energii. Produktami glukolizy są mleczan i proton wodoru H+. Miarą aktywności (stężenia) jonów wodorowych (H+) w roztworze wyraża się jego kwasowość.
Mleczan tylko tymczasowo pobiera środek kwasowy (H+) do przeprowadzenia reakcji, a następnie zawraca go do środowiska obojętnego.
90% mleczanu jest wykorzystywane przez organizm w ciągu pierwszej godziny po treningu.
60% mleczanu w organizmie ulega całkowitemu utlenieniu do CO2 i wody. Około 20% ulega przemianie w glikogen w procesie glukoneogenezy, a część wykorzystywana jest do tworzenia aminokwasów. Tylko mała część(mniej niż 5%) mleczan jest wydalany z potem i moczem.
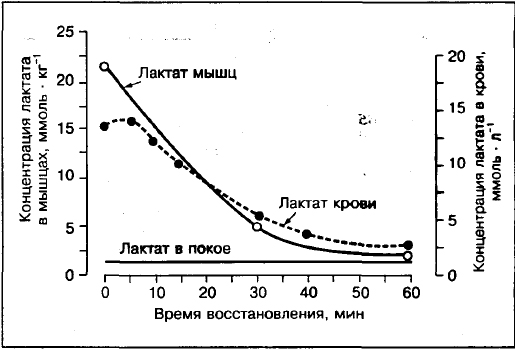
Mleczan we krwi nie będzie systematycznie odzwierciedlał obecności mleczanu w mięśniach.
Z porównań stężeń mleczanów w mięśniach i krwi wynika, że jeśli wysiłek przekracza 75-80% VO2max, to stężenie mleczanu w mięśniach (biopsja mięśnia przedniego uda) jest wyższe niż we krwi. W przeciwieństwie do ćwiczeń o umiarkowanej intensywności 30%, 50%, 70% VO2max, gdzie stężenie mleczanu w krew tętnicza wyższa niż w mięśniach.
Mleczan nie powoduje bólu ani skurczów mięśni.
Bolesność mięśni następnego dnia po intensywnym treningu jest spowodowana uszkodzeniem mięśni i zapaleniem tkanek, które następuje po wysiłku. Większość skurcze mięśni spowodowane przez receptory nerwowe w mięśniach, które stają się nadmiernie pobudzone wraz z pojawieniem się zmęczenia mięśni.
Na podstawie cmtscience.com (2016).
Podobne artykuły
-
Twierdzenia o polach figur. Pole prostokąta
Informacje historyczne Na Rusi Kijowskiej nie istniały, jak wynika z zachowanych źródeł, miary powierzchni podobne do miar kwadratowych. Chociaż starożytni rosyjscy architekci i geodeci mieli o nich pojęcie. Do określenia wielkości gruntu potrzebne były pomiary powierzchniowe...
-
Metody wróżenia za pomocą wahadła - jak zrobić wahadło do wróżenia własnymi rękami
Dla dziecka, przy dobrym montażu, pomysł można rozwinąć np. w upominek biurowy.Podstawą zabawki jest prosty obwód z zawieszką (choć oczywiście lepiej to zrobić na tablicy), składający się z tranzystor, dioda i specjalnie uzwojona cewka,...
-
Nauka pracy z wahadłem różdżkarskim: dobór, kalibracja, zadawanie pytań
Wahadło wykonane własnoręcznie będzie ściśle powiązane z energią jego właściciela, jednak samodzielne wykonanie niektórych rodzajów wahadeł jest prawie niemożliwe. Jeśli chcesz spróbować swoich sił w radiestezji, zacznij od...
-
Funkcja pierwotna funkcji wykładniczej w zadaniach UNT
Różniczkowanie funkcji wykładniczej i logarytmicznej 1. Liczba e. Funkcja y = e x, jej własności, wykres, różniczkowanie. Rozważmy funkcję wykładniczą y = a x, gdzie a > 1. Dla różnych podstaw a otrzymujemy różne wykresy (Rys....
-
Pochodna logarytmu dziesiętnego
Zachowanie Twojej prywatności jest dla nas ważne. Z tego powodu opracowaliśmy Politykę prywatności, która opisuje, w jaki sposób wykorzystujemy i przechowujemy Twoje dane. Prosimy o zapoznanie się z naszymi zasadami zgodności...
-
Wakacje to wspaniały czas!
Wielcy o poezji: Poezja jest jak malarstwo: niektóre prace zafascynują Cię bardziej, jeśli przyjrzysz się im bliżej, inne, jeśli odsuniesz się dalej. Małe, urocze wierszyki bardziej drażnią nerwy niż skrzypienie niepomalowanych...
