Soluții și solubilitate. Mare enciclopedie a petrolului și gazelor
Sarea de masă în aspect curat e, sau clorura de sodiu conține sodiu 39,34, clor 60,66%,
În natură sare se găsește în apa mărilor, oceanelor, unor lacuri și surselor subterane, precum și sub formă de straturi de sedimente cristaline. În funcție de natura zăcămintelor și a metodelor de extracție, sarea gemă se distinge, se autosare, cușcă sau bazin și se evaporă.
Sarea gemă este extrasă din straturi situate la adâncimi diferite în subteran. Cele mai apropiate zăcăminte mari de sare gemă sunt situate în zona orașului Sol-Iletsk, regiunea Chkalov și orașul Artemovsk, regiunea Lugansk din Ucraina. După prăbușirea URSS, Rusia a continuat să cumpere sare din Ucraina. Sarea auto-sedimentată este extrasă din straturi de sare care s-au așezat pe fundul lacurilor. Cristalizarea sării are loc vara ca urmare a evaporării naturale a apei lacului. Se face o distincție între cristalizarea actuală și cristalizarea veche (radicală).
O cantitate semnificativă de sare sedimentară este extrasă în lacul Baskunchak, lacul Kuuli și lacurile din regiunea Pavlodar.
Sarea de cușcă sau de bazin este extrasă din sedimentele obținute în bazine speciale ca urmare a evaporării naturale a apei din estuare sau din unele lacuri separate de mare prin fâșii înguste de țărm. Sarea tristă este extrasă în principal din apa estuarelor sau a lacurilor sărate din regiunea Crimeea. Sarea evaporata se obtine prin evaporarea apei din saramura naturale sau artificiale in unitati speciale de evaporare sau evaporatoare cu vid. Extracția sării evaporate este concentrată în Slaviansk, Usolye în regiunea Irkutsk și în alte zăcăminte.
Proprietățile sării de masă. Clorura de sodiu pură se obține după cristalizare sub formă de cristale cubice incolore, regulate, cu o greutate specifică de 2,167 și un punct de topire de 800°.
Greutatea specifică a sării naturale variază de la 1,95 la 2,2, în funcție de dimensiunea cristalelor și de tipul de sare. În timpul cristalizării (precipitării), o parte din saramură este reținută în interiorul cristalelor, cu atât mai mult dimensiuni mai mari cristale care cad. Greutatea specifică a saramurii este mai mică decât greutatea specifică a cristalelor pure, prin urmare cristalele de sare naturală au o valoare ușor redusă a acesteia din urmă. Există mai puține incluziuni de saramură în cristalele de sare gemă decât în sarea autosedată și de piscină a cuștii actuale, prin urmare greutatea specifică a sării gemă este mai mare decât greutatea specifică a sării autoseditate și de piscină. Pentru calcule practice, greutatea specifică poate fi considerată egală cu 2,2.
Cristalele de clorură de sodiu la o umiditate relativă peste 75,5% absorb (absorb) umiditatea, iar la o umiditate relativă sub 75,5% o pierd. Această proprietate explică modificarea conținutului de umiditate în sare atunci când este depozitată în aer fără ambalaj sigilat. Sărurile naturale, în special sărurile de auto-decantare și de piscină, care conțin impurități de săruri de calciu și magneziu, au o higroscopicitate crescută în comparație cu clorura de sodiu pură. Când este depozitat într-o cameră umedă sau în aer liber, conținutul de umiditate din sare poate ajunge fără dizolvare vizibilă,
absorbția ulterioară a umidității duce la dizolvarea parțială a sării. Higroscopicitatea se datorează în mare măsură aglomerării sării în timpul depozitării, adică aderării cristalelor individuale între ele, în urma căreia sarea este compactată într-o masă solidă, omogenă.
Sarea umedă, datorită aderenței reciproce mai puternice a cristalelor cauzată de prezența unei pelicule de soluție saturată pe cristale, este slab dispersată; a-l distribui uniform prin împrăștierea lui dintr-o spatulă pe suprafața unui strat de pește în cuve este mult mai dificilă decât sarea uscată.
Dar sarea umedă (care conține umiditate mai mult de 4-5%), în comparație cu sarea uscată, atunci când este amestecată, formează cocoloașe dense, care nu se împrăștie, care se lipesc de pește mai ferm și în cantități mai mari. Prin urmare, atunci când sărați peștele cu amestecare preliminară cu sare, este mai bine să utilizați sare umedă, în timp ce atunci când sărați cu împrăștierea sării peste straturile de pește, este mai bine să utilizați sare uscată.
Atunci când amestecați sare cu zăpadă sau gheață mărunțită fin, aceasta din urmă se topește, deoarece la temperaturi de peste -21,2° sarea și zăpada (gheața) nu pot fi prezente în același timp. Când gheața (zăpada) se topește, ha mediu inconjurator absorbit un numar mare de căldură, iar prepararea amestecurilor de răcire se bazează pe această proprietate. Cea mai scăzută temperatură, egală cu -21,2°, se obține prin amestecarea a 100 de părți în greutate de gheață (zăpadă) cu 33 de părți de sare (compoziția amestecului: 24,4% sare și 75,6% zăpadă sau gheață).
Impurități în sare. Sarea de masă naturală, în plus față de clorura de sodiu ca compus principal, conține impurități ale altor compuși asemănătoare sării, cel mai adesea săruri ale metalelor alcalino-pământoase (calciu, magneziu), impurități insolubile și apă. Conținutul de apă depinde de condițiile de depozitare, în timp ce conținutul de impurități asemănătoare sării depinde de tipul de sare și de metodele de extracție a acesteia. În tabel Tabelul 1 arată compoziția celor mai comune tipuri de sare de masă din Federația Rusă.
Impuritățile de săruri de magneziu și calciu la sărarea peștelui sunt nedorite. În prezența unei cantități semnificative din aceste impurități, suprafața peștelui este sever deshidratată; sărarea uscată întârzie formarea saramură și pătrunderea sării în pește și pește sărat capătă un gust amar. S-a stabilit că atunci când conținutul de săruri de magneziu și calciu din sarea de masă depășește 2%, aceasta din urmă devine improprie pentru sărarea peștelui. Printre alte impurități solubile, clorura de potasiu și sulfatul de sodiu pot fi prezente în sare, dar de obicei în cantități atât de mici încât nu pot avea niciun efect asupra vitezei de sărare și a calității peștelui.
Substanțele insolubile sunt amestecate cu sare atât în timpul extracției acesteia, cât și în timpul depozitării și transportului fără ambalare. Dacă recoltarea, transportul și depozitarea nu sunt organizate corect, cantitatea de impurități insolubile poate fi atât de mare încât în timpul sărării acestea învăluie suprafața peștelui și sunt greu de îndepărtat chiar și cu o spălare minuțioasă.
Impuritățile insolubile includ atât compuși organici, cât și anorganici. Printre cele anorganice se pot număra nisip, argilă, cărbune, care cad în principal în timpul depozitării și transportului, precum și oxizi de fier, aluminiu, săruri de dioxid de carbon ale metalelor alcalino-pământoase. Oxizii de fier și aluminiu sunt întotdeauna prezenți în sarea gemă, în timp ce sărurile de carbonat de calciu se găsesc în sarea obținută din apa de mare.
Săruri autoprecipitante și cușcă, pe lângă contaminarea cu organice și origine minerală, contin microorganisme care patrund in el din saramura lacurilor si piscinelor, precum si din exterior in timpul depozitarii in camp, transport si la locurile de consum. Cel mai mare număr de microorganisme care intră în sarea de saramură se găsește în sarea proaspătă; în timpul depozitării (învechirii), cantitatea acestora scade. Printre aceste microorganisme cea mai mare valoare au microorganisme din grupa micrococilor care au capacitatea de pigmentare. Când temperatura aerului crește în timpul depozitării peștelui sărat cu o astfel de sare, pe carne apare o culoare roșie, însoțită de apariția mucusului și de miros de produse de descompunere a proteinelor. Împreună cu sarea în întreprinderile din industria pescuitului, bacteriile care formează pigment infectează depozitele, zonele de depozitare a sării și sarea evaporată și sarea gemă situate în depozit.
Cerințe de calitate a sării. Standard de stat Următoarele sunt permise pentru sarea de masă: cel mai scăzut conținut clorură de sodiu și cea mai mare cantitate de impurități (Tabelul 2).
Conținutul de sulfat de sodiu în materie de substanță uscată este permis:
a) pentru sare suplimentară - nu mai mult de 0,2%;
b) pentru alte soiuri - nu mai mult de 0,5%;
Cercetări pentru studiul efectelor impurităților conținute de sare asupra calității produselor finite sărate, efectuate în timp diferit, precum si practica sararii, s-a stabilit ca pt căi diferiteși tipurile de sărare, conținutul maxim de impurități în sare ar trebui să fie după cum urmează (Tabelul 3).
Calitățile de sare, de la extra (sărare specială a caviarului) până la gradul I inclusiv, sunt destul de potrivite pentru sărare.
Pisați sare. Sarea de masă, în funcție de măcinare (dimensiunea cristalelor), se împarte în mai multe numere: 0,1,2,3. Sarea suplimentară are un număr de măcinare 0; cel mai mare și gradul I - de la Nr. 0 la 3: sare de gradul II - de la Nr. I la 3. Caracteristicile de măcinare sunt date în tabel. 4.
Măcinarea sării sau, cu alte cuvinte, dimensiunea cristalelor de sare are un foarte important pentru sărarea peștelui: viteza de dizolvare a sării depinde de dimensiunea acestora, greutate în vrac dispersibilitatea sa, higroscopicitatea.
Raportul dintre suprafața cristalelor și volumul lor, așa-numita suprafață specifică a cristalelor mari, este mai mică decât cea a celor mici. Când este dizolvată, aceeași cantitate de sare trece în soluție din fiecare unitate de suprafață. Dar dacă această cantitate este atribuită unei unități de volum sau greutate a cristalelor, atunci în aceeași perioadă de timp, mult mai multă sare se va dizolva în cristale mici decât în cristale mari, deoarece suprafața totală a primelor este mult mai mare decât cea din urmă. . Dacă se cere ca sarea să se dizolve rapid, este necesar să se folosească o sare mai fină.
În plus, pentru o sărare uniformă este necesară cea mai densă distribuție a cristalelor de sare, astfel încât suprafața pe care acestea o ocupă să fie aproape de suprafața peștelui. Acest lucru se poate realiza numai dacă, la determinarea mărimii cristalelor de sare, se ia în considerare suprafața peștelui sau, mai precis, suprafața specifică a acestuia (raportul dintre suprafață și greutatea peștelui). De exemplu, un hering din Pacific care cântărește 200 g are o suprafață de 280 cm2, în timp ce un hering din Pacific care cântărește 22 g are o suprafață de 74 cm2. Pentru sărarea saturată, primul necesită 60 g de sare, iar al doilea - 6 g; pe 1 cm2 de suprafață, ar trebui distribuite 0,21 și, respectiv, 0,08 g. Cu aceeași dimensiune a cristalelor, raportul dintre suprafața lor de contact și suprafata comuna heringul mare va fi de 2,5 ori mai mare decât heringul mic, deoarece cantitatea de sare pe 1 cm3 de suprafață a peștelui este de 2,5 ori mai mare în primul caz decât în al doilea. În consecință, pentru ca raportul dintre suprafața de contact și suprafața totală a peștelui să fie același, pentru sărarea heringului mic trebuie folosită sare mai fină, care are o suprafață mai mare pentru aceeași greutate decât a celor mari.
În acest sens, se poate face o a doua concluzie: cu cât doza de sare în timpul sărării este mai mică, cu atât dimensiunea cristalelor de sare este mai mică și numărul de măcinare este mai mic pentru a avea cea mai mare suprafață de contact între sare și peşte
Utilizarea sării foarte fine (măcinate nr. 0 și 1) în cantități mari în timpul sărării poate duce la rezultate nedorite. Sarea fină, având o higroscopicitate crescută în comparație cu cristalele mai mari, atunci când peștele nu are suficientă apă pentru a forma primele porțiuni de saramură, deshidratează sever țesutul tegumentar și astfel încetinește pătrunderea sării în carne. Acest fenomen este similar cu deshidratarea suprafeței peștilor din cauza prezenței unor cantități mari de săruri de magneziu și calciu în sare. Pentru a evita deshidratarea intensă a suprafeței peștelui atunci când sărarea cu sare uscată este saturată, ei preferă să folosească sare de masă constând din amestecuri de cristale de diferite dimensiuni - până la 3-4 mm inclusiv (măcinare nr. 2). Într-un astfel de amestec există cantități suficiente de cristale de 1 mm sau mai mici, care măresc suprafața de contact a sării cu peștele și, dizolvându-se rapid, formează primele porțiuni de saramură fără deshidratare severă a țesuturilor. Porțiunile ulterioare de saramură se formează datorită dizolvării cristalelor având o suprafață mare; Observațiile arată că dacă în sare există un amestec de cristale de diferite dimensiuni, dizolvarea în recipientul de sărare a peștelui se desfășoară normal, dacă procesul de sărare a început.
Greutatea volumetrică a sării. Pentru a ține cont de cantitatea de sare din depozitele de sare și fluxul de curent Este util să cunoașteți greutatea în vrac a sării. Greutatea în vrac a produselor în vrac este greutatea unei unități de volum (1 m3) în tone sau kilograme. Densitatea în vrac depinde de greutatea specifică a produsului, de dimensiunea particulelor sale și de raportul dintre diferitele dimensiuni ale acestora, de umiditate și de gradul de presiune asupra acestuia din straturile de deasupra. Pentru tipuri variate sărurile utilizate în industria pescuitului, greutatea în vrac variază de la 1038 la 1365 kg (Tabelul 5). Densitatea în vrac a sării de același tip și zonă de exploatare este mai mare pentru sărurile mici decât pentru cele mari.
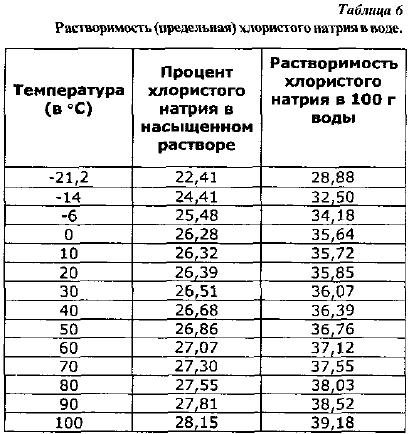
Proprietățile soluțiilor de sare de masă. Clorura de sodiu este solubilă în apă, iar solubilitatea, adică cantitatea maximă necesară pentru a obține o soluție saturată, se modifică ușor odată cu creșterea temperaturii (Tabelul 6).
DI. Mendeleev, pentru intervalul de temperatură de la 0 la 108°, a derivat următoarea formulă pentru a determina dizolvarea limită a sării în 100 g de apă
unde t este temperatura în grade Celsius
Solubilitatea poate fi exprimată în grame de clorură de sodiu la 100 g de soluție sau în grame la 100 g de apă. Între aceste valori există destul simpla dependenta. Să notăm cu c conținutul de sare (în g) în 100 g de soluție și cantitatea de sare (în g) dizolvată în 100 g de apă pentru a obține o soluție cu conținutul de sare specificat cu a. Evident, din grame de sare dizolvate în (100-c) g de apă, în 100 g de apă se va dizolva:
![]()
Cunoscând a, puteți calcula c folosind formula:
![]()
Solubilitatea clorurii de sodiu în 100 g de apă, calculată folosind formula (2), este dată în tabel. 6.
Solubilitatea aproape identică a clorurii de sodiu în intervalul de temperatură de la 0 la 20° este importantă pentru practicarea sărării, deoarece nu este necesară modificarea dozei de sare cu o schimbare a temperaturii în aceste limite.
Soluțiile de clorură de sodiu sunt mai grele decât apa și greutatea lor specifică este mai mare decât unitatea. Pentru o temperatură de 15°, greutatea specifică a soluției, raportată la greutatea specifică a apei la 4°, poate fi calculată folosind următoarea formulă de D. I. Mendeleev:
unde c este concentrația de sare din soluție ca procent din greutatea acesteia.Pentru determinarea greutății specifice se folosesc hidrometre sau densimetre, pe scara cărora există numere care arată valoarea greutății specifice la 20° în raport cu greutatea specifică a apei la 4°, luată egală cu unitatea. Când se folosesc hidrometre convenționale (densimetre), greutatea specifică este determinată cu o precizie de 0,0! și numai cu hidrometre speciale se poate crește precizia determinării la 0,001.
Alături de hidrometre și densimetre, hidrometrele cu o scară convențională de grade Baume au fost folosite în trecutul recent pentru a determina greutatea specifică. 0° din această scară corespunde adâncimii de scufundare în apă curată, și 10° - într-o soluție 10% de clorură de sodiu. Pentru a converti gradele Baume în greutate specifică, utilizați următoarea formulă:
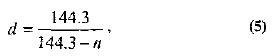
unde n este indicele hidrometrului Baume.
În tabel 7 arată greutatea specifică a soluțiilor de sare la 0°, 10°, 20° și valorile corespunzătoare ale concentrației de sare ca procent din greutatea soluției.
Când se determină greutatea specifică a unei soluții a cărei temperatură nu coincide cu temperatura de calibrare a ariometrului, se poate folosi următoarea formulă pentru a aduce valoarea greutății specifice găsite la o temperatură de 20°:
unde: d4в20 - greutate specifică la 20°;
d4в1 - același la temperatura de măsurare t;
0,0004 este coeficientul de modificare a temperaturii în capacitatea de încărcare a soluției de sare.
Punctele de fierbere și de congelare ale soluțiilor de clorură de sodiu depind de concentrația acestora din urmă: cu cât soluția este mai concentrată, cu atât este mai mare punctul de fierbere și cu atât este mai mic punctul de îngheț (Tabelul 8).
Când o soluție saturată este răcită sub 0°, mai întâi precipită un exces de sare dizolvată, în urma căruia concentrația de sare din soluție scade, iar după ce scade la 24,4%, soluția îngheață la o temperatură de -21,2°. Sarea care precipită la temperaturi sub 0° are compoziţia NaCl 2H20. adică cristalizează cu două molecule de apă. Cu o creștere suplimentară a concentrației, punctul de îngheț nu scade, ci crește, și nu apa, ci sarea este eliberată în formă solidă. Temperatura -21,2° este cea mai scăzută dintre toate temperaturile posibile congelarea unei soluții de sare de masă.
Reacția soluțiilor de clorură de sodiu și săruri naturale este aproape neutră. Conform standardului pentru sare de masă reacția alimentară soluție apoasă testul de turnesol ar trebui să fie neutru sau aproape de acesta.
O soluție de sare saturată la o umiditate relativă a aerului de 75,5% nu pierde umiditatea prin evaporare și nu o absoarbe din aer. Această umiditate relativă de echilibru se numește punctul higroscopic al unei soluții saturate de sare și este aproximativ egală cu punctul higroscopic al sării solide.
Concentratoare de saramură. Pe lângă sarea cristalină, sărarea consumă o cantitate mare de soluții apoase din saramură sau saramură artificială. Pentru prepararea acestora, este indicat să se folosească instalații speciale - concentratoare de saramură, a căror productivitate poate varia foarte mult.Un concentrator de saramură de capacitate mică este un vas de lemn de formă cilindrică sau conică, de aproximativ 60-70 cm înălțime, în care se află un grătar. acoperit cu pânză (pânză de pânză) sau o plasă curată, folosită pentru a se așeza pe acesta un strat cu o înălțime de minim 50-40 cm.
Există o conductă de scurgere direct lângă partea de jos a concentratorului de saramură. Apa intra top parte printr-o conductă perforată sau printr-o suprafață perforată și este distribuit uniform pe întreaga secțiune transversală a stratului de sare din concentratorul de saramură. Prin reglarea debitului de apă și a înălțimii stratului de sare, este ușor de realizat debitul de saramură saturată având o greutate specifică de 1,2.
Pentru a obține rapid cantități mari de saramură, oferim un concentrator de saramură, în care apa este furnizată de o pompă la partea de jos sub presiune, iar saramură curge din vârf.
În acest caz, stratul de sare este menținut la o înălțime de cel puțin 1 m, astfel încât să se producă saturația completă cu o singură mișcare a apei prin stratul de sare.
„Dintre toate sărurile, cea mai importantă și de bază este cea pe care noi o numim pur și simplu sare.”
Dacă apelezi la dicţionar enciclopedic, atunci puteți afla următoarele informații despre sarea de masă.
Clorura de sodiu (clorura de sodiu, sare de masa, sare gema), NaCl, substanta cristalina incolora, punct de topire 801 0C, punct de fierbere 1465 0C Solubilitate 26,4 g in 100 g apa la 20 grade; În plus, este solubil în amoniac lichid, etilen glicol, acid formic și metanol. În natură, clorura de sodiu este distribuită pe scară largă sub formă de sare gemă (halit), găsită în apa de mare(1,5% din greutate) și oceane (2,72%), lacuri sărate cu saramură, în saramură de pământ. Condimente alimentare importante; merge pentru a produce sodă caustică, clor, sifon. Producția mondială – 175 milioane tone/an.
Suntem obișnuiți să vedem sare de masă pe masa noastră în fiecare zi, dar cred că mulți dintre noi nici măcar nu ne gândim la importanța pe care o are în viața noastră și fără sare, după cum se spune, nu poți să faci nici măcar săpun!
Sarea este o substanță care nu se schimbă nici măcar în foc, nu poate fi stricată, ci, dimpotrivă, protejează alimentele de deteriorare. A servit mult timp ca simbol al constanței. Strămoșii noștri au întâmpinat oaspeții cu „pâine și sare” în semn de prietenie de nedespărțit.
ÎN tari diferite ah oamenii mananca diverse produse. Și un singur produs este același peste tot - sarea de masă (NaCl). În mineralogie se numește halit sau sare gemă, în tehnologie și viața de zi cu zi - de masă sau sare de masă, în chimie – NaCl (clorură de sodiu).
Este necesar pentru a pregăti aproape toate felurile de mâncare. Chiar și prăjituri dulci! Și dacă ni se pare că nu este suficientă în mâncare, atunci „nu este suficientă sare pe masă”. Oamenii nu pot trăi fără sare.
Sarea de masă a făcut parte din cele mai vechi medicamente; i-a fost atribuită Proprietăți de vindecare, efect de curățare și dezinfectare. În diferite momente, sarea a pretins a fi un antidot universal. „Trebuie să punem o sare în fața celor care sunt ocupați să mănânce. Sarea controlează otrava și îi face pe cei fără gust gustos”, Arnaldo din Vilanova.
Este interesant că din cele mai vechi timpuri, sarea a fost un obiect de comerț între multe popoare (pentru 1 kg de sare se plăteau 1 kg de nisip de aur).
În bazine speciale, a fost extras din apa de mare de locuitorii regiunilor de coastă din țările calde, iar minerii au dezvoltat acele zăcăminte care erau ușor accesibile. Timp de multe secole, soluțiile de sare (săramură) au fost pompate din adâncimi mari și prelucrate în saline în sare de masă.
Clorura de sodiu nu este doar importantă produs alimentar. Sărurile sunt cea mai importantă materie primă Pentru industria chimica.
1. Sarea de masă în natură. (Tipuri de sare).
Sarea de masă este un compus activ din punct de vedere chimic care necesită o manipulare atentă a sodiului de metal alcalin cu clor extrem de toxic. Acest compus poate fi obținut prin expunerea bucăților de sodiu la clor gazos timp îndelungat într-un vas bine închis. După cum știm, sarea de masă care iese la vânzare nu este otrăvitoare, deoarece atunci când substanțele sunt combinate între ele, proprietățile lor originale nu apar. Constă, ca toate sărurile simple, dintr-un ion metalic și un reziduu acid.
Punctul de topire al sării de masă este de 800 de grade C, densitatea este de 2,16 g/cm3.
Sarea de masă NaCl pură este incoloră și formează cristale cubice. Sarea de masă „Delicacy” sau „regale” are o culoare roz moale și o aromă plăcută. Conține alge microscopice care au intrat în el în timpul cristalizării din apa unui lac sărat.
Se dovedește că se găsește și sare albastră de masă. În natură, sarea gemă de această culoare este foarte rară. Și în laborator nu este greu să obțineți clorură de sodiu albastră. Pentru a face acest lucru, un amestec de sodiu metalic și clorură de sodiu este încălzit într-un vas bine închis. Metalul se poate dizolva în sare. În acest caz, atomii de sodiu pătrund în rețea cristalină, constând din ioni Na+ și Cl-, și „completează-l”, transformându-se în cationi de sodiu. Și electronii eliberați sunt localizați în acele noduri ale rețelei cristaline unde ar trebui să fie localizați anionii de clorură. Astfel de locuri neobișnuite de rețea ocupate de electroni sunt numite locuri libere sau centre F (din cuvântul german Farbe - culoare). Când cristalul este răcit, unii centri F se combină pentru a forma asociații care conțin de la 10 la 1000 de atomi de sodiu. Acesta este motivul apariției vopselei albastre. În halitul mineral natural (sarea gemă), se formează centrii F sub influența radiațiilor care însoțesc transformările radioactive. Interesant este că atunci când sarea de rocă albastră este dizolvată în apă, se formează o soluție incoloră de clorură de sodiu.
2. Sarea in Rus' (fond istoric).
ÎN Rusia Kievană sarea folosită din regiunea Carpatică, precum și din lacurile sărate și estuarele de pe Negru și Mările de Azov. A fost cumpărat în Sudak și transportat în nord. Sarea era atât de scumpă încât la sărbătorile ceremoniale era servită doar pe mesele oaspeților nobili, în timp ce alții părăseau sărbătoarea „fără să sorbi sare”.
Prima mențiune despre exploatarea sării în Rus' a fost găsită în manuscrise din secolul al XII-lea. Producția la acea vreme era primitivă. În locurile în care au apărut izvoarele sărate, au săpat gropi - fântâni și au colectat saramură. Aici s-a îmbogățit: vara prin evaporare, iarna prin îngheț. Până la începutul secolului al XVI-lea. Tehnica de extracție a sării s-a schimbat: ape sărate de adâncime au început să fie extrase folosind foraje - „țevi”.
După anexarea Teritoriului Astrahan surse importante sărurile lacurilor de oțel ale Mării Caspice. Aici, pentru prima dată, industriașii de sare nu au fost nevoiți să „gătească” sarea; aceasta a fost pur și simplu strânsă de pe fundul lacurilor și trimisă pe nave pe Volga. Și totuși nevoia de sare nu a fost satisfăcută. Cele mai sărace segmente ale populației au suferit cel mai mult din cauza penuriei și a prețurilor ridicate. Creșterea taxei pe sare a provocat nemulțumire în rândul straturilor inferioare ale populației, cunoscută sub numele de „Revolta de sare”.
În 1711, Petru I a emis un decret de introducere a monopolului sării. Comerțul cu sare a devenit dreptul exclusiv al statului. Monopolul sării a existat de mai bine de o sută cincizeci de ani, dar a fost desființat.
ÎN Rusia țaristă, în ciuda bogatelor rezerve naturale de sare, datorită metodelor primitive de extracție și transport nu a fost suficientă. Timp de multe secole, sarea a fost o sursă de îmbogățire și profit pentru comercianți și antreprenori. Prin urmare, unul dintre primele decrete ale guvernului sovietic a făcut ca sarea, ca și alte bogății ale subsolului pământului, proprietatea statului poporului. În anii 20, lopata, pick-ul și coșul au fost înlocuite cu recolte de sare, tăietori și evaporatoare cu vid. Mecanizarea mineritului a permis țării noastre să ocupe unul dintre primele locuri la cantitatea de sare produsă. Acum producem la fel de multă sare de masă într-un an cât a produs Rusia pre-revoluționară în 10-12 ani.
3. Ciudățeniile de sare ale Pământului.
Munții de sare din subteran nu sunt mai mici ca mărime decât cei mai mulți vârfuri înalte Pamir și Caucaz. Bazele lor se află la o adâncime de 5-8 km, iar vârfurile lor se ridică la suprafața pământului, uneori chiar ieșind din acesta. Astfel de acumulări gigantice se numesc cupole de sare.
La presiuni mariși temperatură, sarea din intestinele pământului devine plastică. Și din moment ce coeficientul său de dilatare termică este mai mare decât cel al altor roci, atunci când este încălzită se extinde și este strâns în sus. Mase uriașe de sare se pot desprinde de stratul continental și se pot ridica la suprafața pământului, ridicând și uneori străpungând rocile aflate deasupra. Desigur, creșterea domurilor de sare este un proces lung.
În Tadjikistan, Muntele de sare are o cupolă care se ridică la aproape 900 m. Privind-l de jos, pare că este acoperit de zăpadă proaspăt căzută: sarea strălucește atât de puternic sub razele soarelui.
Cupolele de sare sunt însă mai frecvente, nu sunt ridicate atât de sus deasupra suprafeței pământului sau chiar acoperite cu pământ. În vârful unuia dintre aceste domuri, care intră în adâncime de peste un kilometru în pământ și are o circumferință de bază de aproape 100 km, se află binecunoscutul lac Baskunchak. Acest lac este numit un miracol al naturii. Judecă-te singur Printre stepele Astrahanului există un lac cu o suprafață de peste 100 km2. Și adâncimea lacului nu depășește jumătate de metru și chiar și atunci numai iarna și primăvara. Vara și toamna, un strat subțire de apă se evaporă, lăsând o sare albă orbitoare sclipitoare în soare pe întreaga suprafață a lacului. Rezervele sale sunt practic inepuizabile. Lacul din vârful muntelui de sare ne oferă de câteva secole un produs de primă clasă - conținutul de clorură de sodiu din acesta ajunge la 98%.
Există două lacuri cunoscute ale aceluiași dom. Lacul Razval, situat în vârful cupolei de sare Ilețk, are o adâncime neobișnuit de mare - mai mult de 22 m. Datorită concentrație mare Acest lac nu îngheață nici în cele mai aspre ierni. Saramura puternic suprarăcită se scufundă pe fundul lacului și din ea se cristalizează hidrohalita, ale cărei depozite nu dispar nici măcar vara. Acest lucru se explică prin faptul că amestecarea, obișnuită pentru corpurile de apă dulce, este absentă în saramurele dense saturate; căldura straturilor superioare, încălzite de apă nu este transferată către cele inferioare. La doar 150 m de lacul rece Razval se află antipodul său - lacul fierbinte Tuzluchnoye. Adâncimea sa este de 0,2 - 0,3 m. Acest lucru asigură încălzirea intensă de vară a lacului, și un strat subțire apa dulce curgerea peste saramura mai densă creează un fel de efect de seră.
Extracția sării de masă se desfășoară de câteva secole. Minele de sare de stil vechi seamănă cu mine de cărbune. Când ridicau sare gemă în sus pe munte, minerii au lăsat-o în subteran coridoare lungi drifturi, puturi adânci. Acum aceste spații subterane sunt utilizate pe scară largă pentru depozitarea gazelor și a produselor petroliere. Costul depozitării gazului lichefiat în mine este de 2-4 ori mai ieftin, iar în straturile de sare de 20-40 de ori mai ieftin decât în rezervoarele supraterane: pierderile de la evaporare sunt aproape complet eliminate.
Dar nu toate minele de sare sunt folosite în astfel de scopuri. Timp de șapte secole, de exemplu, zăcămintele de sare au fost dezvoltate în orașul polonez Wieliczka, lângă Cracovia. Dacă cobori aproape jumătate de kilometru adânc în pământ, te vei regăsi într-un regat bizar al sării. Minerii și artiștii polonezi au creat un adevărat muzeu subteran în etajele minate ale minei. Sarea gema - destul de material moale, este ușor de prelucrat și arată extrem de frumos când este iluminat.
Peșterile de sare au alta proprietate minunata: dau naștere la efecte sonore neobișnuite. În peșterile în care pereții și bolțile sunt acoperite cu stalactite de sare, vibrațiile din aer produc sunete frumoase, melodice.
Există așa-numitele nume „sărate”. Numele multor orașe și orașe din întreaga lume menționează sare: Solvychegodsk, Solikamsk, Sol-Iletsk, Soligalich, Soligorsk, Usolye-Sibirskoye, Soloneshnoye, Salt Creek, Saltpond, Saltkots, Salzburg, Salzgitter, Marsilia ( sare de mare), în cele din urmă, doar Salt, Solyanka și chiar Saltcellar. Și această listă continuă.
Aceste orașe au astfel de nume, deoarece producția de sare, extragerea sării și prelucrarea sării au fost mult timp cele mai importante industrii pentru locuitorii lor.
4. Utilizarea sării în viața de zi cu zi.
Proprietățile unice ale sării îi permit să fie folosit în viața de zi cu zi. Această substanță uimitoare este folosită la conservare, vopsire, îndepărtarea petelor și pentru a crește rezistența vaselor.
Conservarea diferitelor produse alimentare prin sărare: carne, pește, legume, ciuperci etc. se bazează pe așa-numitele proprietăți antiseptice sau antiputrefactive ale sării de masă, adică pe capacitatea acesteia de a ucide bacteriile sau microbii care provoacă putrezirea substanțelor din plante. și de origine animală.
mă întreb ce Supa de mazare trebuie sărate după gătire. Apă sărată pătrunde slab în mazăre. Prin urmare, dacă adăugați sare în supă înainte de a o găti, mazărea nu se va găti mult timp.
Creșterea durabilității vaselor de gătit. Pentru a crește rezistența sticlei, aceasta poate fi „întărită” prin fierbere. Pentru a face acest lucru, puneți-l într-o tigaie, al cărei fund este acoperit cu un strat de nisip spălat (1 cm grosime) și turnați apă rece. Aduceți apa la fiert și fierbeți timp de 15 minute. Se adauga apoi 2-3 linguri de sare de masa si se mai fierbe inca 30 de minute, dupa care se lasa sa se raceasca, se scot vasele si se clateste bine.
Pentru ca o tigaie emailata sa reziste mai mult, trebuie sa fierbi apa cu sare intr-o tigaie noua (5 lingurite pe litru de apa).
Îndepărtarea petelor. Petele de grăsime de pe gulerele de îmbrăcăminte exterioară pot fi îndepărtate ștergându-le tampon de bumbac, umezit cu o soluție de sare de masă (o jumătate de linguriță) în amoniac(trei linguri).
Vopsire. Viteza de vopsire este crescută de influența sării de masă la vopsirea bumbacului și a fibrelor aferente.
Țesătura este scufundată în soluția de colorant și încălzită până la fierbere. După 15-20 de minute, turnați 2 litri de soluție de sare de masă (o lingură pe litru de apă) într-o soluție de colorant cu punct de fierbere scăzut, din care se îndepărtează mai întâi țesătura. Coborâți apoi țesătura și continuați vopsirea într-o soluție ușor clocotită pentru încă 30-40 de minute. După aceasta, rezervorul este scos de pe căldură și țesătura este păstrată în soluția de răcire încă 30 de minute. În tot acest timp materialul este răsturnat. Dacă este vopsit în culori deschise, cantitatea de sare se reduce la jumătate. Puteți adăuga și sare uscată în soluția de colorant, dar pentru a face acest lucru trebuie să o scoateți timp de 3-5 minute, să adăugați sare, să amestecați și numai după ce s-a dizolvat complet, coborâți din nou materialul.
5. Ai întotdeauna nevoie să mănânci un kilogram de sare pentru a trăi o viață bună?
De ce spun ei că „Sarea și terciul sunt hrana noastră?”
Sarea este implicată în cele mai importante procese fiziologiceîn corpul oamenilor și al animalelor. Se găsește în salivă, sucul gastric, bilă și limfă. Prezența clorurii de sodiu în sânge asigură necesarul presiune osmotica, de care depinde functionare normala celule. Corpul uman adult conține aproximativ 200 g de sare.
Soluțiile fiziologice (soluții apoase de săruri care sunt apropiate de compoziția sării de plasma sanguină) sunt utilizate în medicină. De exemplu, cu unele boli, corpul uman pierde multă apă. Acest lucru poate duce la moarte. În astfel de cazuri, soluția salină este injectată în sângele pacientului.
Se dovedește că soldaților în marșuri lungi și lucrătorilor din magazinele fierbinți li se oferă apă sărată de băut. Pentru că drept urmare metabolismul sării Corpul uman pierde constant sărurile de care are nevoie, inclusiv clorura de sodiu, eliberându-le prin transpirație. Aceste pierderi sunt completate de sărurile conținute în alimente și apă. Pentru a umple rapid lipsa de clorură de sodiu, bând apă adăugați sare de masă.
Aproape toate sărurile minerale de care corpul nostru are nevoie sunt conținute în cantități suficiente în alimentele obișnuite. Numai că îi lipsește clorura de sodiu. Acesta este motivul pentru care trebuie să adăugăm sare de masă în mâncarea noastră. Fiecare persoană consumă 6-8 kg de sare pe an. Poate că niciun produs alimentar nu este folosit în cantități atât de mici și are o importanță atât de mare ca sarea de masă.
Ionii de sodiu reglează conținutul de apă din organism, transmiterea impuls nervos. Deficiența acestuia duce la dureri de cap, slăbiciune, memorie slabă, pierderea poftei de mâncare și excesul duce la creșterea tensiune arteriala, hipertensiune arterială, boli de inimă. Experții în nutriție recomandă să nu consumați mai mult de 5 g (1 linguriță) de sare de masă (NaCl) per adult pe zi, dar oamenii consumă de obicei de două ori mai mult decât este necesar. De aceea oamenii suferă de asta. De exemplu, Japonia, unde fiecare rezident consumă aproximativ 30 g de sare pe zi, deține liderul în ceea ce privește numărul de pacienți cu hipertensiune arterială. Nu numai oamenii, ci și plantele și animalele suferă de lipsa sau excesul de sare.
Masa 1 Influența deficienței și excesului de ioni metalici asupra stării plantelor și animalelor
Exces de deficit de sodiu
La animale - dureri musculare, slăbiciune. La plante - inhibarea formării; la om - hipertensiune arterială. La plante, dezvoltarea clorofilei. forme halofitice.
Am realizat un studiu pentru a mă asigura că excesul de sare este dăunător.
În clinica nr. 12 din districtul Leninsky, a fost efectuat un sondaj pe 183 de pacienți cu vârsta de 50 de ani sau mai mult. Sondajul a arătat că 30% dintre oameni suferă de hipertensiune arterială. Dintre persoanele hipertensive, peste 70% dintre oameni consumă mai multă sare decât este necesar, iar restul, în opinia lor, consumă sare în mod normal. Putem concluziona că într-adevăr, abuzul de sare poate duce la dezvoltarea hipertensiunii arteriale.
6. NaCl din punct de vedere chimic.
Dacă analizezi clorura de sodiu ca Substanta chimica, atunci spunem că acesta este un compus complex cu o rețea cristalină ionică, o legătură ionică. În stare solidă, cristalul de NaCl, ionul de sodiu are ca vecini 6 ioni de clor.
În starea sa de vapori, sarea de masă este formată din molecule individuale. În acest caz, un cation de sodiu este combinat cu un anion de clor.
Clorura de sodiu este solubilă în apă, solubilitatea sa este practic independentă de temperatură (la 20 de grade C solubilitatea este de 35,7 g, la 100 de grade C este de aproximativ 40 g). Când este dizolvată în apă, această substanță se disociază în ioni. Este cauzată de interacțiunea unei substanțe dizolvate cu un solvent. Deoarece nu există molecule de clorură de sodiu în cristalul de clorură de sodiu, atunci când este dizolvat, structura cristalină este distrusă, iar ionii hidrogenați intră în soluție. Nu există molecule în soluție. Prin urmare, în soluțiile de electroliți puternici putem vorbi doar condiționat de molecule nedisociate.
Trebuie avut în vedere că în prezența NaOH, HCl, MgCl2, CaCl2, solubilitatea clorurii de sodiu în apă este mult redusă.
Metode de obținere a clorurii de sodiu
Clorura de sodiu poate fi obținută ca rezultat al reacției:
1. oxid bazic – oxid de sodiu cu acid clorhidric
Na2O + 2HCI = 2NaCI + H2O;
2. când sodiul arde în clor: 2Na + Cl2 = 2NaCl;
3. la interacțiunea hidroxidului de sodiu cu acidul clorhidric:
NaOH + HCI = NaCI + H2O;
4. ca rezultat al reacţiei acidului clorhidric cu o sare, de exemplu cu silicatul de sodiu: 2HCI + Na2SiO3 = 2NaCl + H2SiO3;
5. când hidroxidul de sodiu reacţionează cu o sare, de exemplu cu clorura de cupru (II): 2NaOH + CuCl2 = Cu (OH)2 + 2NaCl;
6. prin interacțiunea a două săruri între ele:
Na2SiO3 + CaCI2 = 2NaCI + CaSi03;
7. când sodiul metalic reacţionează cu acidul clorhidric:
2Na + 2HCI = 2NaCI + H2.
Hidroliza paradoxală
Clorura de sodiu este o sare formata dintr-o baza tare si un acid tare. După cum se știe, astfel de săruri nu suferă hidroliză. Dar dacă o astfel de sare este procesată în condiții dure (la o temperatură de 500 de grade C și o presiune de 1 MPa, folosind apă sub formă de abur supraîncălzit), atunci NaCl se hidrolizează. Clorura de hidrogen începe să fie îndepărtată cu abur, iar hidroliza paradoxală devine o realitate:
NaCI + H2O = NaOH + HCI.
Obținerea acidului clorhidric
Alchimiștii obțin și din sare solidă de masă acid clorhidric. În scrierile călugărului-alchimist Vasile Valentin (secolul al XV-lea), pe care mulți istorici ai chimiei îl consideră o figură mitică, se recomanda obținerea unui „spirit din săruri” - „spiritus salis” - prin calcinarea unui amestec de sare gemă și sulfat de fier. În același timp, s-a distilat un lichid care a uimit imaginația chimiștilor: a fumat în aer, a provocat tuse, țesături corodate, hârtie, metal. Sarea gemă este clorură de sodiu NaCl, sulfatul de fier este hidrat cristalin de fier (II) sulfat FeSO4 x 7H2O. Prin calcinarea unui amestec din aceste substanțe, alchimiștii au obținut acid clorhidric HCI:
2NaCI + 2(FeSO4 x 7H2O) = 2HCI +Fe2O3 + Na2SO4 + SO2 + 13H2O.
Ceva mai târziu, alchimiștii au venit cu o nouă metodă de producere a HCl, care este folosită și astăzi pentru producerea de laborator a acidului clorhidric.
În condiții de laborator, pentru obținerea HCl, se folosește o metodă veche dezvoltată de alchimiști, care constă în acțiunea acidului sulfuric puternic asupra sării de masă:
NaCI+H2SO4 (conc) = NaHS04+HCI.
Clorura de hidrogen părăsește perfect sfera de reacție, iar echilibrul se deplasează spre dreapta. La temperaturi peste 550 de grade C și clorură de sodiu în exces, interacțiunea este posibilă
NaCI + NaHS04= Na2SO4+HCI.
Reacție calitativă
Clorura de sodiu poate fi recunoscută printre alte săruri folosind reacții calitative. În soluție, NaCl = Na- + Cl+, clorura de sodiu se disociază în ioni.
Ionul de clorură poate fi determinat folosind AgNO3. Rezultatul reacției este precipitarea unui precipitat de cheag alb de clorură de argint
NaCl + AgNO3 = AgCI + NaNO3.
Ionul de sodiu este determinat de schimbarea flăcării arzătorului la o culoare galben strălucitor.
Proprietăți uimitoare
Proprietățile sării sunt folosite pentru a obține temperaturi scăzute. Dacă amesteci 1 parte clorură de sodiu și 3 părți gheață zdrobită sau zăpadă, poți obține un amestec care se răcește la -22 de grade.
Sarea poate fi folosită și pentru a stinge funinginea care ia foc într-un coș. Pentru că sarea atrage umezeala din aer. Și pe lângă aceasta, într-un cuptor obișnuit, clorura de sodiu nu se topește, dar cristalele ei se crăpă și se împrăștie datorită transformării în abur a incluziunilor alcoolului mamă, care sunt întotdeauna conținute în ele. La temperaturi ridicate, sarea începe să se evapore vizibil, transformându-se în abur format din molecule de clorură de sodiu și parțial din ioni de sodiu și ioni de clorură. Acești vapori ajută la izolarea funinginei care s-a aprins din oxigenul din aer, fără de care arderea este imposibilă.
7. Utilizarea NaCl în industria chimică.
Sarea de masă este necesară în producția de carne și conserva de peste, în industria metalurgică, în prelucrarea blănurilor, a pieilor brute, în farmacie, în fabricarea săpunului, în medicină. Sarea este principala sursă de material pentru producția de sodă, una dintre cele produse esentiale industria chimica. Dar principalul consumator de sare de masă este industria chimică. Folosește nu doar sarea în sine, ci și ambele elemente care o alcătuiesc. Sarea de masă este de obicei descompusă în elementele sale constitutive prin electroliza unei soluții apoase. În acest caz, se produc simultan clor, hidrogen și sodă caustică (în soluție). După evaporare, din soda caustică se obține un alcali solid (caustic). Prin combinarea hidrogenului si a clorului se obtine acid clorhidric.
7. 1. Electroliza clorurii de sodiu
Pentru a produce sodiu metalic și clor gazos, se utilizează procesul de electroliză a clorurii de sodiu topită. În timpul electrolizei NaCl topit, au loc următoarele procese: la catod - ionii de sodiu se reduc în atomi neutri, adică se formează sodiu metalic; la anod - ionii de clor se oxidează în atomi neutri, iar din aceştia din urmă se formează molecule de clor.
Catod: Na+ + e - Na0 I 2 reducere
Anod: 2Cl- - 2e - Cl20 I 1 oxidare
7. 2. Obținerea de sifon.
Pentru obținere se folosește clorura de sodiu bicarbonat de sodiu. Tehnologia de producere a sifonului: în primul rând, bicarbonatul de amoniu NH4CO3 este obținut din amoniac, dioxid de carbon și apă, care, atunci când reacţionează cu o soluţie de sare de masă, va avea ca rezultat bicarbonat de sodiu NaHCO3 și clorură de amoniu NH4Cl
NaCI+NHCO3=NaHC03+NH4CI
7. 3. Fabricarea săpunului.
De ce se spune că nici măcar nu poți face săpun fără sare? Se pare că pentru a obține de obicei sapun de rufe Se folosește reacția de hidroliză alcalină a grăsimilor.
Acest proces are loc la temperaturi ridicate, în prezența acizilor minerali și alcaline:
H2C – O –OC – C17H35 H2C – OH
HC – O – OC - C17H35 + 3NaOH - HC – OH + 3C17H35 - COONa
H2C – O –OC – C17H35 H2C – OH săpun
Tristearin (grăsimi) glicerină
Reacția de hidroliză este utilizată în tehnologie pentru a produce glicerol, acizi carboxilici și săpun din grăsimi.
Glicerina și acizii se formează atunci când grăsimea este încălzită cu apă în autoclave.
Pentru a produce săpun, acizii sunt încălziți cu soluție de carbonat de sodiu. Pentru a extrage săpunul, în soluție se adaugă clorură de sodiu, iar săpunul plutește în partea de sus sub forma unui strat dens - miezul. Din această masă se prepară așa-numitul săpun de miez - soiuri obișnuite de săpun de rufe.
Să facem următorul experiment: să facem săpun cu și fără sare.
1. Pune 3 g de margarină într-o ceașcă de porțelan (puteți folosi grăsime sau unt) si se adauga 7-8 ml solutie cu fractiune in masa hidroxid de sodiu 0,2. Pentru a accelera reacția, adăugați apă la nivelul inițial. Pentru a verifica dacă a mai rămas vreo grăsime nereacționată, turnez puțin din amestecul fierbinte într-o eprubetă cu apa fierbinte. Dacă, la răcire, nicio picătură de grăsime nu plutește la suprafața apei, atunci procesul de saponificare este complet. Dacă picături de grăsime plutesc la suprafață, atunci continui să fierb amestecul.
După ce reacția de saponificare este finalizată, adaug 3,5 ml dintr-o soluție de sare de masă 20% la masa rezultată și încălzesc amestecul din nou până când săpunul este complet separat. Spre deosebire de apa fierbinte, săpunul este aproape insolubil într-o soluție de sare de masă. Prin urmare, atunci când este sărat, se separă de soluție și plutește în sus.
Stratul apos care rămâne după sărarea săpunului, împreună cu sarea de masă, conține glicerină, care se formează în timpul saponificării grăsimii. Puteți evapora această soluție și, astfel, o puteți îmbogăți cu glicerol. Glicerina este cel mai bine separată de sarea de masă prin distilare la presiune redusă.
În urma acestui experiment, am primit săpun.
2. La efectuarea experimentului fără a adăuga sare, săpunul nu a funcționat.
Concluzie.
Deci, sarea, folosită în trecut în principal pentru alimente, a primit acum o mare varietate de întrebuințări. Și este greu de prezis ce noi industrii economie nationala va mai fi nevoie de ea. Dar și acum clorura de sodiu este implicată în mișcarea submarinelor nucleare, în zborurile navelor spațiale și în crearea unei cantități uriașe de noi materiale în jurul nostru. Analizând utilizarea și importanța enormă a acestei substanțe uimitoare, este imposibil să alegeți ceea ce este mai important: utilizarea sării în viața de zi cu zi sau în industria chimică, efectul acesteia asupra organismului sau producția de substanțe necesare din sodiu. clorură. Putem doar concluziona cu încredere că sarea de masă este sarea numărul 1; nu fără motiv este numită „Sarea Pământului”.
clorură de sodiu NaCl. Moderat solubil în apă, solubilitatea depinde puțin de temperatură: coeficientul de solubilitate al NaCl (în g la 100 g de apă) este de 35,9 la 20 ° C și 38,1 la 80 ° C. Solubilitatea clorurii de sodiu este redusă semnificativ în prezența acid clorhidric, hidroxid de sodiu, săruri cloruri metalice. Se dizolvă în amoniac lichid și intră în reacții de schimb. Densitatea NaCI 2,165 g/cm3, punctul de topire 800,8°C, punctul de fierbere 1465°C.
Se spunea: „Sarea este capul tuturor, fără sare și viața este iarbă”; „Un ochi la poliție (unde este pâinea), celălalt la solonitsa (sare)”, și de asemenea: „Fără pâine nu e sătul, fără sare nu e dulce”... Buryat înțelepciunea populară spune: „Când mergi să bei ceai, pune în el un praf de sare; face ca alimentele să se digere mai repede și bolile de stomac vor dispărea.”
Este puțin probabil să știm când strămoșii noștri îndepărtați au gustat pentru prima dată sarea: suntem despărțiți de ei de zece până la cincisprezece mii de ani. Pe vremea aceea nu existau ustensile pentru gătit, totul produse din plante oamenii erau înmuiați în apă și copți pe cărbuni mocniți, iar carnea, înțepată în bețe, era prăjită în flăcările unui foc. "Sare comună" oameni primitivi probabil că era cenușă care a intrat inevitabil în mâncare în timpul preparării acesteia. Cenușa conține potasiu carbonat de potasiu K 2 CO 3, care în locuri îndepărtate de mări și lacuri sărate, pentru o lungă perioadă de timp servit ca condiment alimentar.
Poate că într-o zi, în lipsa apei proaspete, carnea sau rădăcinile și frunzele plantelor au fost înmuiate în apă sărată de mare sau de lac, iar mâncarea s-a dovedit a fi mai gustoasă decât de obicei. Poate că oamenii au ascuns carnea pe care au recoltat-o pentru o utilizare viitoare în apa de mare pentru a o proteja de păsările de pradă și insecte și apoi au descoperit că a dobândit gust placut. Vânătorii observatori ai triburilor primitive au putut observa că animalelor le place să lingă lingele de sare - cristale albe de sare gemă ieșind ici și colo din pământ și au încercat să adauge sare în hrana lor. Ar putea exista și alte cazuri de prima cunoaștere a oamenilor cu această substanță uimitoare.
Sare de masă pură sau clorură de sodiu NaCl o substanță cristalină incoloră, nehigroscopică (nu absoarbe umezeala din aer), solubilă în apă și care se topește la 801 ° C. În natură, clorura de sodiu apare sub formă de mineral halit sare gema. Cuvântul „halit” provine din grecescul „halos”, însemnând atât „sare”, cât și „mare”. Cea mai mare parte a halitei se găsește cel mai adesea la o adâncime de 5 km sub suprafața pământului. Cu toate acestea, presiunea stratului de rocă situat deasupra stratului de sare îl transformă într-o masă vâscoasă, plastică. Apărând pe alocuri tensiune arterială scăzută roci acoperite, stratul de sare formează „cupole” de sare care ies în mai multe locuri.
Halitul natural este rareori pur alb. Mai des este maroniu sau gălbui din cauza impurităților compușilor de fier. Se găsesc cristale de halit, dar foarte rar. culoarea albastra. Aceasta înseamnă că pentru o lungă perioadă de timp în adâncurile pământului au fost în vecinătatea rocilor care conțineau uraniu și au fost expuși la radiații radioactive.
În laborator puteți obține și cristale albastre de clorură de sodiu. Acest lucru nu necesită radiații; trebuie doar să încălziți un amestec de sare de masă NaCl și o cantitate mică de sodiu metalic Na într-un vas bine închis. Metalul se poate dizolva în sare. Când atomii de sodiu pătrund într-un cristal format din cationi Na + și anioni Cl, ei „completează” rețeaua cristalină, ocupând locuri potrivite și transformându-se în cationi Na +. Electronii eliberaţi sunt localizaţi în acele locuri din cristal în care Cl ? . Astfel de locuri neobișnuiteîn interiorul cristalului, cele ocupate de electroni în loc de ioni sunt numite „locuri vacante”.
Când cristalul se răcește, unele locuri libere se combină, ceea ce face să apară culoarea albastră. Apropo, atunci când un cristal albastru de sare este dizolvat în apă, se formează o soluție incoloră, la fel ca din sarea obișnuită.
Poetul grec Homer (sec. VIII î.Hr.), care a scris IliadaȘi Odiseea, numită sare de masă „divină”. În acele vremuri, era prețuit mai mult decât aurul: la urma urmei, așa cum spunea proverbul, „poți trăi fără aur, dar nu poți trăi fără sare”. Ciocnirile militare au avut loc pe zăcămintele de sare gemă și, uneori, lipsa de sare a provocat „revolte de sare”.
Pe mesele împăraților, regilor, regilor și șahurilor se aflau saline din aur, iar aceștia se ocupau de o persoană deosebit de de încredere - salinerul. Soldații erau adesea plătiți cu sare, iar oficialii primeau rații de sare. De regulă, izvoarele sărate erau proprietatea conducătorilor și a capetelor încoronate. În Biblie există o expresie „bea sare din palatul regelui”, adică o persoană care primește sprijin de la rege.
Sarea a fost mult timp un simbol al purității și al prieteniei. „Voi sunteți sarea pământului”, le-a spus Hristos discipolilor săi, referindu-se la înaltele lor calități morale. Sarea era folosită în timpul sacrificiilor, copiii nou-născuți ai vechilor evrei erau stropiți cu sare, iar în biserici catoliceÎn timpul botezului, în gura bebelușului a fost pus un cristal de sare.
Era obiceiul arabilor, la aprobarea acordurilor solemne, să servească un vas cu sare, din care, în semn de dovadă și garanție a prieteniei constante, persoanele care au încheiat acordul „legământul sării” mâncau mai multe boabe de sare. aceasta. „A mânca împreună o picătură de sare” printre slavi înseamnă să ne cunoaștem bine și să ne facem prieteni. Conform obiceiului rusesc, atunci când aduc oaspeților pâine și sare, ei le urează astfel sănătate.
Sarea de masă nu este doar un produs alimentar, ci a fost mult timp un conservant comun; a fost folosită la prelucrarea materiilor prime din piele și blană. Și în tehnologie este încă materialul de pornire pentru producerea aproape tuturor compușilor de sodiu, inclusiv sifonul.
Sarea de masă a făcut, de asemenea, parte din cele mai vechi medicamente; a fost creditată cu proprietăți vindecătoare, efecte de curățare și dezinfectare și s-a remarcat de mult timp că sarea de masă din diferite depozite are diferite proprietăți biologice: cel mai util în acest sens este cel de mare. ÎN Erborizator, publicat în Rusia în secolul al XVII-lea, scrie: „Două esențe de sare, una a fost săpată din munte, iar cealaltă a fost găsită în mare, și care este din mare, acel lutchi, și pe lângă sarea de mare, acel lutchi, care este alb.”
Cu toate acestea, atunci când consumați sare, trebuie să respectați moderația. Se știe că media europeană zilnic absoarbe până la 15 g de sare cu alimente, în timp ce japonezul mediu consumă aproximativ 40 g. Japonezii sunt cei care dețin campionatul mondial la numărul de pacienți cu hipertensiune arterială - o boală, una dintre cele motive pentru care este că în organism reține mai mult lichid decât are nevoie. Celulele se umflă din excesul său și se micșorează vase de sânge, deci crește tensiune arteriala, din care inima începe să lucreze cu suprasolicitare. De asemenea, devine dificil pentru rinichi, care curăță organismul de excesul de cationi de sodiu.
Nicio plantă nu poate crește pe sol acoperit cu sare; mlaștinile sărate au fost întotdeauna un simbol al pământului sterp și nelocuit. Când conducătorul Sfântului Imperiu Roman, Frederic I Barbarossa, a distrus Milano în Italia în 1155, a ordonat ca ruinele orașului învins să fie stropite cu sare, ca semn al distrugerii sale complete... națiuni diferiteÎn orice moment, a vărsa sare însemna să provoace necazuri și să-ți pierzi sănătatea.
În antichitate, oamenii foloseau mai multe metode pentru extragerea sării de masă: evaporarea naturală a apei de mare în „bazine cu sare”, în care sarea „de mare” cu clorură de sodiu NaCl precipita, apa clocotită din lacurile sărate pentru a obține sare „evaporată” și izbucnirea „ sare rock în minele subterane. Toate aceste metode produc sare cu impurități de clorură de magneziu MgCl 2 6 H 2 O, sulfați de potasiu K 2 SO 4 și MgSO 4 7H 2 O de magneziu și bromură de magneziu MgBr 2 6H 2 O, al cărei conținut ajunge la 8-10%.
În apa de mare, în medie, 1 litru conține până la 30 g de diferite săruri, sarea de masă reprezintă 24 g. Tehnologia de producere a clorurii de sodiu NaCl din apa de mare și lac a fost întotdeauna destul de primitivă.
De exemplu, la sfârșitul „Epocii Bronzului” trei, trei, trei mii și jumătate de ani î.Hr., vechii producători de sare au stropit buștenii apa de mare, iar apoi le-au ars și au luat sare din cenușă. Ulterior, apele sărate au fost evaporate pe foi mari de copt, iar sânge de animal a fost adăugat pentru a îndepărta impuritățile, colectând spuma rezultată. Pe la sfârșitul secolului al XVI-lea. Soluțiile de sare au fost purificate și concentrate prin trecerea prin turnuri umplute cu ramuri de paie și tufiș. Evaporarea soluției de sare în aer s-a realizat și ea într-un mod foarte primitiv, prin turnarea saramurii peste un perete format din mănunchiuri de tufiș și paie.
Fabricarea sării, cea mai veche dintre meșteșugurile chimice, a apărut în Rus', se pare, la începutul secolului al VII-lea. Minele de sare aparțineau călugărilor, care erau favorizați de țarii ruși, nu li se percepea nici măcar o taxă pe sarea pe care o vindeau. Fierberea sării aducea mănăstiri profituri uriașe. Saramurile erau extrase nu numai din lacuri, ci și din izvoarele sărate subterane; foraje care au fost construite în acest scop în secolul al XV-lea. a ajuns la o lungime de 6070 m. Țevile din lemn masiv erau coborâte în puțuri, iar saramurile erau evaporate în tigăi de fier pe un focar cu lemne. În 1780, peste o sută de mii de tone de sare au fost fierte în Rusia în acest fel...
În prezent, sarea de masă este extrasă din zăcămintele lacurilor sărate și zăcămintele de sare gemă și halit.
Sarea de masă nu este doar un condiment alimentar important, ci și o materie primă chimică: din ea se obțin hidroxid de sodiu, sifon și clor.
Stepin B.D., Alikberova L.Yu. Carte de chimie pentru citit acasă, ed. a II-a. M., Chimie, 1995
Lidin R.A. si etc. Proprietăți chimice substante anorganice
: Manual. manual pentru universități / R.A. Lidin, V.A. Molochko, L.L. Andreeva; editat de R.A.Lidina. M., Chimie, 1996
Alikberova L.Yu. Chimie distractivă: O carte pentru elevi, profesori și părinți. M., AST-PRESS, 1999
Stepin B.D., Alikberova L.Yu., Rukk N.S. Produse chimice de uz casnic. Chimia în viața de zi cu zi și pentru fiecare zi. M., RET, 2001
SARE DE MASĂ – clorură de sodiu NaCl. Moderat solubil în apă, solubilitatea depinde puțin de temperatură: coeficientul de solubilitate al NaCl (în g la 100 g de apă) este de 35,9 la 20 ° C și 38,1 la 80 ° C. Solubilitatea clorurii de sodiu este redusă semnificativ în prezența acid clorhidric, hidroxid de sodiu, săruri – cloruri metalice. Se dizolvă în amoniac lichid și intră în reacții de schimb. Densitatea NaCl este de 2,165 g/cm3, punctul de topire este de 800,8°C, punctul de fierbere este de 1465°C.
Se spunea: „Sarea este capul tuturor, fără sare și viața este iarbă”; „Un ochi la poliție (unde este pâinea), celălalt la sare (sare)” și de asemenea: „Fără pâine nu e sătul, fără sare nu e dulce”... Înțelepciunea populară buriată spune: „ Când ai de gând să bei ceai, pune în el un praf de sare; face ca alimentele să se digere mai repede și bolile de stomac vor dispărea.”
Este puțin probabil să știm când strămoșii noștri îndepărtați au gustat pentru prima dată sarea: suntem despărțiți de ei de zece până la cincisprezece mii de ani. Pe vremea aceea nu existau ustensile pentru gătit; oamenii înmuiau toate produsele vegetale în apă și le coaceau pe cărbuni mocniți, iar carnea prăjită în țeapă pe bețișoare în flăcările unui foc. „Sarea de masă” a oamenilor primitivi a fost probabil cenușa, care a ajuns inevitabil în mâncare în timpul preparării sale. Cenușa conține potasiu - carbonat de potasiu K2CO3, care în locuri departe de mări și lacuri sărate a servit mult timp ca condiment alimentar.
Poate că într-o zi, în lipsa apei proaspete, carnea sau rădăcinile și frunzele plantelor au fost înmuiate în apă sărată de mare sau de lac, iar mâncarea s-a dovedit a fi mai gustoasă decât de obicei. Poate că oamenii au ascuns carnea pe care au recoltat-o pentru o utilizare viitoare în apa de mare pentru a o proteja de păsările de pradă și insecte și apoi au descoperit că a căpătat un gust plăcut. Vânătorii observatori ai triburilor primitive au putut observa că animalelor le place să lingă lingele de sare - cristale albe de sare gemă ieșind ici și colo din pământ și au încercat să adauge sare în hrana lor. Ar putea exista și alte cazuri de prima cunoaștere a oamenilor cu această substanță uimitoare.
Sarea de masă pură, sau clorură de sodiu NaCl, este o substanță cristalină incoloră, nehigroscopică (nu absoarbe umezeala din aer), solubilă în apă și care se topește la 801° C. În natură, clorura de sodiu se găsește sub formă de halit mineral - sare gema. Cuvântul „halit” provine din grecescul „halos”, însemnând atât „sare”, cât și „mare”. Cea mai mare parte a halitei se găsește cel mai adesea la o adâncime de 5 km sub suprafața pământului. Cu toate acestea, presiunea stratului de rocă situat deasupra stratului de sare îl transformă într-o masă vâscoasă, plastică. „Plutește în sus” în locurile de presiune scăzută ale rocilor de acoperire, stratul de sare formează „cupole” de sare care ies în mai multe locuri.
Halitul natural este rareori alb pur. Mai des este maroniu sau gălbui din cauza impurităților compușilor de fier. Se găsesc cristale de halit albastru, dar foarte rar. Aceasta înseamnă că pentru o lungă perioadă de timp în adâncurile pământului au fost în vecinătatea rocilor care conțineau uraniu și au fost expuși la radiații radioactive.
În laborator puteți obține și cristale albastre de clorură de sodiu. Acest lucru nu necesită radiații; trebuie doar să încălziți un amestec de sare de masă NaCl și o cantitate mică de sodiu metalic Na într-un vas bine închis. Metalul se poate dizolva în sare. Când atomii de sodiu pătrund într-un cristal format din cationi Na+ și anioni Cl–, ei „completează” rețeaua cristalină, ocupând locuri potrivite și transformându-se în cationi Na+. Electronii eliberați sunt localizați în acele locuri din cristal în care ar fi localizați anionii de clorură de Cl–?. Astfel de locuri neobișnuite din interiorul cristalului, ocupate de electroni în loc de ioni, sunt numite „locuri vacante”.
Când cristalul se răcește, unele locuri libere se combină, ceea ce face să apară culoarea albastră. Apropo, atunci când un cristal albastru de sare este dizolvat în apă, se formează o soluție incoloră - la fel ca sarea obișnuită.
Poetul grec Homer (secolul al VIII-lea î.Hr.), care a scris Iliada și Odiseea, a numit sarea de masă „divină”. În acele vremuri era prețuit mai mult decât aurul: la urma urmei, după cum spuneau ei
Articol din " Marea Enciclopedie"editat de S.N. Yuzhakova, 1904
Sarea (sare de masă, clorură de sodiu), NaCl, un compus chimic format din 39,32 părți sodiu și 60,68 părți clor, se formează atunci când sodiul arde în clor sau când carbonatul de sodiu (sodă) se descompune cu acid clorhidric (acid clorhidric). Sarea de masă se cristalizează în cuburi anhidre care conțin puțin lichior-mamă, în urma cărora se sparg la încălzire. La o temperatură de 10°, sarea de masă se cristalizează în tablete mari cu șase fețe, care se dezintegrează când sunt încălzite în apă și cuburi. Sarea pură nu se umezește în aer; se topește la 772° și se evaporă la cea mai ridicată temperatură, mai ales cu fluxul de aer; la intarire, cristalizeaza in cuburi. Întreaga sa valoare specifică este 2,15. La temperatura de fierbere, sarea este puțin mai solubilă decât la temperatura obișnuită; 100 de părți de apă se dizolvă la:
|
Cantități de sare în greutate |
% greutate sare în soluție |
Greutatea specifică a soluției |
Grame de sare la 1 litru |
|
1 parte sare se dizolvă:
|
Părți de apă |
O soluție cu 26% sare îngheață doar la -18,43°. Soluția saturată fierbe la presiune obișnuită la 109,7° și conține 28,75% sare. Soluțiile de sare saturată pot fi concentrate prin înghețare, iar apa este eliberată sub formă de gheață la temperaturi scăzute. Formarea gheții are loc atunci când cea mai scăzută temperatură, cu cât apa este mai înghețată și cu cât soluția este mai mică, cu atât soluția este mai puternică, iar gheața conține întotdeauna puțină sare. Când sarea este dizolvată în apă, volumul soluției devine mai mic (cu 24,5% din volumul de sare solidă) decât volumul ambelor corpuri înainte de a fi combinate.
Greutatea specifică a soluțiilor de sare la 15°
|
Gravitație specifică |
Gravitație specifică |
Gravitație specifică |
|||
La 15° se dizolvă alcoolul de diferite tărie:
Extracția sării.
Sarea se găsește dizolvată în mod natural în apa oceanelor, mărilor și lacurilor sărate (Marea Caspică, Marea Aral, Marea Moartă, Utah), în izvoare și râuri sărate (Karizakha, care se varsă în Lacul Elton, Rio ensalado în Chile, apa de care contine pana la 32% cloruri racorduri). In stare solida se gaseste sub forma de sare gema, sare de perete si in deserturi. Sarea gemă joacă un rol important în educație Scoarta terestra. În multe țări există zăcăminte uriașe și stocuri de sare gemă pură, anhidrit, dolomit, marnă și gips care conțin sare. Straturile de sare pură sunt adesea acoperite cu un strat de lut purtător de sare, iar în multe locuri există straturi de sare gemă pură una peste alta, alternând cu straturi de lut. Oxenius explică formarea zăcămintelor de sare gemă prin existența golfurilor de adâncime cu strâmtoare aproximativ orizontală, ceea ce permite apa mării doar în măsura în care apa de la suprafața golfului se poate evapora într-o anumită perioadă de timp.
Cu un climat uscat și cald și o evaporare puternică, în strâmtoare se formează o soluție de sare concentrată și, prin urmare, mai grea, care se varsă constant în adâncurile golfului. Din soluția concentrată rezultată, sarea este eliberată în cristale. După ce s-a format un depozit de sare în acest fel și este acoperit deasupra cu săruri mai solubile ale lichidului mamă, ar trebui să se formeze un proces circular când apa de mare curge în golf de sus în strâmtoare, iar lichidul mamă curge de jos. . Primul, amestecat cu o soluție concentrată, precipită gipsul și polihalita, iar cu cât durează mai mult această perioadă, cu atât straturile de acoperire de gips sau anhidrit vor fi mai mari. Dacă în această perioadă golful se desparte de mare, lichidul-mamă se va cristaliza deasupra straturilor de gips și anhidrit. Unele depozite de sare (Stasfurt, Kaluets) sunt acoperite cu un strat gros de săruri din lichiorul mamă cristalizat (Abraumsalze), deși foarte des sunt spălate din nou și rămân doar urme din ele.
În fig. Figura 1 prezintă profilul de dezvoltare a două zăcăminte de sare gemă foarte diferite; stratul vechi inferior de grosime încă necunoscută, cu un amestec de alte minerale anhidrit, polihalit și kieserit, este separat de cel superior prin straturi valoroase de săruri de potasiu, argilă sărată, anhidrit și gips dintr-un depozit mai nou. Acesta din urmă în mine I atinge o grosime de 60 de metri, este acoperit cu gips și un strat de formațiune de gresie pestriță se înclină treptat în sus și reprezintă sare pură, care este minat.
În Germania există zăcăminte mari de sare, ajungând la 1500 de metri în grosime, care se întind de la Helgoland până la Inowraclav și formând zăcăminte de Stasfurt, Erfurt etc. În plus, există zăcăminte în Württemberg, Alsacia, Lorena, Salzburg etc. În Austro-Ungaria , zăcămintele sunt disponibile în Tirol , Salzkamergut, zăcăminte mari din Wieliczka, Bosnia, Stebnik și Zlanina, Sugatage și Siebenbürgen. România are zăcăminte în Alpii Transilvaniei. În plus, în Spania există zăcăminte în Catalonia și Cordoba, în Italia (Sicilia), în Elveția (Bex), Franța (Meurthe et-Moselle, Jura, Ariens, Bas-Pyrenees), în Anglia (Bleshiere, Middler borough on Tees). ). Rusia este foarte bogată în zăcăminte de sare gemă, cele mai importante sunt zăcămintele zăcămintelor Bryansk, provincia Ekaterinoslav, protecția Ilețk din provincia Orenburg, Kulpinsky, zăcămintele Nahicevan, zăcămintele din regiunea Kars, provincia Perm, provincia Astrakhan. și diverse zone ale Siberiei.
Sarea gemă se găsește în aproape toate formațiunile (de la șistul mic până la depozitele terțiare) însoțită de obicei de anhidrit și gips. Multe zăcăminte vin direct la suprafața pământului, altele sunt descoperite datorită operațiunilor de foraj. Dezvoltarea zăcămintelor de sare gemă pură se realizează de obicei prin drifturi, așa cum este indicat în Fig. 2 și 4, Tabelele I. Există, de asemenea, diferențe între săpăturile în formă de sticlă, folosite în România și Ungaria, și săpăturile de tip stâlp, folosite în minele Stassfurt și Bryansk. Dezvoltarea este facilitată de faptul că sarea gemă este un material foarte durabil și vă permite să lucrați fără elemente de fixare. Sarea gemă este adesea complet incoloră și se dezintegrează ușor în cuburi strălucitoare sau formează mase cristaline gălbui, roșiatice și brun-verzui care conțin oxid de fier, argilă, ciliați etc. Tabelul prezintă câteva analize ale sării geme din cele mai importante zăcăminte:
|
Clorura de sodiu |
Clorura de potasiu |
Clorura de calciu |
Clorura de magneziu |
Sulfat de sodiu |
Sulfat de potasiu |
Sulfat de calciu |
Sulfat de magneziu |
Substante insolubile |
||
|
Stassfurt |
||||||||||
|
Stassfurt |
||||||||||
|
Inowraclav |
||||||||||
|
Sumbakovaya |
||||||||||
|
Bakhmutskaya |
||||||||||
|
Permanent |
||||||||||
|
Permanent |
pe langa acestea componente Sarea gema conține compuși de clorură ferică, brom, iod și fluor, amoniac, fosfați, borați etc. Unele probe de sare conțin gaze puternic comprimate (metan, dioxid de carbon, aer), care distrug cristalele atunci când sunt încălzite. Sarea gema se vinde sub forma de blocuri, bucati sau pulbere si se foloseste direct. În locurile de zăcăminte de sare și în natură în general, pe lângă sarea gemă, există numeroase saramuri și izvoare de sare care ies la suprafața pământului sau umplu minele special construite în acest scop, de unde sunt pompate saramurele. Astfel de izvoare sunt foarte rar saturate și conțin de la 2% până la 24% sare de masă cu un amestec de săruri sulfat și clorură ale altor metale, fier, silice etc. În plus, apele izvoarelor conțin: ioduri, bromuri, compuși de rubidiu, cesiu, talie, materie organică, acid carbonic etc. Saramurile puternice sunt evaporate, saramurale slabe sunt concentrate prin congelare (Ohotsk, Irkutsk) sau prin evaporarea lor la temperatura obisnuita). Saramurile slabe sunt mai întâi prelucrate în turnuri de răcire (vezi tabel), purificate, aduse la o concentrație de 15-20% și apoi evaporate. Pentru a lucra cu turnuri de răcire, este mai bine să folosiți cea mai caldă perioadă a anului; în Germania există 200-260 de zile pe an.
O saramură suficient de concentrată și purificată, când este fiartă, este condensată prin încălzire sau evaporare în fabrici de sare (vezi tabel), unde se obține sare fin sau grosier cristalină. Primul constă, de obicei, dintr-o piramidă goală, încasată, cu laturi în trepte constând din cuburi individuale. Cuvele sau rezervoarele de evaporare sunt de obicei plate, făcute din fier și încălzite fie pur și simplu cu cărbune sau abur, fie prin eliberarea de gaze fierbinți pe suprafața soluției. Dimensiunea cazanelor variază de la 45 la 335 de metri pătrați. m. La începutul operațiunii, saramura se fierbe puternic, în timp ce spuma și nămolul rezultat sunt îndepărtate și se adaugă saramură nouă până când soluția este saturată prin fierbere, se lasă să se limpezească și se transferă în alte cuve în care începe sarea. a forma. Sarea rezultată este de obicei de culoare albă, dar cu munca constantă se murdărește, pentru a evita că este necesară eliberarea lichiorului mamă, apoi sarea se usucă în încăperi speciale sau în cazane de fier încălzite de jos (vezi tabel). Cea mai bună sare de masă este centrifugată și uscată în vase de cupru conservate prin suflare de aer fierbinte.
În Anglia, saramura fierbinte, concentrată este turnată în forme de lemn, în care se întărește în blocuri, care se usucă treptat în uscătoare.
Ape marii la 1 metru cub. metru conțin în medie 26-31 kg. clorură de sodiu, 3-7 kg. clorură de magneziu, 0,5-6 kg. sulfat de magneziu, 0,14-6 kg. sulfat de var, 0,0111 kg. clorura de potasiu. Multe lacuri sărate sunt asediate în timpul sezonului cald cantitati mari săruri sub formă de ciorchini care sunt ușor de extras (Lacul Elton, Utakh, Kara-Bugaz). În sudul Rusiei, golfurile și estuarele naturale sunt folosite pentru a evapora apa de mare până când se formează un strat de sare de 2 până la 30 cm grosime. În climă caldă de pe malul mării, cantități mari de sare sunt extrase din apa de mare, cum ar fi în Portugalia, Spania și Franța pe coastă. Marea Mediterana(Languedoc) și Oceanul Atlantic, în Italia, Dalmația, Istria și în Statele Unite. Pentru a face acest lucru, ei construiesc garduri căptușite cu lut, cu o zonă mare de evaporare, formând un sistem de bazine plate umplute cu apă de mare prin pompe sau împrejmuind golfurile. Mai întâi, în ele se depune oxid de fier, apoi gips, urmat de cristalizarea sării de masă. Sarea care precipită prima este cea mai pură și se folosește pentru masă. La sfârșitul verii, bazinele de cristalizare se usucă, sarea se îngrămădește și este expusă la umiditatea aerului, care o curăță de lichidul mamă și, dacă vor să o obțină într-o formă complet pură, se recristalizează. De obicei, rezultatul este 80-85% sare conținută în apa de mare. Cu o evaporare mai mare se obține un amestec de clorură de sodiu și sulfat de magneziu, aducându-l la compoziția 2NaCl + MgS04, dizolvând în apă și răcind cu mașini de gheață la -6°, sarea Glauber Na2SO4 este forțată să cristalizeze. Ultimul lichior-mamă din iarnă dă sare amară MgSO4. Cu o evaporare suplimentară în timpul verii, se obține sare de masă, sulfat de magneziu și kainit, iar soluția rămasă este procesată în brom.
Sarea de masă conține aproape întotdeauna cantități mici compuși sulfatați și clorurați de sodiu, calciu, magneziu și potasiu, mai rar și doar urme de oxid de fier și compuși bromurați de potasiu și sodiu. Datorita continutului clorura de calciuși magneziu, este umed în aer. Conținutul de apă nu trebuie să depășească 6%.
Sarea de masă este foarte frecventă în organismele animale și în lichidele acestora din urmă în cantități predominante față de altele minerale. Conținutul său în sânge este de obicei constant și nu depinde de nutriție. Saliva, sucul gastric, mucusul, puroiul și exsudatele inflamatorii sunt deosebit de bogate în ea. Toată sarea de masă provine din alimente și părăsește organismul prin urină, excremente, gură, nas și transpirație. Persoana normala cu o greutate de 64 kg. excretă 11,9 grame de sare de masă pe zi în urină, transferând o parte din ea către alți compuși din organism. Sarea acționează în organism, în primul rând, prin influența sa asupra proceselor de difuzie, ea factor principal mișcarea lichidelor și servește drept sursă pentru formarea acidului clorhidric suc gastric. Adăugarea lui în alimente determină o creștere a digestiei, iar instinctul uman recunoaște adăugarea lui ca fiind ceva necesar, care este dezvoltat în rândul tuturor popoarelor în orice moment.
Este de remarcat faptul că sarea de masă este necesară pentru animalele care mănâncă alimente vegetale și nu mănâncă carne. CU partea chimică sarea de masă din organism produce acid clorhidric în sucul stomacului; este posibil ca acesta să fie strâns legat de formarea celulelor. Cantitatea de sare de masă necesară pe an pentru o persoană este calculată a fi de 7,5 kg. Despre efectul sării de masă în regnul vegetal se cunosc puține lucruri sigure, dar excesul său dăunează semințelor și formează sol infertil. În unele cazuri, este util prin faptul că transformă sărurile de calciu, fosfații etc., care sunt necesari plantelor, în compuși solubili, care sunt utilizați pentru îngrășământ.
În tehnologie, sarea de masă este folosită pentru prepararea sodei, a clorului, a amoniacului, în metalurgie pentru prăjirea cu clor a minereurilor de argint și a cuprului sărac, la prepararea aluminiului, la producerea sodiului, pentru săpun, la prepararea tutunului. , ape minerale, bai, pentru glazurarea produselor din argila, pentru conservarea lemnului de nave si traverse, pentru saratul pestelui, carnii, untului. ÎN agricultură sarea de masă este folosită pentru îngrășământ și hrana animalelor.
Extracția sării pt anul trecutîn diferite țări este prezentat în tabel în milioane de puși:
|
1891 |
1894 |
1898 |
1899 |
1900 |
|
|
Marea Britanie |
|||||
|
Germania |
|||||
|
Statele Unite |
|||||
Peste 10 ani, producția de sare din Rusia este prezentată în următorul tabel în puds:
|
Al anului |
Piatră |
Auto-sedimentară |
Evaporare |
Total |
Vezi Karsten, „Salinonkunde” (Berl., 1846-47, 2 vol.); Kerl, „Salinenkunde”; Hehn, „Das Salz” (1873); Moeller, „Das Salinen in seiner kulturgeschichtlichen und naturwissenschaftlichen Bedeutung” (1874); Schwarz, „Vorkommen und Bildung des Steinsalzes” (Halle, 1885); Wagner, „Tehnologia chimică”; Dammer, Chemische Technologie.
Articolul „Sarea” din „Marea Enciclopedie” ed. S.N. Yuzhakova, Sankt Petersburg, „Iluminismul”, 1904, volumul 17, p. 654-657
Articole similare
-
Aperitiv picant de vinete pentru iarna
Vinetele este o legumă pe care mulți oameni o iubesc și există atât de multe moduri de a o pregăti. Și deși astăzi sunt disponibile pe tot parcursul anului, costul vinetelor proaspete iarna este destul de mare. De aceea mulți oameni încearcă să se pregătească...
-
Conserve de vinete
Rețete de gătit: Multe gospodine folosesc rar această legumă ca preparat sau, în general, ca fel de mâncare. Dar în zadar. Acest produs conține o cantitate incredibilă de substanțe utile, care merită doar fibra. Este util pentru intarirea...
-
Salata coreeană de castraveți - un preparat picant pentru iarnă
Castraveții cu semințe de susan sunt un aperitiv ușor, picant și rapid, care se potrivește bine cu mezeluri și o varietate de garnituri. Pentru a vă pregăti, veți avea nevoie de doar 20 de minute de timp liber și de dorința de a vă surprinde familia cu un nou...
-
Mâncăruri din morcovi care te vor înnebuni Salate de morcovi dietetice
Salata de slabit cu mere si morcovi este ideala pentru oricine intentioneaza sa slabeasca rapid. Se știe de mult că salatele dietetice te ajută să slăbești rapid și ieftin, fără înfometare obositoare. În plus, o salată simplă de mere și...
-
Rețete de smoothie-uri delicioase și sănătoase
Principalele avantaje ale smoothie-urilor cu mere sunt caracterul lor revigorant și textura surprinzător de plăcută, ușoară, familiară și care ajută la normalizarea digestiei nu mai puțin decât merele proaspete. Aceste fructe suculente și aromate fac absolut...
-
Somon roz copt într-o mânecă cu cartofi Cum să gătești somon roz într-o pungă de copt
Care sunt beneficiile diferitelor mâneci și pungi de copt? Fiecare gospodină competentă înțelege că valoarea lor constă nu numai în gustul și bogăția felului de mâncare, ci și în consumul minim de energie ulterior pentru spălarea vaselor. Manecile si pungile de copt au ramas...
