Biochimia glicogenezei. Sinteza glicogenului și glicogenoliza. Semnificația biologică și reglarea acestor procese și rolul ficatului în implementarea lor.
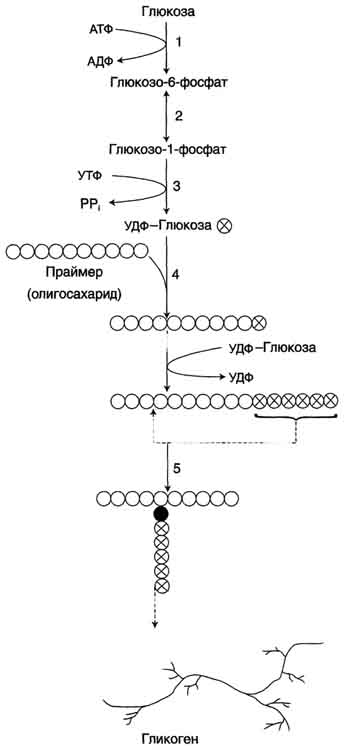
Glicogenul este carbohidrat complex, constând din molecule de glucoză legate într-un lanț.
Sinteza glicogenului (glicogeneza) are loc în decurs de 1-2 ore după ingerarea alimentelor cu carbohidrați. Sinteza glicogenului are loc cel mai intens în ficat. În plus, glicogenul este sintetizat în muschii scheletici.
O moleculă de glicogen conține aproximativ un milion de unități de glucoză. Acest fapt sugerează că organismul cheltuiește o cantitate considerabilă de energie pentru producerea de glicogen.
Defalcarea glicogenului
Defalcarea glicogenului (glicogenoliza) are loc în perioadele dintre mese. În acest moment, ficatul descompune glicogenul din el cu o anumită viteză, ceea ce permite organismului să mențină concentrația de glucoză din sânge la un nivel constant.
Rolul biologic al glicogenului
Glucoza este principalul material energetic al organismului, susținând funcțiile sale de bază. Ficatul stochează glucoza sub formă de glicogen nu atât pentru propriile nevoi, ci pentru a asigura fluxul de glucoză către alte țesuturi - în principal globule roșii și creier.

După cum sa menționat mai sus, celulele musculare, ca și celulele hepatice, sunt, de asemenea, capabile să transforme glucoza în glicogen. Cu toate acestea, glicogenul conținut în mușchi este cheltuit doar pentru munca musculară. Cu alte cuvinte, glicogenul din mușchi rămâne o sursă de glucoză doar pentru celula însăși, în timp ce glicogenul stocat în ficat, după ce a fost procesat în glucoză, este cheltuit pentru hrănirea întregului organism și, cel mai important, pentru menținerea concentrației necesare de glucoză. în sânge.
Sinteza și descompunerea glicogenului
Sinteza și descompunerea glicogenului sunt reglementate de sistem nervos si hormoni. Acestea sunt două procese independente care au loc în diverse moduri. Așa cum am discutat deja, rolul principal al glicogenului este de a regla concentrația de glucoză în sânge, precum și de a crea rezerva de glucoză necesară pentru o muncă musculară intensă.
Metabolismul glicogenului în ficat, mușchi și alte celule este reglat de mai mulți hormoni, dintre care unii activează sinteza glicogenului, iar alții - descompunerea glicogenului. în care într-o cușcă Sinteza și descompunerea glicogenului nu pot avea loc simultan - acestea sunt procese opuse cu sarcini complet diferite. Sinteza și degradarea se exclud reciproc sau, cu alte cuvinte, sunt reciproce.
Activitatea enzimelor cheie ale metabolismului glicogenului glicogen fosforilazăȘi glicogen sintetaza variază în funcție de prezența acidului fosforic în enzimă - sunt active fie în fosforilat, fie în defosforilat formă.
Adăugarea de fosfați la enzimă este efectuată de protein kinaze, sursa de fosfor este ATP:
- fosforilază glicogenul este activat după adăugarea unei grupări fosfat,
- sintaza glicogenul este inactivat după adăugarea de fosfat.
Viteza de fosforilare a acestor enzime crește după expunerea la celulă adrenalina , glucagonși alți hormoni. Ca urmare, epinefrina și glucagonul provoacă glicogenoliza prin activarea glicogen fosforilazei.
De exemplu,
- în timpul lucrului muscular adrenalină determină fosforilarea enzimelor metabolice intramusculare a glicogenului. Ca rezultat, glicogen fosforilaza este activată și sintaza este inactivată. Glicogenul se descompune în mușchi și se formează glucoza pentru a furniza energie pentru contracția musculară.
- în timpul postului, ca răspuns la scăderea glicemiei, este secretată de pancreas glucagon. Afectează hepatocitele și provoacă fosforilarea enzimelor metabolice de glicogen, ceea ce duce la glicogenoliza și la creșterea glicemiei.
Modificări ale activității enzimelor din metabolismul glicogenului în funcție de condiții
Metode de activare a glicogen sintazei
alosterică glicogen sintaza este activată glucoză-6-fosfat.
O altă modalitate de a-și schimba activitatea este chimic(covalent) modificare. Când se adaugă fosfat, glicogen sintetaza încetează să funcționeze, adică. ea este activă în de forma fosforilata. Se efectuează îndepărtarea fosfatului din enzime proteine fosfataze. Acționează ca un activator al proteinelor fosfatazei insulină– ca urmare, crește sinteza glicogenului.
Împreună cu asta, insulinăȘi glucocorticoizii accelerează sinteza glicogenului, crescând numărul de molecule glicogen sintetaza.
Metode de activare a glicogen fosforilazei
Viteza glicogenolizei este limitată doar de viteza glicogen fosforilazei. Activitatea sa se poate modifica în trei moduri:
- modificare covalentă,
- activare dependentă de calciu,
- activare alosterică de către AMP.
Modificarea covalentă a fosforilazei
Când anumiți hormoni acționează asupra celulei, enzima este activată prin mecanismul adenilat-ciclazei, care este așa-numita reglare în cascadă. Secvența evenimentelor în acest mecanism include:
- Molecula de hormon ( adrenalină, glucagon) interacționează cu receptorul său;
- Complexul hormon-receptor activ acționează asupra membranei proteina G;
- Proteina G activează enzima adenilat ciclază;
- Adenilat ciclaza transformă ATP în AMP ciclic(cAMP) – mesager secundar (mesager);
- cAMP activează alosteric enzima protein kinaza A;
- Protein kinaza A fosforilează diferite proteine intracelulare:
- una dintre aceste proteine este glicogen sintetaza, activitatea sa este suprimată,
- altă proteină - fosforilaz kinaza, care este activat la fosforilare;
- Fosforilază kinazei fosforilați fosforilaza "b" glicogenul, acesta din urmă se transformă în fosforilază activă „a”;
- Activ fosforilaza "a" glicogenul scindează legăturile α-1,4-glicozidice din glicogen pentru a forma glucoză-1-fosfat.

Metoda adenilat-ciclazei de activare a glicogen fosforilazei
Pe lângă hormonii care influențează activitatea adenilat-ciclazei prin intermediul proteinelor G, există și alte modalități de reglare a acestui mecanism. De exemplu, după expunere insulină enzima este activată fosfodiesteraza, care se hidrolizează tabără prin urmare reduce activitate glicogen fosforilază.
Activare dependentă de calciu
Unii hormoni afectează metabolismul carbohidraților prin mecanismul calciu-fosfolipide. Activarea de către ionii de calciu implică activarea fosforilază kinazei nu de către protein kinazei, ci de către ionii de Ca 2+ și calmodulină. Această cale funcționează prin inițierea căii calciu-fosfolipide. Această metodă se justifică, de exemplu, când sarcina musculara, Dacă influente hormonale prin adenilat ciclază sunt insuficiente, dar în citoplasmă sub influență impulsuri nervoase Intră ionii de Ca 2+.

Schema rezumativă a metodelor de activare a fosforilazei
Activare alosterică
Există, de asemenea, activarea glicogen fosforilazei prin AMP - activare alosterică datorită adăugării de AMP la molecula de fosforilază „b”. Metoda funcționează în orice celulă - cu o creștere a consumului de ATP și acumularea produselor sale de descompunere.
VI. METABOLISMUL GLICOGENULUI
Multe țesuturi sintetizează glicogenul ca formă de rezervă de glucoză. Sinteza și descompunerea glicogenului asigură o concentrație constantă de glucoză în sânge și creează un depozit pentru utilizarea acestuia de către țesuturi, după cum este necesar.
A. Structura și funcțiile glicogenului
Glicogenul este un homopolimer ramificat al glucozei în care reziduurile de glucoză sunt conectate în regiuni liniare printr-o legătură α-1,4-glicozidică. În punctele de ramificare, monomerii sunt legați prin legături α-1,6-glicozidice. Aceste legături se formează cu aproximativ fiecare al zecelea reziduu de glucoză. Prin urmare, punctele de ramificare în glicogen apar aproximativ la fiecare zece reziduuri de glucoză. Aceasta are ca rezultat o structură asemănătoare arborelui cu o greutate moleculară >107D, care corespunde la aproximativ 50.000 de reziduuri de glucoză (Fig. 7-21). Astfel, în molecula de glicogen există o singură grupă OH anomerică liberă și, prin urmare, un singur capăt reducător.
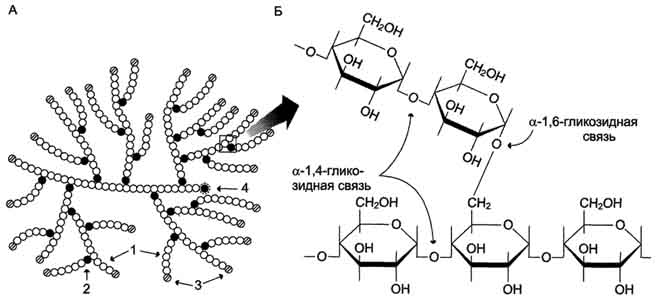
Orez. 7-21. Structura glicogenului. A. Structura moleculei de glicogen: 1 - reziduuri de glucoză legate printr-o legătură α-1,4-glicozidică; 2 - reziduuri de glucoză legate printr-o legătură α-1,6-glicozidică; 3 - monomeri terminali nereductori; 4 - monomer terminal reducător. B. Structura unui fragment separat al moleculei de glicogen.
În celulele animale, glicogenul este principala polizaharidă de rezervă. Când glucoza se polimerizează, solubilitatea moleculei de glicogen rezultată scade și, în consecință, efectul acesteia asupra presiune osmotica intr-o cusca. Această împrejurare explică de ce glicogenul este depus în celulă, și nu glucoza liberă.
Glicogenul este stocat în citosolul celulei sub formă de granule cu diametrul de 10-40 nm. Unele enzime implicate în metabolismul glicogenului sunt, de asemenea, asociate cu granulele, ceea ce facilitează interacțiunea acestora cu substratul. Structura ramificată a glicogenului determină un numar mare de monomeri terminali, care facilitează activitatea enzimelor care elimină sau adaugă monomeri în timpul descompunerii sau sintezei glicogenului, deoarece aceste enzime pot lucra simultan pe mai multe ramuri ale moleculei. Glicogenul se depune în principal în ficat și mușchii scheletici.
Dupa masa, bogat în carbohidrați, rezerva de glicogen din ficat poate fi de aproximativ 5% din masa sa. Aproximativ 1% glicogen este stocat în mușchi, dar masa tesut muscular mult mai mult și deci total Există de 2 ori mai mult glicogen în mușchi decât în ficat. Glicogenul poate fi sintetizat în multe celule, de exemplu în neuroni, macrofage și celule de țesut adipos, dar conținutul său în aceste țesuturi este nesemnificativ. Organismul poate conține până la 450 g de glicogen.
Defalcarea glicogenului hepatic servește în principal la menținerea nivelului de glucoză din sânge în perioada post-absorbție. Prin urmare, conținutul de glicogen din ficat se modifică în funcție de ritmul de nutriție. Cu postul prelungit, scade la aproape zero. Glicogenul muscular servește ca rezervă de glucoză, o sursă de energie în timpul contracției musculare. Glicogenul muscular nu este utilizat pentru a menține nivelul de glucoză din sânge. După cum am menționat mai devreme, celulele musculare nu conțin enzima glucoză-6-fosfatază, iar formarea glucozei libere este imposibilă. Consumul de glicogen în mușchi depinde în principal de activitate fizica(Figura 7-22).
B. Sinteza glicogenului (glicogenogeneza)
Glicogenul este sintetizat în timpul digestiei (1-2 ore după consumul de alimente cu carbohidrați). Trebuie remarcat faptul că sinteza glicogenului din glucoză (Fig. 7-23), ca orice proces anabolic, este endergonic, adică. care necesită cheltuieli de energie.

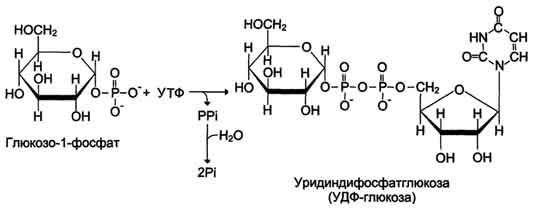
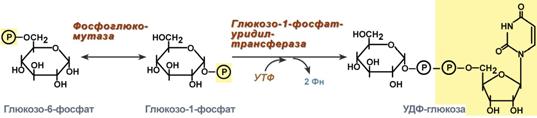
Glucoza care intră în celulă este fosforilată cu participarea ATP (reacția 1). Apoi glucoză-6-fosfat în timpul reacție reversibilă transformat în glucoză-1-fosfat (reacția 2) sub acțiunea enzimei fosfoglucomutaze. Conform stării sale termodinamice, glucoza-1-fosfat ar putea servi ca substrat pentru sinteza glicogenului. Dar datorită reversibilității reacției glucoză-6-fosfat ↔ glucoză-1-fosfat, sinteza glicogenului din glucoză-1-fosfat și descompunerea acestuia ar fi, de asemenea, reversibile și, prin urmare, necontrolabile. Pentru ca sinteza glicogenului să fie ireversibilă termodinamic, este necesară o etapă suplimentară de formare a uridin difosfat glucoză din UTP și glucoză 1-fosfat (reacția 3). Enzima care catalizează această reacție este numită după reacția inversă: UDP-glucopirofosforilază. Cu toate acestea, în celulă nu are loc reacția inversă, deoarece pirofosfatul format în timpul reacției directe este descompus foarte rapid de pirofosfatază în 2 molecule de fosfat (Fig. 7-24).
Reacția de formare a UDP-glucozei determină ireversibilitatea întregii serii de reacții care apar în timpul sintezei glicogenului. Acest lucru explică și imposibilitatea decăderii
Orez. 7-23. Sinteza glicogenului. 1 - glucokinaza sau hexokinaza; 2 - fosfoglucomutaza; 3 - UDP-glucropirofosforilază; 4 - glicogen sintetaza (glucoziltransferaza); 5 - enzima de „ramificare” (amilo-1,4 → 1,6-glucoziltransferaza), cercurile deschise și umbrite sunt reziduuri de glucoză, cercurile umplute sunt reziduuri de glucoză la punctul de ramificare.
glicogenul prin simpla inversare a procesului de sinteză a acestuia.
Educat UDP-glucoză utilizat în continuare ca donor de reziduu de glucoză în timpul sintezei glicogenului (Fig. 7-23, reacția 4). Această reacție este catalizată de o enzimă glicogen sintaza (glucoziltransferaza). Deoarece această reacție nu folosește ATP, enzima se numește mai degrabă sintetază decât sintetază. Partea nucleotidă a UDP-glucozei joacă un rol semnificativ în acțiunea glicogen sintetazei, îndeplinind funcția de „mâner” cu ajutorul căruia enzima poziționează glucoza în lanțul polizaharidic în poziția dorită. În plus, fragmentul nucleotidic al UDP-glucozei pare a fi necesar pentru recunoașterea substratului în timpul catalizei.
Deoarece glicogenul din celulă nu este niciodată complet descompus, sinteza glicogenului se realizează prin prelungirea unei molecule de polizaharidă existentă numită "samanta", sau "grund". Moleculele de glucoză sunt atașate secvenţial de „sămânţă”. Structura moleculei „sămânță” pare să predetermina tipul de legătură care apare în reacția de transglicozilare. Astfel, se sintetizează o polizaharidă, asemănătoare ca structură cu cea „sămânță”. „Sămânța” poate include proteina glicogenină, în care un lanț de oligozaharidă (aproximativ 8 resturi de glucoză) este atașat la gruparea OH a unuia dintre resturile de tirozină. Reziduurile de glucoză sunt transferate de glicogen sintetaza la capătul nereducător al oligozaharidei și legate prin legături α-1,4-glicozidice. La terminarea sintezei, glicogenina rămâne inclusă în granula de glicogen.
Structura ramificată a glicogenului se formează cu participarea amilo-1,4 →1,6-glucoziltransferazei, numită enzima „ramificație” (din engleză, enzimă de ramificare). Odată ce glicogen sintetaza extinde regiunea liniară până la aproximativ 11 resturi de glucoză, enzima de ramificare își transferă blocul terminal, care conține 6-7 resturi, la un reziduu intern de glucoză din acest sau alt lanț. La punctul de ramificare, restul terminal de glucoză al oligozaharidei se combină cu gruparea hidroxil în poziţia C6 pentru a forma o legătură a-1,6-glicozidică. Punct nou ramificarea se poate forma la o distanta de cel putin 4 reziduuri fata de oricare existent. Astfel, pe măsură ce glicogenul este sintetizat, numărul ramurilor crește de multe ori. Capetele lanțurilor servesc ca puncte de creștere ale moleculei în timpul sintezei și începutul în timpul dezintegrarii sale.
B. Defalcarea glicogenului (glicogenoliza)
Defalcarea sau mobilizarea glicogenului are loc ca răspuns la o creștere a nevoii de glucoză a organismului. Glicogenul hepatic se descompune în principal în intervalele dintre mese, în plus, acest proces din ficat și mușchi se accelerează în timpul muncii fizice.
Descompunerea glicogenului (Fig. 7-25) are loc prin scindarea secvenţială a reziduurilor de glucoză sub formă de glucoză-1-fosfat. Legătura glicozidică este scindată folosind fosfat anorganic, astfel încât procesul se numește fosforoliză, iar enzima este glicogen fosforilază.
La fel ca și sinteza, descompunerea glicogenului începe de la capătul nereducător al polizaharidei.
lanţuri. În același timp, prezența unei structuri ramificate a glicogenului facilitează eliberarea rapidă a reziduurilor de glucoză, deoarece cu cât o moleculă de glicogen are mai multe capete, cu atât mai multe molecule de glicogen fosforilază pot acționa simultan.
Glicogen fosforilaza scindează numai legături α-1,4-glicozidice (reacția 1). Scindarea secvenţială a resturilor de glucoză se opreşte atunci când 4 monomeri rămân înaintea punctului de ramificare. Această caracteristică în acțiunea glicogen fosforilazei se datorează dimensiunii și structurii centrului său activ.
Descompunerea ulterioară a glicogenului necesită participarea altor două enzime. În primul rând, cele trei reziduuri de glucoză rămase până la punctul de ramificare sunt transferate cu participarea oligozaharid transferazei (reacția 2) la capătul nereducător al lanțului adiacent, prelungindu-l și creând astfel condiții pentru acțiunea fosforilazei. Reziduul de glucoză rămas în punctul de ramificare este scindat hidrolitic de către α-1,6-glucozidază sub formă de glucoză liberă (reacția 3), după care secțiunea neramificată a glicogenului poate fi din nou atacată de fosforilază.
Se crede că transferul a trei resturi de glucoză și îndepărtarea monomerului din punctul de ramificare (reacțiile 2 și 3) sunt catalizate de aceeași enzimă, care are două activități enzimatice diferite - transferază și glicozidază. Se numește enzimă „de ramificare” (din engleză, enzima de deramificare).
Produsul glicogen fosforilazei, glucoza-1-fosfat, este apoi izomerizat la glucoză-6-fosfat de către fosfoglucomutază. Apoi, glucoza-6-fosfatul este inclus în procesul de catabolism sau în alte căi metabolice. În ficat (dar nu în mușchi), glucoza-6-fosfatul poate fi hidrolizat pentru a forma glucoză, care este eliberată în sânge. Această reacție este catalizată de enzima glucozo-6-fosfatază. Reacția are loc în lumenul ER, unde glucoza-6-fosfatul este transportat folosind o proteină specială. Enzima este localizată pe membrana ER în așa fel încât centru activ cu fața către lumenul ER. Produșii de hidroliză (glucoză și fosfat anorganic) sunt, de asemenea, returnați în citoplasmă folosind sisteme de transport.
![]()
Orez. 7-25. Defalcarea glicogenului.În cadru este un fragment de glicogen cu un punct de ramificare. Cercul umplut este un reziduu de glucoză legat printr-o legătură α-1,6-glicozidică; cercurile deschise și umbrite sunt reziduuri de glucoză în regiuni liniare și ramuri laterale legate printr-o legătură α-1,4-glicozidică. 1 - Glicogen fosforilază; 2 - oligozaharid transferaza; 3-a-1,6-glucozidază.
G. Semnificație biologică schimbul de glicogen în ficat și mușchi
Figura 7-26 arată schema generala sinteza și descompunerea glicogenului și reglarea acestor procese de către hormoni.
Compararea acestor procese ne permite să tragem următoarele concluzii:
- sinteza și descompunerea glicogenului se desfășoară prin diferite căi metabolice;
- ficatul stochează glucoza sub formă de glicogen nu atât pentru nevoile proprii, ci pentru a menține o concentrație constantă de glucoză în sânge și, prin urmare, asigură furnizarea de glucoză către alte țesuturi. Prezența glucozo-6-fosfatazei în ficat provoacă acest lucru functie principala ficatul în metabolismul glicogenului;
- funcția glicogenului muscular este de a elibera glucoză-6-fosfat, care este consumat în mușchi pentru oxidare și utilizarea energiei;
- Sinteza glicogenului este un proces endergonic. Astfel, 1 mol de ATP și 1 mol de UTP sunt utilizate pentru a încorpora un reziduu de glucoză în lanțul polizaharidic;
- descompunerea glicogenului în glucoză-6-fosfat nu necesită energie;
- Ireversibilitatea proceselor de sinteză și descompunere a glicogenului este asigurată de reglarea acestora.
Mobilizarea glicogenului (glicogenoliza)
Rezervele de glicogen sunt utilizate diferit în funcție de caracteristici funcționale celule.
Glicogen ficat se descompune atunci când concentrația de glucoză din sânge scade, în primul rând între mese. După 12-18 ore de post, rezervele de glicogen din ficat sunt complet epuizate.
ÎN muşchii cantitatea de glicogen scade de obicei doar in timpul activitatii fizice – de lunga durata si/sau intensa. Glicogenul este folosit aici pentru a furniza glucoză pentru activitatea miocitelor înseși. Astfel, mușchii, ca și alte organe, folosesc glicogenul doar pentru nevoile proprii.
Mobilizarea (defalcarea) glicogenului sau glicogenoliza activat atunci când există o lipsă de glucoză liberă în celulă și, prin urmare, în sânge (post, munca musculara). în care nivelul glucozei din sânge„intenționat” acceptă numai ficat, care conține glucoză-6-fosfatază, care hidrolizează esterul fosfat al glucozei. Glucoza liberă formată în hepatocit iese prin membrană plasmaticăîn sânge.
Trei enzime sunt direct implicate în glicogenoliză:
1. Glicogen fosforilaza(coenzima piridoxal fosfat) - scindează legăturile α-1,4-glicozidice pentru a forma glucoză-1-fosfat. Enzima funcționează până când rămân 4 reziduuri de glucoză înainte de punctul de ramificare (legatură α1,6).
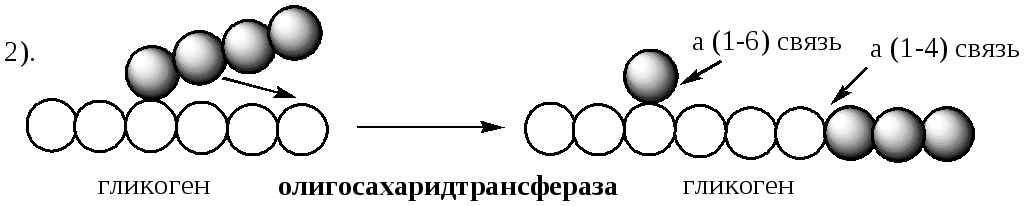
2. a(1,4)-a(1,4)-glucantransferaza– o enzimă care transferă un fragment din trei resturi de glucoză într-un alt lanț cu formarea unei noi legături α1,4-glicozidice. În acest caz, un reziduu de glucoză și o legătură α1,6-glicozidică accesibilă „deschisă” rămân în același loc.
3. Amilo-α1,6-glucozidază, ("deramificare„enzimă) – hidrolizează legătura α1,6-glicozidică pentru a elibera gratuit glucoză (nefosforilată). Ca rezultat, se formează un lanț fără ramuri, servind din nou ca substrat pentru fosforilază.
Rolul enzimelor în descompunerea glicogenului
Glicogenul poate fi sintetizat în aproape toate țesuturile, dar cele mai mari rezerve de glicogen se găsesc în ficat și mușchii scheletici.
Cantitatea de glicogen din mușchi este în scădere de obicei numai în timpul activității fizice – prelungite și/sau obositoare. Acumulare nivelurile de glicogen sunt observate aici în perioada de recuperare, mai ales atunci când consumați alimente bogate în carbohidrați.
Glicogenul hepatic despica atunci când concentrația de glucoză din sânge scade, în special între mese ( post-absorbtiv perioadă). După 12-18 ore de post, rezervele de glicogen din ficat sunt complet epuizate. Se acumulează glicogen în ficat numai după mese, cu hiperglicemie. Acest lucru se explică prin caracteristicile hexokinazei hepatice (glucokinazei), care are o afinitate scăzută pentru glucoză și poate funcționa doar la concentrații mari.
La concentratii normale glucoza din sânge nu este absorbită de ficat.
Următoarele enzime sintetizează direct glicogenul:
1. Fosfoglucomutaza– transformă glucoza-6-fosfat în glucoză-1-fosfat;
2. Glucozo-1-fosfat uridiltransferaza– o enzimă care realizează reacția cheie de sinteză. Ireversibilitatea acestei reacții este asigurată de hidroliza difosfatului rezultat;
Reacții de sinteză UDP-glucoză
3. Glicogen sintetaza– formează legături α1,4-glicozidice și prelungește lanțul de glicogen prin atașarea C1 activat al UDP-glucozei de restul C4 terminal al glicogenului;

Chimia reacției glicogen sintazei
4. Amilo-a1,4-a1,6-glicoziltransferaza enzima „ramificare a glicogenului” - transferă un fragment cu o lungime minimă de 6 resturi de glucoză în lanțul adiacent cu formarea unei legături α1,6-glicozidice.

Multe țesuturi sintetizează glicogenul ca formă de rezervă de glucoză. Sinteza și descompunerea glicogenului în ficat menține homeostazia glicemiei.
Glicogen - o homopolizaharidă ramificată de glucoză cu o masă >10 7 Da (50.000 de resturi de glucoză), în care resturile de glucoză sunt legate în secțiuni liniare printr-o legătură α-1,4-glicozidică. În punctele de ramificare, aproximativ la fiecare 10 reziduuri de glucoză, monomerii sunt legați prin legături α-1,6-glicozidice. Glicogenul, insolubil în apă, este depozitat în citosolul celulei sub formă de granule cu diametrul de 10-40 nm. Glicogenul se depune în principal în ficat (până la 5%) și în mușchii scheletici (până la 1%). Organismul poate conține de la 0 la 450 g de glicogen.
Structura ramificată a glicogenului facilitează activitatea enzimelor care îndepărtează sau adaugă monomeri.
Sinteza glicogenului (glicogenogeneza)
Glicogenul este sintetizat cu consumul de energie în timpul digestiei (1-2 ore după ingestia alimentelor carbohidrate).


Sinteza glicogenului se realizează prin prelungirea unei molecule de polizaharidă deja existentă numită " sămânță ", sau " grund " Primerul poate conține proteina glicogenină, în care o oligozaharidă (aproximativ 8 resturi de glucoză) este atașată la Tyr. Reziduurile de glucoză sunt transferate de glicogen sintetaza la capătul nereducător al oligozaharidei și legate prin legături α-1,4-glicozidice.
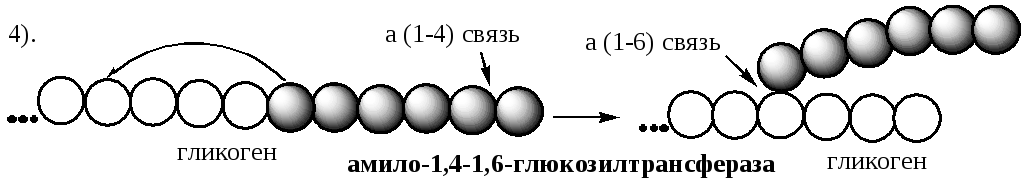
Când regiunea liniară este extinsă la aproximativ 11 resturi de glucoză, enzima de ramificare își transferă blocul terminal, care conține 6-7 resturi, la restul intern de glucoză al acestui sau altui lanț cu formarea unei legături α-1,6-glicozidice. Se formează un nou punct de ramificare la o distanță de cel puțin 4 reziduuri de orice punct de ramificare existent.
Defalcarea glicogenului (glicogenoliza)
Defalcarea glicogenului are loc prin eliminarea secvenţială a glucozei-1-ph ca răspuns la o creştere a nevoii de glucoză a organismului. Reacția este catalizată de glicogen fosforilază:
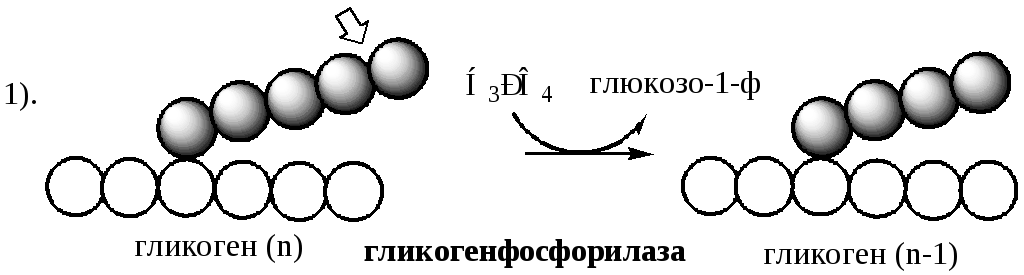
Glicogen fosforilaza este format din 2 subunităţi identice (94500 Da). Forma inactivă este desemnată b, forma activă -a. Activat fosforilaz kinaza b de fosforilarea fiecărei subunități la serină în poziția 14.
Glicogen fosforilaza scindează legăturile α-1,4-glicozidice prin fosforoliză până când 4 reziduuri de glucoză rămân înaintea punctului de ramificare.
Inactivarea glicogen fosforilazei are loc prin defosforilare cu participarea unei fosfataze fosforilaze specifice (fosfoprotein fosfatază FPP).
Se efectuează îndepărtarea ramurilor enzima de deramificare . Are activități de transferază și glicozidază. parte transferază ( oligozaharid transferaza ) transferă cele trei resturi de glucoză rămase până la punctul de ramificare la capătul nereducător al lanțului adiacent, prelungindu-l pentru fosforilază.
parte glicozidaza ( a-1,6-glucozidază ) hidrolizează legătura α-1,6-glicozidică, eliberând glucoză.
Glucoza-1-ph este izomerizată la glucoză-6-ph de către fosfoglucomutază.
Reglarea metabolismului glicogenului în ficat
Glucoză-1-ph Glicogen
4Ca2+ km
Ca 2+ , DAG
Reglarea metabolismului glicogenului în mușchi
Glucoză-1-ph Glicogen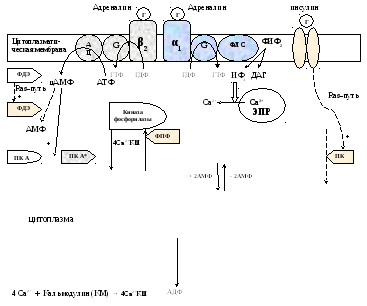
Metabolismul glicogenului este controlat de hormoni (în ficat - insulina, glucagon, adrenalină; în mușchi - insulina și adrenalina), care reglează fosforilarea/defosforilarea a 2 enzime cheie glicogen sintetaza și glicogen fosforilază.
Când nivelul de glucoză din sânge este insuficient, hormonul glucagon este eliberat, iar în cazuri extreme, adrenalină. Ele stimulează fosforilarea glicogen sintetazei (este inactivată) și a glicogen fosforilazei (este activată). Când nivelul de glucoză din sânge crește, se eliberează insulină, care stimulează defosforilarea glicogen sintetazei (este activată) și a glicogen fosforilazei (este inactivată). În plus, insulina induce sinteza glucokinazei, accelerând astfel fosforilarea glucozei în celulă. Toate acestea duc la faptul că insulina stimulează sinteza glicogenului, iar adrenalina și glucagonul stimulează descompunerea acestuia.
În ficat, există și o reglare alosterică a glicogen fosforilazei: este inhibată de ATP și glucoză-6ph și activată de AMP.
Tulburări ale metabolismului glicogenului
Bolile glicogenului - un grup de tulburări ereditare care se bazează pe scăderea sau absența activității enzimelor care catalizează reacțiile de sinteza sau defalcare a glicogenului sau o încălcare a reglementării acestor enzime.
Glicogenoze - boli cauzate de un defect al enzimelor implicate în descompunerea glicogenului. Ele se manifestă fie printr-o structură neobișnuită a glicogenului, fie prin acumularea excesivă a acestuia în ficat, mușchii cardiaci sau scheletici, rinichi, plămâni și alte organe.
În prezent, glicogenozele sunt împărțite în 2 grupe: ficat și mușchi.
Forme hepatice de glicogenoză duce la întreruperea utilizării glicogenului pentru menținerea nivelului de glucoză din sânge. De aceea simptom general pentru aceste forme – hipoglicemie în perioada postabsorbtivă.
boala lui Gierke (tipul I) se notează cel mai des. Motivul este un defect ereditar al glucozo-6-fosfatazei, o enzimă care asigură eliberarea glucozei în fluxul sanguin după eliberarea acesteia din glicogenul celulelor hepatice și renale. Celulele ficatului și tubii contorți ai rinichilor sunt umplute cu glicogen, ficatul și splina sunt mărite, iar pacienții au fața umflată - o „față de păpușă chineză”. Boala se manifestă prin hipoglicemie, hipertriacilglicerolemie, hiperuricemie și acidoză.
1). În hepatocite: glucoză-6-ph → PVC, lactat (acidoză), riboză-5-ph. riboză-5-ph→ purine→ acid uric
2). În sânge: ↓glucoză →↓insulina/glucagon→: a) lipoliza ţesutului adipos → FA în sânge.
b). ↓LPL de țesut adipos → TAG în sânge.
Tratamentul este o dietă cu glucoză, hrănire frecventă.
Boala de rujeolă (tip III) comun, 1/4 din totalul glicogenozei hepatice. Glicogenul ramificat se acumulează deoarece enzima de deramificare este defectă. Glicogenoliza este posibilă, dar într-o mică măsură. Nu se observă acidoză lactică și hiperuricemie. Boala are o evoluție mai blândă decât boala Gierke.
Forme musculare de glicogenoză caracterizată prin tulburări în alimentarea cu energie a mușchilor scheletici. Aceste boli se manifestă în timpul efortului fizic și sunt însoțite de durere și crampe musculare, slăbiciune și oboseală.
boala McArdle (tip V) - o patologie autosomal recesivă, activitatea glicogen fosforilazei este absentă în mușchii scheletici. Acumularea de glicogen de structură anormală în mușchi.
Aglicogenoze
Glicogenoza (glicogenoza 0 conform clasificării) este o boală rezultată dintr-un defect al glicogen sintazei. Se observă un conținut foarte scăzut de glicogen în ficat și alte țesuturi ale pacienților. Aceasta se manifestă prin hipoglicemie pronunțată în perioada postabsorbtivă. Un simptom caracteristic sunt crampele, care apar mai ales dimineata. Boala este compatibilă cu viața, dar copiii bolnavi au nevoie de hrănire frecventă.
Articole similare
-
Plan pe termen lung pentru educația muncii a copiilor preșcolari
Munca este o parte integrantă a vieții umane, motiv pentru care educația pentru muncă ar trebui să fie, de asemenea, constantă și continuă. Nu se obișnuiește să îi dedice ore specifice (cum ar fi muzica, educația fizică). Munca este una dintre componentele importante...
-
dezvoltare metodologică (grup junior) pe tema
Rezumatul unei lecții în grupa de juniori pe tema „Păsări” Domeniul educațional: „Dezvoltarea vorbirii” Obiective: 1. Continuați să prezentați copiilor păsările domestice și păsările care locuiesc în cartier, trăsăturile vieții lor. 2. Faceți cunoștință copiilor cu...
-
Rezumatul GCD în grupa a doua de juniori pe tema: Basme
Proiect „Lumea magică a basmelor” (grup junior) Harta tehnologică a proiectului Tipul de proiect: de grup, artistic și estetic. Participanți la proiect: copii din a doua grupă mai mică, profesor, director muzical, părinți....
-
Învață să citești o aplicație pe un computer
02oct2010 Trenuri. Învățarea cititului după silabe Anul lansării: 2009 Gen: Jocuri educaționale și educaționale pentru copii Dezvoltator: Bayun Editura: Bayun Site-ul dezvoltatorului: http://bayun.ru/ Limba interfeței: numai rusă Platformă: PC...
-
Rezumatul unei lecții despre dezvoltarea vorbirii în grupul de mijloc: „În curtea păsărilor de curte Lecția despre dezvoltarea vorbirii în grupul de mijloc
Rezumatul unei lecții despre dezvoltarea vorbirii în grupul de mijloc folosind TIC. La o vizită la basmul „Cei trei urși” Scop: dezvoltarea vorbirii copiilor prin activități teatrale și introducere în arta populară orală. 1....
-
Eseul „Cum să economisești apă”.
I. Alegerea unei teme de cercetare. Apa este una dintre principalele resurse de pe Pământ. Este greu de imaginat ce s-ar întâmpla cu planeta noastră dacă apa dulce ar dispărea. Dar o astfel de amenințare există. Toate viețuitoarele suferă de apa poluată, este dăunătoare pentru...
