Kemiska och fysikaliska egenskaper för mjölksyra kemisk referensbok för mjölksyra
Mjölksyra
MJÖLKSYRA(2-hydroxipropionsyra) CH3CH(OH)COOH, mol. m. 90,1; färglös kristaller. D(+)-mjölksyra, D(-)-mjölksyra (köttmjölk) och racemisk syra är kända. Mjölksyra är en mjölksyra för jäsning. För D, L- och D-mjölksyra, smp. resp. 18°C och 53°C; t. bal resp. 85°C/1 mmHg och 103°C/2 mmHg; för D-mjölksyra [a]D20 -2,26 (koncentration 1,24 % i vatten). För D,L-mjölksyra DH 0 arr - 682,45 kJ/mol; DH 0 pl 11,35 kJ/mol; DH isp 110,95kJ/mol (25°C), 65,73 kJ/mol (150°C). För L-mjölksyra DH 0 förbränning - 1344,8 kJ/mol; DH 0 obp -694,54 kJ/mol; DH 0 pl 16,87 kJ/mol.
På grund av mjölksyrans höga hygroskopicitet används vanligtvis dess koncentrat. vattenlösningar, sirapsliknande, färglösa. luktfria vätskor. För vattenhaltiga lösningar av mjölksyra d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 och 28,5 mPa. s (25 0 C) resp. för 45,48 och 85,32% lösningar; g 46,0. 10-3 N/m (25°C) för 1 M lösning; e 22 (17°C). Mjölksyrasol. i vatten, etanol, dåligt i bensen, kloroform och andra halogenerade kolväten; RK а 3,862 (25 ° С); pH för vattenlösningar 1,23 (37,3%), 0,2 (84,0%).
Oxidation av mjölksyra åtföljs vanligtvis av nedbrytning. Vid exponering för HNO 3 eller O 2 luft i närvaro. Cu eller Fe bildas av HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 och pyrodruvsyra. Reduktion av mjölksyra HI leder till propionsyra, och återställande är närvarande. Re-black - till propylenglykol.
Mjölksyra torkar ut till akrylsyra vid upphettning. med HBr bildar 2-bromopropionsyra, vid interaktion. Ca-salter med PCl5 eller SOCl2-2-klorpropionylklorid. I närvaro gruvarbetare Sålunda sker självförestring av mjölksyra med bildning av lakton typ I, såväl som linjära polyestrar. När man interagerar mjölksyra med alkoholer bildar hydroxisyror RCH 2 CH(OH)COOH, och vid interaktion. salter av mjölksyra medalkoholetrar. Salter och estrar av mjölksyra kallas. laktater (se tabell).
Mjölksyra bildas som ett resultat av mjölksyrajäsning (under syrning av mjölk, surkål, inläggning av grönsaker, mognad av ost, ensileringsfoder); D-mjölksyra finns i vävnader hos djur, växter och mikroorganismer.
Inom industrin erhålls mjölksyra genom hydrolys av 2-klorpropionsyra och dess salter (100 °C) eller laktonitril CH 3 CH(OH)CN (100 ° C, H 2 SO 4) med följande. bildandet av estrar, isolering och hydrolys av vilka leder till en högkvalitativ produkt. Andra metoder för att framställa mjölksyra är kända: oxidation av propen med kväveoxider (15-20°C) följt av. behandling med H 2 SO 4, interaktion. CH3CHO med CO (200°C, 20 MPa).
EGENSKAPER HOS VISSA LAKTAT

M mjölksyra används i livsmedel. industri, vid betningsfärgning, vid garvning, i jäsningsbutiker som ett bakteriedödande medel, för att erhålla medicin. Ons, mjukgörare. Etyl- och butyllaktater används som lösningar för cellulosaetrar, torkande oljor och växter. oljor; butyllaktat är också ett lösningsmedel för vissa syntetiska produkter. polymerer.
Hydroxisyror (alkoholsyror) är derivat av karboxylsyror som innehåller en, två eller flera hydroxylgrupper i radikalen kopplad till karboxylgruppen.
Beroende på antalet karboxylgrupper delas hydroxisyror in i monobasiska, dibasiska, etc.; beroende på Totala numret hydroxylgrupper, hydroxisyror delas in i mono- eller polyatomära.
Beroende på radikalens natur är hydroxisyror mättade och omättade, acykliska, cykliska eller aromatiska.
Följande typer av isomerism förekommer i hydroxisyror:
strukturell(isomerism av radikalkedjan, isomerism av de relativa positionerna av karboxyl och hydroxyl);
optisk(spegel) på grund av närvaron av asymmetriska kolatomer.
Hydroxisyror benämns efter syrans namn med tillägg av "oxi" eller "dioxi" etc. Trivial nomenklatur används också flitigt.
HO–CH 2 –COOH
glykolsyra (hydroxiättiksyra)
mjölk (α-hydroxipropionsyra)
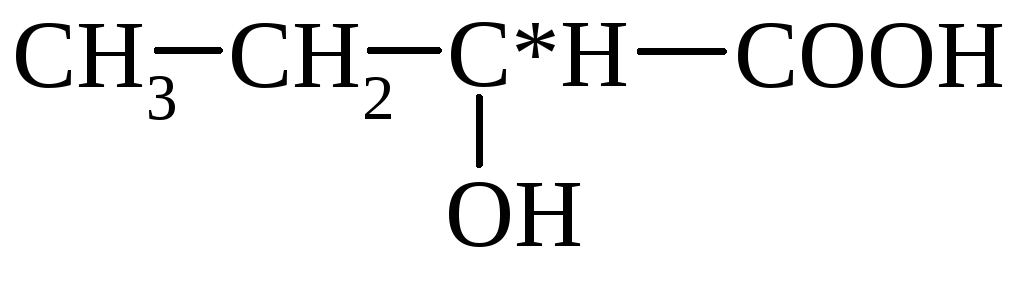

a-hydroxismörsyra p-hydroxismörsyra
(2-hydroxibutan) (3-hydroxibutan)
Fysikaliska egenskaper. Lägre hydroxisyror är oftast tjocka, sirapsliknande ämnen. Hydroxisyror är blandbara med vatten i vilket förhållande som helst, och med ökande molekylvikt minskar lösligheten.
Kemiska egenskaper.
1. Syra egenskaper– Hydroxisyror ger alla reaktioner som är karakteristiska för karboxyl: bildning av salter, estrar, amider, syrahalider, etc. Hydroxisyror är starkare elektrolyter än deras motsvarande karboxylsyror (effekten av hydroxylgruppen).

2. Alkoholegenskaper– reaktioner av substitution av väte i hydroxigruppen, bildning av etrar och estrar, ersättning av –OH med halogen, intramolekylär dehydrering, oxidation.
klorättiksyraglykolglyoxal
sur sur syra
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
ester av glykolsyra och metylalkohol
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glykolmetylmetyleter
sur alkohol metoxiättiksyra
(full sändning)
3. Hydroxisyrors förhållande till uppvärmning - vid upphettning spjälkar α-hydroxisyror av vatten och bildar en cyklisk ester, byggd av två molekyler av α-hydroxisyror:

a-hydroxipropionsyralaktid
β-hydroxisyror under samma förhållanden förlorar lätt vatten för att bilda omättade syror.
HO–CH 2 –CH 2 –COOH  CH2=CH–COOH
CH2=CH–COOH
β-hydroxipropionsyra akrylsyra
γ-hydroxisyror kan också förlora en vattenmolekyl för att bilda intramolekylära estrar - laktoner.

HO–CH2–CH2–CH2–COOH
y-hydroxismörsyra
y-butyrolakton
Vissa hydroxisyror erhålls från naturliga produkter. Sålunda erhålls mjölksyra från mjölksyrajäsning av sockerhaltiga ämnen. Syntetiska beredningsmetoder är baserade på följande reaktioner:
1) Cl–CH2–COOH + HOH  HO-CH2-COOH;
HO-CH2-COOH;
monoklorättiksyraglykol
sur syra
2) CH2 =CH–COOH + HOH  HO–CH 2 –CH 2 –COOH.
HO–CH 2 –CH 2 –COOH.
akrylsyra p-hydroxipropionsyra
Representanter för hydroxisyror.
Glykolisk (hydroxiättiksyra) är ett kristallint ämne som finns i omogna frukter, betorjuice, kålrot och andra växter. Inom industrin erhålls den genom att reducera oxalsyra. Används för färgning (calicotryck).
Mjölksyra (α-hydroxipropionsyra) – en tjock flytande eller smältbar kristallin massa. Mjölksyra bildas under mjölksyrafermenteringen av sockerarter, under inverkan av mjölksyrabakterier. Ingår i fermenterade mjölkprodukter, surkål, ensilage. Används vid betningsfärgning, garvning och medicin.
Mjölksyra finns i animalisk muskeljuice och köttextrakt.
Diatomisk glycerolsyra deltar i växters och djurs livsprocesser.

Askorbinsyra (vitamin C) är ett kristallint ämne som finns i färsk frukt, citroner, svarta vinbär, färska grönsaker- kål, bönor. Syntetiskt erhålls C-vitamin genom oxidation av den flervärda alkoholen sorbitol.
 a-askorbinsyra
a-askorbinsyra
Askorbinsyra bryts lätt ned av atmosfäriskt syre, särskilt vid upphettning
Acyklisk två-och tribasiska hydroxisyror.
Äpple (hydroxibärnstenssyra) (HOOC–CHOH–CH 2 –COOH) är ett kristallint ämne, mycket lösligt i vatten; används i medicin, finns i omogen rönn, berberis, rabarber, druvjuice, vin.
Vin (vinsyra, dihydroxibärnstenssyra) (HOOC–*CHOH–*CHOH–COOH) har 2 asymmetriska kolatomer och har därför 4 optiska isomerer. Formar sura kaliumsalter som är svårlösliga i vatten och faller ut. Saltkristaller kan observeras i vin (vinsten). Det blandade kalium-natriumsaltet kallas Rochellesalt. Salter av vinsyra kallas tartrater.


grädde av tandsten, seignette salt
Vinsyra är vanlig i växter (rönn, vindruvor etc.).
Citronsyra
 finns i citrusfrukter. Inom industrin erhålls det från citronfrukter genom oxidation av sockerarter mögelsvampar, vid bearbetning av granbarr.
finns i citrusfrukter. Inom industrin erhålls det från citronfrukter genom oxidation av sockerarter mögelsvampar, vid bearbetning av granbarr.
Citronsyra är en biologiskt viktig förening som deltar i ämnesomsättningen. Det används inom medicin-, livsmedels- och textilindustrin som en tillsats till färgämnen.
Cykliska monobasiska flervärda hydroxisyror är en del av gallsyror och andra fysiologiskt viktiga föreningar; till exempel förbättrar auxin växternas tillväxt.
Aromatiska hydroxisyror delas in i fenolsyror och aromatiska fettsyror som innehåller hydroxyl i sidokedjan.


o-hydroxibensoe-mandelsyra
(salicylsyra
Salicylsyra finns i vissa växter i fri form (calendula), men oftare i form av estrar. Inom industrin erhålls det genom att värma natriumfenolat med koldioxid. Används som desinfektionsmedel och vid syntes av färgämnen. Många salicylsyraderivat används som läkemedel (aspirin, salol).


aspirinsalol (fenylester
(acetylsalicylsyra) salicylsyra)
Gallussyra (3,4,5-trioxibensoesyra).

Ingår i teblad, ekbark och granatäpple. Industriellt erhålls det från tannin genom att koka med utspädda syror. Det används för att göra bläck, i fotografi och i medicin som ett antiseptiskt medel. Gallsyra och dess derivat används ofta som konserveringsmedel för många mat produkter(fetter, högvärdig tvål, mejeriprodukter), har garvningsegenskaper och är av särskild betydelse vid lädertillverkning och vid betningsfärgning.
Mandelsyra avser aromatiska fettsyror (C 6 H 5 – CH (OH) – COOH), som finns i amygdalin, senap, fläder, etc.
Tanniner är ofta derivat av flervärda fenoler. De är en del av växter och erhålls från extrakt av bark, trä, löv, rötter, frukter eller utväxter (gallar).
Tanniner är de viktigaste tanninerna. Det är en blandning av olika kemiska föreningar, av vilka de huvudsakliga är estrar av galliska och digalliska syror och glukos eller flervärda alkoholer.

Dg-digallinsyra

m-digallinsyra
Tannin uppvisar egenskaperna hos fenoler och estrar. Med en lösning av järnklorid bildar den en svart komplex förening. Tanniner används i stor utsträckning som garvningsextrakt, betningsmedel för färgning av bomullstyger, som sammandragningsmedel i medicin (de har bakteriedödande och hemostatiska egenskaper) och är konserveringsmedel.
Lipider inkluderar organiska ämnen, av vilka många är estrar av högmolekylära fettsyror och flervärda alkoholer - fetter, fosfatider, växer, steroider, högmolekylära fettsyror, etc.
Lipider finns främst i växtfrön, nötkärnor och i djurorganismer - i fett- och nervvävnader, särskilt i hjärnan hos djur och människor.
Naturliga fetter är blandningar av estrar av trevärd alkoholglycerol och högre karboxylsyror, d.v.s. blandningar av glycerider av dessa syror.
HANDLA OM 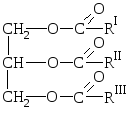 allmän fettformel:
allmän fettformel:
där R I R II R III är kolväteradikaler av högre fettsyror normal struktur med ett jämnt antal kolatomer. Fetter kan innehålla rester av både mättade och omättade syror.
Mättade syror:
C15H31COOH – palmitinsyra;
C 17 H 35 COOH – stearinsyra;
C 3 H 7 COOH – olja (finns i Smör) och så vidare.
Omättade syror:
C17H33COOH – oljesyra;
C17H31COOH – linolsyra;
C 17 H 29 COOH – linolen etc.
Fetter erhålls från naturliga källor av animaliskt och vegetabiliskt ursprung.
Fysikaliska egenskaper fetter beror på deras sura sammansättning. Fetter som huvudsakligen innehåller rester av mättade syror är fasta eller pastaliknande ämnen (lamm, nötfett etc.) Fetter som huvudsakligen innehåller rester av omättade syror har flytande konsistens vid rumstemperatur och kallas oljor. Fetter löser sig inte i vatten, men löser sig väl i organiska lösningsmedel: eter, bensen, kloroform, etc.
Kemiska egenskaper. Liksom alla estrar genomgår fetter hydrolys. Hydrolys kan ske i en sur, neutral eller alkalisk miljö.
1. Syrahydrolys.

Katalognummer för mjölksyra: CAS 50-21-5
Beskrivning av mjölksyra:
Nästan transparent, lätt gulaktig hygroskopisk sirapsliknande vätska med lätt sur lukt, som påminner om lukten av kold mjölk. Löslig i vatten, etanol, dåligt löslig i bensen, kloroform och andra halogenerade kolväten. Det finns olika optiskt aktiva isomerer i form av D och L. Och även en optiskt inaktiv blandning av D och L. Den senare erhålls genom kemisk syntes, och aktiva former med bakteriell (enzymmetod) I människokroppen är det den optiskt aktiva formen av L som deltar i Kreps-cykeln, varför det rekommenderas att användas som tillsats (mjölksyra, E270), i andra industrier gör detta inte spelar en speciell roll.
Det globala namnet Mjölksyra har inte slagit rot i Ryssland, men namnet på dess laktatsalt finns överallt, mycket oftare än kalciummjölksyra skär vi ner kalciumlaktat.
Specifikation för mjölksyra 80%.
Kokpunkt (100 % lösning) 122 °C (115 mm Hg)
Specifik vikt (20 °C) 1,22
Löslighet i vatten Fullständigt löslig
Densitet (vid 20°C) 1,18-1,20 g/ml
Tungmetaller, inte mer än 0,001 %
Järnhalt, högst 0,001 %
Arsenikhalt, högst 0,0001 %
Kloridhalt, högst 0,002 % (faktiskt 0,0015 %)
Sulfathalt, högst 0,01 % (faktiskt 0,004 %)
Återstod efter kalcinering, inte mer än 0,1 % (faktiskt 0,06 %)
Tillverkare: Kina
Förpackning: 25 kg fat eller 1200 kg kuber
Grundläggande fysikaliska egenskaper hos mjölksyra:
Smältpunkt: 17°C För optiskt inaktiv (racematisk),
25-26 °C optiskt aktiv + eller - form
(skillnader i smälttemperaturer gör det möjligt att kvalitativt och snabbt skilja dyrare optiskt aktiva former från billigare inaktiva!!)
Relativ densitet(vatten = 1): 1,2
Löslighet i vatten: blandbar
Molekylvikt: 90,08 g/mol
Flampunkt: 110°C c.c.
Fördelningskoefficient oktanol/vatten som log Pow: -0,6
Explosions- och brandrisk:
Stöder förbränning kl normala förhållanden. spontan förbränning är osannolikUndvik öppen låga och rökning.
Brandsläckning: med pulver, alkoholbeständigt skum, sprutvatten,
koldioxid.
Kemisk stabilitet: Stall kl normala temperaturer och tryck.
Förhållanden som ska undvikas: Dammbildning, överdriven värme.
Inkompatibilitet med andra material: Starka oxidationsmedel, mineralsyror.
Farliga nedbrytningsprodukter: Kväveoxider, kolmonoxid, koldioxid, par
cyanid.
Farlig polymerisation: Ej markerad.
Fara för människor:
Inträdesvägar i kroppen:Ämnet kan tas upp i kroppen genom inandning av aerosolen och genom munnen.
Vid kortvarig exponering för koncentrationer som överstiger MPC:Ämnet är irriterande för huden och Airways, och har också en frätande
effekt på ögonen. Frätande vid förtäring.
Vid ögonkontakt: Rodnad. Smärta. Svåra djupa brännskador. Skyddsglasögon-mask, eller
skyddsmask. Skölj först stor mängd vatten för flera
minuter (ta bort kontaktlinser, om detta inte är svårt), ta då till läkaren.
Arbetsområdesstandarder:
TLV (US TLV) har inte fastställts.
Cancerframkallande egenskaper: Ej listad av ACGIH, IARC, NTP eller CA Prop 65.
Epidemiologi: Ingen information.
Tetratogenicitet: Ingen information.
Reproduktiva effekter: Ingen information.
Mutagenicitet: ingen information
Neurotoxicitet: Ingen information.
Djurförsök har visat:
LD50/LC50:
Draize-test, kanin, ögon: 100 mg Svår;
Draize-test, kanin, hud: 500 mg/24H Mild;
Inandning, råtta: LC50 = >26 mg/m(kub)/1H;
Oral, mus: LD50 = 1940 mg/kg;
Oral, råtta: LD50 = 1700 mg/kg;
Läder, kanin: LD50 = >10 gm/kg;
Uppmärksamhet. Information ges om koncentratet av ämnet, i små kvantiteter och koncentrationer av mjölksyra, enligt tillgängliga data det här ögonblicket data ofarlig!
Mjölksyra(2-hydroxipropionsyra) CH3CH(OH)COOH, molekylvikt 90,1; färglös. L(+)-mjölksyra, D(–)-mjölksyra (kött-mjölk)syra och racemisk mjölksyrafermenterad mjölksyra är kända. För D-, L- och D-mjölksyra motsvarar smältpunkten 18°C och 53°C; t. bal resp. 85°C/1 mmHg och 103°C/2 mmHg; för D-mjölksyra [α] D 20 -2,26 (koncentration 1,24 % i . För D,L-mjölksyra D H O prov - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H isp 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). För L-mjölksyra D H 0 förbränning - 1344,8 kJ/mol; D H 0 obp -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
På grund av mjölksyrans höga hygroskopicitet används vanligtvis dess koncentrerade vattenlösningar - sirapsliknande, färglös, luktfri. För vattenlösningar mjölksyra d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 och 28,5 mPa. s (25 0 C) resp. för 45,48 och 85,32% lösningar; g 46,0. 10-3 N/m (25°C) för 1 M lösning; e 22 (17°C). Mjölksyra är löslig i, men dåligt löslig i, och andra halogenkolväten; R K a 3,862 (25°C); pH för vattenlösningar 1,23 (37,3%), 0,2 (84,0%).
Mjölksyra dehydratiseras till akrylsyra, när den upphettas med HBr bildar den 2-bromopropionsyra, när Ca-saltet reagerar med PCl 5 eller SOCl 2-2-klorpropionylklorid. I närvaro av mineralsyror sker autoesterifiering av mjölksyra med bildningen av formel I, såväl som linjära polyestrar. När mjölksyra reagerar bildas hydroxisyrorna RCH 2 CH(OH)COOH och när mjölksyra reagerar med alkoholer bildas estrar. Salter och estrar av mjölksyra kallas laktater (se tabell).
mjölksyra bildas som ett resultat av mjölksyra (vid syrning av mjölk, surkål, inläggning av grönsaker, mognad av ost, ensileringsfoder); D-mjölksyra finns i vävnader hos djur, växter och även i mikroorganismer.
Inom industrin framställs mjölksyra av 2-klorpropionsyra och dess (100 °C) eller laktonitril CH 3 CH(OH)CN (100 °C, H 2 SO 4) med efterföljande bildning av estrar, isolering och hydrolys av vilket leder till en högkvalitativ produkt. Andra metoder för att framställa mjölksyra är kända: oxidation av propen med kväveoxider (15-20°C) följt av behandling med H2SO4, interaktion av CH3CHO med CO (200°C, 20 MPa).
EGENSKAPER HOS VISSA LAKTAT

mjölksyra används i Livsmedelsindustrin, i betningsfärgning, i garvning, i jäsningsbutiker som bakteriedödande medel, för att få mediciner mjukgörare. Etyl- och butyllaktater används som lösningsmedel för cellulosaetrar, torkande oljor, vegetabiliska oljor; butyllaktat - även som lösningsmedel för vissa syntetiska polymerer.
Världsproduktionen av mjölksyra är 40 tusen ton (1983).
Belyst.: Holten C.H., Mjölksyra. Egenskaper och kemi. Mjölksyror och derivat, Weisheim, 1971. Yu. A. Treger.
Välj den första bokstaven i artikeltiteln:
Mjölksyra (laktat)- a-hydroxipropionsyra (2-hydroxipropansyra).
- t pl 25-26 °C optiskt aktiv (+)- eller (-)-form.
- smälttemperatur 18 °C racemisk form.
- Kemisk formel: CH 3 CH(OH)COOH
- Racemisk formel: C 3 H 6 O 3

Mjölksyra bildas när mjölksyrajäsning sockerarter, särskilt i surmjölk, under jäsning av vin och öl. Det används både inom kemi- och livsmedelsindustrin - som konserveringsmedel. I människokroppen bildas mjölksyra (laktat) under nedbrytningen av glukos.
Så är det skillnad på mjölksyra och laktat? Nej. Inom organisk kemi kallas det ofta för mjölksyra, inom biokemi kallas det för laktat.
Laktat, omger nog det mesta Ett stort antal olika myter, mest av som inte är sanna. Och även om det finns tillräckligt med tillförlitligt material om laktat på ryska, fortsätter många amatöridrottare (och vissa proffs) envist att tro och upprepa förra seklets myter.
Låt oss kort och koncist granska de grundläggande fakta om laktat.
Laktat bildas alltid vid energiproduktion i kroppen.
Den huvudsakliga vägen för energi som kommer in i cellerna är nedbrytningen av glukos. Glukosmolekylen genomgår en serie av 10 sekventiella reaktioner för att producera pyruvat genom en process som kallas glykolys. Därefter oxideras en del av pyruvatet delvis och omvandlas till koldioxid och vatten. Den andra delen omvandlas till laktat under kontroll av enzymet laktatdehydrogenas.
Denna reaktion är reversibel.

En del av laktatet används för energisyntes.
Cirka 15 till 20 procent av det totala laktatet omvandlas till glykogen genom processen med glukoneogenes.
Laktat är en universell energibärare.
Under förhållanden hög produktion energi i anaerobt läge är laktat en energibärare från de platser där det är omöjligt att omvandla energi, p.g.a. ökad surhet, till de platser där det kan omvandlas till energi (hjärta, andningsmuskler, långsam ryck muskelfibrer, andra muskelgrupper).
En ökning av laktatnivåerna är inte en konsekvens av syrebrist.
Djurstudier indikerar att intracellulär syrebrist i isolerade muskler inte visar någon begränsning i mitokondriell andningskedjas aktivitet ens under maximal träning. Vi kommer alltid att ha tillräckligt med syre i våra muskler.
Laktat är en indikator på belastningen av anaerob glykolys.
Varje gång pyruvat bildas, slutprodukt Metabolism av glukos under glykolys leder till bildning av laktat. Laktat ackumuleras helt enkelt för att hastigheten för energiomvandling vid anaerob och aerob träning är olika.
Ju högre intensitet arbetet är, desto mer laktat produceras.
Laktatnivåer i blodet är nära relaterade till träningsintensitet. Laktat ackumuleras på grund av skillnaden i hastigheten för energiomvandling vid anaerob och aerob träning. Hastigheten för energiomvandling i anaerob energimetabolism är snabbare än i aerob metabolism.
Laktat skapar inte surhet, det följer med det.
Genom att producera energi producerar vi samtidigt surhet. Energireaktioner i vår kropp sker med deltagande av elektroner som energibärare. Glukolysprodukterna är laktat och väteprotonen H+. Ett mått på aktiviteten (koncentrationen) av vätejoner (H+) i en lösning uttrycker dess surhet.
Laktat tar endast tillfälligt det sura medlet (H+) för att utföra reaktionen och återför det sedan till en neutral miljö.
90% av laktatet utnyttjas av kroppen den första timmen efter träning.
60% av laktatet i kroppen oxideras helt till CO2 och vatten. Cirka 20 % omvandlas till glykogen under processen med glukoneogenes, och en del används för bildandet av aminosyror. Endast liten del(mindre än 5%) laktat utsöndras i svett och urin.
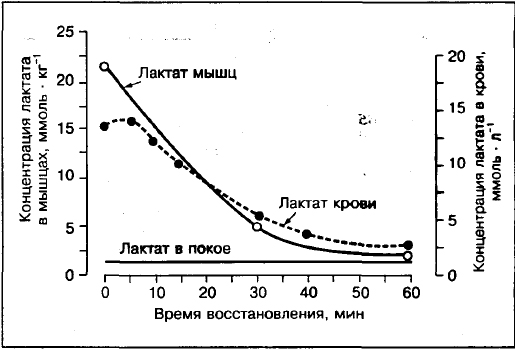
Blodlaktat kommer inte systematiskt att återspegla närvaron av muskellaktat.
Jämförelser av laktatkoncentrationer i muskler och blod visar att om ansträngningen överstiger 75-80% VO2max, så är laktatkoncentrationen i muskel (framtill lårmuskelbiopsi) högre än i blod. Till skillnad från träning med måttlig intensitet 30%,50%,70% VO2max där laktatkoncentrationen i arteriellt blod högre än i muskler.
Laktat orsakar inte smärta eller muskelkramper.
Muskelömhet dagen efter ett intensivt träningspass orsakas av muskelskador och vävnadsinflammation som uppstår efter träningen. Majoritet muskelkramp orsakas av nervreceptorer i musklerna som blir överexiterade med uppkomsten av trötthet i musklerna.
Anpassad från cmtscience.com (2016).
Liknande artiklar
-
När mannen är emot barnet, hur blir man gravid utan hans vetskap?
Ibland kan man bli gravid på grund av slarv. För att förhindra att detta händer är det viktigt att veta hur du kan bli gravid med ett barn av misstag och vilka medel du kan använda för att undvika en oönskad graviditet. Även i den här artikeln kan du hitta information om...
-
Vilka stenar och amuletter är lämpliga för Oxen enligt horoskop och födelsedatum Elefant talisman för Oxen
April-maj Oxen (21.04 - 20.05) är mätta, inte kinkiga och extremt produktiva! Deras avundsvärda envishet kan göra andra galna, men de vet exakt vad de gör och varför de behöver det. Bland de positiva egenskaperna...
-
Restriktioner för åtkomst till data i 1c-roller
Alla inställningar för användarrättigheter som vi kommer att göra inom ramen för denna artikel finns i avsnitt 1C 8.3 "Administration" - "Användar- och rättighetersinställningar". Denna algoritm är liknande i de flesta konfigurationer på...
-
1c lanserar en tunn klient istället för en tjock
Plattformar: 1C:Enterprise 8.3, 1C:Enterprise 8.2, 1C:Enterprise 8.1 Konfigurationer: Alla konfigurationer2012-11-16 21362 Som du vet tillåter klienter dig inte att välja en databas. De lanseras genom att specificera speciella...
-
Uppenbarhet av kända metoder för att stjäla el Hur man hittar vem som stjäl el
Stigande energitaxor är ett av de slående dragen i den allt djupare ekonomiska krisen. I samband med detta blir stöld av el och frågor relaterade till dess upptäckt av största vikt Metoder för att upptäcka stöld...
-
Funktioner för att installera uttag och strömbrytare på olika ytor
Hälsningar till alla läsare av vår blogg Idag, kära läsare, vill jag täcka ämnet hur man installerar uttag. Denna procedur efterfrågas mycket ofta när man byter ut ett gammalt uttag mot ett nytt i händelse av haveri, när...
