Hemijska i fizička svojstva mliječne kiseline Priručnik o kemijskim tvarima mliječne kiseline
Mliječna kiselina
MLEČNA KISELINA(2-hidroksipropionska kiselina) CH 3 CH(OH)COOH, mol. m. 90,1; bezbojan kristali. Poznate su D(+)-mliječna kiselina, D(-)-mliječna (meso-mlijeko) i racemična kiselina. Mliječna kiselina je mliječna kiselina za fermentaciju. Za D, L- i D-mliječnu kiselinu, t.t. odn. 18 °C i 53 °C; t. bale odn. 85°C/1 mmHg i 103°C/2mmHg; za D-mliječnu kiselinu [a] D 20 -2,26 (koncentracija 1,24% u vodi). Za D,L-mliječnu kiselinu DH 0 arr - 682,45 kJ/mol; DH 0 pl 11,35 kJ/mol; DH isp 110,95kJ/mol (25°C), 65,73 kJ/mol (150°C). Za sagorevanje L-mliječne kiseline DH 0 - 1344,8 kJ/mol; DH 0 obp -694,54 kJ/mol; DH 0 pl 16,87 kJ/mol.
Zbog visoke higroskopnosti mliječne kiseline, obično se koristi njen koncentrat. vodeni rastvori, nalik na sirup, bezbojni. tečnosti bez mirisa. Za vodene rastvore mlečne kiseline d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 mPa. s (25 0 C) odn. za 45,48 i 85,32% rastvora; g 46.0. 10 -3 N/m (25°C) za 1 M rastvor; e 22 (17°C). Sol mliječne kiseline. u vodi, etanolu, slabo u benzenu, hloroformu i drugim halogenizovanim ugljovodonicima; rK a 3,862 (25 °S); pH vodenih rastvora 1,23 (37,3%), 0,2 (84,0%).
Oksidacija mliječne kiseline obično je praćena razgradnjom. Kada je izložen HNO 3 ili O 2 vazduhu u prisustvu. Cu ili Fe formiraju HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 i pirogrožđana kiselina. Smanjenje mliječne kiseline HI dovodi do propionske kiseline, a obnavljanje je prisutno. Ponovo crni - na propilen glikol.
Mliječna kiselina dehidrira u akrilnu kiselinu kada se zagrijava. sa HBr formira 2-bromopropionsku kiselinu, nakon interakcije. Ca soli sa PCl 5 ili SOCl 2 -2-kloropropionil hloridom. U prisustvu rudar Tako dolazi do samoesterifikacije mliječne kiseline sa stvaranjem laktona tipa I, kao i linearnih poliestera. Prilikom interakcije mliječna kiselina sa alkoholima formiraju hidroksi kiseline RCH 2 CH(OH)COOH, a pri interakciji. soli mliječne kiseline saetri alkohola. Zovu se soli i estri mliječne kiseline. laktati (vidi tabelu).
Mliječna kiselina nastaje kao rezultat mliječne fermentacije (prilikom kiseljenja mlijeka, kiselog kupusa, kiseljenja povrća, zrenja sira, siliranja hrane); D-mliječna kiselina se nalazi u tkivima životinja, biljaka i mikroorganizama.
U industriji, mliječna kiselina se dobiva hidrolizom 2-kloropropionske kiseline i njenih soli (100 °C) ili laktonitrila CH 3 CH(OH)CN (100 °C, H 2 SO 4) sa sljedećim. formiranje estera, čijom izolacijom i hidrolizom se dobija proizvod visokog kvaliteta. Poznate su i druge metode za proizvodnju mliječne kiseline: oksidacija propilena dušikovim oksidima (15-20°C) nakon čega slijedi. tretman sa H 2 SO 4, interakcija. CH 3 CHO sa CO (200 °C, 20 MPa).
SVOJSTVA NEKIH LAKTATA

M mliječna kiselina se koristi u hrani. industriji, u jedljivom bojenju, u štavljenju, u fermentacionim radnjama kao baktericidno sredstvo, za dobijanje lekova. sri, plastifikatori. Etil i butil laktati se koriste kao rastvori za celulozne etere, ulja za sušenje i biljke. ulja; butil laktat je također otapalo za određene sintetičke proizvode. polimeri.
Hidroksi kiseline (alkoholne kiseline) su derivati karboksilnih kiselina koji sadrže jednu, dvije ili više hidroksilnih grupa u radikalu povezanom s karboksilom.
U zavisnosti od broja karboksilnih grupa, hidroksi kiseline se dele na jednobazne, dvobazne itd.; zavisno od ukupan broj hidroksilne grupe, hidroksi kiseline se dijele na jedno- ili višeatomne.
Prema prirodi radikala, hidroksi kiseline su zasićene i nezasićene, aciklične, ciklične ili aromatične.
U hidroksi kiselinama se javljaju sljedeće vrste izomerizma:
strukturalni(izomerizam lanca radikala, izomerizam relativnih položaja karboksila i hidroksila);
optički(ogledalo) zbog prisustva asimetričnih atoma ugljika.
Hidroksi kiseline se nazivaju po imenu kiseline sa dodatkom "oksi" ili "dioksi" itd. Trivijalna nomenklatura je također u širokoj upotrebi.
HO–CH 2 –COOH
glikol (hidroksioctena kiselina)
mlijeko (α-hidroksipropionsko)
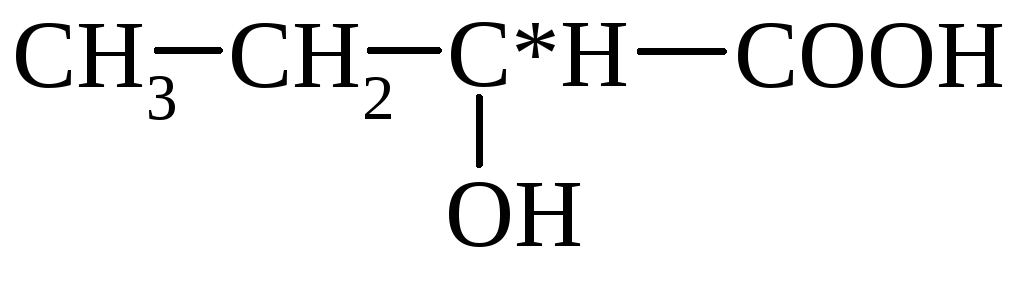

α-hidroksimaslačna β-hidroksibutirna
(2-hidroksibutan) (3-hidroksibutan)
Fizička svojstva. Niže hidroksi kiseline su najčešće guste, sirupaste supstance. Hidroksi kiseline se miješaju s vodom u bilo kojem omjeru, a s povećanjem molekularne težine, topljivost se smanjuje.
Hemijska svojstva.
1. Svojstva kiselina– hidroksi kiseline daju sve reakcije karakteristične za karboksil: stvaranje soli, estera, amida, kiselih halogenida itd. Hidroksi kiseline su jači elektroliti od odgovarajućih karboksilnih kiselina (učinak hidroksilne grupe).

2. Alkoholna svojstva– reakcije supstitucije vodonika u hidroksi grupi, formiranje etera i estera, zamena –OH halogenom, intramolekularna dehidratacija, oksidacija.
hlorocteni glikol glioksal
kiselina kiselina kiselina
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
estar glikolne kiseline i metil alkohola
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glikol metil metil eter
kiseli alkohol metoksisirćetna kiselina
(cijela emisija)
3. Odnos hidroksi kiselina prema zagrijavanju - kada se zagrije, α-hidroksi kiseline odvajaju vodu, formirajući ciklički estar, izgrađen od dva molekula α-hidroksi kiselina:

laktid α-hidroksipropionske kiseline
β-hidroksi kiseline pod istim uslovima lako gube vodu i formiraju nezasićene kiseline.
HO–CH 2 –CH 2 –COOH  CH 2 =CH–COOH
CH 2 =CH–COOH
β-hidroksipropionska akrilna kiselina
γ-hidroksi kiseline takođe mogu izgubiti molekul vode da bi formirale intramolekularne estre - laktone.

HO–CH 2 –CH 2 –CH 2 –COOH
γ-hidroksibuterna kiselina
γ-butirolakton
Neke hidroksi kiseline se dobivaju iz prirodnih proizvoda. Tako se mliječna kiselina dobiva mliječno kiselom fermentacijom slatkih tvari. Sintetičke metode pripreme baziraju se na sljedećim reakcijama:
1) Cl–CH 2 –COOH + HOH  HO–CH 2 –COOH;
HO–CH 2 –COOH;
monohlorocteni glikol
kisela kiselina
2) CH 2 =CH–COOH + HOH  HO–CH 2 –CH 2 –COOH.
HO–CH 2 –CH 2 –COOH.
akrilna kiselina β-hidroksipropionska kiselina
Predstavnici hidroksi kiselina.
Glikolni (hidroksisirćetna) kiselina je kristalna supstanca koja se nalazi u nezrelom voću, soku cvekle, repi i drugim biljkama. U industriji se dobiva redukcijom oksalne kiseline. Koristi se za bojenje (kaliko štampa).
Mliječna kiselina (α-hidroksipropionska) – gusta tečna ili topiva kristalna masa. Mliječna kiselina nastaje mliječno kiselom fermentacijom šećera, pod djelovanjem bakterija mliječne kiseline. Sadrži u fermentisanim mlečnim proizvodima, kiselom kupusu, silaži. Koristi se u jedljivom bojenju, štavljenju i medicini.
Meso-mliječna kiselina se nalazi u životinjskom mišićnom soku i mesnim ekstraktima.
Dijatomski glicerinska kiselina učestvuje u životnim procesima biljaka i životinja.

Askorbinska kiselina (vitamin C) je kristalna supstanca koja se nalazi u svežem voću, limunu, crnoj ribizli, svježe povrće- kupus, pasulj. Sintetički, vitamin C se dobija oksidacijom polihidričnog alkohola sorbitola.
 α-askorbinska kiselina
α-askorbinska kiselina
Askorbinska kiselina se lako razlaže atmosferskim kiseonikom, posebno kada se zagreje
Aciklično dva-i trobazične hidroksi kiseline.
Apple (hidroksisukcinska) kiselina (HOOC–CHOH–CH 2 –COOH) je kristalna supstanca, visoko rastvorljiva u vodi; koristi se u medicini, nalazi se u nezrelom čamcu, žutici, rabarbari, soku od grožđa, vinu.
Vino (vinska, dihidroksisukcinska) kiselina (HOOC–*CHOH–*CHOH–COOH) ima 2 asimetrična atoma ugljika i stoga ima 4 optička izomera. Formira kisele kalijumove soli, koji su slabo rastvorljivi u vodi i talože se. U vinu (tartaru) mogu se uočiti kristali soli. Mešana kalijum-natrijumova so se zove Rochelle so. Soli vinske kiseline nazivaju se tartrati.


krema od tartara, seignette so
Vinska kiselina je česta u biljkama (oren, grožđe, itd.).
Limunova kiselina
 nalazi u citrusnom voću. U industriji se dobija iz plodova limuna oksidacijom šećera gljivice plijesni, pri obradi iglica smreke.
nalazi u citrusnom voću. U industriji se dobija iz plodova limuna oksidacijom šećera gljivice plijesni, pri obradi iglica smreke.
Limunska kiselina je biološki važan spoj koji učestvuje u metabolizmu. Koristi se u medicini, prehrambenoj i tekstilnoj industriji kao dodatak bojama.
Ciklične monobazne polihidrične hidroksi kiseline su dio žučnih kiselina i drugih fiziološki važnih spojeva; na primjer, auksin pospješuje rast biljaka.
Aromatične hidroksi kiseline dijele se na fenolne kiseline i aromatične masne kiseline koje sadrže hidroksil u bočnom lancu.


o-hidroksibenzojeva bademova kiselina
(salicilna kiselina
Salicilna kiselina nalazi se u nekim biljkama u slobodnom obliku (kalendula), ali češće u obliku estera. U industriji se dobiva zagrijavanjem natrijevog fenolata sa ugljičnim dioksidom. Koristi se kao dezinfekciono sredstvo i u sintezi boja. Mnogi derivati salicilne kiseline se koriste kao lijekovi (aspirin, salol).


aspirin salol (fenil ester
(acetilsalicilna kiselina) salicilna kiselina)
Galna kiselina (3,4,5-trioksibenzojev).

Sadrži se u listovima čaja, hrastovoj kori i stablu nara. Industrijski se dobiva iz tanina kuhanjem s razrijeđenim kiselinama. Koristi se za pravljenje mastila, u fotografiji i u medicini kao antiseptik. Galna kiselina i njeni derivati se naširoko koriste kao konzervansi za mnoge prehrambeni proizvodi(masti, visokokvalitetni sapuni, mliječni proizvodi), ima svojstva štavljenja i od posebnog je značaja u proizvodnji kože i jedljivom bojenju.
Mandelic acid odnosi se na aromatične masne kiseline (C 6 H 5 – CH (OH) – COOH), koje se nalaze u amigdalinu, senfu, bazgi itd.
Tanini često su derivati polihidričnih fenola. Oni su dio biljaka i dobivaju se iz ekstrakata kore, drveta, lišća, korijena, plodova ili izraslina (žuči).
Tanini su najvažniji tanini. To je mješavina različitih hemijska jedinjenja, od kojih su glavni estri galne i digalne kiseline i glukoze ili polihidričnih alkohola.

Dg-digalna kiselina

m-digalna kiselina
Tanin pokazuje svojstva fenola i estera. Sa otopinom željeznog hlorida formira crni kompleksni spoj. Tanini se široko koriste kao ekstrakti za štavljenje, jedila za bojenje pamučnih tkanina, kao adstringensi u medicini (imaju baktericidna i hemostatska svojstva), te su konzervansi.
Lipidi uključuju organske tvari, od kojih su mnoge estri masnih kiselina visoke molekularne težine i polihidričnih alkohola - masti, fosfatidi, voskovi, steroidi, masne kiseline visoke molekularne težine itd.
Lipidi se nalaze uglavnom u sjemenkama biljaka, jezgri orašastih plodova, te u životinjskim organizmima - u masnom i nervnom tkivu, posebno u mozgu životinja i ljudi.
Prirodne masti su mješavine estera trihidričnog alkohola glicerola i viših karboksilnih kiselina, tj. mješavine glicerida ovih kiselina.
O 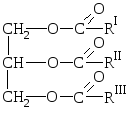 opšta formula masti:
opšta formula masti:
gdje su R I R II R III ugljikovodični radikali viših masnih kiselina normalna struktura sa parnim brojem atoma ugljika. Masti mogu sadržavati ostatke i zasićenih i nezasićenih kiselina.
Zasićene kiseline:
C 15 H 31 COOH – palmitinska;
C 17 H 35 COOH – stearinska;
C 3 H 7 COOH – ulje (sadržano u puter) i sl.
Nezasićene kiseline:
C 17 H 33 COOH – oleinska;
C 17 H 31 COOH – linolna;
C 17 H 29 COOH – linolenski itd.
Masti se dobijaju iz prirodnih izvora životinjskog i biljnog porekla.
Fizička svojstva masti su zbog njihovog kiselog sastava. Masti koje sadrže uglavnom ostatke zasićenih kiselina su čvrste ili pastozne supstance (jagnjeća, goveđa mast, itd.) Masti koje sadrže uglavnom ostatke nezasićenih kiselina imaju tečne konzistencije na sobnoj temperaturi i nazivaju se uljima. Masti se ne rastvaraju u vodi, ali se dobro rastvaraju u organskim rastvaračima: eter, benzol, hloroform itd.
Hemijska svojstva. Kao i svi estri, masti podležu hidrolizi. Hidroliza se može dogoditi u kiseloj, neutralnoj ili alkalnoj sredini.
1. Hidroliza kiseline.

Kataloški broj za mliječnu kiselinu: CAS 50-21-5
Opis mliječne kiseline:
Gotovo prozirna, blago žućkasta higroskopna sirupasta tečnost sa blago kiselkast miris, koji podsjeća na miris usivljenog mlijeka. Rastvorljiv u vodi, etanolu, slabo rastvorljiv u benzenu, hloroformu i drugim halogenizovanim ugljovodonicima. Postoje različiti optički aktivni izomeri D i L oblika. I također optički neaktivna mješavina D i L. Potonji se dobiva kemijskom sintezom, a aktivni oblici sa bakterijskim (enzimska metoda) U ljudskom organizmu u Krepsovom ciklusu učestvuje optički aktivan oblik L, zbog čega se preporučuje da se koristi kao aditiv (mliječna kiselina, E270), u drugim industrijama to nije igraju posebnu ulogu.
Globalni naziv Mliječna kiselina nije se ukorijenio u Rusiji, ali naziv njenih laktatnih soli nalazi se posvuda, mnogo češće od kalcijum mliječne kiseline, smanjujemo kalcijum laktat.
Specifikacija za mliječnu kiselinu 80%.
Tačka ključanja (100% rastvor) 122 °C (115 mm Hg)
Specifična težina (20 °C) 1.22
Rastvorljivost u vodi Potpuno rastvorljiv
Gustina (na 20°C) 1,18-1,20 g/ml
Teški metali, ne više od 0,001%
Sadržaj gvožđa, ne više od 0,001%
Sadržaj arsena, ne više od 0,0001%
Sadržaj hlorida, ne više od 0,002% (stvarno 0,0015%)
Sadržaj sulfata, ne više od 0,01% (stvarno 0,004%)
Ostatak nakon kalcinacije, ne više od 0,1% (stvarno 0,06%)
Proizvođač: kina
Pakovanje: Bačve od 25 kg ili kocke od 1200 kg
Osnovna fizička svojstva mliječne kiseline:
Tačka topljenja: 17°C Za optički neaktivne (racemske),
25-26 °C optički aktivna + ili - forma
(razlike u temperaturama topljenja omogućavaju kvalitativno i brzo razlikovanje skupljih optički aktivnih oblika od jeftinijih neaktivnih!!)
Relativna gustina(voda = 1): 1.2
Rastvorljivost u vodi: miješa se
Molekulska težina: 90,08 g/mol
Tačka paljenja: 110°C c.c.
Koeficijent raspodjele oktanol/voda kao log Pow: -0,6
Opasnost od eksplozije i požara:
Podržava sagorevanje na normalnim uslovima. spontano sagorevanje je malo verovatnoIzbjegavajte otvoreni plamen i pušenje.
Gašenje požara: prahom, penom otpornom na alkohol, vodom za prskanje,
ugljen-dioksid.
Hemijska stabilnost: Stabilno na normalne temperature i pritisak.
Uslovi koje treba izbegavati: Stvaranje prašine, prekomerna toplota.
Nekompatibilnost sa drugim materijalima: Jaki oksidanti, mineralne kiseline.
Opasni proizvodi raspadanja: dušikovi oksidi, ugljen monoksid, ugljen-dioksid, parovi
cijanid.
Opasna polimerizacija: Nije označeno.
Opasnost po ljude:
Putevi ulaska u organizam: Supstanca se može apsorbirati u tijelo udisanjem aerosola i kroz usta.
Kod kratkotrajnog izlaganja koncentracijama koje prelaze MPC: Supstanca iritira kožu i Airways, a također ima korozivnu
efekat na oči. Korozivno ako se proguta.
U slučaju kontakta očima: Crvenilo. Bol. Teške duboke opekotine. Zaštitne naočare-maska, ili
zaštitna maska. Prvo isperite veliki iznos vode za nekoliko
minuta (ukloniti Kontaktne leće, ako to nije teško), onda odnesite ljekaru.
Standardi radnog područja:
TLV (US TLV) nije utvrđen.
karcinogenost: Nije na listi ACGIH, IARC, NTP ili CA Prop 65.
epidemiologija: Nema informacija.
tetratogenost: Nema informacija.
Reproduktivni efekti: Nema informacija.
mutagenost: nema informacija
Neurotoksičnost: Nema informacija.
Eksperimenti na životinjama su pokazali:
LD50/LC50:
Draize test, zec, oči: 100 mg Teška;
Draize test, zec, koža: 500 mg/24H Blagi;
Udisanje, pacov: LC50 = >26 mg/m(cc)/1H;
Oralno, miš: LD50 = 1940 mg/kg;
Oralno, pacov: LD50 = 1700 mg/kg;
Koža, zec: LD50 = >10 gm/kg;
Pažnja. Daju se informacije o koncentratu supstance, u male količine i koncentracije mliječne kiseline, prema dostupnim podacima ovog trenutka podaci bezopasni!
Mliječna kiselina(2-hidroksipropionska kiselina) CH 3 CH(OH)COOH, molekulska težina 90,1; bezbojan. Poznate su L(+)-mliječna kiselina, D(-)-mliječna (mesno-mliječna) kiselina i mliječna kiselina fermentacije racemske mliječne kiseline. Za D, L- i D-mliječnu kiselinu, tačka topljenja odgovara 18 °C i 53 °C; t. bale odn. 85°C/1 mmHg i 103°C/2mmHg; za D-mliječnu kiselinu [α] D 20 -2,26 (koncentracija 1,24% u . Za D,L-mliječnu kiselinu D H 0 uzorak - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H isp 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Za L-mliječnu kiselinu D H 0 sagorijevanje - 1344,8 kJ/mol; D H 0 obp -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
Zbog visoke higroskopnosti mliječne kiseline, obično se koriste njene koncentrirane vodene otopine - sirupaste, bezbojne, bez mirisa. Za vodeni rastvori mlečne kiseline d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 mPa. s (25 0 C) odn. za 45,48 i 85,32% rastvora; g 46.0. 10 -3 N/m (25°C) za 1 M rastvor; e 22 (17°C). Mliječna kiselina je rastvorljiva u, ali slabo rastvorljiva u, i drugim halougljovodonicima; R K a 3,862 (25 °C); pH vodenih rastvora 1,23 (37,3%), 0,2 (84,0%).
Mliječna kiselina dehidrira do akrilne kiseline, kada se zagreje sa HBr formira 2-bromopropionsku kiselinu, kada Ca so reaguje sa PCl 5 ili SOCl 2 -2-hloropropionil hloridom. U prisustvu mineralnih kiselina dolazi do autoesterifikacije mliječne kiseline sa stvaranjem formule I, kao i linearnih poliestera. Kada mliječna kiselina reagira, nastaju hidroksi kiseline RCH 2 CH(OH)COOH, a kada mliječna kiselina reagira s alkoholima, nastaju estri. Soli i estri mliječne kiseline nazivaju se laktati (vidi tabelu).
mliječna kiselina nastaje kao rezultat mliječne kiseline (prilikom kiseljenja mlijeka, kiselog kupusa, kiseljenja povrća, zrenja sira, siliranja hrane); D-mliječna kiselina se nalazi u tkivima životinja, biljaka, a također i u mikroorganizmima.
U industriji se mliječna kiselina proizvodi od 2-kloropropionske kiseline i njene (100 °C) ili laktonitrila CH 3 CH(OH)CN (100 °C, H 2 SO 4) s naknadnim stvaranjem estera, izolacijom i hidrolizom što dovodi do visokokvalitetnog proizvoda. Poznate su i druge metode za proizvodnju mliječne kiseline: oksidacija propilena dušikovim oksidima (15-20°C) nakon čega slijedi tretman sa H 2 SO 4, interakcija CH 3 CHO sa CO (200 ° C, 20 MPa).
SVOJSTVA NEKIH LAKTATA

mliječna kiselina se koristi u Prehrambena industrija, u jedljivom bojenju, u štavljenju, u fermentacionim radnjama kao baktericidno sredstvo, za dobijanje lijekovi, plastifikatori. Etil i butil laktati se koriste kao rastvarači za celulozne etere, ulja za sušenje, biljna ulja; butil laktat - također kao rastvarač za neke sintetičke polimere.
Svjetska proizvodnja mliječne kiseline iznosi 40 hiljada tona (1983).
Lit.: Holten C.H., Mliječna kiselina. Svojstva i hemija. Mliječne kiseline i derivati, Weisheim, 1971. Yu. A. Treger.
Odaberite prvo slovo u naslovu članka:
Mliječna kiselina (laktat)- α-hidroksipropionska (2-hidroksipropanska) kiselina.
- t pl 25-26 °C optički aktivan (+)- ili (-)-oblik.
- temperatura topljenja 18 °C racemični oblik.
- Hemijska formula: CH 3 CH(OH)COOH
- Racemska formula: C 3 H 6 O 3

Mliječna kiselina nastaje kada fermentacija mliječne kiselinešećera, posebno u kiselom mlijeku, tokom fermentacije vina i piva. Koristi se i u hemijskoj i u prehrambenoj industriji - kao konzervans. U ljudskom tijelu tokom razgradnje glukoze nastaje mliječna kiselina (laktat).
Dakle, postoji li razlika između mliječne kiseline i laktata? br. U organskoj hemiji se često naziva mliječna kiselina, u biohemiji laktat.
Laktat, vjerovatno najviše okružuje veliki broj razni mitovi, večina od kojih nisu istinite. I iako na ruskom jeziku postoji dovoljno pouzdanog materijala o laktatu, brojni sportaši amateri (i neki profesionalci) tvrdoglavo nastavljaju vjerovati i ponavljati mitove prošlog stoljeća.
Pogledajmo ukratko i sažeto osnovne činjenice o laktatu.
Laktat se uvijek stvara tokom proizvodnje energije u tijelu.
Glavni put energije koja ulazi u ćelije je razgradnja glukoze. Molekul glukoze prolazi kroz niz od 10 uzastopnih reakcija kako bi proizveo piruvat kroz proces koji se naziva glikoliza. Zatim se jedan dio piruvata djelomično oksidira i pretvara u ugljični dioksid i vodu. Drugi dio se pretvara u laktat pod kontrolom enzima laktat dehidrogenaze.
Ova reakcija je reverzibilna.

Dio laktata se koristi za sintezu energije.
Oko 15 do 20 posto ukupnog laktata se pretvara u glikogen kroz proces glukoneogeneze.
Laktat je univerzalni nosilac energije.
U uslovima visoka proizvodnja energije u anaerobnom režimu, laktat je nosilac energije sa onih mesta gde je nemoguće transformisati energiju, zbog povećana kiselost, do onih mjesta gdje se može transformisati u energiju (srce, respiratornih mišića, spori trzaji mišićna vlakna, druge mišićne grupe).
Povećanje nivoa laktata nije posledica nedostatka kiseonika.
Studije na životinjama pokazuju da intracelularna deprivacija kiseonika u izolovanom mišiću ne pokazuje nikakva ograničenja u aktivnosti mitohondrijalnog respiratornog lanca čak i tokom maksimalne vežbe. Uvek ćemo imati dovoljno kiseonika u mišićima.
Laktat je indikator opterećenja anaerobnom glikolizom.
Svaki put kada se formira piruvat, finalni proizvod Metabolizam glukoze tokom glikolize dovodi do stvaranja laktata. Laktat se akumulira jednostavno zato što su stope transformacije energije u anaerobnim i aerobnim vježbama različite.
Što je veći intenzitet rada, proizvodi se više laktata.
Nivo laktata u krvi usko je povezan s intenzitetom vježbanja. Laktat se akumulira zbog razlike u brzini transformacije energije u anaerobnim i aerobnim vježbama. Brzina transformacije energije u anaerobnom energetskom metabolizmu je brža nego u aerobnom metabolizmu.
Laktat ne stvara kiselost, već je prati.
Proizvodnjom energije istovremeno proizvodimo kiselost. Energetske reakcije u našem tijelu odvijaju se uz sudjelovanje elektrona kao nosioca energije. Proizvodi glukolize su laktat i vodikov proton H+. Mjera aktivnosti (koncentracije) vodikovih jona (H+) u otopini izražava njenu kiselost.
Laktat samo privremeno uzima kiseli agens (H+) da izvrši reakciju, a zatim ga vraća u neutralnu sredinu.
90% laktata tijelo iskoristi u prvom satu nakon treninga.
60% laktata u tijelu se potpuno oksidira u CO2 i vodu. Oko 20% se pretvara u glikogen tokom procesa glukoneogeneze, a dio se koristi za stvaranje aminokiselina. Samo mali dio(manje od 5%) laktata se izlučuje znojem i urinom.
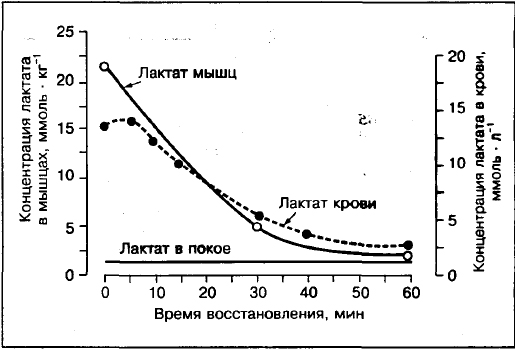
Laktat u krvi neće sistematski odražavati prisustvo mišićnog laktata.
Poređenja koncentracija laktata u mišićima i krvi pokazuju da ako napor prelazi 75-80% VO2max, tada je koncentracija laktata u mišićima (biopsija prednjeg mišića bedra) veća nego u krvi. Za razliku od vježbanja umjerenog intenziteta 30%,50%,70% VO2max gdje je koncentracija laktata u arterijske krvi više nego u mišićima.
Laktat ne uzrokuje bol ili grčeve u mišićima.
Bol u mišićima dan nakon intenzivnog treninga uzrokovan je oštećenjem mišića i upalom tkiva koja se javlja nakon vježbe. Većina grčevi mišića uzrokovane nervnim receptorima u mišićima koji postaju prenadraženi sa pojavom umora u mišićima.
Preuzeto sa cmtscience.com (2016).
Slični članci
-
Prijevod imena Olesya. Olesya - značenje imena. Razni aspekti života
Aktivna Hrabri optimista Alesya Berulava, pjevačica, producentica, kompozitorka Kada imate sreće: Utorak Kada imate problema: Petak Važne godine života: 17, 22, 28, 34, 41, 52 Horoskopski znak: Jarac Sretan broj: 3 Šta znači ime Alesya znači?.. .
-
Istorija nastanka i tumačenje imena Belle
Ime Bella nije samo skup slova ili kolona na izvodu iz matične knjige rođenih, već, bez pretjerivanja, energična poruka budućnosti. Znajući šta znači ime Bella, značenje imena Bella, porijeklo imena Bella, šta ime nosi...
-
Kako platiti račune za komunalije putem interneta
Činjenica je da je pružalac usluge plaćanja komunalnih računa ERIP sistem „Obračun”. Preporučujemo da kontaktirate kontakt centar ERIP sistema "Raschet" na broj telefona 141 ili pišete na email adresu [email protected] i...
-
Šta je sistem stambene štednje i koliko brzo će početi sa radom?
„Stambeno-građevinska štednja“, ili drugim rečima „Građevinske štedionice“ za Rusiju je potpuno nov i još uvek malo poznat sistem hipotekarnih kredita za građane. Iako je u drugim zemljama ovaj sistem već bio uspješan...
-
Značenje imena Semjon, karakter i sudbina
Semjon je ljubazan, simpatičan, aktivan, vrijedan i uporan čovjek. Stidljiv i ranjiv, i dalje lako pronalazi zajednički jezik sa drugima. Zanima ga sve što se dešava oko njega, to ga čini zanimljivim i prijatnim sagovornikom....
-
Značenje i misterija imena sjemenke
Naravno, može se pohvaliti svojim vrlo lijepim i zvučnim imenom. Svaki narod ima svoju istoriju, a uz to je svaka nacija stvorila tradiciju svog imena, koja je od antičkih vremena dobila posebnu strukturu i specifičnost...
