Biochemia glikogenezy. Synteza i glikogenoliza glikogenu. Znaczenie biologiczne i regulacja tych procesów oraz rola wątroby w ich realizacji.
Glikogen jest węglowodany złożone, składający się z cząsteczek glukozy połączonych w łańcuch.
Synteza glikogenu (glikogeneza) zachodzi w ciągu 1-2 godzin po spożyciu pokarmu zawierającego węglowodany. Synteza glikogenu zachodzi najintensywniej w wątrobie. Ponadto syntezowany jest glikogen mięśnie szkieletowe.
Jedna cząsteczka glikogenu zawiera około miliona jednostek glukozy. Fakt ten sugeruje, że organizm zużywa znaczną ilość energii na produkcję glikogenu.
Rozpad glikogenu
Rozkład glikogenu (glikogenoliza) następuje w okresach pomiędzy posiłkami. W tym czasie wątroba rozkłada zawarty w niej glikogen z określoną prędkością, co pozwala organizmowi utrzymać stężenie glukozy we krwi na stałym poziomie.
Biologiczna rola glikogenu
Glukoza jest głównym materiałem energetycznym organizmu, wspierającym jego podstawowe funkcje. Wątroba magazynuje glukozę w postaci glikogenu nie tyle na własne potrzeby, ile w celu zapewnienia przepływu glukozy do innych tkanek – głównie czerwonych krwinek i mózgu.

Jak wspomniano powyżej, komórki mięśniowe, podobnie jak komórki wątroby, są również zdolne do przekształcania glukozy w glikogen. Jednak glikogen zawarty w mięśniach wydawany jest wyłącznie na pracę mięśni. Innymi słowy, glikogen w mięśniach pozostaje źródłem glukozy jedynie dla samej komórki, natomiast glikogen zmagazynowany w wątrobie, po przetworzeniu w glukozę, zużywany jest na odżywienie całego organizmu, a co najważniejsze, na utrzymanie wymaganego stężenia glukozy w krwi.
Synteza i rozkład glikogenu
Syntezę i rozkład glikogenu regulują: system nerwowy i hormony. Są to dwa niezależne procesy zachodzące na różne sposoby. Jak już wspomnieliśmy, główną rolą glikogenu jest regulacja stężenia glukozy we krwi, a także tworzenie rezerwy glukozy niezbędnej do intensywnej pracy mięśni.
Metabolizm glikogenu w wątrobie, mięśniach i innych komórkach jest regulowany przez kilka hormonów, z których niektóre aktywują syntezę glikogenu, a inne - rozkład glikogenu. W której w jednej klatce Synteza i rozkład glikogenu nie mogą zachodzić jednocześnie – są to procesy przeciwstawne, o zupełnie innych zadaniach. Synteza i rozpad wzajemnie się wykluczają lub, innymi słowy, są wzajemne.
Aktywność kluczowych enzymów metabolizmu glikogenu fosforylaza glikogenu I syntaza glikogenu zmienia się w zależności od obecności kwasu fosforowego w enzymie – są one aktywne albo w fosforylowane, albo w defosforylowany formularz.
Dodanie fosforanów do enzymu przeprowadzają kinazy białkowe, źródłem fosforu jest ATP:
- fosforylaza glikogen ulega aktywacji po dodaniu grupy fosforanowej,
- syntaza glikogen ulega inaktywacji po dodaniu fosforanu.
Szybkość fosforylacji tych enzymów wzrasta po ekspozycji na komórkę adrenalina , glukagon i kilka innych hormonów. W rezultacie epinefryna i glukagon powodują glikogenolizę poprzez aktywację fosforylazy glikogenu.
Na przykład,
- podczas pracy mięśni adrenalina powoduje fosforylację enzymów metabolizmu domięśniowego glikogenu. W rezultacie następuje aktywacja fosforylazy glikogenu i inaktywacja syntazy. Glikogen rozkłada się w mięśniach i powstaje glukoza, która dostarcza energię do skurczu mięśni.
- podczas postu, w odpowiedzi na spadek poziomu glukozy we krwi, jest wydzielana z trzustki glukagon. Oddziałuje na hepatocyty i powoduje fosforylację enzymów metabolicznych glikogenu, co prowadzi do glikogenolizy i wzrostu stężenia glukozy we krwi.
Zmiany aktywności enzymów metabolizujących glikogen w zależności od warunków
Metody aktywacji syntazy glikogenu
Allosteryczny Aktywowana jest syntaza glikogenu glukozo-6-fosforan.
Innym sposobem na zmianę jego aktywności jest chemiczny(kowalencyjny) modyfikacja. Po dodaniu fosforanu syntaza glikogenu przestaje działać, tj. jest aktywna de forma fosforylowana. Przeprowadza się usuwanie fosforanów z enzymów fosfatazy białkowe. Działa jako aktywator fosfataz białkowych insulina– w efekcie zwiększa syntezę glikogenu.
Razem z tym insulina I glukokortykoidy przyspieszyć syntezę glikogenu, zwiększając liczba cząsteczek syntaza glikogenu.
Metody aktywacji fosforylazy glikogenowej
Szybkość glikogenolizy jest ograniczona jedynie szybkością fosforylazy glikogenu. Jego aktywność może zmieniać się na trzy sposoby:
- modyfikacja kowalencyjna,
- aktywacja zależna od wapnia,
- aktywacja allosteryczna przez AMP.
Kowalencyjna modyfikacja fosforylazy
Kiedy na komórkę działają określone hormony, następuje aktywacja enzymu mechanizm cyklazy adenylanowej, czyli tzw. regulacja kaskadowa. Kolejność wydarzeń w ten mechanizm obejmuje:
- Cząsteczka hormonu ( adrenalina, glukagon) oddziałuje ze swoim receptorem;
- Aktywny kompleks hormon-receptor działa na błonę białko G;
- Białko G aktywuje enzym cyklaza adenylanowa;
- Cyklaza adenylanowa przekształca ATP w cykliczny AMP(cAMP) – komunikator wtórny (posłaniec);
- cAMP allosterycznie aktywuje enzym kinaza białkowa A;
- Kinaza białkowa A fosforyluje różne białka wewnątrzkomórkowe:
- jednym z tych białek jest syntaza glikogenu, jego aktywność jest tłumiona,
- kolejne białko - kinaza fosforylazy, który jest aktywowany podczas fosforylacji;
- Fosforyluje kinaza fosforylazy fosforylaza „b” glikogen, ten w rezultacie zamienia się w aktywną fosforylazę „a”;
- Aktywny fosforylaza „a” glikogen rozszczepia wiązania α-1,4-glikozydowe w glikogenie, tworząc glukozo-1-fosforan.

Metoda cyklazy adenylanowej aktywacji fosforylazy glikogenu
Oprócz hormonów wpływających na aktywność cyklazy adenylanowej poprzez białka G, istnieją inne sposoby regulacji tego mechanizmu. Na przykład po ekspozycji insulina enzym jest aktywowany fosfodiesteraza, który hydrolizuje obóz i dlatego zmniejsza działalność fosforylaza glikogenu.
Aktywacja zależna od wapnia
Niektóre hormony wpływają metabolizm węglowodanów poprzez mechanizm wapniowo-fosfolipidowy. Aktywacja przez jony wapnia obejmuje aktywację kinazy fosforylazy nie przez kinazę białkową, ale przez jony Ca 2+ i kalmodulinę. Szlak ten działa poprzez inicjowanie szlaku wapniowo-fosfolipidowego. Ta metoda uzasadnia się na przykład kiedy obciążenie mięśni, Jeśli wpływy hormonalne przez cyklazę adenylanową są niewystarczające, ale do cytoplazmy pod wpływem Impulsy nerwowe Wchodzą jony Ca 2+.

Schemat podsumowujący metody aktywacji fosforylazy
Aktywacja allosteryczna
Następuje również aktywacja fosforylazy glikogenu przez AMP - aktywacja allosteryczna w wyniku dodania AMP do cząsteczki fosforylazy „b”. Metoda działa w każdej komórce – ze wzrostem zużycia ATP i akumulacją produktów jego rozkładu.
VI. METABOLIZM GLIKOGENU
Wiele tkanek syntetyzuje glikogen jako rezerwową formę glukozy. Synteza i rozkład glikogenu zapewnia stałe stężenie glukozy we krwi i tworzy magazyn, który w razie potrzeby może zostać wykorzystany przez tkanki.
A. Budowa i funkcje glikogenu
Glikogen jest rozgałęzionym homopolimerem glukozy, w którym reszty glukozy są połączone w obszarach liniowych wiązaniem α-1,4-glikozydowym. W punktach rozgałęzień monomery są połączone wiązaniami α-1,6-glikozydowymi. Wiązania te powstają z mniej więcej co dziesiątą resztą glukozy. Dlatego punkty rozgałęzień w glikogenie występują w przybliżeniu co dziesięć reszt glukozy. Daje to strukturę drzewiastą o masie cząsteczkowej >10 7 D, co odpowiada w przybliżeniu 50 000 reszt glukozy (ryc. 7-21). Zatem w cząsteczce glikogenu znajduje się tylko jedna wolna anomeryczna grupa OH, a zatem tylko jeden koniec redukujący.
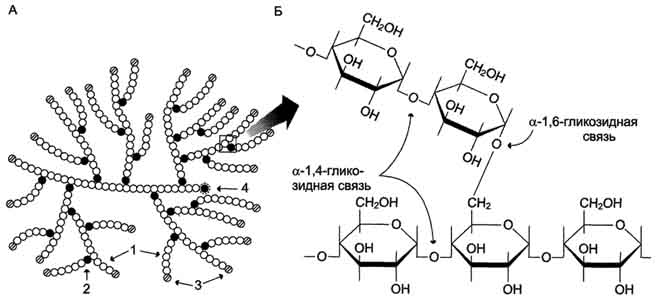
Ryż. 7-21. Struktura glikogenu. A. Struktura cząsteczki glikogenu: 1 - reszty glukozy połączone wiązaniem α-1,4-glikozydowym; 2 - reszty glukozy połączone wiązaniem α-1,6-glikozydowym; 3 - nieredukujące monomery końcowe; 4 - redukujący monomer końcowy. B. Struktura oddzielnego fragmentu cząsteczki glikogenu.
W komórkach zwierzęcych glikogen jest głównym polisacharydem rezerwowym. Podczas polimeryzacji glukozy zmniejsza się rozpuszczalność powstałej cząsteczki glikogenu, a w konsekwencji jej wpływ na ciśnienie osmotyczne w klatce. Ta okoliczność wyjaśnia, dlaczego w komórce odkłada się glikogen, a nie wolna glukoza.
Glikogen magazynowany jest w cytozolu komórki w postaci granulek o średnicy 10-40 nm. Niektóre enzymy biorące udział w metabolizmie glikogenu są również związane z granulkami, co ułatwia ich interakcję z substratem. Determinuje rozgałęzioną strukturę glikogenu duża liczba monomery końcowe, co ułatwia pracę enzymów usuwających lub dodających monomery podczas rozkładu lub syntezy glikogenu, ponieważ enzymy te mogą jednocześnie działać na kilku gałęziach cząsteczki. Glikogen odkłada się głównie w wątrobie i mięśniach szkieletowych.
Po jedzeniu, bogaty w węglowodany rezerwa glikogenu w wątrobie może wynosić około 5% jej masy. Około 1% glikogenu magazynuje się w mięśniach, ale w masie tkanka mięśniowa znacznie więcej i dlatego całkowity W mięśniach znajduje się 2 razy więcej glikogenu niż w wątrobie. Glikogen może być syntetyzowany w wielu komórkach, np. w neuronach, makrofagach i komórkach tkanki tłuszczowej, jednak jego zawartość w tych tkankach jest znikoma. Organizm może zawierać aż 450 g glikogenu.
Rozkład glikogenu wątrobowego służy głównie utrzymaniu poziomu glukozy we krwi w okresie poabsorpcyjnym. Dlatego zawartość glikogenu w wątrobie zmienia się w zależności od rytmu odżywiania. Przy długotrwałym poszczeniu spada prawie do zera. Glikogen mięśniowy służy jako rezerwa glukozy, źródło energii podczas skurczu mięśni. Glikogen mięśniowy nie jest wykorzystywany do utrzymania poziomu glukozy we krwi. Jak wspomniano wcześniej, komórki mięśniowe nie zawierają enzymu glukozo-6-fosfatazy i nie jest możliwe tworzenie wolnej glukozy. Zużycie glikogenu w mięśniach zależy głównie od aktywność fizyczna(Rysunek 7-22).
B. Synteza glikogenu (glikogeneza)
Glikogen syntetyzuje się podczas trawienia (1-2 godziny po spożyciu pokarmów zawierających węglowodany). Należy zaznaczyć, że synteza glikogenu z glukozy (ryc. 7-23), jak każdy proces anaboliczny, ma charakter endergoniczny, tj. wymagające nakładów energetycznych.

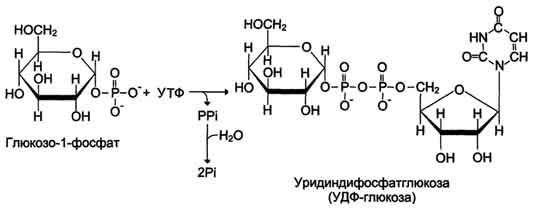
Glukoza wchodząca do komórki ulega fosforylacji przy udziale ATP (reakcja 1). Następnie glukozo-6-fosforan w trakcie reakcja odwracalna ulega przemianie do glukozo-1-fosforanu (reakcja 2) pod wpływem enzymu fosfoglukomutazy. Zgodnie ze swoim stanem termodynamicznym glukozo-1-fosforan może służyć jako substrat do syntezy glikogenu. Jednak ze względu na odwracalność reakcji glukozo-6-fosforan ↔ glukozo-1-fosforan, synteza glikogenu z glukozo-1-fosforanu i jego rozkład również byłyby odwracalne, a zatem niekontrolowane. Aby synteza glikogenu była termodynamicznie nieodwracalna, wymagany jest dodatkowy etap tworzenia urydynodifosforanu glukozy z UTP i glukozo-1-fosforanu (reakcja 3). Nazwa enzymu katalizującego tę reakcję pochodzi od reakcji odwrotnej: UDP-glukopirofosforylaza. Jednak w komórce nie zachodzi reakcja odwrotna, ponieważ pirofosforan powstający podczas reakcji bezpośredniej jest bardzo szybko rozkładany przez pirofosfatazę na 2 cząsteczki fosforanu (ryc. 7-24).
Reakcja powstania UDP-glukozy decyduje o nieodwracalności całego szeregu reakcji zachodzących podczas syntezy glikogenu. To wyjaśnia również niemożność rozkładu
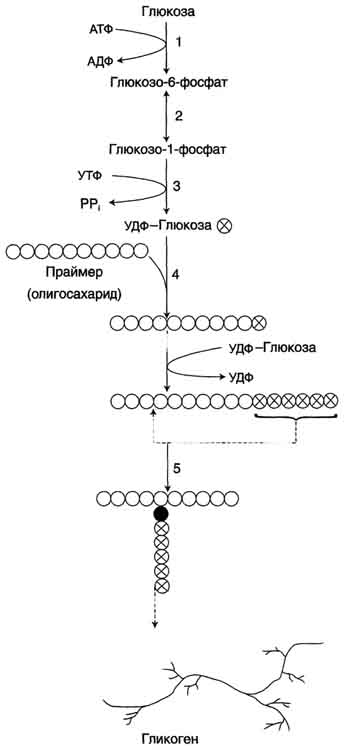
Ryż. 7-23. Synteza glikogenu. 1 - glukokinaza lub heksokinaza; 2 - fosfoglukomutaza; 3 - UDP-glukropirofosforylaza; 4 - syntaza glikogenu (glukozylotransferaza); 5 - enzym „rozgałęziający” (amylo-1,4 → 1,6-glukozylotransferaza), otwarte i zacienione kółka to reszty glukozy, wypełnione kółka to reszty glukozy w punkcie rozgałęzienia.
glikogenu poprzez proste odwrócenie procesu jego syntezy.
Wykształcony UDP-glukoza dalej wykorzystywany jako donor reszty glukozy podczas syntezy glikogenu (ryc. 7-23, reakcja 4). Reakcja ta jest katalizowana przez enzym syntaza glikogenu (glukozylotransferaza). Ponieważ w tej reakcji nie wykorzystuje się ATP, enzym nazywany jest syntazą, a nie syntetazą. Część nukleotydowa UDP-glukozy odgrywa znaczącą rolę w działaniu syntazy glikogenu, pełniąc funkcję „uchwytu”, za pomocą którego enzym ustawia glukozę w łańcuchu polisacharydowym w pożądanej pozycji. Ponadto wydaje się, że do rozpoznania substratu podczas katalizy wymagana jest część nukleotydowa UDP-glukozy.
Ponieważ glikogen w komórce nigdy nie ulega całkowitemu rozkładowi, synteza glikogenu odbywa się poprzez wydłużenie istniejącej cząsteczki polisacharydu zwanej "nasionko", Lub "Elementarz". Cząsteczki glukozy są kolejno przyłączane do „nasiona”. Wydaje się, że struktura cząsteczki „zarodkowej” determinuje rodzaj wiązania zachodzącego w reakcji transglikozylacji. W ten sposób syntetyzuje się polisacharyd o strukturze podobnej do „nasionowej”. „Ziarno” może obejmować białko glikogeninę, w którym łańcuch oligosacharydowy (około 8 reszt glukozy) jest przyłączony do grupy OH jednej z reszt tyrozyny. Reszty glukozy są przenoszone przez syntazę glikogenu na nieredukujący koniec oligosacharydu i łączone wiązaniami α-1,4-glikozydowymi. Po zakończeniu syntezy glikogenina pozostaje zawarta w granulkach glikogenu.
Rozgałęziona struktura glikogenu powstaje przy udziale amylo-1,4 →1,6-glukozylotransferazy, zwanej enzymem „rozgałęziającym” (z ang. enzym rozgałęziający). Gdy syntaza glikogenu rozszerzy region liniowy do około 11 reszt glukozy, enzym rozgałęziający przenosi swój blok końcowy, zawierający 6-7 reszt, na wewnętrzną resztę glukozy tego lub innego łańcucha. W punkcie rozgałęzienia końcowa reszta glukozy oligosacharydu łączy się z grupą hydroksylową w pozycji C6, tworząc wiązanie α-1,6-glikozydowe. Nowy punkt rozgałęzienie może powstać w odległości co najmniej 4 reszt od dowolnej reszty. Zatem w miarę syntezy glikogenu liczba rozgałęzień wzrasta wielokrotnie. Końce łańcuchów służą jako punkty wzrostu cząsteczki podczas jej syntezy i początek podczas jej rozpadu.
B. Rozkład glikogenu (glikogenoliza)
Rozkład lub mobilizacja glikogenu następuje w odpowiedzi na wzrost zapotrzebowania organizmu na glukozę. Glikogen wątrobowy rozkłada się głównie w przerwach między posiłkami, ponadto proces ten w wątrobie i mięśniach przyspiesza podczas pracy fizycznej.
Rozkład glikogenu (ryc. 7-25) następuje poprzez sekwencyjne rozszczepianie reszt glukozy w postaci glukozo-1-fosforanu. Wiązanie glikozydowe rozszczepia się za pomocą nieorganicznego fosforanu, dlatego proces ten nazywa się fosforolizą, a enzymem jest fosforylaza glikogenu.
Podobnie jak synteza, rozkład glikogenu rozpoczyna się od nieredukującego końca polisacharydu
więzy. Jednocześnie obecność rozgałęzionej struktury glikogenu ułatwia szybkie uwalnianie reszt glukozy, ponieważ im więcej końców ma cząsteczka glikogenu, tym więcej cząsteczek fosforylazy glikogenu może działać jednocześnie.
Fosforylaza glikogenu rozszczepia tylko wiązania α-1,4-glikozydowe (reakcja 1). Sekwencyjne rozszczepianie reszt glukozy zatrzymuje się, gdy przed punktem rozgałęzienia pozostają 4 monomery. Ta cecha działania fosforylazy glikogenu wynika z wielkości i struktury jej centrum aktywnego.
Dalszy rozkład glikogenu wymaga udziału dwóch innych enzymów. W pierwszej kolejności trzy reszty glukozy pozostałe do punktu rozgałęzienia przenoszone są przy udziale transferazy oligosacharydowej (reakcja 2) na nieredukujący koniec sąsiedniego łańcucha, wydłużając go i tworząc w ten sposób warunki do działania fosforylazy. Pozostała w punkcie rozgałęzienia reszta glukozy jest odcinana hydrolitycznie przez α-1,6-glukozydazę w postaci wolnej glukozy (reakcja 3), po czym nierozgałęziona część glikogenu może ponownie zostać zaatakowana przez fosforylazę.
Uważa się, że przeniesienie trzech reszt glukozy i usunięcie monomeru z punktu rozgałęzienia (reakcje 2 i 3) są katalizowane przez ten sam enzym, który ma dwie różne aktywności enzymatyczne – transferazę i glikozydazę. Nazywa się go enzymem „odgałęziającym” (z angielskiego, enzym rozgałęziający).
Produkt fosforylazy glikogenu, glukozo-1-fosforan, jest następnie izomeryzowany do glukozo-6-fosforanu przez fosfoglukomutazę. Następnie glukozo-6-fosforan bierze udział w procesie katabolizmu lub innych szlakach metabolicznych. W wątrobie (ale nie w mięśniach) glukozo-6-fosforan może ulegać hydrolizie, tworząc glukozę, która jest uwalniana do krwi. Reakcja ta jest katalizowana przez enzym glukozo-6-fosfatazę. Reakcja zachodzi w świetle ER, gdzie glukozo-6-fosforan jest transportowany za pomocą specjalnego białka. Enzym jest zlokalizowany na błonie ER w taki sposób, że aktywny ośrodek twarzą w stronę światła ER. Produkty hydrolizy (glukoza i nieorganiczny fosforan) również wracają do cytoplazmy za pomocą systemów transportowych.
![]()
Ryż. 7-25. Rozpad glikogenu. W ramce znajduje się fragment glikogenu z punktem rozgałęzienia. Wypełnione kółko to reszta glukozy połączona wiązaniem α-1,6-glikozydowym; otwarte i zacienione kółka to reszty glukozy w obszarach liniowych i bocznych gałęziach połączonych wiązaniem α-1,4-glikozydowym. 1 - Fosforylaza glikogenu; 2 - transferaza oligosacharydowa; 3 - α-1,6-glukozydaza.
G. Znaczenie biologiczne wymianę glikogenu w wątrobie i mięśniach
Rysunek 7-26 pokazuje ogólny schemat synteza i rozkład glikogenu oraz regulacja tych procesów przez hormony.
Porównanie tych procesów pozwala na wyciągnięcie następujących wniosków:
- synteza i rozkład glikogenu przebiega różnymi szlakami metabolicznymi;
- wątroba magazynuje glukozę w postaci glikogenu nie tyle na własne potrzeby, ile w celu utrzymania stałego stężenia glukozy we krwi, a tym samym zapewnia dostawę glukozy do innych tkanek. Powoduje to obecność glukozo-6-fosfatazy w wątrobie główna funkcja wątroba w metabolizmie glikogenu;
- funkcją glikogenu mięśniowego jest uwalnianie glukozo-6-fosforanu, który jest zużywany w samym mięśniu w celu utleniania i wykorzystania energii;
- Synteza glikogenu jest procesem endergonicznym. Zatem 1 mol ATP i 1 mol UTP wykorzystuje się do włączenia jednej reszty glukozy do łańcucha polisacharydowego;
- rozkład glikogenu do glukozo-6-fosforanu nie wymaga energii;
- Nieodwracalność procesów syntezy i rozkładu glikogenu zapewnia ich regulacja.
Mobilizacja glikogenu (glikogenoliza)
Zapasy glikogenu są wykorzystywane w różny sposób w zależności od cechy funkcjonalne komórki.
Glikogen wątroba rozkłada się, gdy zmniejsza się stężenie glukozy we krwi, głównie między posiłkami. Po 12-18 godzinach postu zapasy glikogenu w wątrobie są całkowicie wyczerpane.
W mięśnie ilość glikogenu zwykle zmniejsza się dopiero podczas wysiłku fizycznego – długotrwałego i/lub intensywnego. Glikogen służy tu do zapewnienia glukozy do pracy samych miocytów. Zatem mięśnie, podobnie jak inne narządy, wykorzystują glikogen wyłącznie na własne potrzeby.
Mobilizacja (rozkład) glikogenu lub glikogenoliza aktywuje się, gdy w komórce, a co za tym idzie i we krwi, brakuje wolnej glukozy (na czczo, praca mięśni). W której poziom glukozy we krwi„celowo” obsługuje tylko wątroba, który zawiera glukozo-6-fosfatazę, która hydrolizuje ester fosforanowy glukozy. Wolna glukoza powstająca w hepatocytach wychodzi przez błona plazmatyczna do krwi.
W glikogenolizie bezpośrednio biorą udział trzy enzymy:
1. Fosforylaza glikogenu(koenzym fosforan pirydoksalu) - rozszczepia wiązania α-1,4-glikozydowe tworząc glukozo-1-fosforan. Enzym działa do momentu, gdy przed punktem rozgałęzienia pozostaną 4 reszty glukozy (wiązanie α1,6).
2. α(1,4)-α(1,4)-glukantransferaza– enzym, który przenosi fragment trzech reszt glukozy na inny łańcuch, tworząc nowe wiązanie α1,4-glikozydowe. W tym przypadku jedna reszta glukozy i „otwarte” dostępne wiązanie α1,6-glikozydowe pozostają w tym samym miejscu.
3. Amylo-α1,6-glukozydaza, ("rozgałęzianie„enzym) – hydrolizuje wiązanie α1,6-glikozydowe w celu uwolnienia bezpłatny(niefosforylowana) glukoza. W rezultacie powstaje łańcuch bez rozgałęzień, który ponownie służy jako substrat dla fosforylazy.
Rola enzymów w rozkładzie glikogenu
Glikogen może być syntetyzowany niemal we wszystkich tkankach, jednak największe rezerwy glikogenu znajdują się w wątrobie i mięśniach szkieletowych.
Ilość glikogenu w mięśniach maleje zwykle tylko podczas wysiłku fizycznego – długotrwałego i/lub wytężonego. Akumulacja Poziom glikogenu obserwuje się tutaj w okresie rekonwalescencji, zwłaszcza podczas spożywania pokarmów bogatych w węglowodany.
Glikogen wątrobowy dzieli gdy zmniejsza się stężenie glukozy we krwi, szczególnie między posiłkami ( poabsorpcyjne okres). Po 12-18 godzinach postu zapasy glikogenu w wątrobie są całkowicie wyczerpane. Kumuluje się glikogen w wątrobie tylko po posiłkach, przy hiperglikemii. Wyjaśnia to charakterystyka heksokinazy wątrobowej (glukokinazy), która ma niskie powinowactwo do glukozy i może działać tylko w wysokich stężeniach.
Na normalne stężenia glukoza we krwi nie jest wychwytywana przez wątrobę.
Następujące enzymy bezpośrednio syntetyzują glikogen:
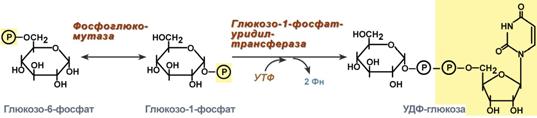
1. Fosfoglukomutaza– przekształca glukozo-6-fosforan w glukozo-1-fosforan;
2. Urydylotransferaza glukozo-1-fosforanowa– enzym przeprowadzający kluczową reakcję syntezy. Nieodwracalność tej reakcji zapewnia hydroliza powstałego difosforanu;
Reakcje syntezy UDP-glukozy
3. Syntaza glikogenu– tworzy wiązania α1,4-glikozydowe i wydłuża łańcuch glikogenu poprzez przyłączenie aktywowanego C1 UDP-glukozy do końcowej reszty C4 glikogenu;

Chemia reakcji syntazy glikogenu
4. Amylo-α1,4-α1,6-glikozylotransferaza Enzym „rozgałęziający glikogen” – przenosi fragment o długości minimum 6 reszt glukozy na sąsiedni łańcuch z utworzeniem wiązania α1,6-glikozydowego.

Wiele tkanek syntetyzuje glikogen jako rezerwową formę glukozy. Synteza i rozkład glikogenu w wątrobie utrzymuje homeostazę glukozy we krwi.
Glikogen - rozgałęziony homopolisacharyd glukozy o masie >10 7 Da (50 000 reszt glukozy), w którym reszty glukozy są połączone w odcinkach liniowych wiązaniem α-1,4-glikozydowym. W punktach rozgałęzień, co około 10 reszt glukozy, monomery są połączone wiązaniami α-1,6-glikozydowymi. Glikogen, nierozpuszczalny w wodzie, magazynowany jest w cytozolu komórki w postaci granulek o średnicy 10-40 nm. Glikogen odkłada się głównie w wątrobie (do 5%) i mięśniach szkieletowych (do 1%). Organizm może zawierać od 0 do 450 g glikogenu.
Rozgałęziona struktura glikogenu ułatwia pracę enzymów usuwających lub dodających monomery.
Synteza glikogenu (glikogeneza)
Glikogen syntetyzuje się przy wydatku energetycznym podczas trawienia (1-2 godziny po spożyciu pokarmów zawierających węglowodany).


Synteza glikogenu odbywa się poprzez wydłużenie już istniejącej cząsteczki polisacharydu zwanej „ nasionko ", Lub " Elementarz " Starter może zawierać białko glikogeninę, w którym do Tyr jest przyłączony oligosacharyd (około 8 reszt glukozy). Reszty glukozy są przenoszone przez syntazę glikogenu na nieredukujący koniec oligosacharydu i łączone wiązaniami α-1,4-glikozydowymi.
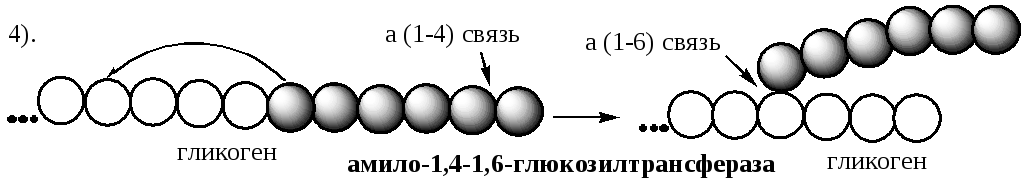
Gdy region liniowy zostanie przedłużony do około 11 reszt glukozy, enzym rozgałęziający przenosi swój blok końcowy, zawierający 6-7 reszt, na wewnętrzną resztę glukozy tego lub innego łańcucha, tworząc wiązanie α-1,6-glikozydowe. Nowy punkt rozgałęzienia powstaje w odległości co najmniej 4 reszt od dowolnego istniejącego punktu rozgałęzienia.
Rozkład glikogenu (glikogenoliza)
Rozkład glikogenu następuje poprzez sekwencyjną eliminację glukozy-1-ph w odpowiedzi na wzrost zapotrzebowania organizmu na glukozę. Reakcja jest katalizowana przez fosforylazę glikogenu:
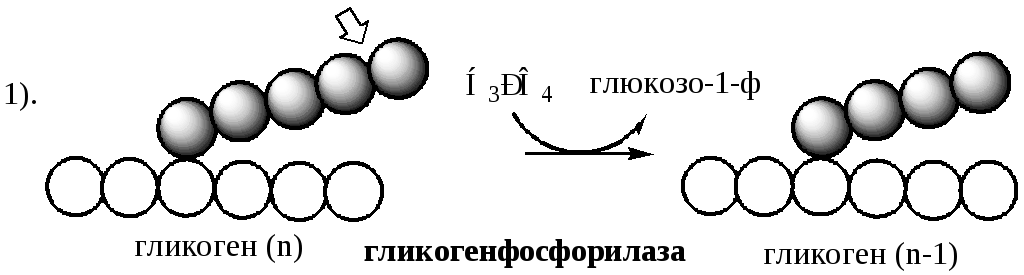
Fosforylaza glikogenu składa się z 2 identycznych podjednostek (94500 Da). Formę nieaktywną oznaczono jako b, formę aktywną -a. Aktywowany kinaza fosforylazy B przez fosforylacja każdej podjednostki w serynie w pozycji 14.
Fosforylaza glikogenu rozszczepia wiązania α-1,4-glikozydowe poprzez fosforolizę, aż przed punktem rozgałęzienia pozostaną 4 reszty glukozy.
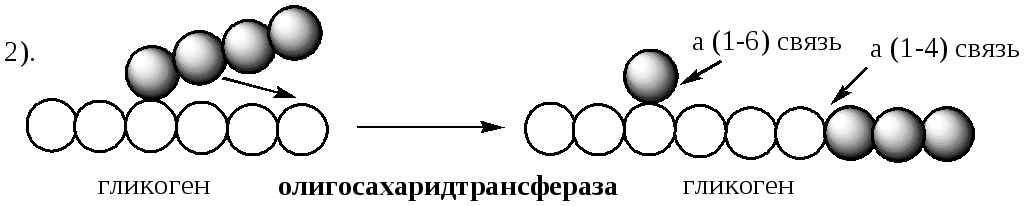
Inaktywacja fosforylazy glikogenowej następuje poprzez defosforylację przy udziale specyficznej fosforylazy fosfatazy (fosfataza fosfoproteinowa FPP).
Przeprowadzane jest usuwanie gałęzi enzym rozgałęziający . Ma aktywność transferazy i glikozydazy. Część transferazy ( transferaza oligosacharydowa ) przenosi trzy reszty glukozy pozostałe do punktu rozgałęzienia na nieredukujący koniec sąsiedniego łańcucha, wydłużając go dla fosforylazy.
Część glikozydazowa ( α-1,6-glukozydaza ) hydrolizuje wiązanie α-1,6-glikozydowe, uwalniając glukozę.
Glukoza-1-ph jest izomeryzowana do glukozy-6-ph przez fosfoglukomutazę.
Regulacja metabolizmu glikogenu w wątrobie
Glikogen glukozowo-1-ph
4Ca2+ km
Ok 2+ , DAG
Regulacja metabolizmu glikogenu w mięśniach
Glikogen glukozowo-1-ph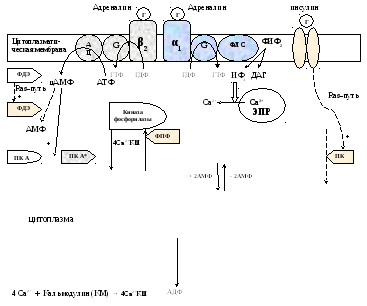
Metabolizm glikogenu jest kontrolowany przez hormony (w wątrobie – insulina, glukagon, adrenalina; w mięśniach – insulina i adrenalina), które regulują fosforylację/defosforylację 2 kluczowych enzymów, syntazy glikogenu i fosforylazy glikogenu.
Kiedy poziom glukozy we krwi jest niewystarczający, uwalniany jest hormon glukagon, a w skrajnych przypadkach adrenalina. Stymulują fosforylację syntazy glikogenu (jest inaktywowana) i fosforylazy glikogenu (jest aktywowana). Kiedy wzrasta poziom glukozy we krwi, uwalniana jest insulina, która stymuluje defosforylację syntazy glikogenu (jest aktywowana) i fosforylazy glikogenu (jest inaktywowana). Dodatkowo insulina indukuje syntezę glukokinazy, przyspieszając tym samym fosforylację glukozy w komórce. Wszystko to prowadzi do tego, że insulina stymuluje syntezę glikogenu, a adrenalina i glukagon stymulują jego rozkład.
W wątrobie zachodzi także allosteryczna regulacja fosforylazy glikogenu: jest ona hamowana przez ATP i glukozę-6ph oraz aktywowana przez AMP.
Zaburzenia metabolizmu glikogenu
Choroby glikogenowe - grupa chorób dziedzicznych, które polegają na zmniejszeniu lub braku aktywności enzymów katalizujących reakcje syntezy lub rozpadu glikogenu lub naruszeniu regulacji tych enzymów.
Glikogenozy - choroby spowodowane defektem enzymów biorących udział w rozkładaniu glikogenu. Objawiają się one albo niezwykłą strukturą glikogenu, albo jego nadmiernym gromadzeniem w wątrobie, mięśniach sercowych czy szkieletowych, nerkach, płucach i innych narządach.
Obecnie glikogenozy dzieli się na 2 grupy: wątrobowe i mięśniowe.
Wątrobowe formy glikogenozy prowadzić do zakłócenia wykorzystania glikogenu do utrzymania poziomu glukozy we krwi. Dlatego objaw ogólny dla tych postaci - hipoglikemia w okresie poabsorpcyjnym.
choroba Gierkego (typ I) jest odnotowywany najczęściej. Powodem jest dziedziczny defekt glukozo-6-fosfatazy, enzymu zapewniającego uwolnienie glukozy do krwiobiegu po jej uwolnieniu z glikogenu komórek wątroby i nerek. Komórki wątroby i kręte kanaliki nerek są wypełnione glikogenem, wątroba i śledziona są powiększone, a pacjenci mają opuchniętą twarz – „twarz chińskiej lalki”. Choroba objawia się hipoglikemią, hipertriacyloglicerolemią, hiperurykemią i kwasicą.
1). W hepatocytach: glukoza-6-ph → PVC, mleczan (kwasica), ryboza-5-ph. ryboza-5-ph → puryny → kwas moczowy
2). We krwi: ↓glukoza →↓insulina/glukagon →: a) lipoliza tkanki tłuszczowej → FA we krwi.
B). ↓LPL tkanki tłuszczowej → TAG we krwi.
Leczenie to dieta glukozowa, częste karmienie.
Choroba odry (typ III) powszechne, 1/4 wszystkich glikogenoz wątrobowych. Rozgałęziony glikogen gromadzi się, ponieważ enzym usuwający rozgałęzienia jest wadliwy. Glikogenoliza jest możliwa, ale w niewielkim stopniu. Nie obserwuje się kwasicy mleczanowej i hiperurykemii. Choroba ma łagodniejszy przebieg niż choroba Gierkego.
Mięśniowe formy glikogenozy charakteryzuje się zaburzeniami w dostawie energii do mięśni szkieletowych. Choroby te objawiają się podczas wysiłku fizycznego i towarzyszą im bóle i skurcze mięśni, osłabienie i zmęczenie.
choroba McArdle’a (typ V) - patologia autosomalna recesywna, w mięśniach szkieletowych nie ma aktywności fosforylazy glikogenu. Nagromadzenie glikogenu o nieprawidłowej budowie w mięśniach.
Aglikogenozy
Aglikogenoza (glikogenoza 0 według klasyfikacji) jest chorobą wynikającą z defektu syntazy glikogenu. W wątrobie i innych tkankach pacjentów obserwuje się bardzo niską zawartość glikogenu. Przejawia się to wyraźną hipoglikemią w okresie poabsorpcyjnym. Charakterystycznym objawem są skurcze, które występują szczególnie rano. Choroba jest zgodna z życiem, ale chore dzieci wymagają częstego karmienia.
Podobne artykuły
-
Twierdzenia o polach figur. Pole prostokąta
Informacje historyczne Na Rusi Kijowskiej nie istniały, jak wynika z zachowanych źródeł, miary powierzchni podobne do miar kwadratowych. Chociaż starożytni rosyjscy architekci i geodeci mieli o nich pojęcie. Do określenia wielkości gruntu potrzebne były pomiary powierzchniowe...
-
Metody wróżenia za pomocą wahadła - jak zrobić wahadło do wróżenia własnymi rękami
Dla dziecka, przy dobrym montażu, pomysł można rozwinąć np. w upominek biurowy.Podstawą zabawki jest prosty obwód z zawieszką (choć oczywiście lepiej to zrobić na tablicy), składający się z tranzystor, dioda i specjalnie uzwojona cewka,...
-
Nauka pracy z wahadłem różdżkarskim: dobór, kalibracja, zadawanie pytań
Wahadło wykonane własnoręcznie będzie ściśle powiązane z energią jego właściciela, jednak samodzielne wykonanie niektórych rodzajów wahadeł jest prawie niemożliwe. Jeśli chcesz spróbować swoich sił w radiestezji, zacznij od...
-
Funkcja pierwotna funkcji wykładniczej w zadaniach UNT
Różniczkowanie funkcji wykładniczej i logarytmicznej 1. Liczba e. Funkcja y = e x, jej własności, wykres, różniczkowanie. Rozważmy funkcję wykładniczą y = a x, gdzie a > 1. Dla różnych podstaw a otrzymujemy różne wykresy (Rys....
-
Pochodna logarytmu dziesiętnego
Zachowanie Twojej prywatności jest dla nas ważne. Z tego powodu opracowaliśmy Politykę prywatności, która opisuje, w jaki sposób wykorzystujemy i przechowujemy Twoje dane. Prosimy o zapoznanie się z naszymi zasadami zgodności...
-
Wakacje to wspaniały czas!
Wielcy o poezji: Poezja jest jak malarstwo: niektóre prace zafascynują Cię bardziej, jeśli przyjrzysz się im bliżej, inne, jeśli odsuniesz się dalej. Małe, urocze wierszyki bardziej drażnią nerwy niż skrzypienie niepomalowanych...
