Az enzimatikus reakció kinetikájának jellemzői. Az enzimes reakció feltételei
Az E enzim reverzibilisen egyesül az S szubsztráttal, instabil közbenső ES enzim-szubsztrát komplexet képezve, amely a reakció végén szétesik, és felszabadul az enzim és a P reakciótermékek.
Ezek a gondolatok képezték az alapot E. Fisher (1890) „kulcszár” elmélete. Az aktív centrum szerkezete komplementer a szubsztrát molekulaszerkezetével, ezáltal biztosítja az enzim magas specifitását. Az enzim-szubsztrát komplexek képződése hidrogénkötésekkel, elektrosztatikus és hidrofób kölcsönhatásokkal, illetve esetenként kovalens és koordinációs kötésekkel is jár.
D. Koshland fejlesztették ki az "indukált levelezés" elmélete (1958) . A szubsztrát szerkezete és az enzim aktív centruma közötti térbeli megfelelés az egymással való kölcsönhatás pillanatában jön létre, ami a képlettel fejezhető ki. "kesztyű - kéz". A szubsztrát konformációs változásokat indukál az enzimmolekulában oly módon, hogy az aktív centrum felveszi a szubsztrát megkötéséhez szükséges térbeli orientációt. Azok. Az enzim csak az aktív (feszítő) T-formában (húzó) lesz a szubsztrát rögzítésének pillanatában, ellentétben az inaktív R-formával (relaxe).
Jelenleg Koshland hipotézise fokozatosan lecserélődik hipotézis topokémiai levelezés. Megtartva az „indukált megfelelés” elméletének alapelveit, az enzimműködés specifitását a szubsztrát azon részének felismerésével magyarázza, amely nem változik a katalízis során.
A többi katalizátorhoz hasonlóan az enzimek is termodinamikai szempontból felgyorsítják a kémiai reakciókat az aktiválási energia csökkentésével.
Aktiválási energia az az energia, amely egy mól anyag összes molekulájának aktivált állapotba való átalakításához szükséges egy adott hőmérsékleten.
Mind az enzimkatalizált, mind a nem enzimkatalizált reakciókban azonos a standard szabadenergia-változás (ΔG). Az enzimreakciónak azonban alacsonyabb az aktiválási energiája. A reakciósebességre ható enzimek nem változtatják meg az előre és fordított reakció közötti egyensúlyi helyzetet, hanem csak felgyorsítják annak beindulását.
2.3. Az enzimes reakciók kinetikája
Az enzimkinetika a reagáló anyagok (enzimek, szubsztrátok) kémiai természetének és kölcsönhatásuk körülményeinek (koncentráció, pH, hőmérséklet, aktivátorok vagy inhibitorok jelenléte) hatását vizsgálja az enzimatikus reakció sebességére. Az enzimreakció sebességét (V) a szubsztrát mennyiségének csökkenésével vagy a termék időegység alatti növekedésével mérjük.
Az enzimkatalízis során az enzim (E) reverzibilisen egyesül a szubsztráttal (S), instabil enzim-szubsztrát komplexet (ES) képezve, amely a reakció végén szétesik, és az enzim (E) és a reakciótermékek (P) felszabadul. :
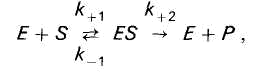
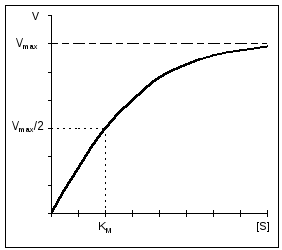
Az enzimreakciók fontos jellemzője az az enzim szubsztráttal való telítése. Alacsony szubsztrátkoncentráció esetén a reakció sebessége egyenesen arányos a koncentrációjával. Nagy sebességnél a reakciósebesség maximális, állandóvá válik és függetlenné válik a szubsztrát koncentrációjától [S], és teljes mértékben az enzimkoncentráció határozza meg (11. ábra).
|
|
|
Rizs. 11. Egy enzimreakció sebességének függése a szubsztrát koncentrációjától állandó enzimkoncentráció mellett. |
K S – az enzim-szubsztrát komplex disszociációs állandója ES, az egyensúlyi állandó reciproka:
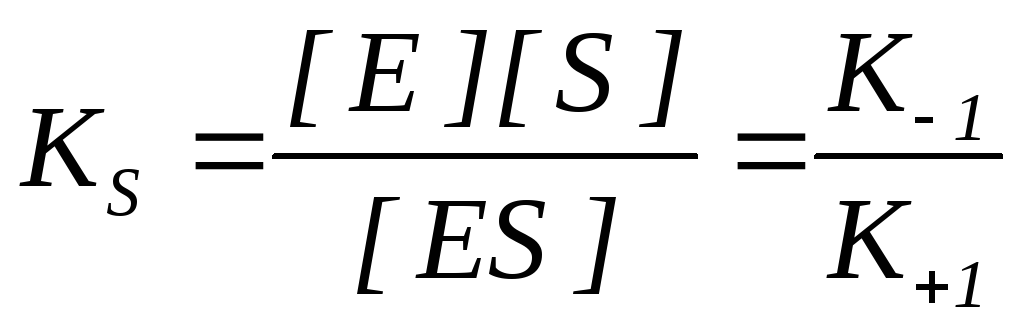
Minél alacsonyabb a K S érték, annál nagyobb az enzim affinitása a szubsztráthoz.
A szubsztrát koncentrációja és az enzimatikus reakció sebessége közötti mennyiségi összefüggés kifejeződik az egyenlet Michaelisa-Menten:
 ,
,
- reakciósebesség, V max - az enzimreakció maximális sebessége.
Briggs és Haldane javította az egyenletet a bevezetésével Michaelis állandóK M, kísérletileg határozták meg.
Briggs-Haldane egyenlet: 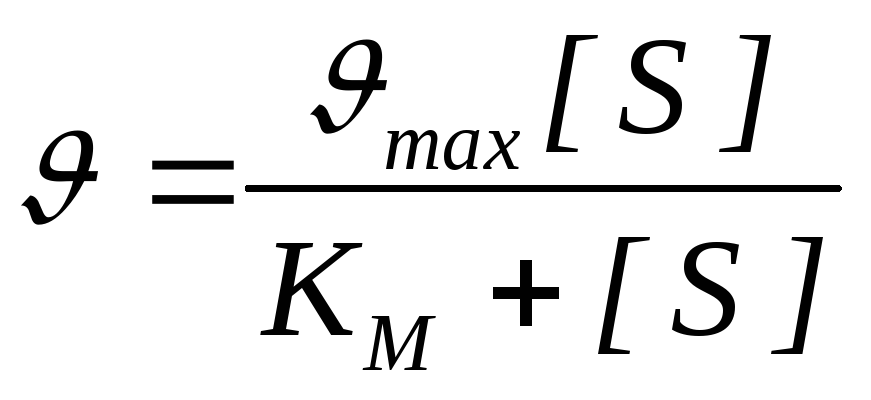
A Michaelis-állandó számszerűen megegyezik a szubsztrát koncentrációval (mol/l), amelynél az enzimreakció sebessége a maximum fele (12. ábra). K m mutatja az enzim affinitását a szubsztráthoz; minél kisebb az értéke, annál nagyobb az affinitás.
A legtöbb, egy szubsztrátot érintő enzimreakciónál a K m kísérleti értéke általában 10 -2 -10 -5 M. Ha a reakció reverzibilis, akkor az enzim kölcsönhatása a közvetlen reakció szubsztrátjával K m különböző abból a fordított reakció szubsztrátjára.
AZ ENZIMEK ÁLTALÁNOS JELLEMZŐI
Az enzimek biológiai katalizátorok.
Az enzimek kémiai természete. Az enzimek aktív helye.
Az enzimatikus katalízis mechanizmusa.
én. Enzimek – fehérje jellegű biológiai katalizátorok, amelyek sokszoros gyorsulásra képesek kémiai reakciók beáramló testben, de önmagukban nem részei a végső reakciótermékeknek.
Azokat az anyagokat, amelyekre az enzim hat, nevezzük szubsztrátok.
A mikroorganizmusokban, növényekben és állatokban végbemenő sokféle biokémiai reakciót megfelelő enzimek katalizálják. Az enzimek nagy szerepe a technológiában élelmiszer termékek. Bármilyen élelmiszertermék előállítása biokémiai (enzimatikus) vagy fizikai alapú kémiai folyamatok, vagy ezek a folyamatok összefüggenek egymással.
A szervetlen katalizátorokkal ellentétben az enzimek saját jellemzőkkel rendelkeznek:
Az enzimatikus katalízis sebessége több nagyságrenddel nagyobb (10 3-tól 10 9-ig), mint egy nem biológiai katalizátoré;
az egyes enzimek hatása erősen specifikus, azaz. minden enzim csak a saját szubsztrátjára vagy rokon szubsztrátjainak csoportjára hat;
Az enzimek katalizálják a kémiai reakciókat enyhe körülmények között, azaz normál nyomáson, magas hőmérsékletű(20-50С) és környezeti pH-értékeken, a legtöbb esetben közel semleges.
Az enzimek sejtbeli lokalizációja szempontjából extracelluláris és intracelluláris csoportokra oszthatók.
Extracelluláris enzimeket egy élő sejt bocsát ki a külső környezetbe, intracelluláris – vagy sejtszervecskékben, vagy szupramolekuláris struktúrákkal komplexben helyezkednek el.
Az enzimek egy speciális csoportja a multienzim komplexek, amelyek számos olyan enzimet tartalmaznak, amelyek katalizálják bármely szubsztrát átalakulásának egymást követő reakcióit. Ezek a komplexek az intramolekuláris struktúrákban lokalizálódnak oly módon, hogy minden enzim egy adott reakciósorozat láncában a reakciót katalizáló enzim közvetlen közelében helyezkedik el. Az enzimek ezen elrendezésének köszönhetően a szubsztrát és a reakciótermékek diffúziós folyamata minimálisra csökken.
II. Az enzimek nagy molekulatömegű fehérjevegyületek.
Más fehérjékhez hasonlóan az enzimek is 4 szerkezeti szinttel rendelkeznek, a fehérjék összes fizikai és kémiai tulajdonságával rendelkeznek, és egyetlen megkülönböztető tulajdonságuk a kémiai reakciók felgyorsítása. Az enzimek lehetnek egyszerűek - egykomponensűek és összetettek kétkomponensűek.
Egykomponensű enzimek – polipeptid láncokból épül fel, és hidrolízis hatására csak aminosavakra bomlik.
Kétkomponensű enzimek - fehérje részből áll apoformaés a nem fehérje rész - kofaktor. Mindkét komponens külön-külön hiányzik az enzimaktivitásból. Csak úgy, hogy összefogunk ( holoenzim) a biokatalizátorokra jellemző tulajdonságokra tesznek szert. A kofaktor szerepét bármilyen ion betöltheti (Zn 2+, Mg 2+, Fe 2+, Cu 2+, ritkábban K + és Na +) ill. szerves összetevő(vitaminok, nukleotidok). A szerves kofaktorokat nevezzük koenzimek.
A kofaktor és az apoenzim közötti kapcsolat típusa eltérő lehet. Egyes esetekben külön léteznek, és csak a reakció során kötődnek; más esetekben a kofaktor és az apoenzim állandóan összekapcsolódik, néha erős kovalens kötésekkel.
Az enzimek aktív helye– ez az enzimmolekula egy lokális szakasza, amely részt vesz a katalízisben. BAN BEN egykomponensű Az enzimekben az aktív centrum a polipeptidlánc aminosav-maradékainak bizonyos orientációja következtében jön létre. Kialakításában általában kis számú, 12-16 aminosav vesz részt. Ezen aminosavak funkcionális csoportjai a polipeptidlánc olyan egységeihez tartozhatnak, amelyek távol vannak egymástól. Konvergenciájuk az enzim harmadlagos szerkezetének kialakulásával függ össze.
BAN BEN kétkomponensű Az enzimekben az aktív centrum egy kofaktor és néhány szomszédos aminosav komplexe.
Az aktív központban vannak kapcsolatba lépni(horgony) egy régió, amelynek feladata a szubsztrátum megkötése, és katalitikus - ahol a szubsztrátum átalakulása reakciótermékekké az érintkezési helyhez való kötődés után következik be. E területek kialakításában a következők vesznek részt: funkcionális csoportok: dikarbonsav-aminosavak COOH-csoportjai vagy egy polipeptidlánc terminális csoportjai; a hisztidin imidazolcsoportja; a szerin OH csoportja, NH 2 - lizin csoport és a polipeptid lánc terminális csoportjai; a tirozin fenolos csoportja és az alifás aminosavak hidrofób csoportja.
III. Bármely enzimatikus reakció sebességét meghatározzuk energiaakadály, amelyet a reagáló molekuláknak le kell győzniük. Arrhenius szerint egy kémiai reakciót a folyamat energiája szempontjából az egyenlet ír le.
N = N 0 e -(E act /RT) ,
ahol N az aktív molekulák száma, N 0 a reagáló molekulák száma; e – a természetes logaritmus alapja; R – gázállandó; T – abszolút hőmérséklet; E act – aktiválási energia.
Aktiválási energia- a további energiamennyiség, amely ahhoz szükséges, hogy minden molekula leküzdje a reakció energiagátját és belépjen abba. Ez az energia a reagáló molekulák összenergiája és az energia közötti különbség gerjesztett átmeneti állapot. Minél nagyobb az aktiválási energia egy reagáló rendszerben, annál magasabb az energiagát és annál kisebb a reakciósebesség.
Az enzim legfontosabb funkciója az az aktiválási energia csökkenése katalizált folyamat. ábrán. Az 1. ábra a nem enzimatikus anyagok energiájának változásait mutatja be (1) és enzimatikus (2) reakciók. Az enzim csökkenti az energiagát magasságát (E act E act).
Az enzimatikus katalízis mechanizmusa továbbra is nagyrészt tisztázatlan. Az enzimatikus kinetika megalkotásában azonban nagy szerepet játszottak M. Michaelis és M. Menten munkái, amelyekben a enzim-szubsztrát komplex. Ennek a komplexnek a kialakulása a reakció aktiválási energiájának csökkenéséhez vezet.
Az enzimatikus katalízis folyamata három szakaszra osztható:
Az S szubsztrát szterikus kötődése az E enzim aktív helyéhez (ES enzim-szubsztrát komplex kialakulása).
A primer komplex ES átalakítása aktivált átmeneti komplexussá ES ≠.
Ág végtermék P-reakciók egy enzimből.
Az első szakasz időben rövid, és a tápközegben lévő szubsztrát és enzim koncentrációjától, valamint a szubsztrát diffúziós sebességétől függ az enzim aktív centrumába. Az ES komplex kialakulásában kovalens, koordinációs, ionos kötések és kevésbé erős kötésformák egyaránt részt vehetnek különböző kombinációkban - poláris csoportok elektrosztatikus vonzása, van der Waals kohéziós erők a nem poláris molekulaszakaszok között, hidrogénkötések. E kötések természetét mind a szubsztrát, mind az enzim aktív centrumában lévő funkciós csoportok kémiai jellemzői határozzák meg.
A második szakasz tulajdonképpen a katalízis aktusa, azaz. az a tény, hogy megszakad vagy új kötés alakul ki a szubsztrátumban; ez a leglassabb és korlátozza a kémiai reakció sebességét. Ebben a szakaszban az enzimreakció aktiválási energiája csökken, mivel aktív átmeneti komplex kialakulása ES ≠ .
Tovább molekuláris szinten világosabb megértést ad az enzimek hatásmechanizmusáról a sav-bázis katalízis elmélete. Bármilyen reakció, amely hiányossággal jár kovalens kötések, két ellentétes természetű elektronikus komponens részvételével jár. A megszakadt kötés elektronjait az elektrofil komponenshez kell vonzani, és távol kell lennie a nukleofil komponenstől. A reagensek, amelyek ilyen elektronikus átrendeződést okozhatnak, egy sav és egy bázis. Lehetetlen azonban egyidejűleg mindkét komponensből magas koncentrációt létrehozni ugyanabban az oldatban, mivel semlegesítik egymást. Az enzim fehérje molekulájában, köszönhetően konszolidáció Az elektrofil és nukleofil csoportok katalitikus helyén nem megy végbe közvetlen semlegesítési reakció. Valójában ez határozza meg a katalízis aktusát. Az enzim katalitikus helyének elektrofil és nukleofil csoportjai egymástól bizonyos távolságban nem csak a szubsztrát reagáló csoportjaihoz kötődnek, hanem erős polarizáló hatást is fejtenek ki a szubsztrátcsoportokra. Ehhez hozzá kell adni az ES komplexum töltésingadozásának lehetőségét, ami ennek a polarizációnak a hatékonyságát magas fokon hozza létre. Ez az oka annak, hogy az enzimatikus katalízis során csökken az aktiválási energia.
Az elmélet szerint kovalenskatalízis egyes enzimek kölcsönhatásba lépnek szubsztrátjaikkal, és instabil, kovalens kötésű enzim-szubsztrát komplexeket képeznek. Ezekből a komplexekből a következő reakció során reakciótermékek keletkeznek, sokkal gyorsabban, mint a nem katalizált reakcióknál.
Így a harmadik szakaszt, amely a reakciótermékek képződésével zárul, az előző szakaszokban lezajló folyamatok adják.
AZ ENZIMEK ÁLTALÁNOS JELLEMZŐI
Az enzimek biológiai katalizátorok.
Az enzimek kémiai természete. Az enzimek aktív helye.
Az enzimatikus katalízis mechanizmusa.
én. Enzimek – fehérje jellegű biológiai katalizátorok, amelyek képesek sokszorosára felgyorsítani a benne lezajló kémiai reakciókat testben, de önmagukban nem részei a végső reakciótermékeknek.
Azokat az anyagokat, amelyekre az enzim hat, nevezzük szubsztrátok.
A mikroorganizmusokban, növényekben és állatokban végbemenő sokféle biokémiai reakciót megfelelő enzimek katalizálják. Az enzimek szerepe az élelmiszertechnológiában nagy. Bármilyen élelmiszertermék előállítása vagy biokémiai (enzimatikus), vagy fizikai-kémiai folyamatokon alapul, vagy ezek a folyamatok összefüggenek egymással.
A szervetlen katalizátorokkal ellentétben az enzimek saját jellemzőkkel rendelkeznek:
Az enzimatikus katalízis sebessége több nagyságrenddel nagyobb (10 3-tól 10 9-ig), mint egy nem biológiai katalizátoré;
az egyes enzimek hatása erősen specifikus, azaz. minden enzim csak a saját szubsztrátjára vagy rokon szubsztrátjainak csoportjára hat;
az enzimek enyhe körülmények között katalizálják a kémiai reakciókat, pl. normál nyomáson, magas hőmérsékleten (20-50С) és környezeti pH-értékeken, a legtöbb esetben közel semleges.
Az enzimek sejtbeli lokalizációja szempontjából extracelluláris és intracelluláris csoportokra oszthatók.
Extracelluláris enzimeket egy élő sejt bocsát ki a külső környezetbe, intracelluláris – vagy sejtszervecskékben, vagy szupramolekuláris struktúrákkal komplexben helyezkednek el.
Az enzimek egy speciális csoportja a multienzim komplexek, amelyek számos olyan enzimet tartalmaznak, amelyek katalizálják bármely szubsztrát átalakulásának egymást követő reakcióit. Ezek a komplexek az intramolekuláris struktúrákban lokalizálódnak oly módon, hogy minden enzim egy adott reakciósorozat láncában a reakciót katalizáló enzim közvetlen közelében helyezkedik el. Az enzimek ezen elrendezésének köszönhetően a szubsztrát és a reakciótermékek diffúziós folyamata minimálisra csökken.
II. Az enzimek nagy molekulatömegű fehérjevegyületek.
Más fehérjékhez hasonlóan az enzimek is 4 szerkezeti szinttel rendelkeznek, a fehérjék összes fizikai és kémiai tulajdonságával rendelkeznek, és egyetlen megkülönböztető tulajdonságuk a kémiai reakciók felgyorsítása. Az enzimek lehetnek egyszerűek - egykomponensűek és összetettek kétkomponensűek.
Egykomponensű enzimek – polipeptid láncokból épül fel, és hidrolízis hatására csak aminosavakra bomlik.
Kétkomponensű enzimek - fehérje részből áll apoformaés a nem fehérje rész - kofaktor. Mindkét komponens külön-külön hiányzik az enzimaktivitásból. Csak úgy, hogy összefogunk ( holoenzim) a biokatalizátorokra jellemző tulajdonságokra tesznek szert. A kofaktor szerepét bármely ion (Zn 2+, Mg 2+, Fe 2+, Cu 2+, ritkábban K + és Na +) vagy szerves vegyület (vitaminok, nukleotidok) betöltheti. A szerves kofaktorokat nevezzük koenzimek.
A kofaktor és az apoenzim közötti kapcsolat típusa eltérő lehet. Egyes esetekben külön léteznek, és csak a reakció során kötődnek; más esetekben a kofaktor és az apoenzim állandóan összekapcsolódik, néha erős kovalens kötésekkel.
Az enzimek aktív helye– ez az enzimmolekula egy lokális szakasza, amely részt vesz a katalízisben. BAN BEN egykomponensű Az enzimekben az aktív centrum a polipeptidlánc aminosav-maradékainak bizonyos orientációja következtében jön létre. Kialakításában általában kis számú, 12-16 aminosav vesz részt. Ezen aminosavak funkcionális csoportjai a polipeptidlánc olyan egységeihez tartozhatnak, amelyek távol vannak egymástól. Konvergenciájuk az enzim harmadlagos szerkezetének kialakulásával függ össze.
BAN BEN kétkomponensű Az enzimekben az aktív centrum egy kofaktor és néhány szomszédos aminosav komplexe.
Az aktív központban vannak kapcsolatba lépni(horgony) egy régió, amelynek feladata a szubsztrátum megkötése, és katalitikus - ahol a szubsztrátum átalakulása reakciótermékekké az érintkezési helyhez való kötődés után következik be. Ezen szakaszok kialakításában a következő funkciós csoportok vesznek részt: dikarbonsav-aminosavak COOH csoportjai vagy a polipeptid lánc terminális csoportjai; a hisztidin imidazolcsoportja; a szerin OH csoportja, NH 2 - lizin csoport és a polipeptid lánc terminális csoportjai; a tirozin fenolos csoportja és az alifás aminosavak hidrofób csoportja.
III. Bármely enzimatikus reakció sebességét meghatározzuk energiaakadály, amelyet a reagáló molekuláknak le kell győzniük. Arrhenius szerint egy kémiai reakciót a folyamat energiája szempontjából az egyenlet ír le.
N = N 0 e -(E act /RT) ,
ahol N az aktív molekulák száma, N 0 a reagáló molekulák száma; e – a természetes logaritmus alapja, R – gázállandó, T – abszolút hőmérséklet; E act – aktiválási energia.
Aktiválási energia- a további energiamennyiség, amely ahhoz szükséges, hogy minden molekula leküzdje a reakció energiagátját és belépjen abba. Ez az energia a reagáló molekulák összenergiája és az energia közötti különbség gerjesztett átmeneti állapot. Minél nagyobb az aktiválási energia egy reagáló rendszerben, annál magasabb az energiagát és annál kisebb a reakciósebesség.
Az enzim legfontosabb funkciója az az aktiválási energia csökkenése katalizált folyamat. ábrán. Az 1. ábra a nem enzimatikus anyagok energiájának változásait mutatja be (1) és enzimatikus (2) reakciók. Az enzim csökkenti az energiagát magasságát (E act E act).
Az enzimatikus katalízis mechanizmusa továbbra is nagyrészt tisztázatlan. Az enzimatikus kinetika megalkotásában azonban nagy szerepet játszottak M. Michaelis és M. Menten munkái, amelyekben a enzim-szubsztrát komplex. Ennek a komplexnek a kialakulása a reakció aktiválási energiájának csökkenéséhez vezet.
Az enzimatikus katalízis folyamata három szakaszra osztható:
Az S szubsztrát szterikus kötődése az E enzim aktív helyéhez (ES enzim-szubsztrát komplex kialakulása).
A primer komplex ES átalakítása aktivált átmeneti komplexussá ES ≠.
A reakció P végtermékének elválasztása az enzimtől.
Az első szakasz időben rövid, és a tápközegben lévő szubsztrát és enzim koncentrációjától, valamint a szubsztrát diffúziós sebességétől függ az enzim aktív centrumába. Az ES komplex kialakulásában kovalens, koordinációs, ionos kötések és kevésbé erős kötésformák egyaránt részt vehetnek különböző kombinációkban - poláris csoportok elektrosztatikus vonzása, van der Waals kohéziós erők a nem poláris molekulaszakaszok között, hidrogénkötések. E kötések természetét mind a szubsztrát, mind az enzim aktív centrumában lévő funkciós csoportok kémiai jellemzői határozzák meg.
A második szakasz tulajdonképpen a katalízis aktusa, azaz. az a tény, hogy megszakad vagy új kötés alakul ki a szubsztrátumban; ez a leglassabb és korlátozza a kémiai reakció sebességét. Ebben a szakaszban az enzimreakció aktiválási energiája csökken, mivel aktív átmeneti komplex kialakulása ES ≠ .
Molekuláris szinten az enzimek hatásmechanizmusának világosabb megértése ad a sav-bázis katalízis elmélete. Minden olyan reakció, amely kovalens kötések megszakadásával jár, két ellentétes természetű elektronikus komponens részvételével jár. A megszakadt kötés elektronjait az elektrofil komponenshez kell vonzani, és távol kell lennie a nukleofil komponenstől. A reagensek, amelyek ilyen elektronikus átrendeződést okozhatnak, egy sav és egy bázis. Lehetetlen azonban egyidejűleg mindkét komponensből magas koncentrációt létrehozni ugyanabban az oldatban, mivel semlegesítik egymást. Az enzim fehérje molekulájában, köszönhetően konszolidáció Az elektrofil és nukleofil csoportok katalitikus helyén nem megy végbe közvetlen semlegesítési reakció. Valójában ez határozza meg a katalízis aktusát. Az enzim katalitikus helyének elektrofil és nukleofil csoportjai egymástól bizonyos távolságban nem csak a szubsztrát reagáló csoportjaihoz kötődnek, hanem erős polarizáló hatást is fejtenek ki a szubsztrátcsoportokra. Ehhez hozzá kell adni az ES komplexum töltésingadozásának lehetőségét, ami ennek a polarizációnak a hatékonyságát magas fokon hozza létre. Ez az oka annak, hogy az enzimatikus katalízis során csökken az aktiválási energia.
Az elmélet szerint kovalenskatalízis egyes enzimek kölcsönhatásba lépnek szubsztrátjaikkal, és instabil, kovalens kötésű enzim-szubsztrát komplexeket képeznek. Ezekből a komplexekből a következő reakció során reakciótermékek keletkeznek, sokkal gyorsabban, mint a nem katalizált reakcióknál.
Így a harmadik szakaszt, amely a reakciótermékek képződésével zárul, az előző szakaszokban lezajló folyamatok adják.
Az enzimkinetika különböző tényezők (S és E koncentráció, pH, hőmérséklet, nyomás, inhibitorok és aktivátorok) hatását vizsgálja az enzimreakciók sebességére. Az enzimreakciók kinetikájának vizsgálatának fő célja olyan információk megszerzése, amelyek lehetővé teszik az enzimek hatásmechanizmusának mélyebb megértését.
Kinetikus görbe lehetővé teszi a V 0 kezdeti reakciósebesség meghatározását.
Szubsztráttelítettségi görbe.
A reakciósebesség függése az enzimkoncentrációtól.
A reakciósebesség függése a hőmérséklettől.
A reakciósebesség függése a pH-tól.
|
|
A legtöbb enzim működéséhez az optimális pH-érték ebben rejlik élettani értékek 6,0-8,0. A pepszin 1,5-2,0 pH-értéken aktív, ami megfelel a gyomornedv savasságának. Az argináz, egy májspecifikus enzim, 10,0-nél aktív. A pH befolyása az enzimatikus reakció sebességére az enzim- és szubsztrátmolekulák ionogén csoportjainak állapotával és ionizációs fokával függ össze. Ez a tényező határozza meg a fehérje konformációját, az aktív centrum és a szubsztrát állapotát, az enzim-szubsztrát komplex képződését és magát a katalízis folyamatát. |
A szubsztrát telítési görbe, Michaelis állandó matematikai leírása .
|
|
A szubsztrát telítettségi görbéjét leíró egyenletet Michaelis és Menton javasolta, és az ő nevüket viseli (Michaelis-Menten egyenlet): V = (V MAX *[ S])/(Km+[ S]) , ahol Km a Michaelis állandó. Könnyen kiszámítható, hogy ha V = V MAX /2 Km = [S], azaz. Km az a szubsztrátkoncentráció, amelynél a reakciósebesség ½ V MAX. A V MAX és Km meghatározásának egyszerűsítésére a Michaelis-Menten egyenlet újraszámítható. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
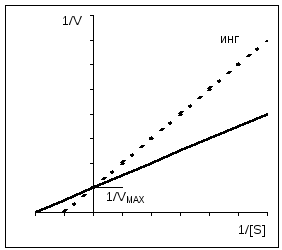
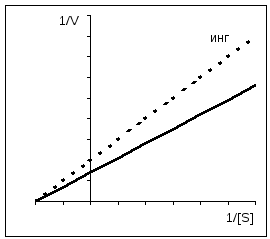
1/ V = Km/ V MAX *1/[ S] + 1/ V MAX Lineweaver-Burk egyenlet. A Lineweaver-Burk diagramot leíró egyenlet egy egyenes egyenlete (y = mx + c), ahol 1/V MAX az egyenes metszéspontja az y tengelyen; Km/V MAX - az egyenes érintője; az egyenes metszéspontja az abszcissza tengellyel 1/Km értéket ad. A Lineweaver-Burk diagram lehetővé teszi a Km meghatározását viszonylag kis számú pontból. Ezt a grafikont az inhibitorok hatásának értékelésére is használják, amelyről az alábbiakban lesz szó. A Km-érték széles skálán mozog: 10 -6 mol/l-től nagyon aktív enzimeknél, 10 -2-ig az alacsony aktivitású enzimeknél. |
A km-becsléseknek gyakorlati értéke van. Km-nél 100-szor nagyobb szubsztrátkoncentráció esetén az enzim közel maximális sebességgel működik, így a maximális V MAX sebesség a jelenlévő aktív enzim mennyiségét tükrözi. Ez a körülmény a készítmény enzimtartalmának becslésére szolgál. Ezenkívül a Km egy enzim jellemzője, amelyet az enzimopátiák diagnosztizálására használnak.
Az enzimaktivitás gátlása.
Az enzimek rendkívül jellemző és fontos tulajdonsága, hogy bizonyos inhibitorok hatására inaktiválódnak.
Inhibitorok - ezek olyan anyagok, amelyek az enzimek által katalizált reakciók részleges vagy teljes gátlását okozzák.
Az enzimaktivitás gátlása lehet irreverzibilis vagy reverzibilis, kompetitív vagy nem kompetitív.
Irreverzibilis gátlás - ez az enzim tartós inaktivációja, amely egy inhibitor molekula kovalens kötődéséből adódik az aktív helyen vagy más speciális centrumban, amely megváltoztatja az enzim konformációját. Az ilyen stabil komplexek disszociációja a szabad enzim regenerációjával gyakorlatilag kizárt. Az ilyen gátlás következményeinek leküzdéséhez a szervezetnek új enzimmolekulákat kell szintetizálnia.
Reverzibilis gátlás – nem kovalens kötések következtében az inhibitor egyensúlyi komplexképződése jellemzi az enzimmel, melynek eredményeként az ilyen komplexek képesek disszociálni az enzimaktivitás helyreállításával.
Az inhibitorok kompetitív és nem kompetitív osztályozása azon alapul, hogy gyengült-e ( kompetitív gátlás ) vagy nem legyengült ( nem kompetitív gátlás ) gátló hatásukat a szubsztrátkoncentráció növekedésével.
Kompetitív gátlók - ezek általában olyan vegyületek, amelyek szerkezete hasonló a hordozó szerkezetéhez. Ez lehetővé teszi számukra, hogy ugyanazon az aktív helyen kötődjenek, mint a szubsztrátok, megakadályozva, hogy az enzim már a kötődési szakaszban kölcsönhatásba lépjen a szubsztráttal. A kötődés után az inhibitor termékké alakulhat, vagy az aktív helyen maradhat, amíg disszociáció meg nem történik.
Reverzibilis kompetitív gátlás diagramként ábrázolható:
E↔ E-I → E + P 1
S (inaktív)
Az enzimgátlás mértékét a szubsztrát és az enzimkoncentráció aránya határozza meg.
Az ilyen típusú gátlás klasszikus példája a szukcinát-dehidrogenáz (SDH) aktivitásának malát általi gátlása, amely kiszorítja a szukcinátot a szubsztrát helyéről, és megakadályozza annak fumaráttá történő átalakulását:

Az inhibitor kovalens kötődése az aktív helyhez az enzim inaktiválódását (irreverzibilis gátlás) eredményezi. Példa irreverzibilis kompetitív gátlás szolgálhat a triózfoszfát izomeráz inaktiválására 3-klóracetol-foszfáttal. Ez az inhibitor a szubsztrát, a dihidroxi-aceton-foszfát szerkezeti analógja, és irreverzibilisen kötődik az aktív helyen lévő glutaminsav-maradékhoz:
Egyes inhibitorok kevésbé szelektíven hatnak, kölcsönhatásba lépnek a különböző enzimek aktív helyén lévő specifikus funkciós csoporttal. Így a jód-acetát vagy amidja a cisztein aminosav SH-csoportjához való kötődése, amely az enzim aktív központjában található, és részt vesz a katalízisben, az enzimaktivitás teljes elvesztéséhez vezet:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
Ezért ezek az inhibitorok inaktiválják az összes olyan enzimet, amelyekben SH csoportok vesznek részt a katalízisben.
Az ideggázok (szarin, szomán) hatására a hidrolázok irreverzibilis gátlása annak köszönhető, hogy kovalens kötődésük van az aktív központban lévő szerinmaradékhoz.
A kompetitív gátlási módszer széleskörű alkalmazásra talált orvosi gyakorlat. A szulfonamid gyógyszerek, a p-amino-benzoesav antagonisták, a metabolizált kompetitív inhibitorok példájaként szolgálhatnak. A dihidropterát szintetázhoz kötődnek, egy bakteriális enzimhez, amely a p-aminobenzoátot folsavvá alakítja, amely szükséges a baktériumok növekedéséhez. A baktérium a megkötött szulfanilamid másik vegyületté alakulása következtében elpusztul, és folsav nem alakult ki.
Nem kompetitív gátlók általában a szubsztrátkötő helytől eltérő helyen kötődnek az enzimmolekulához, és a szubsztrát közvetlenül nem verseng az inhibitorral. Mivel az inhibitor és a szubsztrát különböző centrumokhoz kötődik, lehetséges mind az E-I komplex, mind az S-E-I komplex kialakulása. Az S-E-I komplex is lebomlik, és termék keletkezik, de lassabb ütemben, mint az E-S, így a reakció lelassul, de nem áll le. Így a következő párhuzamos reakciók léphetnek fel:
E↔ E-I ↔ S-E-I → E-I + P
Reverzibilis, nem kompetitív gátlás viszonylag ritka.
A nem kompetitív gátlókat nevezzük allosztérikus ellentétben a versenytársakkal ( izosztérikus ).
A reverzibilis gátlás kvantitatívan tanulmányozható a Michaelis-Menten egyenlet segítségével.
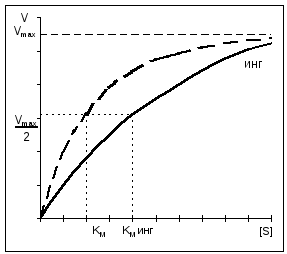
Kompetitív gátlás esetén a V MAX állandó marad, és a Km növekszik.
|
|
|
Nem kompetitív gátlás esetén a V MAX csökken, miközben a Km változatlan marad.
|
|
|
Ha egy reakciótermék gátolja a képződését katalizáló enzimet, ezt a gátlási módszert nevezzük retroinhibíció vagy visszacsatolás gátlása . Például a glükóz gátolja a glükóz-6-foszfatázt, amely katalizálja a glükóz-6-foszfát hidrolízisét.
Ennek a gátlásnak a biológiai jelentősége bizonyos anyagcsereutak szabályozásában rejlik (lásd a következő leckét).
GYAKORLATI RÉSZ
Feladat diákoknak
1. Vizsgálja meg a fehérjék denaturálódását ásványi és szerves savak oldatának hatására és melegítés hatására.
2. Határozza meg a NAD koenzimet az élesztőben.
3. Határozza meg az amiláz aktivitást a vizeletben (vérszérum).
9. A PROBLÉMÁKRA VONATKOZÓ VÁLASZOK SZABVÁNYAI, tesztkérdések az ismeretek ellenőrzésére az órán (mellékletként használható)
10. A TÉMÁVAL KAPCSOLATOS LEHETSÉGES OKTATÁSI ÉS KUTATÁSI MUNKÁK JELLEGE ÉS KÖRE
(Konkrétan jelölje meg az UIRS jellegét és formáját: absztrakt prezentációk készítése, önálló kutatások lebonyolítása, szimulációs játékok, kórtörténet készítése monografikus irodalom és egyéb formák felhasználásával)
Küldje el a jó munkát a tudásbázis egyszerű. Használja az alábbi űrlapot
Diákok, végzős hallgatók, fiatal tudósok, akik a tudásbázist tanulmányaikban és munkájukban használják, nagyon hálásak lesznek Önnek.
Közzétéve: http://www.allbest.ru/
ABSZTRAKT
Enzimek és enzimreakciók
Enzimek
Enzimaktivitás
Reakció és szubsztrátspecifitás
Enzim osztályok
Enzim katalízis
Az enzimes reakciók kinetikája
Inhibitorok
Enzimatikus elemzés
tulajdonság reakciókatalizátor enzim
Enzimek
Az enzimek azok biokatalizátorok, azaz biológiai eredetű anyagok, amelyek felgyorsítják a kémiai reakciókat. Az anyagcserefolyamatok szervezett sorozata lehetséges, feltéve, hogy minden sejt saját, genetikailag meghatározott enzimkészlettel rendelkezik. Csak ilyen feltételek mellett érhető el koordinált reakciósorozat. Az enzimek sokak szabályozásában is részt vesznek anyagcsere folyamatok, ezáltal biztosítva, hogy az anyagcsere megfeleljen a megváltozott feltételeknek. Szinte minden enzim fehérjék. Az is ismert, hogy katalitikusan aktívak nukleinsavak-- "ribozimek".
Enzimaktivitás
Az enzim katalitikus hatása, azaz annak tevékenység szerint szabványos körülmények között meghatározva sebesség növelése (lila az ábrán) katalitikus reakció ( narancsszín) a nem katalitikushoz képest ( sárga). Általában a reakciósebességet a következőképpen adjuk meg a szubsztrát vagy a termék koncentrációjának változása időegység alatt(mol/(l s)) . Mivel a katalitikus aktivitás nem függ az oldat térfogatától, amelyben a reakció végbemegy, az enzimaktivitást ebben a formában fejezzük ki katalák; 1 cat az az enzimmennyiség, amely 1 mól szubsztrátot 1 másodperc alatt átalakít. A tevékenység másik egysége az nemzetközi egység(E) -- az enzim mennyisége, amely 1 µmol szubsztrátot 1 perc alatt átalakít (1 E = 16,7 ncat).
Reakció és szubsztrátspecifitás
Többségi akció enzimek magas kimondottan. A specifitás fogalma nem csak a katalitikus reakciók típusaira vonatkozik ( reakcióspecifitás), hanem a vegyületek - szubsztrátok természetére is ( szubsztrátspecifitás). Példaként a diagram olyan enzimeket mutat be, amelyek lebontják a kémiai kötéseket. Az erősen specifikus enzimek (A típus – a táblázat felső sora) csak egyfajta kötés hasadását katalizálják egy bizonyos szerkezetű szubsztrátban. A B típusú enzimek (középső sor) korlátozott reakció-specificitásúak, de széles szubsztrátspecificitásúak. A B típusú enzimek (alacsony reakció és alacsony szubsztrátspecifitás; alsó sor) ritkák.
Enzim osztályok
Napjainkig körülbelül 2000 különböző enzim ismeretes. A kidolgozott osztályozási rendszer figyelembe veszi az enzimek reakció- és szubsztrátspecifitását. Az összes enzim szerepel az „Enzimkatalógusban” a sajátjuk alatt osztályozási szám(KF), amely négy számjegyből áll. Az első számjegy azt jelzi, hogy az egyikhez tartozik hat fő osztály. A következő kettő határozza meg az alosztályt és az alosztályt, az utolsó számjegy pedig az ebben az alosztályban lévő enzim száma. Például a laktát-dehidrogenáz CF-számmal rendelkezik 1.1.1.27 (1. osztály, oxidoreduktázok; 1.1 alosztály, donor elektron - CH-OH; 1.1.1 alosztály, elfogadó-- NADP + .)
Mind a hat fő osztály olyan enzimeket tartalmaz, amelyeknek azonos a reakcióspecifitása. RÓL RŐLxidoreduktázs(1. osztály) redox reakciókat katalizálnak. Transzferázok(2. osztály) egyik vagy másik funkciós csoportot egyik szubsztrátról a másikra visznek át. Az oxidoreduktázok és transzferázok közös koenzimet igényelnek. Hidrolázok(3. osztály) is részt vesznek a csoporttranszferben, de az akceptor itt mindig egy vízmolekula. Lyases(4. osztály, néha "szintézisnek" nevezik) katalizálják a kémiai vegyületek hasadását vagy képződését, amelyek során kettős kötések jönnek létre vagy tönkremennek.
Izomerázok(5. osztály) csoportokat mozgatnak a molekulán belül változtatás nélkül általános képlet szubsztrát. Ligázok(„szintézisek”, 6. osztály) energiafüggő addíciós reakciókat katalizálnak, ezért hatásuk a nukleozid-trifoszfát (leggyakrabban ATP) hidrolízisével függ össze.
Enzim katalízis
Enzimek – rendkívül hatékonyak katalizátorok. 10-12-szeresére vagy még többre növelik a katalizált reakció sebességét. Az enzimatikus katalízis mechanizmusának megértéséhez először érdemes megvizsgálni egy nem katalitikus reakció előfordulását.
Nem katalitikus reakció (enzim hiányában)
Példaként vegyünk egy A + B > C + D típusú reakciót. Anyagok Az oldatban lévő A-t és B-t vízmolekulákból álló héj veszi körül (hidrát héj)és hőmozgás hatására véletlenszerűen mozognak. Csak akkor tudnak reagálni egymással, ha kedvező orientációban ütköznek, ami valószínűtlen és ritka.
A C + D termékek előállításához összetett A molekulák ütközéséből származó A--B-nek meg kell képződnie átmeneti állapot, ami általában jelentős aktiválási energia E a. Mivel ezt az energiát csak egy kis rész tudja fogadni komplexek A-B, az átmeneti állapot elérése még ritkább eset, mint egy komplex kialakulása. Az oldatban az aktiválási energia nagy részét arra fordítják a hidratáló héjak leküzdése A és B között, közelebb hozva egymáshoz a reagenseketÉs egyéb kémiai folyamatok, amelyben ezek a reagensek részt vesznek. Emiatt katalizátor hiányában rendkívül ritkán jön létre termékképződés, és a v reakciósebesség elenyésző, még akkor is, ha a reakció termodinamikailag megengedhető, azaz DG.< 0
Enzimatikus reakció
Az enzimek specifikusan megkötik a reagenseket (szubsztrátjaikat). aktív központ. Ebben az esetben a szubsztrátumok úgy vannak orientálva, hogy optimális helyzetet kapjanak az átmeneti állapot kialakításához (1-3). KözeledésÉs szükséges tájékozódás reagensek jelentősen növelik a képződés valószínűségét produktív komplexum A--B. Ezenkívül a szubsztrát megkötése az aktív helyen a szubsztrát hidratáló héjának eltávolítását eredményezi. vízmolekulák eltávolítása Az enzim aktív központjában a katalízis során teljesen más körülmények jönnek létre, mint az oldatban (3-5). Még egy fontos tényező a fehérje aminosav-maradékai és a szubsztrát közötti kölcsönhatás következménye (4). Így az átmeneti állapot enzimes reakció esetén kevesebb aktiválási energiát igényel. Ezen túlmenően sok enzim a katalízis során specifikus csoportokat visz át egy szubsztrátból vagy egy szubsztrátba. Különösen gyakori a protonátvitel. Ez az enzimatikus sav-bázis katalízis sokkal hatékonyabb, mint a protonok cseréje savakkal és bázisokkal oldatban. A kémiai csoportok gyakran kovalensen kapcsolódnak az enzimmaradékokhoz. Ezt a jelenséget az ún kovalens katalízis.. Az enzimkatalízis alapjai
Bár ma nehéz számszerűsíteni az egyes katalitikus hatások hozzájárulását, a döntő tényezőt figyelembe kell venni átmeneti állapot stabilizálása az enzim aktív helyén. Ebben az esetben a legjelentősebb pont az erős kötődés nem annyira a szubsztrát, mint inkább az átmeneti állapota. Ezt az álláspontot támasztja alá számos enzim rendkívül nagy affinitása az átmeneti állapot analógjaihoz, ami egy egyszerű mechanikai analógiával magyarázható (a jobb oldali ábrán): ha valaki fémgolyókat (reagenseket) akar elgurítani a helyről. EA (szubsztrát állapot) energetikailag magasabb átmeneti állapotba, majd EP (termék állapot) úgy kell a mágnest (katalizátort) elhelyezni, hogy a vonzóerő ne az EA-ra (a), hanem az átmenetre hatjon. állapot (b).
Az enzimes reakciók kinetikája
Kinetika elsősorban az enzimreakciót (azaz a reakciósebességnek a körülményeitől való függését) határozzák meg katalizátor tulajdonságai, aminek következtében sokkal összetettebb, mint a nem katalitikus reakciók kinetikája
Michaelis-Menten modell
Az enzimreakció teljes matematikai elemzése ahhoz vezet, hogy összetett egyenletek, nem alkalmas praktikus alkalmazás. A legkényelmesebbnek bizonyult egy egyszerű modell, amelyet 1913-ban fejlesztettek ki. Ez megmagyarázza az enzimaktivitás jellegzetes hiperbolikus függését a szubsztrátkoncentrációtól (1), és lehetővé teszi az enzim hatékonyságát kvantitatívan jellemző állandók meghatározását.
Michaelis-Menten modell abból adódik, hogy kezdetben az A szubsztrát komplexet képez az E (3) enzimmel, amely sokkal gyorsabban alakul B termékké, mint az enzim hiányában. A k kat (2) sebességi állandó sokkal nagyobb, mint a k nem katalitikus reakcióállandó. A konstans k cat más néven " fordulatok száma"mivel az egy enzimmolekula által 1 másodperc alatt termékké alakított szubsztrátmolekulák számának felel meg. E modell szerint az enzim aktivitását az EA komplexnek a teljes enzimkoncentrációhoz viszonyított aránya [E]t, azaz a / [E]t (3) aránya határozza meg. Az egyszerűség kedvéért a modell feltételezi, hogy E, A és EA benne van Kémiai egyensúly a tömeghatás törvénye szerint, amely végül megadja az EA komplex disszociációjának egyenletét:
[E][A]/ = K m Mivel [E] t = [E] + ,
= [E] t [A]/(K m + [A])
A v = k cat (2) és az előző kifejezésből kapjuk Michaelis-Menten egyenlet (4).
Az egyenlet két mennyiséget tartalmaz ( két paraméter), amelyek nem a szubsztrát koncentrációtól [A] függnek, hanem az enzim tulajdonságait jellemzik: ez a k kat [E] t szorzat, aminek megfelelő maximális reakciósebesség V magas szubsztrátkoncentrációnál, és Michaelis állandó m, jellemző affinitás enzimből szubsztráttá. A Michaelis-állandó számszerűen egyenlő a szubsztrát koncentrációval [A].amelynél n eléri a V maximális érték felét (ha v = V/2, akkor [A] / (K m + [A]) = 1/2, azaz. K m = [A]). Az enzim nagy affinitását a szubsztráthoz az jellemzi Alacsony érték m-hez és fordítva,
A Michaelis-Menten modell több, nem teljesen reális feltételezésen alapul, mint például az EA visszafordíthatatlan átalakulása E + B-vé, az E, A és EA közötti egyensúly elérése, az enzim egyéb formáinak hiánya az oldatban, kivéve az E és EA. Csak ezeknek a hipotetikus feltételeknek megfelelően K m a komplex disszociációs állandójának, k cat pedig az EA > E + B reakció sebességi állandójának felel meg.
V és K meghatározása m
Elvileg V és K m meghatározható a v kontra [A] grafikonjából (bal oldali ábra). Mivel v aszimptotikus növekvő szubsztrátkoncentrációval eléri a V-t [A], nehéz extrapolálással megbízható V és K m értéket kapni (bal oldali ábra).
A számítások megkönnyítése érdekében a Michaelis-Menten egyenlet átalakítható úgy, hogy a kísérleti pontok egy egyenesen feküdjenek. Az egyik ilyen grafikus transzformációval az ún Eadie-Hofstee diagram(jobb oldali kép) ábrázolja v függését v/[A]-tól. Ebben az esetben a kísérleti pontok ordinátatengellyel való legjobb lineáris közelítésével kapott egyenes metszéspontja V-nek felel meg, a dőlésszög érintője pedig -K m. A V és K m meghatározásának ez a grafikus megközelítése sem optimális. Jelenleg az enzimkinetikai adatokat gyorsabban és objektívebben dolgozzák fel számítógépes technológia segítségével.
Inhibitorok
Számos vegyület befolyásolhatja az anyagcserét a megfelelő enzimek aktivitásának modulálásával. Különösen fontos funkciókat egyúttal teljesíteni enzimgátlók. Számos enzimgátló gyógyászati anyagok természetes vagy szintetikus eredetű. Metabolitok a szabályozási folyamatokban enzimgátlók is lehetnek.
A gátlás típusai
A legtöbb enzimgátló hatású megfordítható, azaz disszociációjuk után semmilyen változást nem visznek be az enzimmolekulába. Vannak azonban olyanok is visszafordíthatatlan enzimgátlók, amelyek visszafordíthatatlanul módosítják a célenzimet. Az inhibitor hatásának elve gátlás típusaúgy határozzuk meg, hogy összehasonlítjuk a reakció kinetikáját inhibitorok jelenlétében anélkül (lásd B diagram). Megkülönböztetni kompetitív(A, bal) és nem versenyképes(Ah, ugye) gátlás. Fontos szerepet játszik az anyagcsere szabályozásában alloszterikus gátlás(A, 6).
Úgy hívják szubsztrát analógok(2) hasonló tulajdonságokkal rendelkeznek, mint a célenzim szubsztráté. Reverzibilisen blokkolják a rendelkezésre álló enzim molekuláinak egy részét, de nem alakíthatók tovább termékké. Ezért a maximális reakciósebesség felének eléréséhez több magas szubsztrát koncentrációja: ilyen inhibitor jelenlétében a Michaelis-állandó K m megnő (B). Szubsztrát be magas koncentrációk kiszorítja az inhibitort az enzimből. Ezért a V maximális sebesség nem változik ilyen típusú fékezéssel. Mivel a szubsztrát és az inhibitor verseng az enzim kötőhelyéért, ez a típus fékezést hívják kompetitív. Átmeneti állapot analógjai(3) kompetitív inhibitorként is működnek.
Ha az inhibitor funkcionálisan reagál fontos csoport enzimet anélkül, hogy megzavarná a szubsztrátkötést, az ilyen gátlást nevezzük nem versenyképes(a jobb oldali diagramon). Ebben az esetben a K m változatlan marad, ellenkezőleg, a funkcionálisan aktív enzim [E] t koncentrációja és ennek következtében a maximális V reakciósebesség csökken. A nem kompetitív inhibitorok általában hatnak visszafordíthatatlanul, mivel módosítják a célenzim funkciós csoportjait (4).
Abban az esetben, ha az ún. öngyilkos szubsztrátok" (5) arról beszélünk további reakciócsoportot tartalmazó szubsztrát analógokról. Kezdetben reverzibilisen kötődnek, majd kovalens vegyületet képeznek az enzim aktív helyével. Ezért az ilyen vegyületek általi gátlás a következőképpen nyilvánul meg nem versenyképes. Az ilyen inhibitorok jól ismert példája az antibiotikum penicillin.
Alloszterikus inhibitorok kötődnek az enzim egyes régióihoz az aktív centrumon kívül (6). Ez a kapcsolat magában foglalja konformációs változások az enzimmolekulában, ami aktivitásának csökkenéséhez vezet. Alloszterikus hatások szinte kizárólag abban az esetben jelentkeznek oligomer enzimek. Az ilyen rendszerek kinetikája nem írható le egyszerű Michaelis-Menten modellel.
A gátlás kinetikája
A kompetitív gátlás könnyen megkülönböztethető a nem kompetitív gátlástól, ha alkalmazzuk Eady-Hofstee grafika. Mint már említettem, kompetitív Az inhibitorok csak a Km-t érintik, a V-t nem. Az inhibitor hiányában és jelenlétében kapott egyenesek a grafikonon metszik egymást az ordináta tengelyen. Közvetlen a nem versenyképes A gátlások meredeksége azonos (K m nem változik), azonban az inhibitor koncentrációjának növekedésével az ordináta tengelyen ezen egyenesek által levágott szakaszok egyre rövidebbek lesznek. Az alloszterikus enzimek esetében az Eady-Hofstee görbe nem használható, ami ebben az esetben nemlineáris (itt nem látható).
Enzimatikus elemzés
Az enzimek fontos szerepet játszanak biokémiai elemzés . Biológiai anyagokban, például testnedvekben az enzimek elhanyagolható koncentrációban mutathatók ki a katalitikus aktivitás meghatározásával. Az enzimeket úgy lehet használni reagensek a metabolitkoncentrációk, például a vércukorszint meghatározásához (B ábra). A legtöbb enzimes vizsgálat fotometriát használ.
Spektrofotometria alapjai
Sok molekula elnyel fény a spektrum látható vagy ultraibolya tartományában. Ez a tulajdonság felhasználható koncentrációk meghatározására. Az abszorpció mértéke az anyag típusától és koncentrációjától, valamint a felhasznált fény hullámhosszától függ. Ezért használnak monokromatikus fény, azaz egy bizonyos hullámhosszú fény, amely segítségével elválasztható a fehér fénytől monokromátor. Az I 0 intenzitású monokromatikus fény áthalad egy téglalap alakú, üvegből vagy kvarcból (küvettából) készült cellán, amely egy elnyelő anyag oldatát tartalmazza. Az abszorpció által csillapított kilépő fény I intenzitását detektorral mérjük. Fényelnyelés(Egy megoldás ( optikai sűrűség) az I/I 0 arány negatív logaritmusa. Lambert-Beer törvény kimondja, hogy A arányos az anyag koncentrációjával (c) és az oldatréteg vastagságával (d). Kioltási együtthatóe az anyag típusától és hullámhosszától függ, mint fentebb említettük.
A laktát-dehidrogenáz aktivitás meghatározása
A laktát-dehidrogenáz [LDH] aktivitás meghatározása azon alapul, hogy a redukált koenzim NADH + H + 340 nm-en nyeli el a fényt, míg a NAD + ezen a hullámhosszon nincs abszorpciója. Abszorpciós spektrumok Az LDH-reakcióban a szubsztrát és a koenzim grafikonja (az A hullámhossz függvényében) az 1. ábrán látható. B1.
A NAD + és NADH abszorpciójában a 300 és 400 nm közötti különbségek a nikotinamidgyűrűben az oxidáció vagy redukció során bekövetkező változások következményei.
Az aktivitás meghatározásához először a laktát és a NAD + oldatokat egy küvettába helyezzük, és feljegyezzük a felszívódást. állandó hosszon hullámok 340 nm. A nem katalitikus reakció nagyon kis sebességgel megy végbe. Ezért mérhető mennyiségű NADH csak LDH hozzáadása után képződik. Mivel a DA/Dt abszorpció növekedési sebessége a Lambert-Beer törvény szerint arányos a DA/Dt reakciósebességgel, az LDH aktivitása kiszámítható az e extinkciós együttható segítségével 340 nm-en, vagy összehasonlítva egy standard oldattal.
A glükóz enzimatikus meghatározása
A legtöbb biomolekula nem nyeli el a fényt a spektrum látható vagy ultraibolya tartományában. Ezenkívül általában más vegyületekkel keverékben vannak jelen, amelyek szintén hasonló kémiai reakciókat váltanak ki.
Mindkét nehézség leküzdhető megfelelő enzim a meghatározott metabolit szelektív átalakulására színes anyaggá, amit a fényelnyelés intenzitása is meghatároz.
A vércukorszint meghatározásának szokásos módszere két egymást követő reakción alapul:
1) glükonolakton és hidrogén-peroxid H 2 O 2 képződése enzim hatására glükóz-oxidáz ;
2) színtelen anyag oxidációja hidrogén-peroxiddal színes zöld vegyületté egy peroxidáz által katalizált reakcióban.
Amikor a mintában lévő összes glükóz elfogy, a képződött színes anyag mennyisége fényelnyeléssel határozható meg, ami egyenesen arányos a kezdeti glükóztartalommal.
Közzétéve az Allbest.ru oldalon
Hasonló dokumentumok
Kémiai reakciók gyorsítása katalizátorok segítségével. Az enzimek (enzimek), mint biológiai katalizátor funkcióit ellátó, erősen specifikus fehérjék jellemzői. Az enzimek szerkezete, specificitása és osztályozása. Az enzimatikus katalízis szakaszai.
bemutató, hozzáadva 2014.11.20
Az enzimek osztályozása, funkcióik. Az enzimek elnevezési konvenciói, szerkezete és hatásmechanizmusa. Az egyszubsztrát enzimes reakciók kinetikájának leírása. Az indukált levelezés billentyűzáras modelljei. Módosítások, enzimkofaktorok.
bemutató, hozzáadva 2012.10.17
Az élő szervezetek működéséhez szükséges reakciókat felgyorsító fehérje jellegű enzimek, szerves katalizátorok jellemzői. Hatáskörülmények, enzimek előállítása és felhasználása. Az enzimtermelés zavarával járó betegségek.
bemutató, hozzáadva 2013.10.19
Az enzimek általános jellemzői és főbb típusai. Kémiai tulajdonságok enzimek és az általuk katalizált reakciók. Az enzimek szelektivitása és hatékonysága. Függőség a hőmérséklettől és az oldat környezetétől. Az enzim aktív helye. Az enzimes reakciók sebessége.
bemutató, hozzáadva: 2014.10.06
Az enzimek meghatározása a biológiai katalizátorok minden élő sejtjében jelen lévő specifikus fehérjékként. Az enzimek szerkezeti molekulájának térbelisége, az oxidoreduktáz, transzferáz, hidroláz, liáz, izomeráz és ligáz bioszintézisének folyamata.
teszt, hozzáadva 2011.01.27
Enzimatikus reakciók kinetikai vizsgálata enzimek azonosítására és sebességük összehasonlítására. Enzim-szubsztrát komplex kialakulása enzimből és szubsztrátból erőhatások hatására fizikai természet. Fakultatív szervezetek, autotrófok és heterotrófok.
teszt, hozzáadva: 2009.07.26
Enzimek: biokémiai szerkezet és élettani szerepe. Testfolyadékok enzimaktivitásának és enzimatikus spektrumának meghatározására szolgáló módszerek elemzése. A vizeletben lévő fő enzimek normálisak és kórosak. A vizelet enzimspektruma vesebetegségekben.
jelentés, hozzáadva: 2015.10.03
Enzimek, tulajdonságaik és mechanizmusuk vizsgálata biológiai hatás. Kutatások végzése modern ötletek az enzimatikus transzamináció mechanizmusáról. Fejlesztés általános elmélet piridoxál katalízis. Az enzim-szubsztrát komplex szerkezete.
absztrakt, hozzáadva: 2015.03.14
Specifikus fehérjék, amelyek katalizálják a kémiai reakciókat az élő rendszerekben. Az enzimek jellemzői, osztályozása, méretük és szerkezetük. A környezeti feltételek hatása az enzimaktivitásra: tényezők és kofaktorok; termelésük zavarával összefüggő betegségek.
bemutató, hozzáadva 2015.07.05
Az enzimek vagy enzimek céljának tanulmányozása - fehérjemolekulák vagy RNS-molekulák (ribozimek) vagy komplexeik, amelyek felgyorsítják (katalizálják) az élő rendszerek kémiai reakcióit. Az enzimek lokalizációja a sejtben. Örökletes és szerzett enzimpátiák.
Hasonló cikkek
-
„Az Imagevo hivatalos Tatarstan jelenleg nyert, de a tatárok veszítettek
Tegnap „csúccsal” zárta a napot a MICEX index – ez esetünkben konszolidációs adat a folytatódó oldalirányú trendben. A MICEX index ismét tesztelte azonnali 2085-ös támaszát (2087 a szünet idején és reggel), ahonnan újra és újra felpattant...
-
A fedezeti ügyletek költségeinek összehasonlítása a deviza- és származékos piacokon A fedezeti ügylet olyan művelet, amelynek célja az egyéb műveletekből származó kockázat csökkentése.
Deepifr vizsgáló hatszor alkalmazta a fedezetet a szituációs problémáknál, a konszolidációs kérdésben pedig kétszer jegyzett a fedezés témájában. A témával kapcsolatos problémák általában nagy nehézségeket okoznak. Ennek oka, hogy...
-
Hogyan lehet előre jelezni az építőipari cégek részvényárfolyamát
A nagyvárosok építési volumenének folyamatos növekedése az építőipar robbanásszerű növekedéséhez és az építőiparral foglalkozó egyéni cégek számának meredek növekedéséhez vezetett. Az építkezés olyan, mint a többi...
-
Műveletek típusai a devizapiacon
A devizapiac a gazdasági kapcsolatok olyan szférája, amely deviza és értékpapír devizában történő adásvételére, valamint devizatőke befektetésére irányuló ügyletek lebonyolításában nyilvánul meg. VAL VEL...
-
Építőipari szervezetek értékelése Ki segít bármilyen bonyolultságú probléma megoldásában
Egy vállalkozás létrehozásával a szervezők azt a reményt ápolják, hogy megvalósíthatják saját képességeiket, elfoglalhatnak egy bizonyos társadalmi pozíciót és anyagi jólétet. Sőt, pénzbefektetéskor ebben az esetben nem csak arra számíthatsz, hogy megkapod...
-
Mi az a számla elfogadás? Bankári elfogadások. A pénzeszközök közvetlen beszedésének hatékonysága
A banki és információs technológia fejlődése szükségessé tette a különböző pénzügyi eszközök átvételét és elfogadását az elszámolásokhoz. Ilyen eszközzé vált az elfogadás. Elfogadás - mit jelent...