Osobine kinetike enzimske reakcije. Uslovi za enzimsku reakciju
Enzim E se reverzibilno spaja sa supstratom S, formirajući nestabilan intermedijarni kompleks enzim-supstrat ES, koji se na kraju reakcije raspada da bi oslobodio enzim i produkte reakcije P.
Ove ideje su bile osnova teorija "ključ-brava" E. Fishera (1890). Struktura aktivnog centra je komplementarna molekularnoj strukturi supstrata, čime se osigurava visoka specifičnost enzima. Formiranje kompleksa enzim-supstrat uključuje vodonične veze, elektrostatičke i hidrofobne interakcije, au nekim slučajevima i kovalentne i koordinacione veze.
D. Koshland je razvijena teorija "indukovane korespondencije" (1958) . Prostorna korespondencija između strukture supstrata i aktivnog centra enzima nastaje u trenutku njihove međusobne interakcije, što se može izraziti formulom "rukavica - ruka". Supstrat inducira konformacijske promjene u molekuli enzima na način da aktivni centar poprima prostornu orijentaciju neophodnu za vezivanje supstrata. One. Enzim će u trenutku vezivanja supstrata biti samo u aktivnom (tenzijskom) T-formu (zatezanju), za razliku od neaktivnog R-forma (opuštanje).
Trenutno se Koshlandova hipoteza postepeno zamjenjuje hipoteza topohemijska korespondencija. Zadržavajući osnovne principe teorije „indukovane korespondencije“, objašnjava specifičnost delovanja enzima prepoznavanjem onog dela supstrata koji se ne menja tokom katalize.
Kao i drugi katalizatori, enzimi, sa termodinamičke tačke gledišta, ubrzavaju hemijske reakcije smanjenjem energije aktivacije.
Energija aktivacije je energija potrebna za pretvaranje svih molekula mola supstance u aktivirano stanje na datoj temperaturi.
I reakcije katalizirane enzimima i reakcije katalizirane enzimima imaju istu standardnu promjenu slobodne energije (ΔG). Međutim, enzimska reakcija ima nižu energiju aktivacije. Djelujući na brzinu reakcije, enzimi ne mijenjaju ravnotežni položaj između prednje i reverzne reakcije, već samo ubrzavaju njen početak.
2.3. Kinetika enzimskih reakcija
Enzimska kinetika proučava uticaj hemijske prirode reagujućih supstanci (enzima, supstrata) i uslova njihove interakcije (koncentracija, pH, temperatura, prisustvo aktivatora ili inhibitora) na brzinu enzimske reakcije. Brzina enzimske reakcije (V) mjeri se smanjenjem količine supstrata ili povećanjem proizvoda u jedinici vremena.
U enzimskoj katalizi, enzim (E) se reverzibilno spaja sa supstratom (S), formirajući nestabilan kompleks enzim-supstrat (ES), koji se na kraju reakcije raspada da bi oslobodio enzim (E) i produkte reakcije (P) :
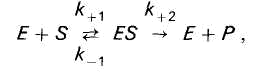
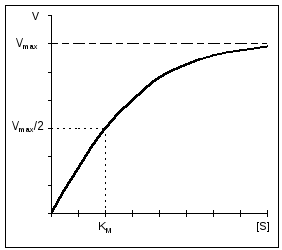
Važna karakteristika enzimskih reakcija je zasićenje enzima supstratom. Pri niskim koncentracijama supstrata, brzina reakcije je direktno proporcionalna njegovoj koncentraciji. Pri velikoj brzini, brzina reakcije je maksimalna, postaje konstantna i neovisna o koncentraciji supstrata [S] i u potpunosti je određena koncentracijom enzima (slika 11).
|
|
|
Rice. 11. Ovisnost brzine enzimske reakcije o koncentraciji supstrata pri konstantnoj koncentraciji enzima. |
K S – konstanta disocijacije kompleksa enzim-supstrat ES, recipročna konstanta ravnoteže:
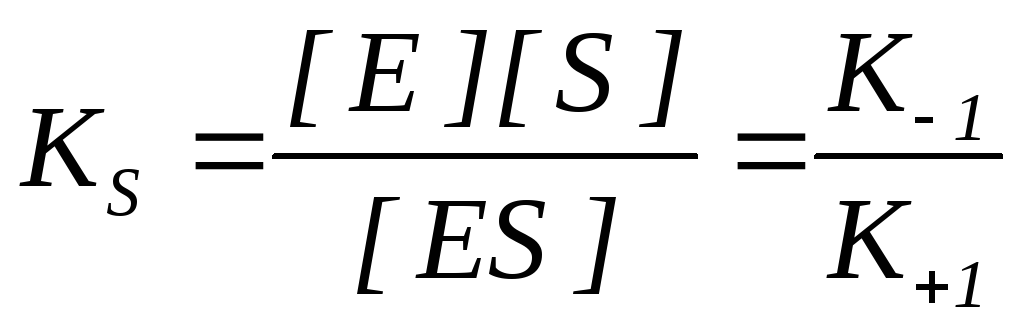
Što je niža KS vrijednost, veći je afinitet enzima za supstrat.
Kvantitativni odnos između koncentracije supstrata i brzine enzimske reakcije izražava jednačina Michaelisa-Menten:
 ,
,
- brzina reakcije, V max - maksimalna brzina enzimske reakcije.
Briggs i Haldane su poboljšali jednačinu uvođenjem Michaelisova konstantaK M, utvrđeno eksperimentalno.
Briggs-Haldaneova jednadžba: 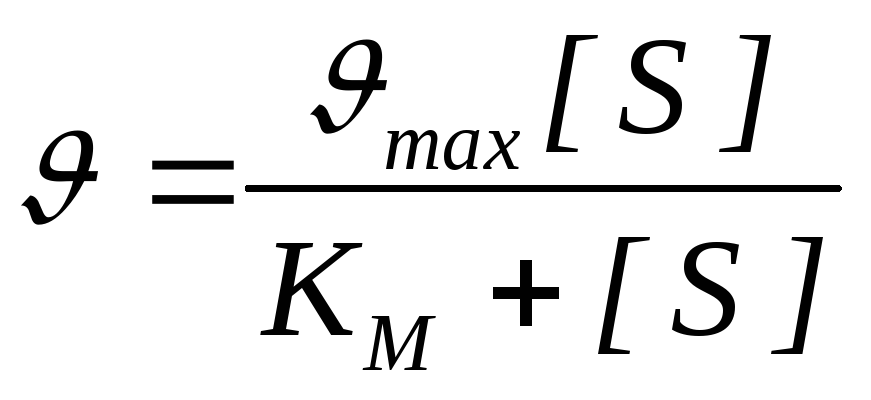
Michaelisova konstanta je numerički jednaka koncentraciji supstrata (mol/l), pri kojoj je brzina enzimske reakcije upola manja (slika 12). K m pokazuje afinitet enzima za supstrat; što je njegova vrijednost manja, to je veći afinitet.
Eksperimentalne vrijednosti K m za većinu enzimskih reakcija koje uključuju jedan supstrat obično su 10 -2 -10 -5 M. Ako je reakcija reverzibilna, tada interakciju enzima sa supstratom direktne reakcije karakterizira K m različit od toga za supstrat obrnute reakcije.
OPĆE KARAKTERISTIKE ENZIMA
Enzimi su biološki katalizatori.
Hemijska priroda enzima. Aktivno mjesto enzima.
Mehanizam enzimske katalize.
I. Enzimi – biološki katalizatori proteinske prirode, sposobni za višestruko ubrzanje hemijske reakcije uliva se tijela, ali sami nisu dio konačnih produkta reakcije.
Nazivaju se supstance na koje enzim djeluje podloge.
Svu raznolikost biohemijskih reakcija koje se javljaju u mikroorganizmima, biljkama i životinjama kataliziraju odgovarajući enzimi. Velika uloga enzima u tehnologiji prehrambeni proizvodi. Proizvodnja bilo kojeg prehrambenog proizvoda temelji se na biohemijskom (enzimskom) ili fizičkom hemijski procesi ili su ti procesi međusobno povezani.
Za razliku od anorganskih katalizatora, enzimi imaju svoje karakteristike:
Brzina enzimske katalize je nekoliko redova veličine veća (od 10 3 do 10 9) nego kod nebiološkog katalizatora;
djelovanje svakog enzima je visoko specifično, tj. svaki enzim djeluje samo na svoj vlastiti supstrat ili grupu srodnih supstrata;
enzimi kataliziraju kemijske reakcije u blagi uslovi, tj. pri normalnom pritisku, visoke temperature(20-50S) i pri pH vrednostima životne sredine, u većini slučajeva blizu neutralnih.
Sa stanovišta lokalizacije enzima u ćeliji, oni se dijele na ekstracelularne i intracelularne.
Ekstracelularno enzime oslobađa živa ćelija u spoljašnju sredinu, intracelularno – nalaze se ili u ćelijskim organelama ili u kompleksu sa supramolekularnim strukturama.
Posebnu grupu enzima čine multienzimski kompleksi, koji uključuju niz enzima koji kataliziraju sekvencijalne reakcije transformacije bilo kojeg supstrata. Ovi kompleksi su lokalizirani u intramolekularnim strukturama na takav način da se svaki enzim nalazi u neposrednoj blizini enzima koji katalizuje reakciju u lancu date sekvence reakcije. Zahvaljujući ovakvom rasporedu enzima, proces difuzije supstrata i produkta reakcije je minimiziran.
II. Enzimi su proteinska jedinjenja visoke molekularne težine.
Kao i drugi proteini, enzimi imaju 4 nivoa strukture, imaju sva fizička i hemijska svojstva proteina, a samo jedna karakteristična karakteristika je sposobnost ubrzavanja hemijskih reakcija. Enzimi mogu biti jednostavni - jednokomponentni i složeni dvokomponentni.
Jednokomponentni enzimi – građeni od polipeptidnih lanaca i hidrolizom se razlažu samo na aminokiseline.
Dvokomponentni enzimi – sastoje se od proteinskog dijela – apoforma i neproteinski dio - kofaktor. Obje komponente pojedinačno nemaju enzimsku aktivnost. Samo udruživanjem ( holoenzim) poprimaju svojstva karakteristična za biokatalizatore. Ulogu kofaktora može imati bilo koji ion (Zn 2+, Mg 2+, Fe 2+, Cu 2+, rjeđe K+ i Na+) ili organsko jedinjenje(vitamini, nukleotidi). Organski kofaktori se nazivaju koenzimi.
Vrsta veze između kofaktora i apoenzima može biti različita. U nekim slučajevima postoje odvojeno i vezuju se samo tokom reakcije; u drugim slučajevima, kofaktor i apoenzim su stalno povezani, ponekad jakim, kovalentnim vezama.
Aktivno mjesto enzima– ovo je lokalni dio molekule enzima koji je uključen u čin katalize. IN jednokomponentni U enzimima se aktivni centar formira kao rezultat određene orijentacije aminokiselinskih ostataka polipeptidnog lanca. Obično mali broj aminokiselina, u rasponu od 12-16, učestvuje u njegovom formiranju. Funkcionalne grupe ovih aminokiselina mogu pripadati jedinicama polipeptidnog lanca koje su udaljene jedna od druge. Njihova konvergencija je povezana sa formiranjem tercijarne strukture enzima.
IN dvokomponentni U enzimima, aktivni centar je kompleks kofaktora i nekih susjednih aminokiselinskih ostataka.
U aktivnom centru postoje kontakt(sidro) regija čija je funkcija da veže supstrat, i katalizator - gdje se transformacija supstrata u produkte reakcije događa nakon što je vezan kontaktnim mjestom. U formiranju ovih područja učestvuju: funkcionalne grupe: COOH grupe dikarboksilnih aminokiselina ili terminalne grupe polipeptidnog lanca; imidazolna grupa histidina; OH grupa serina NH 2 - lizinska grupa i terminalne grupe polipeptidnog lanca; fenolna grupa tirozina i hidrofobni ostaci alifatskih aminokiselina.
III. Određuje se brzina bilo koje enzimske reakcije energijebarijera, koje reagujući molekuli moraju savladati. Prema Arrheniusu, hemijska reakcija sa stanovišta energije procesa opisuje se jednadžbom
N = N 0 e -(E act /RT) ,
gdje je N broj aktivnih molekula, N 0 ukupan broj reagujućih molekula; e – baza prirodnog logaritma; R – gasna konstanta; T – apsolutna temperatura; E akt – energija aktivacije.
Energija aktivacije- dodatna količina energije potrebna svim molekulima da prevladaju energetsku barijeru reakcije i uđu u nju. Ova energija je razlika između ukupne energije reagujućih molekula i energije pobuđeno prelazno stanje.Što je veća energija aktivacije u sistemu koji reaguje, to je viša energetska barijera i niža je brzina reakcije.
Najvažnija funkcija enzima je smanjenje energije aktivacije katalizirani proces. Na sl. 1 prikazuje grafik promjena u energiji neenzimskog (1) i enzimski (2) reakcije. Enzim smanjuje visinu energetske barijere (E act E act).
Mehanizam enzimske katalize ostaje uglavnom nejasan. Ipak, veliku ulogu u stvaranju enzimske kinetike odigrali su radovi M. Michaelisa i M. Mentena, u kojima je ideja o kompleks enzim-supstrat. Formiranje ovog kompleksa dovodi do smanjenja energije aktivacije reakcije.
Proces enzimske katalize može se podijeliti u tri faze:
Steričko vezivanje supstrata S za aktivno mesto enzima E (formiranje kompleksa enzim-supstrat ES).
Konverzija primarnog kompleksa ES u aktivirani prijelazni kompleks ES ≠.
Filijala finalni proizvod P reakcije iz enzima.
Prva faza je kratka i zavisi od koncentracije supstrata i enzima u medijumu, od brzine difuzije supstrata do aktivnog centra enzima. U formiranju ES kompleksa mogu učestvovati i kovalentne, koordinacione, jonske veze i manje jaki oblici veza u različitim kombinacijama - elektrostatičko privlačenje polarnih grupa, van der Waalsove kohezione sile između nepolarnih sekcija molekula, vodikove veze. Priroda ovih veza određena je hemijskim karakteristikama i supstrata i funkcionalnih grupa uključenih u aktivni centar enzima.
Druga faza je, u stvari, čin katalize, tj. čin prekida ili formiranja novih veza u podlozi; najsporiji je i ograničava brzinu hemijske reakcije. U ovoj fazi, energija aktivacije enzimske reakcije opada zbog formiranje aktivnog prelaznog kompleksa ES ≠ .
On molekularnom nivou daje jasnije razumijevanje mehanizma djelovanja enzima teorija kiselinsko-bazne katalize. Svaka reakcija koja dolazi sa prazninom kovalentne veze, uključuje učešće dvije elektronske komponente suprotne prirode. Elektroni veze koja se prekida moraju biti privučeni elektrofilnom komponentom i udaljeni od nukleofilne komponente. Reagensi koji bi mogli izazvati takvo elektronsko preuređenje su kiselina i baza. Međutim, nemoguće je istovremeno stvoriti visoke koncentracije obje komponente u istoj otopini, jer one međusobno neutraliziraju. U proteinskom molekulu enzima, zahvaljujući konsolidacija Na katalitičkom mjestu elektrofilnih i nukleofilnih grupa ne dolazi do izravne reakcije neutralizacije. Ovo, zapravo, određuje čin katalize. Nalazeći se na određenoj udaljenosti jedna od druge, elektrofilne i nukleofilne grupe katalitičkog mjesta enzima ne samo da se vežu za reagujuće grupe supstrata, već imaju i snažan polarizacijski učinak na grupe supstrata. Ovome treba dodati i mogućnost fluktuacije naelektrisanja u ES kompleksu, što stvara visok stepen efikasnosti ove polarizacije. To je razlog za smanjenje energije aktivacije tokom enzimske katalize.
Prema teoriji kovalentnakataliza neki enzimi u interakciji sa svojim supstratima formiraju nestabilne, kovalentno vezane komplekse enzim-supstrat. Iz ovih kompleksa nastaju produkti reakcije tokom naknadne reakcije, mnogo brže nego u slučaju nekataliziranih reakcija.
Dakle, treću fazu, koja se završava stvaranjem produkta reakcije, osiguravaju procesi koji su se odvijali u prethodnim fazama.
OPĆE KARAKTERISTIKE ENZIMA
Enzimi su biološki katalizatori.
Hemijska priroda enzima. Aktivno mjesto enzima.
Mehanizam enzimske katalize.
I. Enzimi – biološki katalizatori proteinske prirode, sposobni višestruko ubrzati kemijske reakcije koje se odvijaju u tijela, ali sami nisu dio konačnih produkta reakcije.
Nazivaju se supstance na koje enzim djeluje podloge.
Svu raznolikost biohemijskih reakcija koje se javljaju u mikroorganizmima, biljkama i životinjama kataliziraju odgovarajući enzimi. Uloga enzima u prehrambenoj tehnologiji je velika. Proizvodnja bilo kojeg prehrambenog proizvoda zasniva se ili na biohemijskim (enzimskim) ili fizičko-hemijskim procesima, ili su ti procesi međusobno povezani.
Za razliku od anorganskih katalizatora, enzimi imaju svoje karakteristike:
Brzina enzimske katalize je nekoliko redova veličine veća (od 10 3 do 10 9) nego kod nebiološkog katalizatora;
djelovanje svakog enzima je visoko specifično, tj. svaki enzim djeluje samo na svoj vlastiti supstrat ili grupu srodnih supstrata;
enzimi katalizuju hemijske reakcije u blagim uslovima, tj. pri normalnom pritisku, visokoj temperaturi (20-50S) i pri pH vrednostima životne sredine, u većini slučajeva blizu neutralnih.
Sa stanovišta lokalizacije enzima u ćeliji, oni se dijele na ekstracelularne i intracelularne.
Ekstracelularno enzime oslobađa živa ćelija u spoljašnju sredinu, intracelularno – nalaze se ili u ćelijskim organelama ili u kompleksu sa supramolekularnim strukturama.
Posebnu grupu enzima čine multienzimski kompleksi, koji uključuju niz enzima koji kataliziraju sekvencijalne reakcije transformacije bilo kojeg supstrata. Ovi kompleksi su lokalizirani u intramolekularnim strukturama na takav način da se svaki enzim nalazi u neposrednoj blizini enzima koji katalizuje reakciju u lancu date sekvence reakcije. Zahvaljujući ovakvom rasporedu enzima, proces difuzije supstrata i produkta reakcije je minimiziran.
II. Enzimi su proteinska jedinjenja visoke molekularne težine.
Kao i drugi proteini, enzimi imaju 4 nivoa strukture, imaju sva fizička i hemijska svojstva proteina, a samo jedna karakteristična karakteristika je sposobnost ubrzavanja hemijskih reakcija. Enzimi mogu biti jednostavni - jednokomponentni i složeni dvokomponentni.
Jednokomponentni enzimi – građeni od polipeptidnih lanaca i hidrolizom se razlažu samo na aminokiseline.
Dvokomponentni enzimi – sastoje se od proteinskog dijela – apoforma i neproteinski dio - kofaktor. Obje komponente pojedinačno nemaju enzimsku aktivnost. Samo udruživanjem ( holoenzim) poprimaju svojstva karakteristična za biokatalizatore. Ulogu kofaktora može imati bilo koji jon (Zn 2+, Mg 2+, Fe 2+, Cu 2+, rjeđe K+ i Na+) ili organsko jedinjenje (vitamini, nukleotidi). Organski kofaktori se nazivaju koenzimi.
Vrsta veze između kofaktora i apoenzima može biti različita. U nekim slučajevima postoje odvojeno i vezuju se samo tokom reakcije; u drugim slučajevima, kofaktor i apoenzim su stalno povezani, ponekad jakim, kovalentnim vezama.
Aktivno mjesto enzima– ovo je lokalni dio molekule enzima koji je uključen u čin katalize. IN jednokomponentni U enzimima se aktivni centar formira kao rezultat određene orijentacije aminokiselinskih ostataka polipeptidnog lanca. Obično mali broj aminokiselina, u rasponu od 12-16, učestvuje u njegovom formiranju. Funkcionalne grupe ovih aminokiselina mogu pripadati jedinicama polipeptidnog lanca koje su udaljene jedna od druge. Njihova konvergencija je povezana sa formiranjem tercijarne strukture enzima.
IN dvokomponentni U enzimima, aktivni centar je kompleks kofaktora i nekih susjednih aminokiselinskih ostataka.
U aktivnom centru postoje kontakt(sidro) regija čija je funkcija da veže supstrat, i katalizator - gdje se transformacija supstrata u produkte reakcije događa nakon što je vezan kontaktnim mjestom. U formiranju ovih sekcija učestvuju sledeće funkcionalne grupe: COOH grupe dikarboksilnih aminokiselina ili terminalne grupe polipeptidnog lanca; imidazolna grupa histidina; OH grupa serina NH 2 - lizinska grupa i terminalne grupe polipeptidnog lanca; fenolna grupa tirozina i hidrofobni ostaci alifatskih aminokiselina.
III. Određuje se brzina bilo koje enzimske reakcije energijebarijera, koje reagujući molekuli moraju savladati. Prema Arrheniusu, hemijska reakcija sa stanovišta energije procesa opisuje se jednadžbom
N = N 0 e -(E act /RT) ,
gdje je N broj aktivnih molekula, N 0 ukupan broj reagujućih molekula; e – osnova prirodnog logaritma R – gasna konstanta T – apsolutna temperatura; E akt – energija aktivacije.
Energija aktivacije- dodatna količina energije potrebna svim molekulima da prevladaju energetsku barijeru reakcije i uđu u nju. Ova energija je razlika između ukupne energije reagujućih molekula i energije pobuđeno prelazno stanje.Što je veća energija aktivacije u sistemu koji reaguje, to je viša energetska barijera i niža je brzina reakcije.
Najvažnija funkcija enzima je smanjenje energije aktivacije katalizirani proces. Na sl. 1 prikazuje grafik promjena u energiji neenzimskog (1) i enzimski (2) reakcije. Enzim smanjuje visinu energetske barijere (E act E act).
Mehanizam enzimske katalize ostaje uglavnom nejasan. Ipak, veliku ulogu u stvaranju enzimske kinetike odigrali su radovi M. Michaelisa i M. Mentena, u kojima je ideja o kompleks enzim-supstrat. Formiranje ovog kompleksa dovodi do smanjenja energije aktivacije reakcije.
Proces enzimske katalize može se podijeliti u tri faze:
Steričko vezivanje supstrata S za aktivno mesto enzima E (formiranje kompleksa enzim-supstrat ES).
Konverzija primarnog kompleksa ES u aktivirani prijelazni kompleks ES ≠.
Odvajanje konačnog produkta P reakcije od enzima.
Prva faza je kratka i zavisi od koncentracije supstrata i enzima u medijumu, od brzine difuzije supstrata do aktivnog centra enzima. U formiranju ES kompleksa mogu učestvovati i kovalentne, koordinacione, jonske veze i manje jaki oblici veza u različitim kombinacijama - elektrostatičko privlačenje polarnih grupa, van der Waalsove kohezione sile između nepolarnih sekcija molekula, vodikove veze. Priroda ovih veza određena je hemijskim karakteristikama i supstrata i funkcionalnih grupa uključenih u aktivni centar enzima.
Druga faza je, u stvari, čin katalize, tj. čin prekida ili formiranja novih veza u podlozi; najsporiji je i ograničava brzinu hemijske reakcije. U ovoj fazi, energija aktivacije enzimske reakcije opada zbog formiranje aktivnog prelaznog kompleksa ES ≠ .
Na molekularnom nivou daje se jasnije razumijevanje mehanizma djelovanja enzima teorija kiselinsko-bazne katalize. Svaka reakcija koja uključuje prekid kovalentnih veza uključuje učešće dvije elektronske komponente suprotne prirode. Elektroni veze koja se prekida moraju biti privučeni elektrofilnom komponentom i udaljeni od nukleofilne komponente. Reagensi koji bi mogli izazvati takvo elektronsko preuređenje su kiselina i baza. Međutim, nemoguće je istovremeno stvoriti visoke koncentracije obje komponente u istoj otopini, jer one međusobno neutraliziraju. U proteinskom molekulu enzima, zahvaljujući konsolidacija Na katalitičkom mjestu elektrofilnih i nukleofilnih grupa ne dolazi do izravne reakcije neutralizacije. Ovo, zapravo, određuje čin katalize. Nalazeći se na određenoj udaljenosti jedna od druge, elektrofilne i nukleofilne grupe katalitičkog mjesta enzima ne samo da se vežu za reagujuće grupe supstrata, već imaju i snažan polarizacijski učinak na grupe supstrata. Ovome treba dodati i mogućnost fluktuacije naelektrisanja u ES kompleksu, što stvara visok stepen efikasnosti ove polarizacije. To je razlog za smanjenje energije aktivacije tokom enzimske katalize.
Prema teoriji kovalentnakataliza neki enzimi u interakciji sa svojim supstratima formiraju nestabilne, kovalentno vezane komplekse enzim-supstrat. Iz ovih kompleksa nastaju produkti reakcije tokom naknadne reakcije, mnogo brže nego u slučaju nekataliziranih reakcija.
Dakle, treću fazu, koja se završava stvaranjem produkta reakcije, osiguravaju procesi koji su se odvijali u prethodnim fazama.
Kinetika enzima proučava uticaj različitih faktora (koncentracija S i E, pH, temperatura, pritisak, inhibitori i aktivatori) na brzinu enzimskih reakcija. Glavni cilj proučavanja kinetike enzimskih reakcija je dobivanje informacija koje omogućavaju dublje razumijevanje mehanizma djelovanja enzima.
Kinetička kriva omogućava vam da odredite početnu brzinu reakcije V 0 .
Kriva zasićenja podloge.
Ovisnost brzine reakcije o koncentraciji enzima.
Ovisnost brzine reakcije o temperaturi.
Ovisnost brzine reakcije o pH.
|
|
Optimalni pH za djelovanje većine enzima je unutra fiziološke vrijednosti 6.0-8.0. Pepsin je aktivan na pH 1,5-2,0, što odgovara kiselosti želudačnog soka. Arginaza, enzim specifičan za jetru, aktivan je na 10,0. Uticaj pH na brzinu enzimske reakcije povezan je sa stanjem i stepenom jonizacije ionogenih grupa u molekulima enzima i supstrata. Ovaj faktor određuje konformaciju proteina, stanje aktivnog centra i supstrata, formiranje kompleksa enzim-supstrat i sam proces katalize. |
Matematički opis krivulje zasićenja supstrata, Michaelisova konstanta .
|
|
Jednačinu koja opisuje krivulju zasićenja supstrata predložili su Michaelis i Menton i nosi njihova imena (Michaelis-Menten jednadžba): V = (V MAX *[ S])/(Km+[ S]) , gdje je Km Michaelisova konstanta. Lako je izračunati da kada je V = V MAX /2 Km = [S], tj. Km je koncentracija supstrata pri kojoj je brzina reakcije ½ V MAX. Da bi se pojednostavilo određivanje V MAX i Km, Michaelis-Menten jednadžba se može ponovo izračunati. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
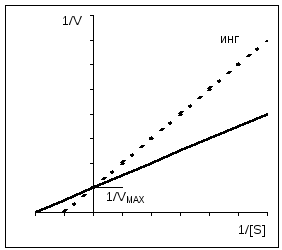
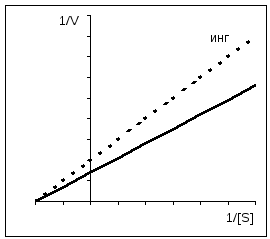
1/ V = Km/ V MAX *1/[ S] + 1/ V MAX Lineweaver-Burk jednadžba. Jednačina koja opisuje Lineweaver-Burk grafikon je jednačina prave linije (y = mx + c), gdje je 1/V MAX presjek prave linije na y-osi; Km/V MAX - tangenta prave; presek prave linije sa apscisnom osom daje vrednost 1/Km. Lineweaver-Burk dijagram omogućava vam da odredite km iz relativno malog broja tačaka. Ovaj grafikon se takođe koristi kada se procenjuje efekat inhibitora, o čemu će biti reči u nastavku. Vrijednost Km varira u velikoj mjeri: od 10 -6 mol/l za vrlo aktivne enzime, do 10 -2 za nisko aktivne enzime. |
Procjene u kilometrima imaju praktičnu vrijednost. Pri koncentracijama supstrata 100 puta većim od Km, enzim će raditi skoro maksimalnom brzinom, tako da će maksimalna brzina V MAX odražavati količinu prisutnog aktivnog enzima. Ova okolnost se koristi za procjenu sadržaja enzima u preparatu. Osim toga, Km je karakteristika enzima koji se koristi za dijagnosticiranje enzimopatija.
Inhibicija aktivnosti enzima.
Izuzetno karakteristična i važna karakteristika enzima je njihova inaktivacija pod uticajem određenih inhibitora.
Inhibitori - to su tvari koje uzrokuju djelomičnu ili potpunu inhibiciju reakcija kataliziranih enzimima.
Inhibicija enzimske aktivnosti može biti ireverzibilna ili reverzibilna, kompetitivna ili nekonkurentna.
Nepovratna inhibicija - ovo je trajna inaktivacija enzima, koja je rezultat kovalentnog vezivanja molekula inhibitora na aktivnom mjestu ili u drugom posebnom centru koji mijenja konformaciju enzima. Disocijacija takvih stabilnih kompleksa sa regeneracijom slobodnog enzima je praktično isključena. Da bi se prevladale posljedice takve inhibicije, tijelo mora sintetizirati nove molekule enzima.
Reverzibilna inhibicija – karakterizira ravnotežno kompleksiranje inhibitora sa enzimom zbog nekovalentnih veza, zbog čega su takvi kompleksi sposobni za disocijaciju uz obnavljanje aktivnosti enzima.
Klasifikacija inhibitora na kompetitivne i nekonkurentne zasniva se na tome da li je oslabljen ( konkurentska inhibicija ) ili nije oslabljen ( nekonkurentna inhibicija ) njihov inhibitorni efekat kada se koncentracija supstrata povećava.
Kompetitivni inhibitori - to su po pravilu spojevi čija je struktura slična strukturi supstrata. To im omogućava da se vežu na istom aktivnom mjestu kao i supstrati, sprječavajući enzim da stupi u interakciju sa supstratom već u fazi vezivanja. Nakon vezivanja, inhibitor se može pretvoriti u proizvod ili ostati na aktivnom mjestu dok ne dođe do disocijacije.
Reverzibilna kompetitivna inhibicija može se predstaviti kao dijagram:
E↔ E-I → E + P 1
S (neaktivan)
Stepen inhibicije enzima određen je odnosom koncentracija supstrata i enzima.
Klasičan primjer ove vrste inhibicije je inhibicija aktivnosti sukcinat dehidrogenaze (SDH) malatom, koji istiskuje sukcinat sa mjesta supstrata i sprječava njegovu konverziju u fumarat:

Kovalentno vezivanje inhibitora na aktivno mesto dovodi do inaktivacije enzima (ireverzibilna inhibicija). Primjer nepovratna kompetitivna inhibicija može poslužiti kao inaktivacija triosefosfat izomeraze sa 3-kloroacetol fosfatom. Ovaj inhibitor je strukturni analog supstrata, dihidroksiaceton fosfata, i nepovratno se veže za ostatak glutaminske kiseline u aktivnom mjestu:
Neki inhibitori djeluju manje selektivno, u interakciji sa specifičnom funkcionalnom grupom u aktivnom mjestu različitih enzima. Dakle, vezivanje jodoacetata ili njegovog amida za SH grupu aminokiseline cisteina, koja se nalazi u aktivnom centru enzima i koja učestvuje u katalizi, dovodi do potpunog gubitka enzimske aktivnosti:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
Stoga ovi inhibitori inaktiviraju sve enzime koji imaju SH grupe uključene u katalizu.
Ireverzibilna inhibicija hidrolaza pod dejstvom nervnih gasova (sarin, soman) je posledica njihovog kovalentnog vezivanja za serinski ostatak u aktivnom centru.
Metoda kompetitivne inhibicije našla je široku primjenu u medicinska praksa. Sulfonamidni lijekovi, antagonisti p-aminobenzojeve kiseline, mogu poslužiti kao primjer metaboliziranih kompetitivnih inhibitora. Vežu se za dihidropterat sintetazu, bakterijski enzim koji pretvara p-aminobenzoat u folnu kiselinu, neophodnu za rast bakterija. Bakterija umire kao rezultat toga što se vezani sulfanilamid pretvara u drugo jedinjenje i folna kiselina nije formirana.
Nekompetitivni inhibitori obično se vežu za molekul enzima na mjestu različitom od mjesta vezivanja supstrata, a supstrat se ne nadmeće direktno sa inhibitorom. Budući da se inhibitor i supstrat vezuju za različite centre, moguće je formiranje i E-I kompleksa i S-E-I kompleksa. Kompleks S-E-I se također razgrađuje kako bi nastao proizvod, ali sporije od E-S, tako da će se reakcija usporiti, ali ne i zaustaviti. Dakle, mogu se javiti sljedeće paralelne reakcije:
E↔ E-I ↔ S-E-I → E-I + P
Reverzibilna nekompetitivna inhibicija je relativno rijetka.
Nekompetitivni inhibitori se nazivaju alosterični za razliku od konkurentskih ( izosteričan ).
Reverzibilna inhibicija se može kvantitativno proučavati pomoću Michaelis-Menten jednačine.
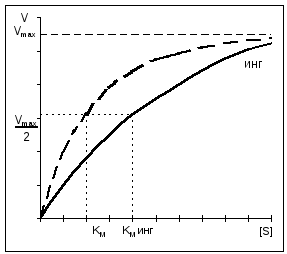
Uz kompetitivnu inhibiciju, V MAX ostaje konstantan, a Km se povećava.
|
|
|
Uz nekonkurentnu inhibiciju, V MAX se smanjuje dok Km ostaje nepromijenjen.
|
|
|
Ako proizvod reakcije inhibira enzim koji katalizuje njegovo stvaranje, ova metoda inhibicije se naziva retroinhibicija ili inhibicija povratnih informacija . Na primjer, glukoza inhibira glukoza-6-fosfatazu, koja katalizira hidrolizu glukoza-6-fosfata.
Biološki značaj ove inhibicije je regulacija određenih metaboličkih puteva (vidi sljedeću lekciju).
PRAKTIČNI DIO
Zadatak za studente
1. Proučavati denaturaciju proteina pod uticajem rastvora mineralnih i organskih kiselina i pri zagrevanju.
2. Otkrijte koenzim NAD u kvascu.
3. Odrediti aktivnost amilaze u urinu (krvnom serumu).
9. STANDARDI ODGOVORA NA PROBLEME, test pitanja koja se koriste za kontrolu znanja na času (mogu se koristiti kao dodatak)
10. PRIRODA I OBIM MOGUĆEG EDUKATIVNO-ISTRAŽIVAČKOG RADA NA TEMU
(Navedite posebno prirodu i oblik UIRS-a: priprema apstraktnih prezentacija, provođenje samostalnog istraživanja, simulacijske igre, kompletiranje anamneze koristeći monografsku literaturu i druge oblike)
Pošaljite svoj dobar rad u bazu znanja je jednostavno. Koristite obrazac ispod
Studenti, postdiplomci, mladi naučnici koji koriste bazu znanja u svom studiranju i radu biće vam veoma zahvalni.
Objavljeno na http://www.allbest.ru/
SAŽETAK
Enzimi i enzimske reakcije
Enzimi
Aktivnost enzima
Specifičnost reakcije i supstrata
Klase enzima
Enzimska kataliza
Kinetika enzimskih reakcija
Inhibitori
Enzimska analiza
svojstvo enzima reakcije katalize
Enzimi
Enzimi su biokatalizatori, tj. supstance biološkog porekla koje ubrzavaju hemijske reakcije. Organizirani slijed metaboličkih procesa je moguć pod uslovom da svaka ćelija ima svoj genetski specificirani set enzima. Samo pod ovim uslovom se postiže koordinisan redosled reakcije. Enzimi su također uključeni u regulaciju mnogih metabolički procesi, čime se osigurava da metabolizam ispunjava promijenjene uslove. Gotovo svi enzimi jesu proteini. Također su poznati katalitički aktivni nukleinske kiseline-- "ribozimi".
Aktivnost enzima
Katalitičko djelovanje enzima, tj aktivnost, određeno pod standardnim uslovima prema povećati brzinu (ljubičasta na dijagramu) katalitička reakcija ( narandžasta boja) u poređenju sa nekatalitičkim ( žuta). Obično se brzina reakcije daje kao promjena koncentracije supstrata ili proizvoda u jedinici vremena(mol/(l s)) . Pošto katalitička aktivnost ne zavisi od zapremine rastvora u kojoj se reakcija odvija, aktivnost enzima se izražava u catalahs; 1 mačka je količina enzima koja pretvara 1 mol supstrata za 1 s. Druga jedinica aktivnosti je međunarodna jedinica(E) -- količina enzima koja pretvara 1 µmol supstrata za 1 minut (1 E = 16,7 ncat).
Specifičnost reakcije i supstrata
Većina akcija enzimi visoko konkretno. Koncept specifičnosti se ne odnosi samo na vrste katalitičkih reakcija ( specifičnost reakcije), ali i na prirodu spojeva - supstrata ( specifičnost supstrata). Kao primjer, dijagram prikazuje enzime koji razgrađuju kemijsku vezu. Visoko specifični enzimi (tip A - gornja linija tabele) kataliziraju cijepanje samo jedne vrste veze u supstratima određene strukture. Enzimi tipa B (srednji red) imaju ograničenu specifičnost reakcije, ali široku specifičnost supstrata. Enzimi tipa B (niska reakcija i niska specifičnost supstrata; krajnji rezultat) su rijetki.
Klase enzima
Do danas je poznato oko 2000 različitih enzima. Razvijeni sistem klasifikacije uzima u obzir reakciju i specifičnost supstrata enzima. Svi enzimi su uključeni u “Katalog enzima” pod njihovim klasifikacioni broj(KF), koji se sastoji od četiri cifre. Prva cifra označava pripadnost jednom od šest glavnih klasa. Sljedeće dvije određuju podklasu i podklasu, a posljednja cifra je broj enzima u ovoj podklasi. Na primjer, laktat dehidrogenaza ima CF broj 1.1.1.27 (klasa 1, oksidoreduktaze; potklasa 1.1, donator elektron - CH-OH; potklasa 1.1.1, akceptor-- NADP + .)
Svaka od šest glavnih klasa sadrži enzime koji imaju istu reakcijsku specifičnost. Oksidoreduktazas(klasa 1) katalizuju redoks reakcije. Transferaze(klasa 2) prenose jednu ili drugu funkcionalnu grupu sa jednog supstrata na drugi. Oksidoreduktaze i transferaze zahtijevaju zajednički koenzim. Hidrolaze(klasa 3) takođe učestvuju u grupnom transferu, ali je ovde akceptor uvek molekul vode. Lyases(klasa 4, ponekad se nazivaju "sinteze") kataliziraju cijepanje ili stvaranje kemijskih spojeva, u kojima se formiraju ili uništavaju dvostruke veze.
Izomeraze(klasa 5) pomera grupe unutar molekula bez promene opšta formula supstrat. Ligaze(„sinteze“, klasa 6) kataliziraju energetski zavisne reakcije adicije i stoga je njihovo djelovanje povezano s hidrolizom nukleozid trifosfata (najčešće ATP).
Enzimska kataliza
Enzimi - visoko efikasni katalizatori. Oni povećavaju brzinu katalizirane reakcije za 10-12 puta ili više. Da bi se razumio mehanizam enzimske katalize, korisno je prvo razmotriti pojavu nekatalitičke reakcije.
Nekatalitička reakcija (u odsustvu enzima)
Kao primjer, razmotrite reakciju tipa A + B > C + D. Supstance A i B u rastvoru su okruženi omotačem od molekula vode (hidratna školjka) a pod uticajem toplotnog kretanja kreću se nasumično. Oni mogu međusobno reagirati samo ako se sudare u povoljnoj orijentaciji, što je malo vjerovatno i rijetko.
Za formiranje proizvoda C + D kompleks A--B, kao rezultat sudara molekula, treba da nastane prelazno stanje, što obično zahtijeva značajnu energija aktivacije E a. Pošto samo mali dio može primiti ovu energiju kompleksi A-B, postizanje prelaznog stanja je još rjeđi slučaj od nastanka kompleksa. U otopini se većina energije aktivacije troši na savladavanje hidratantnih ljuski između A i B, zbližavanje reagensa I drugim hemijskim procesima, u kojoj su ovi reagensi uključeni. Kao rezultat toga, u odsustvu katalizatora, stvaranje produkata se događa izuzetno rijetko i brzina reakcije v je neznatna, čak i kada je reakcija termodinamički dopuštena, tj.< 0
Enzimska reakcija
Enzimi specifično vezuju reagense (njihove supstrate). aktivni centar. U ovom slučaju supstrati su orijentisani na način da zadobiju optimalan položaj za formiranje prelaznog stanja (1-3). Približavanje I potrebna orijentacija reagensi značajno povećavaju vjerovatnoću nastanka proizvodni kompleks A--B. Osim toga, vezivanje supstrata na aktivnom mjestu rezultira uklanjanjem hidratacijske ljuske supstrata. uklanjanje molekula vode U aktivnom centru enzima tokom katalize stvaraju se potpuno drugačiji uslovi nego u rastvoru (3-5). Još jedan važan faktor nastaje zbog interakcije između aminokiselinskih ostataka proteina i supstrata (4). Dakle, prijelazno stanje u slučaju enzimske reakcije zahtijeva manje energije aktivacije. Osim toga, mnogi enzimi prenose specifične grupe sa ili na supstrat tokom katalize. Prijenos protona je posebno čest. Ovaj enzimski kiselo-baznu katalizu mnogo efikasnije od razmene protona sa kiselinama i bazama u rastvoru. Često su hemijske grupe kovalentno vezane za ostatke enzima. Ovaj fenomen se zove kovalentna kataliza.. Osnove enzimske katalize
Iako je danas teško kvantificirati doprinos pojedinačnih katalitičkih efekata, uzima se u obzir odlučujući faktor stabilizacija prelaznog stanja u aktivnom mjestu enzima. U ovom slučaju, najznačajnija tačka je snažno vezivanje ne toliko supstrata koliko njegovog prelaznog stanja. Ovu poziciju potvrđuje izuzetno visok afinitet mnogih enzima za analoge prelaznog stanja, što se može objasniti jednostavnom mehaničkom analogijom (na dijagramu desno): ako se želi kotrljati metalne kuglice (reagense) s mjesta EA (stanje supstrata) u energetski više prelazno stanje, a zatim u EP (stanje proizvoda), potrebno je postaviti magnet (katalizator) na takav način da privlačna sila ne djeluje na EA (a), već na prijelaz stanje (b).
Kinetika enzimskih reakcija
Kinetika primarno se određuje enzimska reakcija (tj. ovisnost brzine reakcije o njenim uvjetima). svojstva katalizatora, zbog čega je mnogo složeniji od kinetike nekatalitičkih reakcija
Michaelis-Menten model
Potpuna matematička analiza enzimske reakcije dovodi do složene jednačine, nije pogodno za praktična primjena. Pokazalo se da je najpogodniji model bio jednostavan, razvijen 1913. godine. On objašnjava karakterističnu hiperboličku zavisnost aktivnosti enzima o koncentraciji supstrata (1) i omogućava da se dobiju konstante koje kvantitativno karakterišu efikasnost enzima.
Michaelis-Menten model polazi od činjenice da u početku supstrat A formira kompleks sa enzimom E (3), koji se mnogo brže pretvara u proizvod B nego u odsustvu enzima. Konstanta brzine k cat (2) je mnogo veća od konstante nekatalitičke reakcije k. Konstanta k mačka se takođe naziva “ broj obrtaja„jer odgovara broju molekula supstrata koje jedan molekul enzima pretvara u proizvod u 1 s. Prema ovom modelu, aktivnost enzima je određena udjelom EA kompleksa od ukupne koncentracije enzima [E]t, odnosno omjerom / [E]t (3). Radi jednostavnosti, model pretpostavlja da su E, A i EA in hemijska ravnoteža prema zakonu djelovanja mase, koji na kraju daje jednačinu za disocijaciju EA kompleksa:
[E][A]/ = K m Pošto je [E] t = [E] + ,
= [E] t [A]/(K m + [A])
Iz v = k cat (2) i prethodnog izraza dobijamo Michaelis-Menten jednadžba (4).
Jednačina sadrži dvije veličine ( dva parametra), koji ne ovise o koncentraciji supstrata [A], ali karakteriziraju svojstva enzima: ovo je proizvod k cat [E] t, koji odgovara maksimalna brzina reakcije V pri visokim koncentracijama supstrata, i Michaelisova konstanta m, karakteriziranje afinitet enzim na supstrat. Michaelisova konstanta je numerički jednaka koncentraciji supstrata [A]. pri kojoj n dostiže polovinu maksimalne vrijednosti V (ako je v = V/2, tada je [A] / (K m + [A]) = 1/2, tj. K m = [A]). Visok afinitet enzima za supstrat karakteriše niska vrijednost Za m i obrnuto,
Michaelis-Menten model se zasniva na nekoliko ne sasvim realističnih pretpostavki, kao što su nepovratna konverzija EA u E + B, postizanje ravnoteže između E, A i EA, odsustvo drugih oblika enzima u otopini osim E i EA. Samo podložni ovim hipotetičkim uslovima K m odgovara konstanti disocijacije kompleksa, a k cat odgovara konstanti brzine reakcije EA > E + B.
Definicija V i K m
U principu, V i K m se mogu odrediti iz grafika v u odnosu na [A] (slika lijevo). Pošto v asimptotski dostigne V sa povećanjem koncentracije supstrata [A], teško je ekstrapolacijom dobiti pouzdanu vrijednost V i K m (slika lijevo).
Radi lakšeg izračunavanja, Michaelis-Menten jednadžba se može transformirati tako da eksperimentalne točke leže na pravoj liniji. Jednom od ovih grafičkih transformacija u tzv Eadie-Hofstee grafikon(slika desno) nacrtajte zavisnost v od v/[A]. U ovom slučaju, tačka preseka prave linije dobijena najboljom linearnom aproksimacijom eksperimentalnih tačaka sa ordinatnom osom odgovara V, a tangenta ugla nagiba jednaka je -K m. Ovaj grafički pristup određivanju V i K m također nije optimalan. Trenutno se podaci o kinetici enzima obrađuju brže i objektivnije korištenjem kompjuterske tehnologije.
Inhibitori
Mnoga jedinjenja mogu uticati na metabolizam modulacijom aktivnosti odgovarajućih enzima. Posebno važne funkcije istovremeno ispuniti inhibitori enzima. Mnogi inhibitori enzima su lekovite supstance prirodnog ili sintetičkog porijekla. Metaboliti takođe mogu biti inhibitori enzima u regulatornim procesima.
Vrste inhibicije
Većina inhibitora enzima djeluje reverzibilan, tj. ne unose nikakve promjene u molekulu enzima nakon njihove disocijacije. Međutim, postoje i oni nepovratan inhibitori enzima koji nepovratno modificiraju ciljni enzim. Princip djelovanja inhibitora vrsta inhibicije određuje se poređenjem kinetike reakcije u prisustvu inhibitora bez njega (vidi dijagram B). Razlikovati konkurentan(A, lijevo) i nekonkurentna(ah, tačno) inhibicija. Igra važnu ulogu u regulaciji metabolizma alosterična inhibicija(A, 6).
Takozvani analozi supstrata(2) imaju svojstva slična onima supstrata ciljnog enzima. Oni reverzibilno blokiraju dio molekula dostupnog enzima, ali se dalje ne mogu pretvoriti u proizvod. Stoga, da bi se postigla polovina maksimalne brzine reakcije, više visoko koncentracija supstrata: u prisustvu takvog inhibitora, Michaelisova konstanta K m raste (B). Podloga unutra visoke koncentracije istiskuje inhibitor iz enzima. Stoga se maksimalna brzina V ne mijenja sa ovom vrstom kočenja. Budući da se supstrat i inhibitor takmiče za mjesto vezivanja na enzimu, ovaj tip kočenje se zove konkurentan. Analogi prijelaznog stanja(3) takođe deluju kao kompetitivni inhibitori.
Ako inhibitor reagira funkcionalno važna grupa enzim bez ometanja vezivanja supstrata, takva inhibicija se naziva nekonkurentna(na dijagramu desno). U tom slučaju K m ostaje nepromijenjen, naprotiv, koncentracija funkcionalno aktivnog enzima [E] t, a samim tim i maksimalna brzina reakcije V. U pravilu djeluju nekonkurentni inhibitori. nepovratno, budući da modificiraju funkcionalne grupe ciljnog enzima (4).
U slučaju tzv. samoubilačke podloge" (5) mi pričamo o tome o analozima supstrata koji sadrže dodatnu reakcionu grupu. U početku se vežu reverzibilno, a zatim formiraju kovalentno jedinjenje sa aktivnim mestom enzima. Stoga se inhibicija takvim spojevima manifestuje kao nekonkurentna. Dobro poznati primjer takvog inhibitora je antibiotik penicilin.
Alosterični inhibitori vezuju se za pojedinačne regije enzima izvan aktivnog centra (6). Ova veza podrazumijeva konformacijske promjene u molekuli enzima, što dovodi do smanjenja njegove aktivnosti. Alosterični efekti se javljaju gotovo isključivo u slučaju oligomerni enzimi. Kinetika takvih sistema ne može se opisati jednostavnim Michaelis-Menten modelom.
Kinetika inhibicije
Konkurentska inhibicija se može lako razlikovati od nekonkurentske inhibicije kada se koristi Eadie-Hofstee grafika. Kao što je već spomenuto, konkurentan inhibitori utiču samo na Km, ali ne i na V. Prave linije dobijene u odsustvu i prisustvu inhibitora na grafu seku se na osi ordinate. Direktno za nekonkurentna inhibicije imaju isti nagib (K m se ne mijenja), međutim, kako se koncentracija inhibitora povećava, segmenti odsječeni ovim pravim linijama na osi ordinate postaju sve kraći i kraći. Za alosterične enzime, Eady-Hofstee dijagram se ne može koristiti, koji je u ovom slučaju nelinearan (ovdje nije prikazan).
Enzimska analiza
Enzimi igraju važnu ulogu u biohemijske analize . U biološkim materijalima, na primjer u tjelesnim tekućinama, enzimi se mogu otkriti u zanemarljivim koncentracijama određivanjem katalitičke aktivnosti. Enzimi se mogu koristiti kao reagensi za određivanje koncentracije metabolita, kao što je nivo glukoze u krvi (slika B). Većina enzimskih testova koristi fotometriju.
Osnove spektrofotometrije
Mnogo molekula apsorbirati svjetlost u vidljivom ili ultraljubičastom području spektra. Ovo svojstvo se može koristiti za određivanje koncentracija. Količina apsorpcije zavisi od vrste i koncentracije supstance, kao i od talasne dužine svetlosti koja se koristi. Stoga koriste monohromatsko svetlo, tj. svjetlost određene valne dužine koja se može odvojiti od bijele svjetlosti pomoću monohromator. Monokromatska svjetlost intenziteta I 0 prolazi kroz pravougaonu ćeliju od stakla ili kvarca (kiveta), koja sadrži otopinu apsorbirajuće tvari. Intenzitet I izlazeće svjetlosti, oslabljen apsorpcijom, mjeri se pomoću detektora. Apsorpcija svjetlosti(A) rješenje ( optička gustina) definira se kao negativni logaritam omjera I / I 0 . Lambert-Beer zakon navodi da je A proporcionalno koncentraciji (c) supstance i debljini (d) sloja rastvora. Koeficijent ekstinkcijee zavisi, kao što je gore pomenuto, od vrste supstance i talasne dužine.
Određivanje aktivnosti laktat dehidrogenaze
Određivanje aktivnosti laktat dehidrogenaze [LDH] zasniva se na činjenici da redukovani koenzim NADH + H + apsorbuje svetlost na 340 nm, dok NAD + nema apsorpciju na ovoj talasnoj dužini. Spektri apsorpcije(tj. grafikoni A u zavisnosti od talasne dužine) supstrata i koenzima u LDH reakciji su prikazani na Sl. B1.
Razlike u apsorpciji NAD+ i NADH između 300 i 400 nm su posljedica promjena u nikotinamidnom prstenu tokom oksidacije ili redukcije.
Za određivanje aktivnosti, prije svega, otopine laktata i NAD+ se stavljaju u kivetu i snima se apsorpcija na konstantnoj dužini talasi 340 nm. Nekatalitička reakcija se odvija vrlo malom brzinom. Stoga se mjerljive količine NADH formiraju tek nakon dodavanja LDH. Budući da je stopa povećanja apsorpcije DA/Dt prema Lambert-Beerovom zakonu proporcionalna brzini reakcije DA/Dt, aktivnost LDH se može izračunati korištenjem koeficijenta ekstinkcije e na 340 nm ili poređenjem sa standardnim rastvorom.
Enzimsko određivanje glukoze
Većina biomolekula ne apsorbuje svjetlost u vidljivim ili ultraljubičastim područjima spektra. Osim toga, obično su prisutni u mješavinama s drugim spojevima koji također proizvode slične kemijske reakcije.
Obe poteškoće se mogu prevazići odgovarajući enzim za selektivnu konverziju određenog metabolita u obojenu supstancu, koja je dalje određena intenzitetom apsorpcije svjetlosti.
Uobičajena metoda za određivanje glukoze u krvi temelji se na dvije uzastopne reakcije:
1) stvaranje glukonolaktona i vodikovog peroksida H 2 O 2 pod djelovanjem enzima glukoza oksidaza ;
2) oksidacija bezbojne supstance vodonik peroksidom u obojeno zeleno jedinjenje u reakciji katalizovanoj peroksidazom.
Kada se potroši sva glukoza prisutna u uzorku, količina formirane obojene tvari može se odrediti apsorpcijom svjetlosti, koja je direktno proporcionalna početnom sadržaju glukoze.
Objavljeno na Allbest.ru
Slični dokumenti
Ubrzanje hemijskih reakcija pomoću katalizatora. Osobine enzima (enzima) kao visoko specifičnih proteina koji obavljaju funkcije bioloških katalizatora. Struktura enzima, njihova specifičnost i klasifikacija. Faze enzimske katalize.
prezentacija, dodano 20.11.2014
Klasifikacija enzima, njihove funkcije. Konvencije imenovanja enzima, struktura i mehanizam djelovanja. Opis kinetike jednosupstratnih enzimskih reakcija. Modeli indukovane korespondencije sa ključem. Modifikacije, kofaktori enzima.
prezentacija, dodano 17.10.2012
Karakteristike enzima, organskih katalizatora proteinske prirode koji ubrzavaju reakcije neophodne za funkcionisanje živih organizama. Uvjeti djelovanja, proizvodnje i upotrebe enzima. Bolesti povezane s poremećenom proizvodnjom enzima.
prezentacija, dodano 19.10.2013
Opće karakteristike i glavne vrste enzima. Hemijska svojstva enzime i reakcije koje katalizuju. Selektivnost i efikasnost enzima. Ovisnost o temperaturi i okruženju rastvora. Aktivno mjesto enzima. Brzina enzimskih reakcija.
prezentacija, dodano 06.10.2014
Definicija enzima kao specifičnih proteina prisutnih u svim živim ćelijama bioloških katalizatora. Prostornost strukturne molekule enzima, proces biosinteze oksidoreduktaze, transferaze, hidrolaze, liaze, izomeraze i ligaze.
test, dodano 27.01.2011
Kinetičke studije enzimskih reakcija za identifikaciju enzima i usporedbu njihove brzine. Formiranje kompleksa enzim-supstrat od enzima i supstrata pod dejstvom sila fizičke prirode. Fakultativni organizmi, autotrofi i heterotrofi.
test, dodano 26.07.2009
Enzimi: biohemijska struktura i fiziološku ulogu. Analiza metoda za određivanje aktivnosti enzima i enzimskog spektra u tjelesnim tekućinama. Glavni enzimi u urinu su normalni i patološki. Enzimski spektar urina kod bolesti bubrega.
izvještaj, dodano 03.10.2015
Proučavanje enzima, njihovih svojstava i mehanizma biološko djelovanje. Sprovođenje istraživanja moderne ideje o mehanizmu enzimske transaminacije. Razvoj opšta teorija piridoksalnu katalizu. Struktura kompleksa enzim-supstrat.
sažetak, dodan 14.03.2015
Specifični proteini koji katalizuju hemijske reakcije u živim sistemima. Karakteristike i klasifikacija enzima, njihova veličina i struktura. Utjecaj uslova okoline na aktivnost enzima: faktori i kofaktori; bolesti povezane s poremećajem njihove proizvodnje.
prezentacija, dodano 07.05.2015
Proučavanje svrhe enzima ili enzima - proteinskih molekula ili molekula RNK (ribozimi) ili njihovih kompleksa koji ubrzavaju (katalizuju) hemijske reakcije u živim sistemima. Lokalizacija enzima u ćeliji. Nasljedne i stečene enzimopatije.
Slični članci
-
Šta zaista prijeti sibirskoj šumi
Izdanje povodom 300. godišnjice projekta posvetili smo veoma važnoj temi izvoza ruskog drveta u Kinu. Ova tema je okružena brojnim mitovima i može postati tačka političkih tenzija u bliskoj budućnosti. Ova studija koristi ne...
-
Uvodne riječi, uvodne rečenice i plug-in konstrukcije
Lekcija br. 4 9. razred ruski. jezik 13.09.2017. Tema: Prosta rečenica i njena gramatička osnova (§ 4) Svrha: 1) ponoviti vrste rečenica na osnovu prisustva glavnih članova (jednodelne, dvodelne), VRSTE jednodelnih rečenice, metode...
-
Nakon Revolucije, odlučili su da nas urone u mrak, uništavajući hramove kako bi od nas ubirali porez za svjetlo
Prije 3 mjeseca aktivirao sam njegovu moć sa magijom SataneV P prije 4 mjeseca Za elitu je zgodnije da vlada glupom biomasom nego radoznalom čovječanstvu u razvoju. Regresija na licu. Hvala na materijalu!Di Alkin prije 5 mjeseci idem sad...
-
Dolazak Mesije. Prvi dolazak Mesije. Kvalitet znanja određuje naš put
Odlomak iz Vodiča kroz židovsku misao rabina Aryeha Kaplana | | | | | | Predgovor Dolazak Mošijaha i naknadno iskupljenje Izraela je crvena nit jevrejske doktrine. U Svetom pismu nalazimo dva kontradiktorna...
-
O čednosti. Tertulijan. O čednosti Šta su rekli crkveni oci
O čednosti braka Dva su cilja zbog kojih je brak ustanovljen: da živimo čedno i da postanemo očevi.Ali najvažnija od ove dvije svrhe je čistoća.Sveti Jovan Zlatousti (IV-V vek) Brak je dobro jer čuva muža u...
-
Mlad Mjesec - preporuke i upozorenja
Obično mladi mjesec traje samo nekoliko sati, iako se rituali mogu obaviti prvog, drugog, pa čak i trećeg lunarnog dana. Na mladom mjesecu preporučuje se izvođenje magijskih praksi kako biste nešto privukli u život - ljubav, novac, sreću. Broji,...