Caracteristici ale cineticii reacției enzimatice. Condiții pentru reacția enzimatică
Enzima E se leagă reversibil de substratul S, formând un complex intermediar instabil enzimă-substrat ES, care se descompune la sfârșitul reacției pentru a elibera enzima și produșii de reacție P.
Aceste idei au stat la baza Teoria „blocarea cu chei” a lui E. Fisher (1890). Structura centrului activ este complementară cu structura moleculară a substratului, asigurând astfel specificitatea ridicată a enzimei. Formarea complexelor enzimă-substrat implică legături de hidrogen, interacțiuni electrostatice și hidrofobe și, în unele cazuri, și covalente, legături de coordonare.
D. Koshland a fost dezvoltat teoria „potrivirii induse” (1958) . Corespondența spațială dintre structura substratului și locul activ al enzimei este creată în momentul interacțiunii lor între ele, ceea ce poate fi exprimat prin formula „mănușă – mână”. Substratul induce modificări conformaționale în molecula de enzimă în așa fel încât centrul activ să-și asume orientarea spațială necesară pentru legarea substratului. Acestea. enzima va fi în forma T activă (încordată) (la tracțiune) numai în momentul atașării substratului, spre deosebire de forma R inactivă (relaxare).
În prezent, ipoteza Koshland este treptat înlocuită ipoteză potrivire topochimică. Păstrând principalele prevederi ale teoriei „corespondenței induse”, explică specificitatea acțiunii enzimelor prin recunoașterea acelei părți a substratului care nu se modifică în timpul catalizei.
Ca și alți catalizatori, enzimele, din punct de vedere termodinamic, accelerează reacțiile chimice prin scăderea energiei de activare.
Energie activatoare numită energia necesară pentru a transfera toate moleculele unui mol de substanță într-o stare activată la o anumită temperatură.
Atât o reacție catalizată de enzime cât și o reacție necatalizată de enzime au aceeași modificare standard de energie liberă (ΔG). Cu toate acestea, reacția enzimatică are o energie de activare mai mică. Acționând asupra vitezei de reacție, enzimele nu modifică echilibrul dintre reacțiile directe și inverse, ci doar accelerează debutul acestuia.
2.3. Cinetica reacțiilor enzimatice
Cinetica enzimatică investighează influenţa naturii chimice a substanţelor care reacţionează (enzime, substraturi) şi condiţiile de interacţiune a acestora (concentraţia, pH-ul mediului, temperatura, prezenţa activatorilor sau inhibitorilor) asupra vitezei unei reacţii enzimatice. Viteza de reacție enzimatică (V) este măsurată prin scăderea cantității de substrat sau creșterea produsului pe unitatea de timp.
În timpul catalizei enzimatice, enzima (E) se combină reversibil cu substratul (S), formând un complex instabil enzimă-substrat (ES), care se descompune la sfârșitul reacției cu eliberarea enzimei (E) și a produselor de reacție ( P):
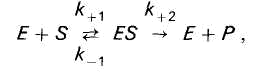
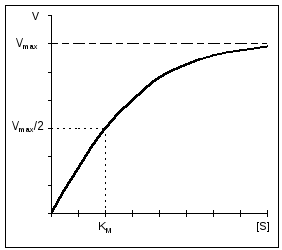
O caracteristică importantă a reacțiilor enzimatice este saturarea enzimei cu substratul. La o concentrație scăzută de substrat, viteza de reacție este direct proporțională cu concentrația acestuia. La mare - viteza de reacție este maximă, devine constantă și nu depinde de concentrația substratului [S] și este determinată în întregime de concentrația enzimei (Fig. 11).
|
|
|
Orez. 11. Dependenţa vitezei reacţiei enzimatice de concentraţia substratului la o concentraţie constantă a enzimei. |
K S este constanta de disociere a complexului enzima-substrat ES, invers constanta de echilibru:
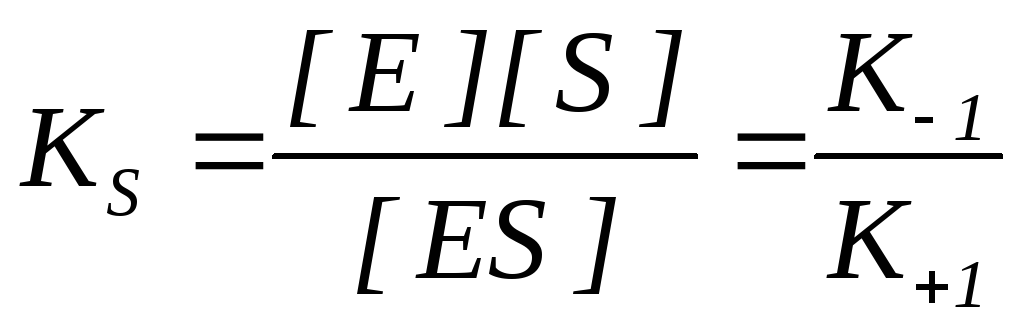
Cu cât valoarea K S este mai mică, cu atât este mai mare afinitatea enzimei pentru substrat.
Relația cantitativă dintre concentrația substratului și viteza reacției enzimatice exprimă ecuația Michaelis-Menten:
 ,
,
- viteza de reacție, V max - viteza maximă a reacției enzimatice.
Briggs și Haldane au îmbunătățit ecuația prin introducerea în ea Michaelis constantăK M determinat experimental.
Ecuația Briggs-Haldane: 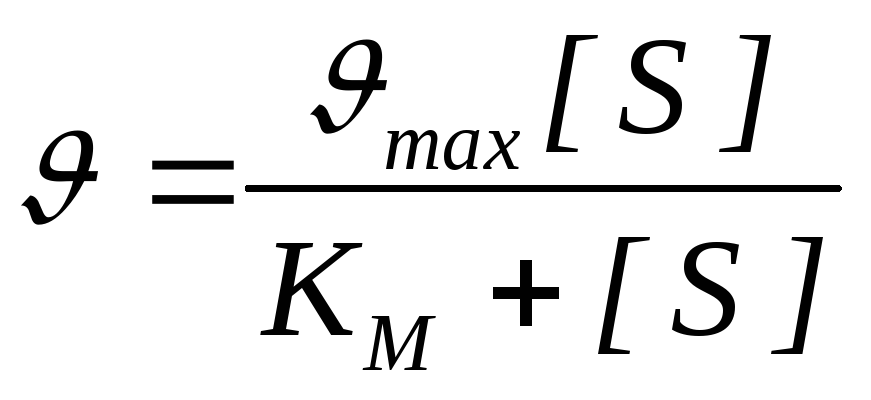
Constanta Michaelis este numeric egală cu concentrația substratului (mol/l) la care viteza de reacție enzimatică este jumătate din maxim (Fig. 12). K m arată afinitatea enzimei pentru substrat; cu cât valoarea sa este mai mică, cu atât este mai mare afinitatea.
Valorile experimentale ale K m pentru majoritatea reacțiilor enzimatice care implică un singur substrat sunt de obicei 10 -2 -10 -5 M. Dacă reacția este reversibilă, atunci interacțiunea enzimei cu substratul reacției directe este caracterizată de K m care diferă de cel pentru substratul reacției inverse.
CARACTERISTICI GENERALE ALE ENZIMELOR
Enzimele sunt catalizatori biologici.
Natura chimică a enzimelor. Loc activ al enzimelor.
Mecanismul catalizei enzimatice.
eu. Enzime – catalizatori biologici de natura proteica, capabili sa accelereze de multe ori reacții chimice curgând înăuntru organism, dar nu fac parte din produsele finale ale reacției.
Substanțele asupra cărora acționează o enzimă se numesc substraturi.
Întreaga varietate de reacții biochimice care apar la microorganisme, plante și animale este catalizată de enzimele corespunzătoare. Rolul enzimelor în tehnologie este mare Produse alimentare. Producerea oricărui produs alimentar se bazează fie pe baza biochimică (enzimatică) fie fizică procese chimice sau aceste procese sunt interconectate.
Spre deosebire de catalizatorii anorganici, enzimele au propriile lor caracteristici:
Viteza catalizei enzimatice este cu câteva ordine de mărime mai mare (de la 103 la 109) decât cea a unui catalizator nebiologic;
acțiunea fiecărei enzime este foarte specifică; fiecare enzimă acționează numai asupra propriului substrat sau a unui grup de substraturi înrudite;
enzimele catalizează reacţiile chimice în condiții blânde, adică la presiune normală temperatura ridicata(20-50С) și la valorile pH-ului mediului, în majoritatea cazurilor apropiate de neutru.
Din punctul de vedere al localizării enzimelor în celulă, acestea sunt împărțite în extracelulare și intracelulare.
Extracelular enzimele sunt secretate de celulele vii în mediu, intracelular - se gasesc fie in organele celulare, fie in complex cu structuri supramoleculare.
Un grup special de enzime este alcătuit din complexe polienzimatice, care includ o serie de enzime care catalizează reacții succesive de transformare a oricărui substrat. Aceste complexe sunt localizate în structuri intramoleculare în așa fel încât fiecare enzimă să fie situată în imediata apropiere a enzimei care catalizează reacția în lanțul acestei secvențe de reacții. Datorită acestei aranjamente a enzimelor, procesul de difuzie a substratului și a produselor de reacție este minimizat.
II. Enzimele sunt compuși proteici cu greutate moleculară mare.
Ca și alte proteine, enzimele au 4 niveluri de structură, au toate proprietățile fizico-chimice ale proteinelor și o singură trăsătură distinctivă este capacitatea de a accelera reacțiile chimice. Enzimele pot fi simple - cu o singură componentă și complexe cu două componente.
Enzime cu un singur component - sunt construite din lanțuri polipeptidice și în timpul hidrolizei se descompun numai în aminoacizi.
Enzime cu două componente - alcatuit din proteine apoformentși partea neproteică - cofactor. Ambele componente separat sunt lipsite de activitate enzimatică. Doar prin unirea împreună holoenzima) dobândesc proprietăţi caracteristice biocatalizatorilor. Rolul unui cofactor poate fi îndeplinit de orice ion (Zn 2+, Mg 2+, Fe 2+, Cu 2+, mai rar K + și Na +) sau compus organic(vitamine, nucleotide). Se numesc cofactorii organici coenzime.
Tipul de conexiune dintre cofactor și apoenzimă poate fi diferit. În unele cazuri, ele există separat și sunt asociate numai în timpul reacției; în alte cazuri, cofactorul și apoenzima sunt conectate permanent, uneori prin legături puternice, covalente.
Loc activ al enzimelor este o regiune locală a moleculei de enzimă care este implicată în actul de cataliză. ÎN monocomponentÎn enzime, centrul activ se formează ca urmare a unei anumite orientări a resturilor de aminoacizi ale lanțului polipeptidic. De obicei, la formarea sa ia parte o cantitate mică de aminoacizi, în intervalul 12-16. Grupările funcționale ale acestor aminoacizi pot aparține legăturilor lanțului polipeptidic, îndepărtate unele de altele. Convergența lor este asociată cu formarea structurii terțiare a enzimei.
ÎN bicomponentÎn enzime, centrul activ este un complex de cofactor și unele reziduuri de aminoacizi adiacente.
În centrul activ există a lua legatura(ancoră) un sit a cărui funcție este de a lega substratul și catalitic - unde transformarea substratului în produşi de reacţie are loc după legarea acestuia de către locul de contact. În formarea acestor zone sunt implicate următoarele: grup functional: grupări COOH ale aminoacizilor dicarboxilici sau grupări terminale ale unui lanț polipeptidic; gruparea imidazolului histidinei; gruparea OH a seriinei, NH2 - gruparea lizină și grupările terminale ale lanțului polipeptidic; grupa fenolică a tirozinei și reziduurile hidrofobe ale aminoacizilor alifatici.
III. Se determină viteza oricărei reacții enzimatice energiebarieră, care trebuie depășit de moleculele care reacţionează. Potrivit lui Arrhenius, o reacție chimică din punctul de vedere al energiei procesului este descrisă de ecuație
N \u003d N 0 e - (E act / RT),
unde N este numărul de molecule active, N 0 este numărul total de molecule care reacţionează; e este baza logaritmului natural; R este constanta gazului; T este temperatura absolută; E act - energie de activare.
Energie activatoare este cantitatea suplimentară de energie necesară tuturor moleculelor pentru a depăși bariera energetică a reacției și a intra în ea. Această energie este diferența dintre energia totală a moleculelor care reacţionează și energia stare de tranziție excitată. Cu cât energia de activare este mai mare în sistemul de reacție, cu atât bariera energetică este mai mare și viteza de reacție este mai mică.
Cea mai importantă funcție a unei enzime este scăderea energiei de activare proces catalizat. Pe fig. 1 prezintă un grafic al modificării energiei neenzimatice (1) și enzimatic (2) reactii. Enzima coboară înălțimea barierei energetice (E act E act).
Mecanismul catalizei enzimatice rămâne în mare parte neexplicat. Cu toate acestea, munca lui M. Michaelis și M. Menten, care au dezvoltat ideea de complex enzima-substrat. Formarea acestui complex duce la o scădere a energiei de activare a reacției.
Procesul de cataliză enzimatică poate fi împărțit în trei etape:
Legarea sterica a substratului S la locul activ al enzimei E (formarea complexului enzima-substrat ES).
Transformarea complexului primar ES într-un complex tranzitoriu activat ES ≠ .
ramură produs final Reacția R de la enzimă.
Prima etapă este scurtă în timp și depinde de concentrația substratului și a enzimei în mediu, de viteza de difuzie a substratului la locul activ al enzimei. În formarea complexului ES, atât legăturile covalente, de coordonare, ionice, cât și formele mai puțin puternice de legături - atracția electrostatică a grupurilor polare, forțele van der Waals de adeziune între regiunile nepolare ale moleculelor, legăturile de hidrogen pot participa la diverse combinatii. Natura acestor legături este determinată de caracteristicile chimice atât ale substratului, cât și ale grupărilor funcționale care alcătuiesc centrul activ al enzimei.
A doua etapă este, de fapt, un act de cataliză, adică. un act de ruptură sau formare de noi legături în substrat; este cel mai lent și limitează viteza unei reacții chimice. În această etapă, energia de activare a reacției enzimatice scade din cauza formarea unui complex de tranziție activ ES ≠ .
Pe nivel molecular o înţelegere mai clară a mecanismului de acţiune al enzimelor dă teoria catalizei acido-bazice. Orice reacție care vine cu o pauză legaturi covalente, implică participarea a două componente electronice opuse. Electronii legăturii rupte trebuie atrași de componenta electrofilă și departe de cea nucleofilă. Reactivii care ar putea provoca o astfel de rearanjare electronică sunt un acid și o bază. Cu toate acestea, este imposibil să se creeze simultan concentrații mari ale ambelor componente în aceeași soluție, deoarece se neutralizează reciproc. În molecula proteică a enzimei datorită consolidare nu are loc nicio reacție de neutralizare directă pe situsul catalitic al grupărilor electrofile și nucleofile. Aceasta, de fapt, determină actul de cataliză. Fiind la o anumită distanță una de cealaltă, grupările electrofile și nucleofile ale situsului catalitic al enzimei nu se leagă numai de grupările de reacție ale substratului, dar exercită și un puternic efect de polarizare asupra grupurilor de substrat. La aceasta ar trebui adăugată posibilitatea fluctuațiilor de sarcină în complexul ES, ceea ce creează un grad ridicat de eficiență a acestei polarizări. Acesta este motivul scăderii energiei de activare în timpul catalizei enzimatice.
Conform teoriei covalentcataliză unele enzime interacționează cu substraturile lor pentru a forma complexe enzimă-substrat instabile, legate covalent. Din acești complecși, în cursul reacției ulterioare, se formează produse de reacție și mult mai rapid decât în cazul reacțiilor necatalizate.
Astfel, a treia etapă, care se încheie cu formarea produselor de reacție, este asigurată de procesele care au loc în etapele anterioare.
CARACTERISTICI GENERALE ALE ENZIMELOR
Enzimele sunt catalizatori biologici.
Natura chimică a enzimelor. Loc activ al enzimelor.
Mecanismul catalizei enzimatice.
eu. Enzime – catalizatori biologici de natura proteica, capabili sa accelereze de multe ori reactiile chimice care au loc in organism, dar nu fac parte din produsele finale ale reacției.
Substanțele asupra cărora acționează o enzimă se numesc substraturi.
Întreaga varietate de reacții biochimice care apar la microorganisme, plante și animale este catalizată de enzimele corespunzătoare. Rolul enzimelor în tehnologia alimentară este mare. Producția oricărui produs alimentar se bazează fie pe procese biochimice (enzimatice), fie pe procese fizico-chimice, sau aceste procese sunt interdependente.
Spre deosebire de catalizatorii anorganici, enzimele au propriile lor caracteristici:
Viteza catalizei enzimatice este cu câteva ordine de mărime mai mare (de la 103 la 109) decât cea a unui catalizator nebiologic;
acțiunea fiecărei enzime este foarte specifică; fiecare enzimă acționează numai asupra propriului substrat sau a unui grup de substraturi înrudite;
enzimele catalizează reacțiile chimice în condiții blânde, de ex. la presiune normală, temperatură ridicată (20-50С) și la valori ale pH-ului mediului, în majoritatea cazurilor apropiate de neutru.
Din punctul de vedere al localizării enzimelor în celulă, acestea sunt împărțite în extracelulare și intracelulare.
Extracelular enzimele sunt secretate de celulele vii în mediu, intracelular - se gasesc fie in organele celulare, fie in complex cu structuri supramoleculare.
Un grup special de enzime este alcătuit din complexe polienzimatice, care includ o serie de enzime care catalizează reacții succesive de transformare a oricărui substrat. Aceste complexe sunt localizate în structuri intramoleculare în așa fel încât fiecare enzimă să fie situată în imediata apropiere a enzimei care catalizează reacția în lanțul acestei secvențe de reacții. Datorită acestei aranjamente a enzimelor, procesul de difuzie a substratului și a produselor de reacție este minimizat.
II. Enzimele sunt compuși proteici cu greutate moleculară mare.
Ca și alte proteine, enzimele au 4 niveluri de structură, au toate proprietățile fizico-chimice ale proteinelor și o singură trăsătură distinctivă este capacitatea de a accelera reacțiile chimice. Enzimele pot fi simple - cu o singură componentă și complexe cu două componente.
Enzime cu un singur component - sunt construite din lanțuri polipeptidice și în timpul hidrolizei se descompun numai în aminoacizi.
Enzime cu două componente - alcatuit din proteine apoformentși partea neproteică - cofactor. Ambele componente separat sunt lipsite de activitate enzimatică. Doar prin unirea împreună holoenzima) dobândesc proprietăţi caracteristice biocatalizatorilor. Rolul unui cofactor poate fi îndeplinit de orice ion (Zn 2+ , Mg 2+ , Fe 2+ , Cu 2+ , mai rar K + și Na +) sau un compus organic (vitamine, nucleotide). Se numesc cofactorii organici coenzime.
Tipul de conexiune dintre cofactor și apoenzimă poate fi diferit. În unele cazuri, ele există separat și sunt asociate numai în timpul reacției; în alte cazuri, cofactorul și apoenzima sunt conectate permanent, uneori prin legături puternice, covalente.
Loc activ al enzimelor este o regiune locală a moleculei de enzimă care este implicată în actul de cataliză. ÎN monocomponentÎn enzime, centrul activ se formează ca urmare a unei anumite orientări a resturilor de aminoacizi ale lanțului polipeptidic. De obicei, la formarea sa ia parte o cantitate mică de aminoacizi, în intervalul 12-16. Grupările funcționale ale acestor aminoacizi pot aparține legăturilor lanțului polipeptidic, îndepărtate unele de altele. Convergența lor este asociată cu formarea structurii terțiare a enzimei.
ÎN bicomponentÎn enzime, centrul activ este un complex de cofactor și unele reziduuri de aminoacizi adiacente.
În centrul activ există a lua legatura(ancoră) un sit a cărui funcție este de a lega substratul și catalitic - unde transformarea substratului în produşi de reacţie are loc după legarea acestuia de către locul de contact. Următoarele grupări funcționale iau parte la formarea acestor situsuri: grupări COOH ale aminoacizilor dicarboxilici sau grupări terminale ale lanțului polipeptidic; gruparea imidazolului histidinei; gruparea OH a seriinei, NH2 - gruparea lizină și grupările terminale ale lanțului polipeptidic; grupa fenolică a tirozinei și reziduurile hidrofobe ale aminoacizilor alifatici.
III. Se determină viteza oricărei reacții enzimatice energiebarieră, care trebuie depășit de moleculele care reacţionează. Potrivit lui Arrhenius, o reacție chimică din punctul de vedere al energiei procesului este descrisă de ecuație
N \u003d N 0 e - (E act / RT),
unde N este numărul de molecule active, N 0 este numărul total de molecule care reacţionează; e este baza logaritmului natural; R este constanta gazului; T este temperatura absolută; E act - energie de activare.
Energie activatoare este cantitatea suplimentară de energie necesară tuturor moleculelor pentru a depăși bariera energetică a reacției și a intra în ea. Această energie este diferența dintre energia totală a moleculelor care reacţionează și energia stare de tranziție excitată. Cu cât energia de activare este mai mare în sistemul de reacție, cu atât bariera energetică este mai mare și viteza de reacție este mai mică.
Cea mai importantă funcție a unei enzime este scăderea energiei de activare proces catalizat. Pe fig. 1 prezintă un grafic al modificării energiei neenzimatice (1) și enzimatic (2) reactii. Enzima coboară înălțimea barierei energetice (E act E act).
Mecanismul catalizei enzimatice rămâne în mare parte neexplicat. Cu toate acestea, munca lui M. Michaelis și M. Menten, care au dezvoltat ideea de complex enzima-substrat. Formarea acestui complex duce la o scădere a energiei de activare a reacției.
Procesul de cataliză enzimatică poate fi împărțit în trei etape:
Legarea sterica a substratului S la locul activ al enzimei E (formarea complexului enzima-substrat ES).
Transformarea complexului primar ES într-un complex tranzitoriu activat ES ≠ .
Separarea produsului final P al reacției de enzimă.
Prima etapă este scurtă în timp și depinde de concentrația substratului și a enzimei în mediu, de viteza de difuzie a substratului la locul activ al enzimei. În formarea complexului ES, atât legăturile covalente, de coordonare, ionice, cât și formele mai puțin puternice de legături - atracția electrostatică a grupurilor polare, forțele van der Waals de adeziune între regiunile nepolare ale moleculelor, legăturile de hidrogen pot participa la diverse combinatii. Natura acestor legături este determinată de caracteristicile chimice atât ale substratului, cât și ale grupărilor funcționale care alcătuiesc centrul activ al enzimei.
A doua etapă este, de fapt, un act de cataliză, adică. un act de ruptură sau formare de noi legături în substrat; este cel mai lent și limitează viteza unei reacții chimice. În această etapă, energia de activare a reacției enzimatice scade din cauza formarea unui complex de tranziție activ ES ≠ .
La nivel molecular, o înțelegere mai clară a mecanismului de acțiune al enzimelor oferă teoria catalizei acido-bazice. Orice reacție care rupe legăturile covalente implică participarea a două componente electronice opuse. Electronii legăturii rupte trebuie atrași de componenta electrofilă și departe de cea nucleofilă. Reactivii care ar putea provoca o astfel de rearanjare electronică sunt un acid și o bază. Cu toate acestea, este imposibil să se creeze simultan concentrații mari ale ambelor componente în aceeași soluție, deoarece se neutralizează reciproc. În molecula proteică a enzimei datorită consolidare nu are loc nicio reacție de neutralizare directă pe situsul catalitic al grupărilor electrofile și nucleofile. Aceasta, de fapt, determină actul de cataliză. Fiind la o anumită distanță una de cealaltă, grupările electrofile și nucleofile ale situsului catalitic al enzimei nu se leagă numai de grupările de reacție ale substratului, dar exercită și un puternic efect de polarizare asupra grupurilor de substrat. La aceasta ar trebui adăugată posibilitatea fluctuațiilor de sarcină în complexul ES, ceea ce creează un grad ridicat de eficiență a acestei polarizări. Acesta este motivul scăderii energiei de activare în timpul catalizei enzimatice.
Conform teoriei covalentcataliză unele enzime interacționează cu substraturile lor pentru a forma complexe enzimă-substrat instabile, legate covalent. Din acești complecși, în cursul reacției ulterioare, se formează produse de reacție și mult mai rapid decât în cazul reacțiilor necatalizate.
Astfel, a treia etapă, care se încheie cu formarea produselor de reacție, este asigurată de procesele care au loc în etapele anterioare.
Cinetica enzimatică studiază influența diverșilor factori (concentrația S și E, pH, temperatură, presiune, inhibitori și activatori) asupra vitezei reacțiilor enzimatice. Scopul principal al studierii cineticii reacțiilor enzimatice este obținerea de informații care să permită o înțelegere mai profundă a mecanismului de acțiune al enzimelor.
Curba cinetică vă permite să determinați viteza de reacție inițială V 0 .
Curba de saturație a substratului.
Dependența vitezei de reacție de concentrația enzimei.
Dependența vitezei de reacție de temperatură.
Dependența vitezei de reacție de pH.
|
|
pH-ul optim pentru acțiunea majorității enzimelor se află în el valori fiziologice 6,0-8,0. Pepsina este activă la pH 1,5-2,0, ceea ce corespunde acidității sucului gastric. Arginaza, o enzimă hepatică specifică, este activă la 10,0. Influența pH-ului mediului asupra vitezei reacției enzimatice este asociată cu starea și gradul de ionizare a grupărilor ionogene din molecula enzimei și substratului. Acest factor determină conformația proteinei, starea centrului activ și a substratului, formarea complexului enzimă-substrat și procesul de cataliză în sine. |
Descrierea matematică a curbei de saturație a substratului, constanta Michaelis .
|
|
Ecuația care descrie curba de saturație a substratului a fost propusă de Michaelis și Menton și poartă numele lor (ecuația Michaelis-Menten): V = (V MAX *[ S])/(km+[ S]) , unde Km este constanta Michaelis. Este ușor de calculat că pentru V = V MAX /2 Km = [S], adică. Km este concentrația substratului la care viteza de reacție este ½ V MAX. Pentru a simplifica determinarea V MAX și Km, ecuația Michaelis-Menten poate fi recalculată. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
1/ V = km/ V MAX *1/[ S] + 1/ V MAX ecuația Lineweaver-Burk. Ecuația care descrie graficul Lineweaver-Burk este ecuația unei linii drepte (y = mx + c), unde 1/V MAX este segmentul interceptat de linia dreaptă pe axa y; Km/V MAX - tangenta pantei dreptei; intersectia dreptei cu axa x da valoarea 1/Km. Graficul Lineweaver-Burk permite determinarea Km dintr-un număr relativ mic de puncte. Acest grafic este folosit și la evaluarea efectului inhibitorilor, așa cum va fi discutat mai jos. Valorile Km variază într-un interval larg: de la 10 -6 mol/l pentru enzimele foarte active până la 10 -2 pentru enzimele inactive. |
Estimările Km sunt de valoare practică. La concentrații de substrat de 100 de ori Km, enzima va funcționa aproape la viteza maximă, astfel încât rata maximă V MAX va reflecta cantitatea de enzimă activă prezentă. Această circumstanță este utilizată pentru a evalua conținutul de enzimă din preparat. În plus, Km este o caracteristică a enzimei, care este utilizată pentru a diagnostica enzimopatiile.
Inhibarea activității enzimatice.
O caracteristică extrem de caracteristică și importantă a enzimelor este inactivarea lor sub influența anumitor inhibitori.
Inhibitori - Sunt substanțe care provoacă inhibarea parțială sau completă a reacțiilor catalizate de enzime.
Inhibarea activității enzimatice poate fi ireversibilă sau reversibilă, competitivă sau necompetitivă.
inhibiție ireversibilă - aceasta este o inactivare persistentă a enzimei rezultată din legarea covalentă a unei molecule inhibitoare în situsul activ sau într-un alt situs special care modifică conformația enzimei. Este practic exclusă disocierea unor astfel de complexe stabile cu regenerarea enzimei libere. Pentru a depăși consecințele unei astfel de inhibiții, organismul trebuie să sintetizeze noi molecule de enzime.
Inhibare reversibilă – se caracterizează prin complexarea de echilibru a inhibitorului cu enzima datorită legăturilor necovalente, în urma căreia astfel de complexe sunt capabile să se disocieze cu restabilirea activității enzimatice.
Clasificarea inhibitorilor în competitivi și necompetitivi se bazează pe atenuarea ( inhibiție competitivă ) sau nu este slăbit ( inhibiție necompetitivă ) acţiunea lor inhibitoare cu creşterea concentraţiei substratului.
Inhibitori competitivi sunt, de regulă, compuși a căror structură este similară cu cea a substratului. Acest lucru le permite să se lege în același loc activ ca și substraturile, prevenind interacțiunea enzimei cu substratul aflat deja în stadiul de legare. Odată legat, inhibitorul poate fi transformat într-un produs sau poate rămâne în situsul activ până când apare disocierea.
Inhibarea competitivă reversibilă poate fi reprezentat sub formă de diagramă:
E↔ E-I → E + P 1
S (inactiv)
Gradul de inhibare a enzimei este determinat de raportul dintre concentrațiile de substrat și enzime.
Un exemplu clasic al acestui tip de inhibiție este inhibarea activității succinat dehidrogenazei (SDH) de către malat, care înlocuiește succinatul de la locul substratului și previne conversia acestuia în fumarat:

Legarea covalentă a inhibitorului la locul activ are ca rezultat inactivarea enzimei (inhibare ireversibilă). Un exemplu inhibiție competitivă ireversibilă poate servi inactivarea triozofosfat izomerazei de către 3-cloroacetolfosfat. Acest inhibitor este un analog structural al substratului, dihidroxiacetona fosfat, și se atașează ireversibil la reziduul de acid glutamic din situsul activ:
Unii inhibitori acționează mai puțin selectiv, interacționând cu un anumit grup funcțional din centrul activ al diferitelor enzime. Astfel, legarea iodoacetatului sau amidei sale de grupa SH a aminoacidului cisteină, care este situat în centrul activ al enzimei și participă la cataliză, duce la o pierdere completă a activității enzimatice:
R-SH + JCH2COOH → HJ + R-S-CH2COOH
Prin urmare, acești inhibitori inactivează toate enzimele care au grupări SH implicate în cataliză.
Inhibarea ireversibilă a hidrolazelor sub acțiunea gazelor nervoase (sarin, soman) se datorează legăturii lor covalente la reziduul de serină din centrul activ.
Metoda de inhibiție competitivă și-a găsit o largă aplicare în practică medicală. Medicamentele sulfanilamide - antagoniști ai acidului p-aminobenzoic, pot servi ca exemplu de inhibitori competitivi metabolizabili. Se leagă de dihidropterat sintetaza, o enzimă bacteriană care transformă p-aminobenzoatul în acid folic, care este necesar pentru creșterea bacteriilor. Bacteria moare ca urmare a faptului că sulfanilamida legată este transformată într-un alt compus și acid folic nu este format.
Inhibitori necompetitivi de obicei se leagă de molecula de enzimă la un loc diferit de locul de legare a substratului, iar substratul nu concurează direct cu inhibitorul. Deoarece inhibitorul și substratul se leagă de centri diferiți, se pot forma atât complexul E-I cât și complexul S-E-I. Complexul S-E-I se descompune, de asemenea, pentru a forma un produs, dar cu o rată mai lent decât E-S, astfel încât reacția va încetini, dar nu se va opri. Astfel, pot avea loc următoarele reacții paralele:
E↔ E-I ↔ S-E-I → E-I + P
Inhibarea reversibilă necompetitivă este relativ rară.
Se numesc inhibitori necompetitivi alosterică spre deosebire de competitiv izosterică ).
Inhibarea reversibilă poate fi studiată cantitativ pe baza ecuației Michaelis-Menten.
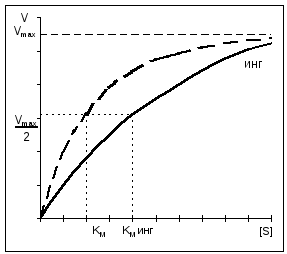
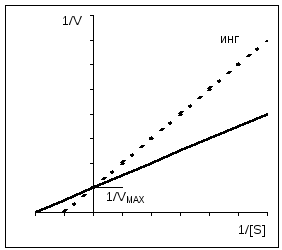
Cu inhibiția competitivă, V MAX rămâne constantă, în timp ce Km crește.
|
|
|
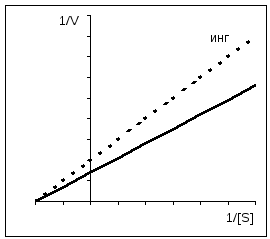
Cu inhibiția necompetitivă, V MAX scade cu Km neschimbat.
|
|
|
Dacă produsul de reacție inhibă enzima care catalizează formarea acesteia, se numește această metodă de inhibare retroinhibarea sau inhibarea feedback-ului . De exemplu, glucoza inhibă glucoza-6-fosfataza, care catalizează hidroliza glucozei-6-fosfatului.
Semnificația biologică a acestei inhibiții este reglarea anumitor căi metabolice (vezi sesiunea următoare).
PARTEA PRACTICĂ
Temă către studenți
1. Să studieze denaturarea proteinelor sub acţiunea soluţiilor de acizi minerali şi organici şi la încălzire.
2. Detectați coenzima NAD în drojdie.
3. Determinați activitatea amilazei în urină (serul de sânge).
9. STANDARDE DE RĂSPUNSURI LA SARCINI, întrebări de testare utilizate în controlul cunoștințelor la clasă (pot fi sub forma unei aplicații)
10. NATURA ȘI SCOPUL POSIBILELOR LUCRĂRI DE FORMARE ȘI CERCETARE PE TEMA
(Indicați în mod specific natura și forma UIRS: pregătirea prezentărilor de rezumate, cercetare independentă, joc de simulare, înregistrarea unui istoric medical folosind literatura monografică etc. formulare)
Trimiteți-vă munca bună în baza de cunoștințe este simplu. Utilizați formularul de mai jos
Studenții, studenții absolvenți, tinerii oameni de știință care folosesc baza de cunoștințe în studiile și munca lor vă vor fi foarte recunoscători.
Găzduit la http://www.allbest.ru/
ABSTRACT
Enzime și reacții enzimatice
Enzime
Activitate enzimatică
Specificitatea de reacție și substrat
Clasele de enzime
Cataliza enzimatică
Cinetica reacțiilor enzimatice
Inhibitori
Analiza enzimatică
proprietate reacție cataliză enzimă
Enzime
Enzimele sunt biocatalizatori, adică substanţe de origine biologică care accelerează reacţiile chimice. O secvență organizată de procese metabolice este posibilă cu condiția ca fiecare celulă să fie prevăzută cu propriul set de enzime specificat genetic. Numai în această condiție se realizează o secvență de reacție consistentă. Enzimele sunt, de asemenea, implicate în reglarea multor procesele metabolice, asigurându-se astfel că metabolismul corespunde condițiilor modificate. Aproape toate enzimele sunt proteine. Cunoscut și ca activ catalitic acizi nucleici- ribozime.
Activitate enzimatică
Acțiunea catalitică a enzimei, adică a acesteia activitate, determinată în condiții standard de creșterea vitezei (Violetîn diagramă) a reacției catalitice ( culoare portocalie) comparativ cu cele necatalitice ( galben). Viteza de reacție este de obicei exprimată ca modificarea concentrației unui substrat sau a unui produs pe unitatea de timp(mol/(l s)) . Deoarece activitatea catalitică nu depinde de volumul soluției în care are loc reacția, activitatea enzimei este exprimată în termeni de katalakh; 1 pisică este cantitatea de enzimă care transformă 1 mol de substrat în 1 s. O altă unitate de activitate este unitate internațională(E) este cantitatea de enzimă care transformă 1 µmol de substrat în 1 min. (1 E = 16,7 ncat).
Specificitatea de reacție și substrat
Acțiune majoritară enzimeînalt specific. Conceptul de specificitate se referă nu numai la tipurile de reacții catalitice ( specificitatea reacției), dar și la natura compușilor - substraturi ( specificitatea substratului). Ca exemplu, diagrama prezintă enzimele care scindează o legătură chimică. Enzimele foarte specifice (tip A - rândul de sus al tabelului) catalizează clivajul unui singur tip de legătură în substraturi cu o anumită structură. Enzimele de tip B (rândul din mijloc) au specificitate de reacție limitată, dar specificitate largă de substrat. Enzimele de tip B (cu reactivitate scăzută și specificitate scăzută pentru substrat; rândul de jos) sunt rare.
Clasele de enzime
Până în prezent, sunt cunoscute aproximativ 2.000 de enzime diferite. Sistemul de clasificare dezvoltat ia în considerare reacția și specificitatea substratului enzimelor. Toate enzimele sunt incluse în Catalogul de enzime sub lor numărul de clasificare(KF), format din patru cifre. Prima cifră indică apartenența la unul dintre șase clase principale. Următoarele două identifică subclasa și subsubclasa, iar ultima cifră este numărul enzimei din acea subsubclasă. De exemplu, lactat dehidrogenaza are numărul CF 1.1.1.27 (clasa 1, oxidoreductaze; subclasa 1.1, donator electron - CH-OH; subsubclasa 1.1.1, acceptor-- NADP +.)
Fiecare dintre cele șase clase principale combină enzime cu aceeași specificitate de reacție. DESPRExidoreductazăs(clasa 1) catalizează reacțiile redox. Transferaze(clasa 2) transfera una sau alta grupa functionala de la un substrat la altul. Oxidoreductazele și transferazele necesită o coenzimă comună. Hidrolazele(clasa 3) sunt, de asemenea, implicați în transferul de grup, dar acceptorul aici este întotdeauna o moleculă de apă. Legătura(clasa 4, numite uneori „sinteze”) catalizează scindarea sau formarea compușilor chimici, în timp ce formarea sau dispariția dublelor legături.
Izomeraze(clasa 5) mută grupuri într-o moleculă fără a se schimba formula generala substrat. Ligaze(„sinteze”, clasa 6) catalizează reacțiile de adiție dependente de energie și, prin urmare, acțiunea lor este asociată cu hidroliza nucleozidului trifosfat (cel mai adesea ATP).
Cataliza enzimatică
Enzime - foarte eficiente catalizatori. Ele măresc viteza reacției catalizate de 1012 ori sau mai mult. Pentru a înțelege mecanismul catalizei enzimatice, este util în primul rând să luăm în considerare cursul unei reacții necatalitice.
Reacție non-catalitică (în absența enzimei)
Ca exemplu, luați în considerare o reacție de tip A + B > C + D. Substanțe A și B în soluție sunt înconjurate de un înveliș de molecule de apă (coaja hidratată)și se deplasează aleatoriu sub influența mișcării termice. Ei pot reacționa unul cu celălalt doar atunci când se ciocnesc într-o orientare favorabilă, ceea ce este puțin probabil și se întâmplă rar.
Pentru formarea produselor C + D complex A--B, care rezultă din ciocnirea moleculelor, ar trebui să se formeze stare de tranziție, care necesită de obicei o semnificativă energia de activare E A. Deoarece doar o mică parte poate primi această energie complexe A--B, realizarea unei stări de tranziție este un caz și mai rar decât apariția unui complex. În soluție, cea mai mare parte a energiei de activare este cheltuită depășirea cochiliilor hidratate intre A si B, abordarea reactivilorȘi alte procese chimiceîn care sunt implicaţi aceşti reactanţi. Ca urmare, în absența unui catalizator, formarea de produse are loc extrem de rar și viteza de reacție v este nesemnificativă, chiar și atunci când reacția este admisibilă termodinamic, adică DG< 0
reactie enzimatica
Enzimele leagă în mod specific reactanții (substraturile lor) în centru activ. În acest caz, substraturile sunt orientate în așa fel încât să dobândească poziția optimă pentru formarea stării de tranziție (1-3). ApropiereȘi orientarea necesară reactivii cresc semnificativ probabilitatea formării complex productiv A-B. În plus, legarea substratului în locul activ duce la îndepărtarea învelișului de hidratare a substratului. îndepărtarea moleculelor de apăîn centrul activ al enzimei în timpul catalizei, se creează condiții complet diferite decât în soluție (3-5). O alta un factor important se datorează interacțiunii dintre resturile de aminoacizi ale proteinei și substratul (4). Astfel, starea de tranziție în cazul unei reacții enzimatice necesită o energie de activare mai mică. În plus, multe enzime transferă grupări specifice de la sau către un substrat în timpul catalizei. Transferul de protoni este deosebit de comun. Acest enzimatic cataliză acido-bazică mult mai eficient decât schimbul de protoni cu acizi și baze în soluție. Adesea, grupările chimice sunt atașate covalent la reziduurile de enzime. Acest fenomen se numește cataliză covalentă.. Fundamentele catalizei enzimatice
Deși în prezent este dificil de cuantificat contribuția efectelor catalitice individuale, factorul decisiv este considerat a fi stabilizarea stării de tranziție la locul activ al enzimei. În acest caz, punctul cel mai semnificativ este legarea puternică nu atât a substratului, cât a stării sale de tranziție. Această afirmație este confirmată de afinitatea extrem de mare a multor enzime pentru analogii stării de tranziție, care poate fi explicată printr-o analogie mecanică simplă (în diagrama din dreapta): dacă doriți să rulați bile de metal (reactivi) din locul EA (substrat). stare) la o stare de tranziție mai mare din punct de vedere energetic, iar apoi în EP (starea produsului), trebuie să poziționați magnetul (catalizatorul) în așa fel încât forța de atracție să nu acționeze asupra EA (a), ci asupra stării de tranziție ( b).
Cinetica reacțiilor enzimatice
Cinetica reacția enzimatică (adică dependența vitezei de reacție de condițiile sale) este determinată în primul rând proprietățile catalizatorului, drept urmare este mult mai complicată decât cinetica reacțiilor necatalitice
Modelul Michaelis-Menten
O analiză matematică completă a reacției enzimatice duce la ecuații complexe nu este potrivit pentru aplicație practică. Cel mai convenabil s-a dovedit cel mai simplu model dezvoltat în 1913. El explică dependența hiperbolică caracteristică a activității enzimei de concentrația substratului (1) și face posibilă obținerea unor constante care caracterizează cantitativ eficiența enzimei.
Modelul Michaelis-Menten decurge din faptul că la început substratul A formează un complex cu enzima E (3), care se transformă în produsul B mult mai repede decât în absența enzimei. Constanta de viteză k cat (2) este mult mai mare decât constanta de reacție necatalitică k. Pisica constantă k se mai numește și „ numărul de revoluții”deoarece corespunde numărului de molecule de substrat transformate într-un produs de către o moleculă de enzimă în 1 s. Conform acestui model, activitatea enzimei este determinată de proporția complexului EA în concentrația totală a enzimei [E]t, adică raportul / [E]t (3). De dragul simplității, modelul presupune că E, A și EA sunt în echilibru chimic conform legii acțiunii în masă, care are ca rezultat următoarea ecuație pentru disocierea complexului EA:
[E][A]/ = K m Deoarece [E] t = [E] + ,
\u003d [E] t [A] / (K m + [A])
Din v = k cat (2) și din expresia anterioară se obține Ecuația Michaelis-Menten (4).
Ecuația conține două mărimi ( doi parametri), care nu depind de concentrația substratului [A], ci caracterizează proprietățile enzimei: acesta este produsul k cat [E] t corespunzător lui viteza maximă de reacție V la concentrație mare de substrat și MichaelisK constantă m caracterizarea afinitate enzimă către substrat. Constanta Michaelis este numeric egală cu acea concentrație de substrat [A] m = [A]). Afinitatea mare a enzimei pentru substrat se caracterizează prin valoare mica la m și invers,
Modelul Michaelis-Menten se bazează pe câteva ipoteze nu în întregime realiste, cum ar fi conversia ireversibilă a EA în E + B, realizarea unui echilibru între E, A și EA, absența altor forme de enzimă în soluție, cu excepția pentru E și EA. Numai sub rezerva acestor condiţii ipotetice K m corespunde constantei de disociere a complexului, iar k cat este constanta de viteză a reacției EA > E + B.
Definiția lui V și K m
În principiu, V și K m pot fi determinate din graficul lui v față de [A] (fig. stânga). Din moment ce v asimptotic atinge V cu creșterea concentrației substratului [A], este dificil să se obțină o valoare sigură a V și K m (fig. stânga) prin extrapolare.
Pentru comoditatea calculelor, ecuația Michaelis-Menten poate fi transformată astfel încât punctele experimentale să se afle pe o dreaptă. Cu una dintre aceste transformări grafice în așa-numita Diagrama Eady-Hofsty(fig. din dreapta) plot v versus v/[A]. În acest caz, punctul de intersecție al dreptei obținute prin cea mai bună aproximare liniară a punctelor experimentale cu axa y corespunde lui V, iar tangentei unghiului de pantă este egală cu -K m . O astfel de abordare grafică a zilei determinării V și K m nu este, de asemenea, optimă. În prezent, datele cineticii enzimatice sunt procesate mai rapid și mai obiectiv cu ajutorul tehnologiei computerizate.
Inhibitori
Mulți compuși pot influența metabolismul prin modularea activității enzimelor corespunzătoare. In mod deosebit caracteristici importanteîn timpul performanţei inhibitori ai enzimelor. Mulți inhibitori de enzime sunt substante medicinale origine naturală sau sintetică. metaboliți pot fi și inhibitori ai enzimelor în procesele de reglare.
Tipuri de inhibiție
Majoritatea inhibitorilor de enzime funcționează reversibil, adică nu introduc modificări în molecula de enzimă după disocierea lor. Cu toate acestea, există și ireversibil inhibitori enzimatici care modifică ireversibil enzima țintă. Cum funcționează inhibitorul tip de inhibiție determinată prin compararea cineticii reacției în prezența inhibitorilor fără ea (vezi schema B). Distinge competitiv(A, stânga) și necompetitiv(Ah corect) inhibitie. joacă un rol important în reglarea metabolismului inhibarea alosterică(A, 6).
Așa-zisul analogi de substrat(2) au proprietăți similare cu cele ale substratului enzimei țintă. Ele blochează în mod reversibil unele dintre moleculele de enzime disponibile, dar nu mai pot fi transformate într-un produs. Prin urmare, pentru a atinge jumătate din viteza maximă de reacție, mai mult de înalt concentrația substratului: în prezența unui astfel de inhibitor, constanta Michaelis Km crește (B). Substratul în concentratii mari deplasează inhibitorul din enzimă. Prin urmare, viteza maximă V nu se modifică la acest tip de frânare. Deoarece substratul și inhibitorul concurează pentru locul de legare al enzimei, tipul dat se numeste franare competitiv. Analogii de stare de tranziție(3) acționează și ca inhibitori competitivi.
Dacă inhibitorul reacţionează cu un funcţional un grup important enzimă fără a interfera cu legarea substratului, se numește o astfel de inhibare necompetitiv(pe diagrama din dreapta). În acest caz, K m rămâne neschimbat, dimpotrivă, concentrația enzimei active funcțional [E] t scade și, în consecință, viteza maximă de reacție V. Inhibitorii necompetitivi acționează de regulă. ireversibil deoarece modifică grupele funcționale ale enzimei țintă (4).
În cazul așa-numitului substraturi suicidare" (5) vorbim despre analogii de substrat care conțin o grupare reactivă suplimentară. Inițial, se leagă reversibil și apoi formează o legătură covalentă cu locul activ al enzimei. Prin urmare, inhibarea de către astfel de compuși se manifestă ca necompetitiv. Un exemplu binecunoscut al unui astfel de inhibitor este antibioticul penicilină.
Inhibitori alosterici se leagă de situsurile individuale ale enzimei în afara centrului activ (6). Această legătură presupune modificări conformaționaleîn molecula de enzimă, ceea ce duce la scăderea activității acesteia. Efectele alosterice apar aproape exclusiv în cazul enzime oligomerice. Cinetica unor astfel de sisteme nu poate fi descrisă folosind un model simplu Michaelis-Menten.
Cinetica inhibiției
Inhibarea competitivă poate fi ușor distinsă de inhibarea necompetitivă prin utilizare Grafica Easy-Hofsty. După cum sa menționat deja, competitiv inhibitorii afectează doar K m dar nu și V. Liniile drepte obținute în absența și prezența inhibitorului se intersectează pe axa y. Direct pentru necompetitiv inhibiția au aceeași pantă (K m nu se modifică), totuși, pe măsură ce concentrația inhibitorului crește, segmentele tăiate de aceste linii drepte pe axa y devin din ce în ce mai scurte. Pentru enzimele alosterice, graficul Eady-Hofsti nu poate fi utilizat, care în acest caz este neliniar (nu este prezentat aici).
Analiza enzimatică
Enzimele joacă un rol important în analiza biochimică . În materialele biologice, cum ar fi fluidele corporale, enzimele pot fi detectate în concentrații neglijabile prin măsurarea activității catalitice. Enzimele pot fi folosite ca reactivi pentru a determina concentrațiile metaboliților, cum ar fi nivelurile de glucoză din sânge (Schema B). Majoritatea testelor enzimatice folosesc fotometria.
Fundamentele spectrofotometriei
multe molecule absorbi lumina în regiunea vizibilă sau ultravioletă a spectrului. Această proprietate poate fi utilizată pentru a determina concentrațiile. Cantitatea de absorbție depinde de tipul și concentrația substanței, precum și de lungimea de undă a luminii utilizate. Prin urmare, aplicați lumină monocromatică, adică lumină cu o anumită lungime de undă, care poate fi separată de lumina albă folosind monocromator. Lumina monocromatică de intensitate I 0 trece printr-o celulă dreptunghiulară din sticlă sau cuarț (cuvetă) care conține o soluție dintr-o substanță absorbantă. Intensitatea I a luminii emise, atenuată prin absorbție, se măsoară cu ajutorul unui detector. absorbția luminii(O solutie ( densitate optica) este definit ca logaritmul negativ al raportului I / I 0 . Legea Lambert-Beer afirmă că A este proporțională cu concentrația (c) a substanței și cu grosimea (d) a stratului de soluție. coeficientul de extincțiee depinde, după cum sa menționat mai sus, de tipul de substanță și de lungimea de undă.
Determinarea activității lactat dehidrogenazei
Determinarea activității lactat dehidrogenazei [LDH (LDH)] se bazează pe faptul că coenzima redusă NADH + H + absoarbe lumina la 340 nm, în timp ce NAD + (NAD +) nu absoarbe la această lungime de undă. Spectre de absorbție(adică, grafice ale dependenței lui A de lungimea de undă) a substratului și a coenzimei în reacția LDH sunt prezentate în fig. B1.
Diferențele de absorbție a NAD+ și NADH între 300 și 400 nm se datorează modificărilor inelului de nicotinamidă în timpul oxidării sau reducerii.
Pentru a determina activitatea, în primul rând, în cuvă se pun soluții de lactat și NAD+ și se înregistrează absorbția la lungime constantă unde 340 nm. Reacția necatalitică se desfășoară cu o viteză foarte scăzută. Prin urmare, cantități măsurabile de NADH se formează numai după adăugarea LDH. Deoarece rata de creștere a absorbției DA/Dt conform legii Lambert-Beer este proporțională cu viteza reacției Ds/Dt, activitatea LDH poate fi calculată folosind coeficientul de extincție e la 340 nm sau prin comparație cu o soluție standard.
Determinarea enzimatică a glucozei
Majoritatea biomoleculelor nu absorb lumina în regiunile vizibile sau ultraviolete ale spectrului. În plus, sunt de obicei prezenți în amestec cu alți compuși care dau, de asemenea, reacții chimice similare.
Ambele dificultăți pot fi depășite enzimă adecvată pentru ca conversia selectivă a metabolitului să fie determinată într-o substanță colorată, care este determinată în continuare de intensitatea absorbției luminii.
Metoda obișnuită pentru determinarea glicemiei se bazează pe două reacții secvențiale:
1) formarea gluconolactonei și a peroxidului de hidrogen H 2 O 2 sub acțiunea enzimei glucoza oxidaza ;
2) oxidarea unei substanțe incolore cu peroxid de hidrogen la un compus colorat verde într-o reacție catalizată de peroxidază.
Când toată glucoza prezentă în probă a fost epuizată, cantitatea de culoare formată poate fi determinată din absorbția luminii, care este direct proporțională cu conținutul inițial de glucoză.
Găzduit pe Allbest.ru
Documente similare
Accelerarea reacțiilor chimice cu ajutorul catalizatorilor. Caracteristicile enzimelor (enzimelor) ca proteine foarte specifice care îndeplinesc funcțiile catalizatorilor biologici. Structura enzimelor, specificitatea și clasificarea lor. Etapele catalizei enzimatice.
prezentare, adaugat 20.11.2014
Clasificarea enzimelor, funcțiile lor. Convenții de denumire a enzimelor, structura și mecanismul acțiunii lor. Descrierea cineticii reacțiilor enzimatice cu un singur substrat. Modele „key-lock”, corespondență indusă. Modificări, cofactori enzimatici.
prezentare, adaugat 17.10.2012
Caracteristici ale enzimelor, catalizatori organici de natura proteica, care accelereaza reactiile necesare functionarii organismelor vii. Condiții de acțiune, producție și utilizare a enzimelor. Boli asociate cu producerea afectată de enzime.
prezentare, adaugat 19.10.2013
Caracteristici generale și principalele tipuri de enzime. Proprietăți chimice enzimelor și reacțiile pe care le catalizează. Selectivitatea și eficiența enzimelor. Dependență de temperatură și mediu de soluție. Locul activ al enzimei. Viteza reacțiilor enzimatice.
prezentare, adaugat 10.06.2014
Definirea enzimelor ca proteine specifice prezente în toate celulele vii ale catalizatorilor biologici. Spațialitatea moleculei structurale a enzimelor, procesul de biosinteză a oxidoreductazei, transferazei, hidrolazei, liazelor, izomerazei și ligazei.
test, adaugat 27.01.2011
Studii cinetice ale reacțiilor enzimatice pentru identificarea enzimelor și compararea ratelor acestora. Formarea unui complex enzimă-substrat dintr-o enzimă și un substrat datorită forțelor natura fizica. Organisme facultative, autotrofe și heterotrofe.
test, adaugat 26.07.2009
Enzime: structura biochimica si rol fiziologic. Analiza metodei de determinare a activității enzimelor și a spectrului enzimatic în fluidele corporale. Principalele enzime din urină sunt normale și patologice. Spectrul enzimatic al urinei în bolile de rinichi.
raport, adaugat 03.10.2015
Studiul enzimelor, proprietățile și mecanismul lor actiune biologica. Efectuarea de cercetări ideile contemporane asupra mecanismului transaminării enzimatice. Dezvoltare teorie generală cataliză piridoxală. Structura complexului enzima-substrat.
rezumat, adăugat 14.03.2015
Proteine specifice care catalizează reacțiile chimice în sistemele vii. Caracteristicile și clasificarea enzimelor, dimensiunea și structura lor. Influența condițiilor de mediu asupra activității enzimatice: factori și cofactori; boli asociate cu o încălcare a producției lor.
prezentare, adaugat 05.07.2015
Studiul scopului enzimelor sau enzimelor - molecule de proteine sau molecule de ARN (ribozime) sau complexe ale acestora care accelerează (catalizează) reacțiile chimice în sistemele vii. Localizarea enzimelor în celulă. Fermentopatie ereditară și dobândită.
Articole similare
-
Când un soț este împotriva unui copil, cum să rămâi însărcinată fără știrea lui?
Uneori poți rămâne însărcinată din neglijență. Pentru a preveni acest lucru, este important să știți cum puteți concepe un copil accidental și ce mijloace puteți utiliza pentru a evita o sarcină nedorită. De asemenea, în acest articol puteți găsi informații despre...
-
Ce pietre și amulete sunt potrivite pentru Taur în funcție de horoscop și data nașterii Talisman de elefant pentru Taur
Aprilie-mai Taurul (21 aprilie - 20 mai) sunt măsurați, nu mofturoși și colosal de productivi! Încăpăţânarea lor de invidiat îi poate aduce pe alţii la mâner, dar ştiu exact ce fac şi de ce au nevoie. Printre aspectele pozitive...
-
Restricții privind accesul la date în roluri 1c
Toate setările pentru drepturile utilizatorului pe care le vom face în cadrul acestui articol se află în secțiunea 1C 8.3 „Administrare” - „Setări pentru utilizatori și drepturi”. Acest algoritm este similar în majoritatea configurațiilor pe...
-
1c pornește un client subțire în loc de unul gros
Platforme: 1C: Enterprise 8.3, 1C: Enterprise 8.2, 1C: Enterprise 8.1 Configurații: Toate configurațiile2012-11-16 21362 Sunt lansate prin specificarea specială...
-
Dovezi despre modalități cunoscute de a fura energie electrică Cum să afli cine fură electricitate
Creșterea tarifelor la energie este una dintre trăsăturile izbitoare ale adâncirii crizei economice. În acest context, furtul de energie electrică și problemele asociate cu detectarea acesteia sunt de o importanță capitală. Modalități de a detecta furtul...
-
Caracteristici de montare prize și întrerupătoare pe diferite suprafețe
Salutări tuturor cititorilor blogului nostru.Astăzi, dragi cititori, vreau să subliniez subiectul cum se instalează prize. Această procedură este foarte des solicitată atunci când înlocuiți o priză veche cu una nouă în cazul unei defecțiuni, când ...