Jak otrzymuje się kwas mlekowy? Właściwości chemiczne i fizyczne kwasu mlekowego. Podręcznik chemiczny kwasu mlekowego
Numer katalogowy kwasu mlekowego: CAS 50-21-5
Opis kwasu mlekowego:
Prawie przezroczysta, lekko żółtawa, higroskopijna, syropowata ciecz o lekko żółtawym zabarwieniu kwaśny zapach, przypominający zapach zsiadłego mleka. Rozpuszczalny w wodzie, etanolu, słabo rozpuszczalny w benzenie, chloroformie i innych węglowodorach halogenowanych. Istnieją różne optycznie czynne izomery D i L. A także optycznie nieaktywna mieszanina D i L. Tę ostatnią otrzymuje się na drodze syntezy chemicznej, a formy aktywne na drodze syntezy bakteryjnej. (metoda enzymatyczna) W organizmie człowieka w cyklu Krepsa bierze udział optycznie czynna forma L, dlatego zaleca się stosowanie go jako dodatku (Kwas mlekowy, E270), w innych gałęziach przemysłu nie ma to wpływu odgrywać szczególną rolę.
Globalna nazwa Kwas mlekowy nie zakorzeniła się w Rosji, ale nazwę jego soli mleczanowych można spotkać wszędzie, znacznie częściej niż kwas mlekowy wapniowy, tniemy mleczan wapnia.
Specyfikacja dla kwasu mlekowego 80%.
Temperatura wrzenia (roztwór 100%) 122 °C (115 mm Hg)
Ciężar właściwy (20 °C) 1,22
Rozpuszczalność w wodzie Całkowicie rozpuszczalny
Gęstość (w 20°C) 1,18-1,20 g/ml
Metale ciężkie, nie więcej niż 0,001%
Zawartość żelaza, nie więcej niż 0,001%
Zawartość arsenu, nie więcej niż 0,0001%
Zawartość chlorków nie więcej niż 0,002% (właściwie 0,0015%)
Zawartość siarczanów nie więcej niż 0,01% (właściwie 0,004%)
Pozostałość po kalcynacji nie więcej niż 0,1% (właściwie 0,06%)
Producent: Chiny
Uszczelka: Beczki 25 kg lub kostki 1200 kg
Podstawowe właściwości fizyczne kwasu mlekowego:
Temperatura topnienia: 17°C Dla nieaktywnych optycznie (racematycznych),
25-26°C postać optycznie czynna + lub -
(różnice temperatur topnienia pozwalają jakościowo i szybko odróżnić droższe formy optycznie aktywne od tańszych nieaktywnych!!)
Gęstość względna(woda = 1): 1,2
Rozpuszczalność w wodzie: mieszalny
Masa cząsteczkowa: 90,08 g/mol
Temperatura zapłonu: 110°C c.c.
Współczynnik podziału oktanol/woda jako log Pow: -0,6
Niebezpieczeństwo wybuchu i pożaru:
Wspomaga spalanie przy normalne warunki. samozapłon jest mało prawdopodobnyUnikaj otwartego ognia i palenia.
Gaszenie: proszkiem, pianą alkoholoodporną, wodą rozpyloną,
dwutlenek węgla.
Stabilność chemiczna: Stabilny o godz normalne temperatury i ciśnienie.
Warunki, których należy unikać: Tworzenie się pyłu, nadmierne ciepło.
Niekompatybilność z innymi materiałami: Silne utleniacze, kwasy mineralne.
Niebezpieczne produkty rozkładu: Tlenki azotu, tlenek węgla, dwutlenek węgla, pary
cyjanek.
Niebezpieczna polimeryzacja: Nie zaznaczone.
Zagrożenie dla ludzi:
Drogi wnikania do organizmu: Substancja może wchłaniać się do organizmu poprzez wdychanie aerozolu i przez usta.
Przy krótkotrwałym narażeniu na stężenia przekraczające MPC: Substancja działa(ją) drażniąco na skórę i Drogi oddechowe, a także ma działanie żrące
wpływ na oczy. Działa żrąco w przypadku połknięcia.
W przypadku kontaktu z oczami: Zaczerwienienie. Ból. Poważne, głębokie oparzenia. Okulary ochronne-maska lub
maska ochronna. Najpierw spłucz duża ilość woda na kilka
minut (usuń szkła kontaktowe, jeśli nie jest to trudne), to udaj się do lekarza.
Standardy obszaru roboczego:
TLV (amerykański TLV) nie został ustalony.
Rakotwórczość: Nie wymieniony przez ACGIH, IARC, NTP ani CA Prop 65.
Epidemiologia: Brak informacji.
Tetratogenność: Brak informacji.
Efekty reprodukcyjne: Brak informacji.
Mutagenność: brak informacji
Neurotoksyczność: Brak informacji.
Eksperymenty na zwierzętach wykazały:
LD50/LC50:
Test Draize’a, królik, oczy: 100 mg Ciężki;
Test Draize’a, królik, skóra: 500 mg/24H Łagodny;
Wdychanie, szczur: LC50 = >26 mg/m(cc)/1H;
Doustnie, mysz: LD50 = 1940 mg/kg;
Doustnie, szczur: LD50 = 1700 mg/kg;
Skóra, królik: LD50 = >10 g/kg;
Uwaga. Podano informację o koncentracie substancji, w małe ilości i stężenia kwasu mlekowego, zgodnie z dostępnymi danymi ten moment dane nieszkodliwe!
Kwas mlekowy(kwas 2-hydroksypropionowy) CH3CH(OH)COOH, masa cząsteczkowa 90,1; bezbarwny. Znane są kwasy L(+)-mlekowy, D(–)-mlekowy (mięsno-mlekowy) i racemiczny kwas mlekowy powstający podczas fermentacji. W przypadku kwasu D, L i D-mlekowego temperatura topnienia odpowiada 18 ° C i 53 ° C; t. bela odpowiednio 85°C/1 mmHg i 103°C/2mmHg; dla kwasu D-mlekowego [α] D 20 -2,26 (stężenie 1,24% w . Dla kwasu D,L-mlekowego D H 0 próbka - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H isp 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Dla kwasu L-mlekowego D H 0 spalanie - 1344,8 kJ/mol; D H 0 obp -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
Ze względu na dużą higroskopijność kwasu mlekowego najczęściej stosuje się jego stężone roztwory wodne – syropowate, bezbarwne, bezwonne. Dla roztwory wodne kwas mlekowy D 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 mPa. s (25 0 C) odpowiednio dla roztworów 45,48 i 85,32%; g 46,0. 10 -3 N/m (25°C) dla 1 M roztworu; e 22 (17°C). Kwas mlekowy jest rozpuszczalny w innych chlorowcowęglowodorach, ale słabo w nich rozpuszczalny; R Ka 3,862 (25°C); pH roztworów wodnych 1,23 (37,3%), 0,2 (84,0%).
Kwas mlekowy odwadnia się do kwasu akrylowego, po podgrzaniu z HBr tworzy kwas 2-bromopropionowy, gdy sól Ca reaguje z chlorkiem PCl 5 lub SOCl 2-2-chloropropionylu. W obecności kwasów mineralnych następuje autoestryfikacja kwasu mlekowego z utworzeniem wzoru I, a także liniowych poliestrów. Kiedy kwas mlekowy reaguje, powstają hydroksykwasy RCH 2 CH(OH)COOH, a gdy kwas mlekowy reaguje z alkoholami, tworzą się estry. Sole i estry kwasu mlekowego nazywane są mleczanami (patrz tabela).
kwas mlekowy powstaje w wyniku działania kwasu mlekowego (podczas zakwaszania mleka, kiszonej kapusty, marynowania warzyw, serów dojrzewających, kiszenia paszy); Kwas D-mlekowy występuje w tkankach zwierząt, roślin, a także w mikroorganizmach.
W przemyśle kwas mlekowy wytwarza się z kwasu 2-chloropropionowego i jego (100°C) lub laktonitrylu CH3CH(OH)CN (100°C, H2SO4) z późniejszym utworzeniem estrów, izolacją i hydrolizą co prowadzi do uzyskania produktu wysokiej jakości. Znane są inne metody wytwarzania kwasu mlekowego: utlenianie propylenu tlenkami azotu (15-20°C), a następnie obróbka H2SO4, oddziaływanie CH3CHO z CO (200°C, 20 MPa).
WŁAŚCIWOŚCI NIEKTÓRYCH MLECZANÓW

stosuje się kwas mlekowy Przemysł spożywczy, w zaciernym barwieniu, w garbarstwie, w fermentowniach jak środek bakteriobójczy, za zdobycie leki, plastyfikatory. Mleczany etylu i butylu stosuje się jako rozpuszczalniki eterów celulozy, olejów schnących, oleje roślinne; mleczan butylu – także jako rozpuszczalnik niektórych polimerów syntetycznych.
Światowa produkcja kwasu mlekowego wynosi 40 tysięcy ton (1983).
Oświetlony.: Holten C.H., Kwas mlekowy. Właściwości i chemia. Kwasy mlekowe i pochodne, Weisheim, 1971. Yu. A. Treger.
Wybierz pierwszą literę w tytule artykułu:
Hydroksykwasy (kwasy alkoholowe) to pochodne kwasów karboksylowych zawierające jedną, dwie lub więcej grup hydroksylowych w rodniku połączonym z karboksylem.
W zależności od liczby grup karboksylowych hydroksykwasy dzielą się na jednozasadowe, dwuzasadowe itp.; W zależności od całkowitej liczby grup hydroksylowych, hydroksykwasy dzielą się na mono- i wielowodorotlenowe.
W zależności od natury rodnika hydroksykwasy są nasycone i nienasycone, acykliczne, cykliczne lub aromatyczne.
W hydroksykwasach występują następujące typy izomerii:
strukturalny(izomeria łańcucha rodnikowego, izomeria względnych pozycji karboksylu i hydroksylu);
optyczny(lustro) ze względu na obecność asymetrycznych atomów węgla.
Hydroksykwasy nazywane są nazwą kwasu z dodatkiem „oksy” lub „dioksy” itp. Powszechnie stosowana jest również trywialna nomenklatura.
HO–CH2–COOH
glikolowy (hydroksyoctowy)
mleko (α-hydroksypropionowe)
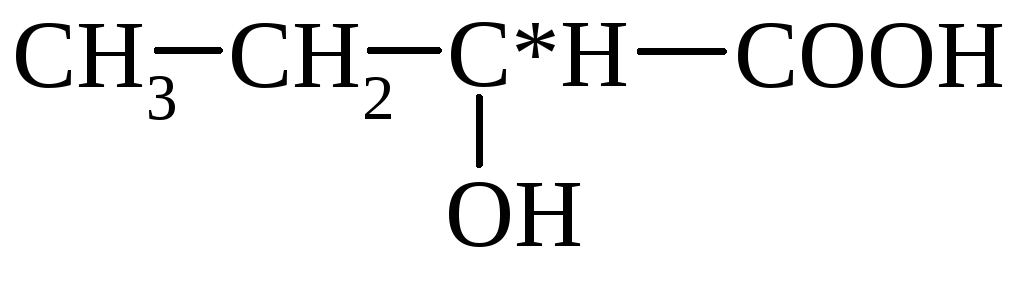

α-hydroksymasłowy β-hydroksymasłowy
(2-hydroksybutan) (3-hydroksybutan)
Właściwości fizyczne. Niższe hydroksykwasy to najczęściej gęste, syropowate substancje. Hydroksykwasy mieszają się z wodą w dowolnym stosunku, a wraz ze wzrostem masy cząsteczkowej rozpuszczalność maleje.
Właściwości chemiczne.
1. Właściwości kwasu– hydroksykwasy dają wszystkie reakcje charakterystyczne dla karboksylu: tworzenie soli, estrów, amidów, halogenków kwasowych itp. Kwasy hydroksylowe są silniejszymi elektrolitami niż odpowiadające im kwasy karboksylowe (efekt grupy hydroksylowej).

2. Właściwości alkoholu– reakcje podstawienia wodoru grupy hydroksylowej, tworzenia eterów i estrów, zastąpienia –OH halogenem, odwodnienie wewnątrzcząsteczkowe, utlenianie.
glioksal glikolu chlorooctowego
kwas kwas kwas
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
ester kwasu glikolowego i alkoholu metylowego
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
eter metylowo-glikolowy
kwas alkoholowy kwas metoksyoctowy
(pełna transmisja)
3. Związek hydroksykwasów z ogrzewaniem - po podgrzaniu α-hydroksykwasy oddzielają się od wody, tworząc cykliczny ester, zbudowany z dwóch cząsteczek α-hydroksykwasów:

laktyd kwasu α-hydroksypropionowego
β-Hydroksykwasy w tych samych warunkach łatwo tracą wodę, tworząc kwasy nienasycone.
HO–CH 2 –CH 2 –COOH 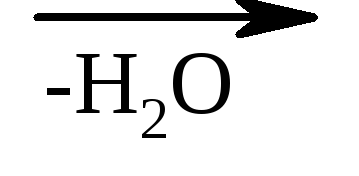 CH2 =CH–COOH
CH2 =CH–COOH
kwas β-hydroksypropionowy akrylowy
γ-hydroksykwasy mogą również tracić cząsteczkę wody, tworząc wewnątrzcząsteczkowe estry - laktony.

HO–CH 2 –CH 2 –CH 2 –COOH
Kwas γ-hydroksymasłowy
γ-butyrolakton
Niektóre hydroksykwasy otrzymywane są z produktów naturalnych. W ten sposób kwas mlekowy otrzymuje się w wyniku fermentacji kwasu mlekowego substancji cukrowych. Syntetyczne metody wytwarzania opierają się na następujących reakcjach:
1) Cl–CH2–COOH + HOH  HO–CH2–COOH;
HO–CH2–COOH;
glikol monochlorooctowy
kwaśny kwas
2) CH2 =CH–COOH + HOH  HO–CH 2 –CH 2 –COOH.
HO–CH 2 –CH 2 –COOH.
kwas akrylowy kwas β-hydroksypropionowy
Przedstawiciele hydroksykwasów.
Glikolowy Kwas (hydroksyoctowy) to substancja krystaliczna występująca w niedojrzałych owocach, soku z buraków, rzepie i innych roślinach. W przemyśle otrzymywany jest poprzez redukcję kwasu szczawiowego. Stosowany do barwienia (druk perkalowy).
Kwas mlekowy (α-hydroksypropionowy) – gęsta ciekła lub topliwa masa krystaliczna. Kwas mlekowy powstaje podczas fermentacji cukrów pod wpływem bakterii kwasu mlekowego. Zawarty w fermentowanych produktach mlecznych, kiszonej kapuście, kiszonkach. Stosowany w zaciekłym farbowaniu, garbowaniu i medycynie.
Kwas mlekowy występuje w sokach mięśniowych zwierząt i ekstraktach mięsnych.
Dwuatomowy kwas glicerynowy uczestniczy w procesach życiowych roślin i zwierząt.

Kwas askorbinowy (witamina C) to krystaliczna substancja występująca w świeżych owocach, cytrynach, czarnych porzeczkach, świeże warzywa- kapusta, fasola. Syntetycznie witaminę C otrzymuje się przez utlenianie sorbitolu w postaci alkoholu wielowodorotlenowego.
 kwas α-askorbinowy
kwas α-askorbinowy
Kwas askorbinowy łatwo ulega rozkładowi pod wpływem tlenu atmosferycznego, zwłaszcza po podgrzaniu
Acykliczne dwa-i trójzasadowe hydroksykwasy.
Jabłko kwas (hydroksybursztynowy) (HOOC–CHOH–CH 2 –COOH) jest substancją krystaliczną, dobrze rozpuszczalną w wodzie; stosowany w medycynie, występuje w niedojrzałej jarzębiny, berberysie, rabarbarze, soku winogronowym, winie.
Wino Kwas (winowy, dihydroksybursztynowy) (HOOC–*CHOH–*CHOH–COOH) ma 2 asymetryczne atomy węgla, a zatem ma 4 izomery optyczne. Tworzy kwaśne sole potasowe, które są słabo rozpuszczalne w wodzie i wytrącają się. W winie można zaobserwować kryształki soli (kamień nazębny). Mieszana sól potasowo-sodowa nazywana jest solą Rochelle. Sole kwasu winowego nazywane są winianami.


krem z kamienia nazębnego, sól seignette
Kwas winowy występuje powszechnie w roślinach (jarzębina, winogrona itp.).
Kwas cytrynowy
 występuje w owocach cytrusowych. W przemyśle otrzymywany jest z owoców cytryny poprzez utlenianie cukrów grzyby pleśniowe, podczas obróbki igieł świerkowych.
występuje w owocach cytrusowych. W przemyśle otrzymywany jest z owoców cytryny poprzez utlenianie cukrów grzyby pleśniowe, podczas obróbki igieł świerkowych.
Kwas cytrynowy jest biologicznie ważnym związkiem biorącym udział w metabolizmie. Stosowany jest w medycynie, przemyśle spożywczym i tekstylnym jako dodatek do barwników.
Cykliczne jednozasadowe wielowodorotlenowe kwasy hydroksylowe są częścią kwasów żółciowych i innych fizjologicznie ważnych związków; na przykład auksyna wspomaga wzrost roślin.
Aromatyczne hydroksykwasy dzielą się na kwasy fenolowe i aromatyczne kwasy tłuszczowe zawierające grupę hydroksylową w łańcuchu bocznym.


kwas o-hydroksybenzoesowy migdałowy
(kwas salicylowy
Kwas salicylowy występuje w niektórych roślinach w postaci wolnej (nagietek), ale częściej w postaci estrów. W przemyśle otrzymuje się go przez ogrzewanie fenolanu sodu z dwutlenkiem węgla. Stosowany jako środek dezynfekujący i do syntezy barwników. Jako leki stosuje się wiele pochodnych kwasu salicylowego (aspiryna, salol).


salol aspiryny (ester fenylowy
(kwas acetylosalicylowy) kwas salicylowy)
Kwas galusowy (3,4,5-trioksybenzoesowy).

Zawarty w liściach herbaty, korze dębu i drzewie granatu. Przemysłowo otrzymuje się go z garbników poprzez gotowanie z rozcieńczonymi kwasami. Używa się go do produkcji atramentu, w fotografii i medycynie jako środek antyseptyczny. Kwas galusowy i jego pochodne są dla wielu powszechnie stosowane jako środki konserwujące produkty żywieniowe(tłuszcze, wysokogatunkowe mydła, nabiał), ma właściwości garbujące i ma szczególne znaczenie przy produkcji skór oraz przy barwieniu zaprawowym.
Kwas migdałowy odnosi się do aromatycznych kwasów tłuszczowych (C 6 H 5 – CH (OH) – COOH), występujących w amigdalinie, musztardzie, czarnym bzie itp.
Garbniki są często pochodnymi fenoli wielowodorotlenowych. Są częścią roślin i otrzymywane są z ekstraktów z kory, drewna, liści, korzeni, owoców lub narośli (galasów).
Garbniki to najważniejsze garbniki. Jest to mieszanina różnych związków chemicznych, z których głównymi są estry kwasu galusowego i digalowego oraz glukozy lub alkoholi wielowodorotlenowych.

Kwas Dg-digallowy

kwas m-digallowy
Tanina wykazuje właściwości fenoli i estrów. Z roztworem chlorku żelaza tworzy czarny związek kompleksowy. Garbniki są szeroko stosowane jako ekstrakty garbnikowe, zaprawy do barwienia tkanin bawełnianych, jako środki ściągające w medycynie (posiadają właściwości bakteriobójcze i hemostatyczne) oraz są konserwantami.
Lipidy obejmują substancje organiczne, z których wiele to estry kwasów tłuszczowych o dużej masie cząsteczkowej i alkohole wielowodorotlenowe - tłuszcze, fosfatydy, woski, steroidy, kwasy tłuszczowe o dużej masie cząsteczkowej itp.
Lipidy występują głównie w nasionach roślin, jądrach orzechów oraz w organizmach zwierzęcych – w tkance tłuszczowej i nerwowej, zwłaszcza w mózgu zwierząt i ludzi.
Tłuszcze naturalne to mieszaniny estrów alkoholu trójwodorotlenowego, gliceryny i wyższych kwasów karboksylowych, tj. mieszaniny glicerydów tych kwasów.
O 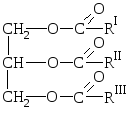 ogólna formuła tłuszczu:
ogólna formuła tłuszczu:
gdzie R I R II R III oznaczają rodniki węglowodorowe wyższych kwasów tłuszczowych normalna struktura z parzystą liczbą atomów węgla. Tłuszcze mogą zawierać pozostałości zarówno kwasów nasyconych, jak i nienasyconych.
Kwasy nasycone:
C 15 H 31 COOH – palmitynowy;
C 17 H 35 COOH – stearynowy;
C 3 H 7 COOH – olej (zawarty w masło) itd.
Kwasy nienasycone:
C 17 H 33 COOH – oleinowy;
C 17 H 31 COOH – linolowy;
C 17 H 29 COOH – linolenowy itp.
Tłuszcze pozyskiwane są z naturalnych źródeł pochodzenia zwierzęcego i roślinnego.
Właściwości fizyczne tłuszcze wynikają z ich kwaśnego składu. Tłuszcze zawierające głównie pozostałości kwasów nasyconych to substancje stałe lub o konsystencji pasty (tłuszcz jagnięcy, wołowy itp.). Tłuszcze zawierające głównie pozostałości kwasów nienasyconych mają płynna konsystencja w temperaturze pokojowej i nazywane są olejami. Tłuszcze nie rozpuszczają się w wodzie, ale dobrze rozpuszczają się w rozpuszczalnikach organicznych: eterze, benzenie, chloroformie itp.
Właściwości chemiczne. Jak wszystkie estry, tłuszcze ulegają hydrolizie. Hydroliza może zachodzić w środowisku kwaśnym, obojętnym lub zasadowym.
1. Hydroliza kwasowa.

Podobne artykuły
-
Tekst, znaczenie stusylabowej mantry Buddy Wadżrasattwy Wadżrasattwy w hinduizmie i buddyzmie
Praktykując mantrę Wadżrasattwy, człowiek może oczyścić się, poznać siebie, osiągnąć nowy poziom duchowy, a także wyleczyć się z wielu dolegliwości. Zastosowanie tego cudownego tekstu, zgodnie z wierzeniami praktykujących joginów, pozwala...
-
Magiczny pamiętnik czytany online
Dedykowane Mariannie, która porusza się bardzo cicho i robi mnóstwo hałasu. Moim czytelnikom z wdzięcznością za wiarę we mnie. Rozdział pierwszy Pąki Mówią, że z każdym opowiadaniem moja historia staje się coraz mniej zabawna. Jeśli to prawda,...
-
Jaka jest astrologia dziewięciu pałaców (dziewięć gwiazd) i jej możliwości
Wu-sin - 9 pałaców Tatyana Panyushkina ZNAJĄC SWOJĄ PRZYSZŁOŚĆ, ZARZĄDZAJ TEŻ TERAZ 9 Pałaców jest powodem do dumy i ozdobą całej chińskiej metafizyki. To niesamowite, jak tak prosty, a jednocześnie harmonijny i skuteczny system pozwala...
-
Dekodowanie Zi Wei Dou Shu
Istnieje możliwość szkoleń stacjonarnych, szkoleń internetowych w formie seminariów ON-LINE oraz seminariów stacjonarnych. Po ukończeniu szkolenia wydawany jest Dyplom Centrum Badań Feng Shui z podpisem MISTRZA Josepha Yu (Kanada). Zodiak dwunastu zwierząt...
-
Jak sprzedać mieszkanie obciążone hipoteką?
Czy można sprzedać mieszkanie z kredytem hipotecznym: jak sprzedać legalnie + 4 powody, dla których warto sprzedać + 4 sposoby zawarcia umowy kupna/sprzedaży + możliwe ryzyko + czy potrzebujesz pomocy profesjonalisty? Materiał ten zainteresuje tych, którzy już...
-
Prawo pierwokupu udziału: w mieszkaniu, spółce z oo, współwłasność, ogłoszenie sprzedaży, wzór umowy, zrzeczenie się prawa pierwokupu Prawo pierwokupu nieruchomości
Prawo pierwokupu mieszkania stosuje się w sytuacji, gdy jeden z kilku właścicieli nieruchomości zamierza sprzedać swój udział. Prawo pierwokupu udziału w mieszkaniu Szanowni Państwo! Nasze artykuły mówią o...
