A nátrium legmagasabb és legalacsonyabb oxidációs állapota. A nátrium és vegyületei - n1.doc fájl
Általános információés megszerzésének módjai
A nátrium (Na) egy ezüstfehér alkálifém, amely gyorsan elhomályosodik a levegőben, ha annak ki vannak téve normál körülmények között. Tartalom benne földkéreg 2,5 tömeg% (tömeg). A világ óceánjainak vizében átlagos koncentrációja 1,035%. Az élő szervezetek legfeljebb 0,02 tömeg% nátriumot tartalmaznak, a növényekben ennek tartalma valamivel alacsonyabb.
Több mint 220 ásványi anyagról ismert, hogy nátriumot tartalmaz. Leggyakoribbak a nátrium-klorid, vagy konyhasó, NaCl, halit NaCl, vagy kősó, chilei salétrom NaN 0 3, thenardit Na 2 S 04, mirabolit (Glauber-só) Na 2 SCv 10H 2 O, trona Na, H (C 0 3) 2 -2 H 2 0 stb.
A nátrium számos összetettebb, alumíniumot, szilíciumot, ként és egyéb elemeket tartalmazó ásványban is megtalálható. Például a jafelinben Na [ A ] Si 0 4 ], lapis lazuli (ultramarin) Na 3 [ Al 3 Si 3 0| 2] Na 2 [S 0 4], jadeit NaCl [Si 2 0 6] stb.
Számos nátriumvegyületet, elsősorban a konyhasót és a szóda Na 2 C 0 3 10H 2 O-t ősidők óta ismeri az ember.
BAN BEN Az ókori Egyiptom ismert volt egy mosószer (szóda), amit neternek hívtak. Arisztotelésznél vixpovj-nak, Plutarkhosznál pedig ( Az ókori Róma) - nitrum. Az arab alkimisták kézirataiban a nátron kifejezés a szódának felel meg, amelyből fokozatosan a XVII-XVIII. keletkezik a „natra” kifejezés, vagyis az a bázis, amelyből az ember beszerezhető asztali só. A "natra"-ból jött modern név elem. Meg kell jegyezni, hogy számos országban Nyugat-Európa(Nagy-Britannia, Franciaország, Olaszország), valamint az USA-ban a nátriumot nátriumnak nevezik.
Fémes nátriumot először 1807-ben Dewi angol kémikus kapott elektrolízis eredményeként. lúgos módszer). A lúgos módszer nagy energiaintenzitása miatt csak a 19. század végén vált iparosodottá. Korábban fémes nátriumot kaptak kémiai redukció vegyületei szénnel vagy olvadt öntöttvassal at magas hőmérsékletű. A jelen század első negyede óta a lúgos módszert fokozatosan felváltotta a sómódszer, azaz a nátrium-klorid olvadék közvetlen elektrolízise, megkerülve a lúggyártás szakaszát. Az olvadt só elektrolízisét 850-860 K hőmérsékleten hajtják végre. A NaCl olvadáspontjának csökkentésére számos sót, különösen NaF-ot, KCl-t, CaClg-t stb. adnak hozzá. A nátrium-klorid elektrolízisével egy másik értékes termék- klórgáz. Ezért jelenleg a nátrium-előállítás sós módszere gyakorlatilag felváltotta a lúgos módszert, nem beszélve a kémiai módszerekről.
Fizikai tulajdonságok
Atom jellemzői. Atomszáma 11, atomtömege 22,98977 a. e.m., atomtérfogat 23,08* 10 -6 m 3 /mol. Atomsugár (fémes) 0,192 nm, ionsugár Na + 0,098 nm, kovalens sugár 0,157 nm. Az atom külső elektronhéjainak konfigurációja 2 p 6 3 s 1. A nátriumnak egyetlen stabil izotópja van, 23 Na; öt ismert radioaktív izotópok 20 és 25 közötti tömegszámokkal; Az izotópok felezési ideje ezredmásodperctől (20 Na) 2,6 évig terjed 22 Na esetében. Szobahőmérsékleten a nátrium kb. c. k) rács a periódussal = 0,42905 nm; energia kristályrács 108,8 µJ/kmol. Nál nél alacsony hőmérsékletek Létezik a nátrium módosítása g.p.u. szerkezet, melynek periódusai 5K-n: a = 0,3767 nm, c = 0,6154 nm. A nátriumatom ionizációs potenciáljai J (eV) 5,138, 47,20, 71,8, elektronegativitása 0,9. Elektron munkafüggvény φ 0 = 2,35 eV. Az elektronok munkafüggvénye egy kristály különböző lapjaira φ -2,75 eV (100), φ = 3,10 eV (110), φ = 2,65 eV (111) esetén.
Sűrűség. Szobahőmérsékleten a nátrium röntgensűrűsége p = 0,966 Mg/m 3, piknometriás sűrűsége p = 0,971 Mg/m 3 .
Olvadáskor a nátrium elektromos ellenállása 1,451-szeresére nő. A nátrium elektromos ellenállásának hőmérsékleti együtthatója 273 K a = 4,34-10-3 K -1.
Nátrium-platina hőelemben 173,16 K forró csatlakozási hőmérsékleten fejlődik i.e. d.s. £=0,29 mV, és 373,16 K hőmérsékleten £=-0,25 mV. Abszolút együttható i.e. d.s. e=- 4,4 µV/K. Hall állandó szobahőmérsékleten /? = 2,3-10 m 3 /K és /? = -2,2-10 m 3 /K 371-383 K hőmérsékleten.
A nátrium mágneses szuszceptibilitása x = +0,70 - 10 -9 293 K-en.
Termikus és termodinamikai. Nátrium olvadáspontja / P l = = 98 ° C, forráspont = forráspont = 878 ° C, jellemző hőmérséklet 6v = 160 K, fajlagos hő olvadáspont DN PL = P7 kJ/kg. A fajlagos szublimációs hő 298 K-on DYa su bl = 4717 kJ/kg, a fajpárolgási hő DYA I sp = 3869 kJ/kg. A nátrium párolgási hője at normál nyomás DYAI<-п = 3869 кДж/кг. При плавлении происходит увеличение объема на ДУ- 27,82-Ю -6 м 3 /кг или AV / V 0 = 0,0265. При повышении давления возрастает температура плавления металла, достигая 515 К при 3 ГПа и 608 при 8 ГПа. Начальное значение углового коэффициента dT / dP = 85 К/ГПа, при 7 ГПа 33 К/ГПа. Фазовых превращений в натрии до давления 8,5 ГПа не обнаружено.
Mechanikai tulajdonságok
Nátriumkeménység a Brinell HB szerint = 0,7 MPa. Normál szakító modulus szobahőmérsékleten £=5,3 GPa. A nátrium összenyomhatósága x = 15,99*10 -11 Pa -1.
Kémiai tulajdonságok
Kémiai vegyületekben, beleértve a hidrideket is, + 1 oxidációs állapotot mutat.
A nátrium az egyik legreaktívabb fém, ezért tiszta formában nem fordul elő a természetben. A nátrium az egyik leginkább elektropozitív fém; intenzív kölcsönhatásba lép a levegő oxigénjével, ezért általában kerozinréteg alatt tárolódik. A feszültségek sorozatában a nátrium messze megelőzi a hidrogént, és kiszorítja azt a vízből, ezáltal NaOH hidroxidot képez.
Ha száraz hidrogént enyhén melegített nátriumon vezetünk át, nátrium-hidrid NaH képződik, amely egy nemionos vegyület, amelyben a nátrium kationként, a hidrogén pedig anionként lép be.
Nátrium-oxid akkor képződik, amikor a nátrium elégtelen mennyiségű oxigénben ég, hevesen reagál vízzel, hidroxidot képezve, és kristályrácsa van, mint a fluorpátnak.
A nátrium-peroxid akkor képződik, amikor a nátrium levegőben vagy oxigénben eléget, és halványsárga por, amely bomlás nélkül megolvad; nagyon erős oxidálószer. Sok szerves anyag meggyullad vele érintkezve. Amikor a Na 2 0 2 kölcsönhatásba lép a szén-dioxiddal, oxigén szabadul fel. Ezt a reakciót használják a tűzoltók és búvárok által használt légzőkészülékekben, valamint a levegő regenerálására zárt terekben, például tengeralattjárókban.
A nátrium-hidroxid NaOH fehér, nagyon higroszkópos kristályok formájában képződik, olvadáspontja 318,3 °C; sűrűsége 2,13 Mg/m3.
Ismeretes egy szén Na 2 C 2 nátriumvegyület, amely acetilénsónak tekinthető. Ezért kapta a nátrium-acet-tnlide nevet. A nátrium-nitrid száraz levegőn stabil, de víz és alkohol hatására azonnal lebomlik, és ammóniává alakul.
A nátrium-szulfid Na 2 S nátrium-szulfát szénnel történő redukálásával nyerhető. A Na 2 S tiszta formájában színtelen és CaF 2 típusú kristályrácsos. A nátrium kénnel és oxigénnel alkotott igen gyakori vegyülete az úgynevezett Glauber-só, Na 2 S 0 4 - 10H 2 O. A nátrium a vegyértékszabálynak megfelelő közönséges kémiai vegyületekkel együtt fémvegyületeket is képez. A Na-K rendszerű ötvözetekben KNa 2 összetételű Laves-fázis képződik, amelynek komplex o. c. k) MgCu 2 (C15) típusú kristályrács. Hasonló fémes vegyület figyelhető meg, amikor a nátrium céziummal reagál. Számos fémvegyület keletkezik a nátriumnak az I. és VII. B csoportba tartozó fémekkel – ezüsttel, arannyal, cinkkel, kadmiummal, higannyal, galliummal, ónnal, ólommal és egyéb elemekkel – való kölcsönhatása révén. Persze vannak kivételek. Így az alumínium, az SHV alcsoport egyik eleme, sem folyékony, sem szilárd állapotban nem lép kölcsönhatásba a nátriummal. A periódusos rendszer III-VIIIA alcsoportjai gyakorlatilag nem lépnek kölcsönhatásba a nátriummal a mérettényező és az olvadáspont közötti nagy különbség miatt.
Felhasználási területek
A nátriumot széles körben használják a technológia különböző területein. Ennek az elemnek a nagy reakcióképessége előre meghatározta a fémek, például titán, cirkónium, hafnium, nióbium stb. nátrium-termikus előállításához redukálószerként történő alkalmazását a kohászatban. Bizonyos típusú öntött alumíniumötvözetek, nátrium és sói gyártásában módosítóként használják. A vegyiparban a nátriumot cianidsók, szintetikus gumi és szintetikus mosószerek (detergenidek), gyógyszerek, valamint az ólom-tetraetil, kopogásgátló anyag, a motorok magas oktánszámú üzemanyagának előállítására használják. Az elmúlt években a tiszta nátrium és káliumot tartalmazó ötvözeteinek nukleáris energiában történő alkalmazása hűtőközegként terjedt el.
Kémiai vegyületeit széles körben alkalmazzák a nemzetgazdaságban. Ez elsősorban a nátrium-hidroxid NaOH (marónátron), amelyet a szappaniparban, festékgyártásban, cellulóz- és papír- és olajiparban, műszálgyártásban stb. használnak. Szóda - nátrium-karbonát Na 2 C 0 3 - üveg-, cellulóz- és papír-, élelmiszer-, textil-, olaj- és egyéb iparágakban használják. A mezőgazdaságban a salétromsav NaN 0 3 nátriumsóját, amelyet chilei nitrátként ismernek, széles körben használják műtrágyaként.
n1.doc
Absztrakt.
Tantárgy: "Nátrium és vegyületei"
Bevezetés……………………………………………………………………3
A nátrium és vegyületeinek előfordulása a természetben………………………….3 – 4
Fizikai és kémiai tulajdonságok………………………………………….4 – 7
Előkészítés és felhasználás…………………………………………..…….7 – 11
Toxicitás…………………………………………………….………………….11
Hivatkozások……………………………………………………….…….12
Bevezetés.
Nátrium
– Mengyelejev periodikus rendszerének I. csoportjának fő alcsoportjának kémiai eleme. A rendszáma 11, a tömege pedig 22,9898. Nátrium– ezüstös-fehér puha fém, amely levegőn gyorsan oxidálódik a felületről, és késsel könnyen vágható. A közvetlenül a vágás utáni nátrium-vágás fényes fémes fényű, de a fém rendkívül gyors oxidációja miatt gyorsan elhalványul. A természetes elem egy stabil izotópból, a Na-ból áll.
Természetes nátriumvegyületek (étkezési só NaCl, szóda Na 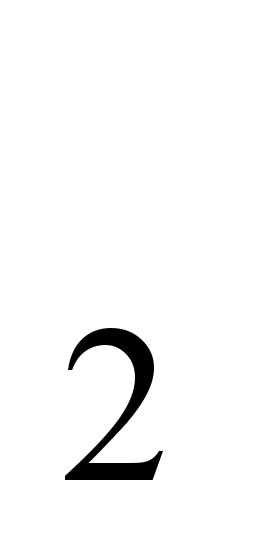 CO) ősidők óta ismertek. Név "nátrium"
, arabból származik natrun, görög nitron, eredetileg natúr szóda. A kémikusok már a 18. században sok más nátriumvegyületet is ismertek. Magát a fémet azonban csak 1807-ben szerezte meg G. Davy nátrium-hidroxid elektrolízisével. Az Egyesült Királyságban, az USA-ban, Franciaországban az elem ún Nátrium(a spanyol szóda szóból - szóda), Olaszországban - sodio.
CO) ősidők óta ismertek. Név "nátrium"
, arabból származik natrun, görög nitron, eredetileg natúr szóda. A kémikusok már a 18. században sok más nátriumvegyületet is ismertek. Magát a fémet azonban csak 1807-ben szerezte meg G. Davy nátrium-hidroxid elektrolízisével. Az Egyesült Királyságban, az USA-ban, Franciaországban az elem ún Nátrium(a spanyol szóda szóból - szóda), Olaszországban - sodio.
A nátrium és vegyületeinek előfordulása a természetben.
Nátrium- a földkéreg felső részének jellegzetes eleme. Átlagos tartalma a litoszférában 2,5 tömeg%, a savas magmás kőzetekben (gránit stb.) 2,77%, a bázikusban (bazaltok stb.) 1,94%, az ultrabázikusban (köpenykőzetek) 0,57%. A Na izomorfizmus miatt 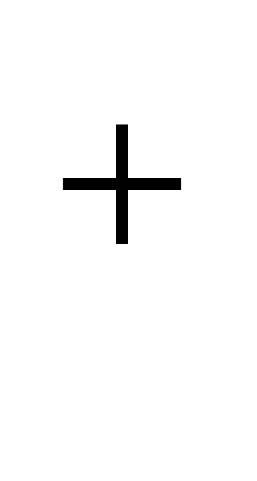 és Ca
és Ca 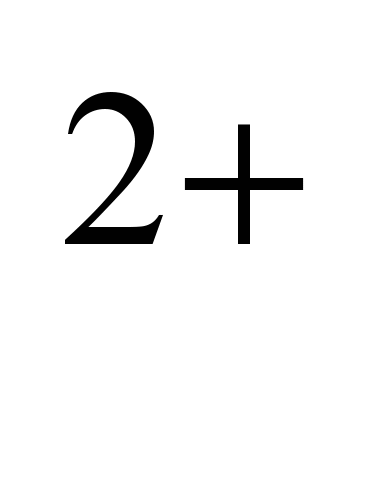 , ionos sugaraik közelsége miatt magmás kőzetekben képződnek nátrium-kalcium földpátok
(plagioklászok)
. A bioszférában a nátrium éles differenciálódása tapasztalható: az üledékes kőzetekben átlagosan nátriumszegény (agyagban és palában 0,66%), a legtöbb talajban kevés (átlagosan 0,63%). A nátrium-ásványok összlétszáma 222. A nátriumot gyengén visszatartják a kontinenseken, és a folyók juttatják a tengerekbe és óceánokba, ahol átlagos tartalma 1,035%. Na– a tenger fő fémeleme víz. A párolgás során nátriumsók rakódnak le a tengerparti tengeri lagúnákban, valamint a sztyeppék és sivatagok kontinentális tavaiban, sótartalmú kőzetrétegeket képezve. A fő ásványi anyagok, amelyek a nátrium és vegyületeinek forrásai halite
(kősó) NaCl,
chilei salétrom
NaNO,
tenarditisz
NaSO
, ionos sugaraik közelsége miatt magmás kőzetekben képződnek nátrium-kalcium földpátok
(plagioklászok)
. A bioszférában a nátrium éles differenciálódása tapasztalható: az üledékes kőzetekben átlagosan nátriumszegény (agyagban és palában 0,66%), a legtöbb talajban kevés (átlagosan 0,63%). A nátrium-ásványok összlétszáma 222. A nátriumot gyengén visszatartják a kontinenseken, és a folyók juttatják a tengerekbe és óceánokba, ahol átlagos tartalma 1,035%. Na– a tenger fő fémeleme víz. A párolgás során nátriumsók rakódnak le a tengerparti tengeri lagúnákban, valamint a sztyeppék és sivatagok kontinentális tavaiban, sótartalmú kőzetrétegeket képezve. A fő ásványi anyagok, amelyek a nátrium és vegyületeinek forrásai halite
(kősó) NaCl,
chilei salétrom
NaNO,
tenarditisz
NaSO  ,
mirabilit vagy glauberi
só
NaSO
,
mirabilit vagy glauberi
só
NaSO 10
HO,
trón
Nem(CO)2
HO,
bórax
NaBO
10
HO,
trón
Nem(CO)2
HO,
bórax
NaBO  10
HO, szilvinitKCINaCl.
A világ nátriumtermelését 110-re becsülik
10
HO, szilvinitKCINaCl.
A világ nátriumtermelését 110-re becsülik  tonna Na– fontos bioelem, az élő anyag átlagosan 0,02% nátriumot tartalmaz. Az állatokban több van, mint a növényekben. A nátrium az állatok és az emberek ásványi anyagcseréjében részt vevő egyik fő elem. Főleg extracelluláris folyadékokban található (kb. 10 mmol/kg humán eritrocitákban, 143 mmol/kg vérszérumban); A növényi szövet nátriumtartalma nedves tömegre vonatkoztatva körülbelül 0,01%.
tonna Na– fontos bioelem, az élő anyag átlagosan 0,02% nátriumot tartalmaz. Az állatokban több van, mint a növényekben. A nátrium az állatok és az emberek ásványi anyagcseréjében részt vevő egyik fő elem. Főleg extracelluláris folyadékokban található (kb. 10 mmol/kg humán eritrocitákban, 143 mmol/kg vérszérumban); A növényi szövet nátriumtartalma nedves tömegre vonatkoztatva körülbelül 0,01%.
Fizikai és kémiai tulajdonságok.
Normál hőmérsékleten a nátrium köbös rácsban kristályosodik, a = 4,28. Atomsugár 1,86, ionsugár Na 0,92. Sűrűsége 0,968 g/cm  (19,7
(19,7 C), t
C), t  =97,83С, t
=97,83С, t  = 882,9 °C; fajlagos hőkapacitás (20C) 1,2310 J/(kgK) vagy 0,295 cal/(ggrad); hővezetési együttható 1,3210
= 882,9 °C; fajlagos hőkapacitás (20C) 1,2310 J/(kgK) vagy 0,295 cal/(ggrad); hővezetési együttható 1,3210  W/(mK) vagy 0,317 cal/(cmsecgrad); lineáris tágulási hőmérsékleti együttható (20C) 7.110
W/(mK) vagy 0,317 cal/(cmsecgrad); lineáris tágulási hőmérsékleti együttható (20C) 7.110  elektromos ellenállás (0C) 4.310
elektromos ellenállás (0C) 4.310 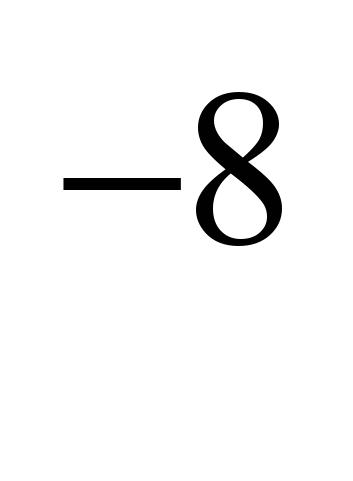 ohm (4,310
ohm (4,310  omsm). A nátrium paramágneses, fajlagos mágneses szuszceptibilitás +9,210; nagyon műanyag és puha (késsel könnyen vágható).
omsm). A nátrium paramágneses, fajlagos mágneses szuszceptibilitás +9,210; nagyon műanyag és puha (késsel könnyen vágható).
A nátrium az alkálifémek közé tartozik, mivel oxidja erősen bázikus természetű, a hidroxid pedig erős elektrolit - lúg. A nátrium normál elektródpotenciálja -2,714 V; Az olvadékban lévő elektródpotenciál 2,4 V. A nátriumgőz a lángot jellegzetes élénksárga színűre színezi ( kvalitatív reakció alkálifém-kationokra). A nátriumatom elektronikus konfigurációja 1
s2
s2
p  3
s
3
s  .
A nátriumnak, mint minden alkálifémnek, van egy s-egy elektron a külső elektronrétegen, amely könnyen veszít a kémiai reakciók során, megmutatkozik oxidációs állapot +1
(Az összes ismert vegyületben a nátrium egyértékű). Ezért Navanerős redukálószer
. Szilárd állapotban jól vezeti az elektromosságot. Mivel a nátrium olvadó és gyorsan oxidálódik a levegőben, levegőhöz és nedvességhez való hozzáférés nélkül tárolják, leggyakrabban kerozin alatt. A nátrium vegyületeket képez túlnyomórészt ionos kötés, amelyek általában vízben oldódnak és könnyen disszociálnak ionokká. Az alkálifémionokra nem jellemző a stabil komplexek képződése. A nátrium kémiai aktivitása nagyon magas. Számos só kristályosodik ki az oldatból kristályos hidrátok formájában: NaSO
.
A nátriumnak, mint minden alkálifémnek, van egy s-egy elektron a külső elektronrétegen, amely könnyen veszít a kémiai reakciók során, megmutatkozik oxidációs állapot +1
(Az összes ismert vegyületben a nátrium egyértékű). Ezért Navanerős redukálószer
. Szilárd állapotban jól vezeti az elektromosságot. Mivel a nátrium olvadó és gyorsan oxidálódik a levegőben, levegőhöz és nedvességhez való hozzáférés nélkül tárolják, leggyakrabban kerozin alatt. A nátrium vegyületeket képez túlnyomórészt ionos kötés, amelyek általában vízben oldódnak és könnyen disszociálnak ionokká. Az alkálifémionokra nem jellemző a stabil komplexek képződése. A nátrium kémiai aktivitása nagyon magas. Számos só kristályosodik ki az oldatból kristályos hidrátok formájában: NaSO  10HO, NaCO
10HO, NaCO  10HO, NaBO
10HO, NaBO  10HO, amelyek szerkezetükben tektohidrátok. A tektohidrátok jég szerkezetűek, amelyek üregeiben az ellentétes töltésű ionok egyenletesen oszlanak el.
10HO, amelyek szerkezetükben tektohidrátok. A tektohidrátok jég szerkezetűek, amelyek üregeiben az ellentétes töltésű ionok egyenletesen oszlanak el.
Kémiai tulajdonságok:
Kölcsönhatás egyszerű anyagokkal:
1) Reakció halogénekkel: 2Na + CI= 2NaCI (nátrium-klorid)
A nátrium közönséges hőmérsékleten közvetlenül kölcsönhatásba lép a fluorral és a klórral (a klórban erőteljesen ég, ami különösen jó megfigyelni egy kalcium-klorid csőben, amelyben klóráram halad át az olvadt és erősen felhevített nátriumon), a brómmal - csak melegítéskor ; nem figyelhető meg közvetlen kölcsönhatás a jóddal.
Nátrium-klorid(só) NaCl
köbös kristályok formájában kristályosodik, nincs szaga, sós ízű, vízben jól oldódik. Oldhatósága a hőmérséklet változásával szinte változatlan marad. Ez különösen akkor fontos, ha az asztali sót más sók oldataiból átkristályosítással izoláljuk.
2) Reakció oxigénnel: 4Na + O= 2NaO (nátrium-oxid)
2Na + O= NaO (nátrium-peroxid)
Az oxigénnel való közvetlen kölcsönhatás során a körülményektől függően NaO-oxid (oxidáció kis mennyiségű oxigénben körülbelül 180 C-on) vagy NaO-peroxid - színtelen kristályos anyagok képződnek. Nátrium-oxid– szilárd higroszkópos anyag, amely könnyen kölcsönhatásba lép a vízzel és erősen bázikus karakterű. Vízzel való kölcsönhatás során lúgot (nátronlúgot) képez:
NaO+HO = 2NaOH
Nátrium-hidroxid vagy nátrium-hidroxid NaOH nagyon fontos nátriumvegyület. Marónátronnak vagy egyszerűen marónak is nevezik. A marószóda előállításához konyhasót használnak - a legolcsóbb természetes nátriumvegyületet. Ezt a sót elektrolízisnek vetik alá, de ebben az esetben nem olvadékot, hanem sóoldatot használnak. Maró A nátrium fehér kristályos szilárd anyag, vízben jól oldódik. Amikor a marónátront vízben feloldjuk, nagy mennyiségű hő szabadul fel, és az oldat nagyon felforrósodik. A nátronlúgot jól zárható tartályokban kell tárolni, hogy megvédjük a vízgőz behatolásától, amelynek hatására nagyon nedvessé válhat, valamint a szén-monoxidtól (IV), amelynek hatására a marónátron fokozatosan megfordulhat. nátrium-karbonátba:
2NaOH + CO = NaCO + HO
Nátrium-peroxid(sárgás por) erős oxidálószer. Vízzel érintkezve lúgot és hidrogén-peroxidot képez (ha a folyamatot melegítéssel végezzük, a HO bomlása miatt oxigén szabadul fel):
NaO+2HO = HO + 2NaOH
Amikor híg savak hatnak a nátrium-peroxidra, hidrogén-peroxid képződik: NaO + HSO = NaSO + HO
A nátrium-peroxid reakcióba lép a légköri szén-dioxiddal a következő egyenlet szerint:
2NaO + 2CO= 2NaCO +O
Ezért légzőkészülékekben használják a levegő regenerálására - a szén-monoxid (IV) felszívódására és az oxigén felszabadítására.
A levegőben a nátrium azonnal oxidálódik. Ezért szerves oldószerréteg alatt tárolják (kerozin vagy paraffin, és a paraffin előnyösebb, mivel bizonyos mennyiségű levegő még mindig feloldódik a kerozinban, és nátrium-oxidáció, bár lassan, de megtörténik).
Halogénekkel és oxigénnel való reakciókban a nátrium fejti ki legerőteljesebben redukáló képességét.
3) Reakció kénnel: 2Na + S = NaS (nátrium-szulfid)
Ha kénnel mozsárban őröljük, a nátrium heves reakcióba lép, nátrium-szulfidot képezve. A reakciót járványok kísérik, ezért tartsa távol a habarcsot a szemétől, és csavarja be a kezét egy törülközőbe. A reakcióhoz vegyen kis darab nátriumot.
4) Reakció nitrogénnel: 6Na+N=2NaN (nátrium-nitrid)
A nátriumgőz és a nitrogén kölcsönhatása csendes elektromos kisülés esetén nátrium-nitrid képződéséhez vezet.
5) Reakció szénnel: 2Na + C = NaC
(nátrium-karbid)
A nátriumgőz és a szén kölcsönhatása 800-900 C-on NaC-karbid képződéséhez vezet.
6) Reakció foszforral: 3Na + P = NaP (nátrium-foszfid)
7) Reakció hidrogénnel: 2Na+H=2NaH (nátrium-hidrid)
A nátrium reakciója hidrogénnel 200 C-on kezdődik, és hidrid képződéséhez vezet Nem – színtelen higroszkópos kristályos anyag. Ez egy sószerű vegyület, amely a kémiai kötés jellegét és az oxidáció mértékét tekintve eltér a IV-VII. csoportok fő alcsoportjainak illékony hidrogénvegyületeitől.
A nátrium erős redukálószer, így a hidrogént oxidációs állapotba redukálja –1.
Kölcsönhatás összetett anyagokkal:
1) Savakkal: 2Na+2HCl=2NaCI+H 
A fémek elektrokémiai feszültségsorában a nátrium a hidrogén elé kerül, így a híg savakból redukálja a hidrogénionokat.
Az ásványi savak megfelelő vízoldható sókat képeznek a nátriummal, de a nátrium viszonylag közömbös a 98-100%-os kénsavhoz képest.
2) Sók vizes oldataival:
A nátrium, mint erős redukáló tulajdonságokkal rendelkező fém, ilyen körülmények között a víz hidrogénét redukálja, nem pedig a megfelelő só fémét.
3) Vízzel: 2Na + 2HOH = 2NaOH + H
A nátrium reakcióba lép a vízzel, kiszorítva belőle a hidrogént (mivel nagyon aktív fém, a feszültségsorban jóval balra van a hidrogéntől), normál körülmények között, és e reakció eredményeként a vízben oldódó NaOH bázis keletkezik és H felszabadul; a reakciót robbanás kísérheti.
4) Ammóniával:
A nátrium folyékony ammóniában (34,6 g/100 g NH 0 C-on) feloldódik, és ammóniakomplexeket képez. Ha gáznemű ammóniát engedünk át 300-350 °C-on megolvadt nátriumon, az képződik nátrium-amidNaNH- színtelen kristályos anyag, víz hatására könnyen lebomlik.
5) Alkoholokkal: 2CHOH + 2Na = 2CHONa + H 
Amikor a nátrium alkoholokkal reagál, a hidroxil-hidrogént nátrium helyettesíti, és alkoholátok (nátrium-etoxid) keletkeznek.
Számos szerves nátriumvegyület ismert, amelyek kémiai tulajdonságaikban nagyon hasonlóak a szerves lítiumvegyületekhez, de reakcióképességükben felülmúlják őket. A szerves nátriumvegyületeket a szerves szintézisben alkilezőszerként használják.
Ötvözetek
.
A nátrium számos, gyakorlatilag fontos ötvözet alkotóeleme. A Na-K ötvözetek, amelyek 40-90 tömeg% K-t tartalmaznak 25°C körüli hőmérsékleten, ezüstfehér színű folyadékok, nagy kémiai aktivitással jellemezhetők, levegőn gyúlékonyak. A folyékony Na-K ötvözetek elektromos vezetőképessége és hővezető képessége alacsonyabb, mint a Na és K megfelelő értékei. Nátrium-amalgámok könnyen előállítható nátrium-fém higanyba juttatásával; közönséges hőmérsékleten több mint 2,5 tömeg% Na-tartalommal már szilárd anyagok.
Átvétel és jelentkezés.
A nátrium előállításának fő ipari módszere az olvadék elektrolízis asztali sóNaCladalékanyagokat tartalmazKCI,
NaF,
CaCIés mások (piroelektrometalurgia), amelyek a só olvadáspontját 575-585 °C-ra csökkentik. A tiszta NaCl elektrolízise nagy nátriumveszteséghez vezetne a párolgás következtében, mivel a NaCI (80 °C) olvadáspontja és a Na (882,9 °C) forráspontja nagyon közel van. Az elektrolízist membrános elektrolizátorokban végzik (az anód és a katód terét membrán választja el, ami a keletkező klórt elválasztja a nátriumtól, így fordított reakció nem megy végbe), a katódok vasból vagy rézből készülnek, az anódok grafit. A klór a nátriummal egyidejűleg képződik. Az elektródákat olvadt sóba mártják. A pozitív nátriumion elektront vesz fel a katódról, és semleges nátriumatommá válik. A semleges nátriumatomok a katódon olvadt fém formájában gyűlnek össze. A katódon lejátszódó folyamat a diagrammal ábrázolható: Na+


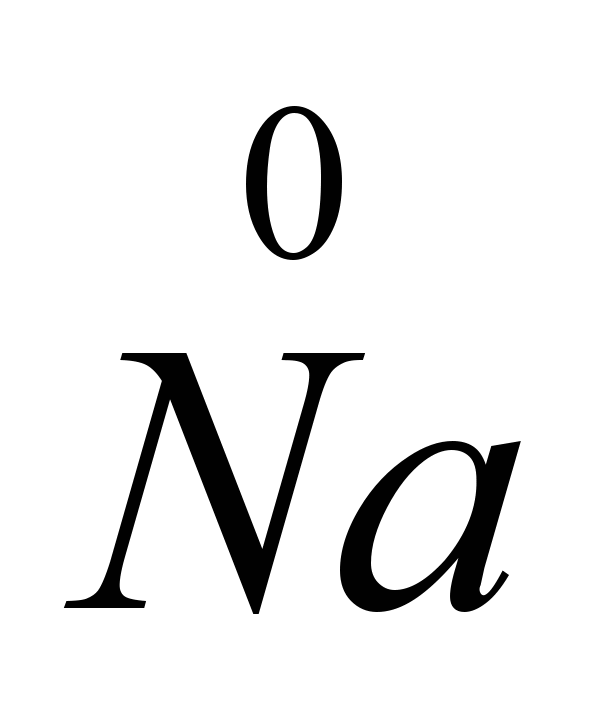
Mivel az elektronok felvétele a katódon történik, és az elektronok atomok vagy ionok általi elfogadása redukciót jelent, a nátriumionok a katódon csökkennek. Az anódnál a klórionok elektronokat adnak fel, azaz. megtörténik az oxidáció és a szabad klórgáz felszabadulása, amelyet a következő diagrammal ábrázolhatunk: C.I.  -
-
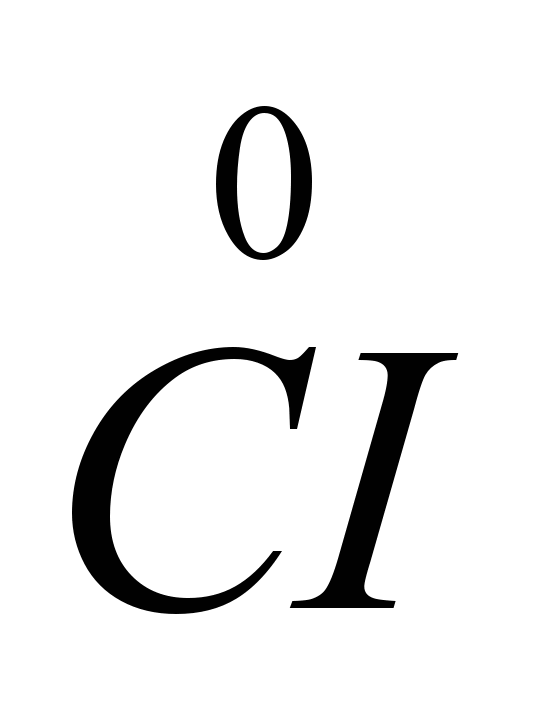
A nátrium kinyerésének régi módszere is megmaradt - olvadt nátronlúg elektrolíziseNaOH, ami jóval drágább, mint a NaCI, de alacsonyabb hőmérsékleten (320-330C) elektrolitikusan lebomlik.
A nátriumot és ötvözeteit széles körben használják hűtőfolyadékként olyan folyamatokhoz, amelyek egyenletes melegítést igényelnek 450-650 C tartományban - repülőgép-hajtóművek szelepeiben és különösen atomerőművekben. Ez utóbbi esetben a Na–K ötvözetek folyékony fémhűtőként szolgálnak (mindkét elem termikus neutronelnyelési keresztmetszete kicsi, Na 0,49 barn esetén); ezeket az ötvözeteket magas forráspont és hőátbocsátási tényező jellemzi, és nem lépnek kölcsönhatásba az atomerőműves reaktorokban kifejlesztett magas hőmérsékleten a szerkezeti anyagokkal. A gyártáshoz NaPb-vegyületet (10 tömeg% Na) használnak tetraetil ólom– a leghatékonyabb kopogásgátló szer. A vasúti kocsik tengelycsapágyainak gyártásához használt ólomalapú ötvözetben (0,73% Ca, 0,58% Na és 0,04% Li) a nátrium erősítő adalék. A kohászatban a nátrium aktív redukálószerként szolgál egyes ritka fémek (Ti, Zr, Ta) metalloterm módszerekkel történő előállításánál; szerves szintézisben - redukciós, kondenzációs, polimerizációs reakciókban. Néha az elektrotechnikában a nátriumot rézzel helyettesítik, amely 9-szer nehezebb, mint ez a fém; A nagyáramú gyűjtősínek nátriummal töltött acélcsövekből készülnek. A világ első szintetikus gumiját, amelyet 1928-ban S. V. Lebedev akadémikus szerzett, nátrium-butadién guminak nevezték el, mivel a nátrium volt a butadién polimerizációjának katalizátora. A nátriumot redukálószerként használják a szerves szintézisekben, különösen a zsírsavak magasabb szénatomszámú alkoholokká redukálására, amelyeket szintetikus mosó- és tisztítószerek előállításához használnak.
A gyógyászatban leggyakrabban használt nátriumkészítmény az nátrium-szulfátNaSO, kloridNaCl(vérvesztés, folyadékvesztés, hányás stb. esetén), borátNaBO10
HO(fertőtlenítőszerként) bikarbonátNaHCO(köptetőként, valamint nátha, gégegyulladás, cukorbetegség stb. esetén mosásra és öblítésre), tioszulfátNaSO (szóda) szükséges üveg, alumínium, mosószerek és festékek gyártásához).
NaCIO + HO + CO= NaHCO + HCIO
NaOH Használják még a papíriparban, szappankészítésben, műszálak gyártásában, galvanizálásban, kőolajtermékek és kőszénkátrány-frakciók tisztítására. A NaOH-t gyümölcsök és zöldségek (gyökérzöldségek, citrusfélék, paradicsom stb.) lúgos tisztítására használják, amelyet bizonyos anyagok lúgos hidrolízise elősegít, ami a héj és a pép közötti kapcsolat megszakadásához vezet. Erős NaOH-oldatot használnak a kazánok és radiátorok vízkőtől való tisztítására. Nátrium-klorid NaCl a vegyiparban klór, marónátron, szóda, fehérítő, bizonyos típusú műanyagok és szerves vegyületek előállítására használják. Nátrium-nitrátNaNOásványi műtrágyaként használják. Nátrium-szilikátNaSiO - azon kevés vízoldható szilikátok egyike. Neveztetik oldható üveg, és a megoldás az folyékony üveg. A fát és a szöveteket oldható üveggel impregnálják, hogy megvédjék őket a gyulladástól. A folyékony üveget az üveg, porcelán és kő ragasztására szolgáló tűzálló gittek tartalmazzák. Nátrium-nitritNaNO gátlószerként használják, amely lassítja az acél korrózióját vizes és sóoldatokban (védőfilmet hoz létre a fém felületén).
Nátrium-amidNaNH, A folyékony ammónia nátriummal való reagáltatásával nyert kékfesték - indigó és A-vitamin - előállításához szükséges.
Többnyire nátrium-peroxidNaO papír fehérítésére és levegő regenerálására használják tengeralattjárókban; korábban széles körben használták szalmakalapok fehérítésére.
A szerves anyagok nedvességtartalmának meghatározásához nátrium-amalgámmal (higanyoldat) keverik őket. A vízzel való kölcsönhatás következtében ekvivalens mennyiségű H szabadul fel, amelynek térfogata alapján határozzuk meg a vett minta nedvességtartalmát.
Az ilyen nátriumvegyületeket széles körben használják a mindennapi életben, mint sóNaCl És szódaNaCO. Egy személy napi nátrium-klorid szükséglete 2 és 10 g között van, és az izzadtság által elvesztett só mennyiségétől függ.
Mesterségesen előállított radioaktív izotópok  Na (felezési idő T
Na (felezési idő T  = 2,64 g) és
= 2,64 g) és 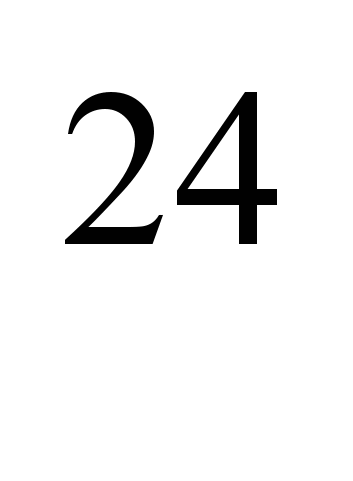 A Na (T=15 óra) a keringési rendszer egyes részein a véráramlás sebességének meghatározására szolgál szív- és érrendszeri és tüdőbetegségek, endarteritis obliteráló stb. vaszkuláris permeabilitás, tanulmányozza a szervezet összes metabolikus nátriumtartalmát, a víz-só anyagcserét, a bélből való felszívódást, az idegi aktivitás folyamatait és néhány más kísérleti vizsgálatot.
A Na (T=15 óra) a keringési rendszer egyes részein a véráramlás sebességének meghatározására szolgál szív- és érrendszeri és tüdőbetegségek, endarteritis obliteráló stb. vaszkuláris permeabilitás, tanulmányozza a szervezet összes metabolikus nátriumtartalmát, a víz-só anyagcserét, a bélből való felszívódást, az idegi aktivitás folyamatait és néhány más kísérleti vizsgálatot.
A nátrium az állatok és az emberek ásványi anyagcseréjében részt vevő egyik fő elem. Részt vesz a karbantartásban ozmotikus nyomásÉs sav-bázis egyensúly, az idegimpulzusok vezetésében. A nátriumionok koncentrációját a szervezetben elsősorban a mellékvesekéreg hormonja szabályozza - aldoszteron. A növényi szövetek viszonylag magas nátriumtartalma ellenére (kb. 0,01% nedves tömegre vonatkoztatva), a növényi életben betöltött szerepe nem teljesen ismert. U halofiták(erősen szikes talajon termő fajok) a nátrium nagy ozmotikus nyomást hoz létre a sejtnedvben, és ezáltal elősegíti a víz kivonását a talajból.
Toxicitás.
A nátrium magas kémiai aktivitása miatt a kezelése óvatosságot igényel. A vízzel való érintkezés nátriummal különösen veszélyes, ami tüzet és robbanást okozhat. A szemet védőszemüveggel, a kezét vastag gumikesztyűvel kell védeni; A nátrium nedves bőrrel vagy ruhával való érintkezése súlyos égési sérüléseket okozhat.
Az alkálifém tüzet vízzel nem lehet eloltani. A legjobb, ha szódaporral töltjük meg.
A marószóda súlyos égési sérüléseket okozhat, ha a bőrrel érintkezik, ezért a kristályos lúgot nem szabad kézzel fogni, csak fogóval vagy csipesszel. Ha lúgos oldat kerül a bőrére, először le kell mosni az oldatot, amíg a szappanos érzet el nem tűnik, nagy mennyiségű vízzel, majd bórsav oldattal semlegesíteni kell.
Bibliográfia.
Sittig M. „Nátrium, előállítása, tulajdonságai és alkalmazásai”, ford. angolból, 1961.
- Ripan R., Ceteanu I. „Inorganic chemistry”, 1. kötet, ford. románból, 1971.
Pavlov N.N. „Általános és szervetlen kémia”, „Drofa” kiadó, 2002.
Krjucskova-Csernobelskaya G.M. „Inorganic Chemistry”, 3. kiadás, „Orvostudomány” Kiadó, 1980.
NÁTRIUM- A (nátrium) Na, a periódusos rendszer 1. (Ia) csoportjába tartozó kémiai elem, a lúgos elemek közé tartozik. Atomszáma 11, relatív atomtömege 22,98977. A természetben egyetlen stabil izotóp van, a 23 Na. Ennek az elemnek hat radioaktív izotópja ismert, amelyek közül kettő a tudomány és az orvostudomány számára érdekes. A 2,58 éves felezési idejű nátrium-22-t pozitronforrásként használják. A nátrium-24-et (felezési ideje körülbelül 15 óra) a gyógyászatban a leukémia egyes formáinak diagnosztizálására és kezelésére használják.
Oxidációs állapot +1.
A nátriumvegyületek ősidők óta ismertek. A nátrium-klorid az emberi táplálék elengedhetetlen összetevője. Úgy tartják, hogy az emberek a neolitikumban kezdték használni, i.e. körülbelül 5-7 ezer évvel ezelőtt.
Az Ószövetség említ egy „neter” nevű anyagot. Ezt az anyagot mosószerként használták. Valószínűleg a neter szóda, egy nátrium-karbonát, amely a sós egyiptomi tavakban keletkezett, mészpartival. A görög szerzők, Arisztotelész és Dioszkoridész később ugyanarról az anyagról írtak, de „nitron” néven, az ókori római történész, Idősebb Plinius pedig, aki ugyanezt az anyagot említi, „nitrumnak” nevezte.
A 18. században A kémikusok már sokféle nátriumvegyületet ismertek. A nátriumsókat széles körben használták az orvostudományban, a bőr cserzésében és a szövetek festésében.
A fémes nátriumot először Humphry Davy angol kémikus és fizikus állította elő olvadt nátrium-hidroxid elektrolízisével (250 pár réz- és cinklemezből álló voltaikus oszlop segítségével). A Davy által erre az elemre választott "nátrium" név a szóda Na 2 CO 3 eredetét tükrözi. Az elem latin és orosz neve az arab „natrun” (természetes szóda) szóból származik.
A nátrium elterjedése a természetben és ipari kitermelése.
A nátrium a hetedik leggyakrabban előforduló elem és az ötödik leggyakrabban előforduló fém (alumínium, vas, kalcium és magnézium után). Tartalma a földkéregben 2,27%. A nátrium nagy része különféle alumínium-szilikátokban található.
A viszonylag tiszta formában lévő nátriumsók hatalmas lerakódásai minden kontinensen léteznek. Az ősi tengerek párolgásából származnak. Ez a folyamat még mindig tart Salt Lake-ben (Utah), a Holt-tengeren és más helyeken. A nátrium NaCl-klorid (halit, kősó), valamint karbonát Na 2 CO 3 NaHCO 3 2H 2 O (trona), nitrát NaNO 3 (sópéter), szulfát Na 2 SO 4 10H 2 O (mirabilit) formájában található. ), tetraborát Na 2 B 4 O 7 10 H 2 O (bórax) és Na 2 B 4 O 7 4H 2 O (kernit) és egyéb sók.
A természetes sóoldatokban és az óceánvizekben kimeríthetetlen nátrium-klorid készletek találhatók (kb. 30 kg m -3). Becslések szerint a Világóceán nátrium-klorid-tartalmának megfelelő mennyiségű kősó 19 millió köbméter térfogatot foglalna el. km (50%-kal több, mint az észak-amerikai kontinens tengerszint feletti teljes térfogata). Ilyen térfogatú prizma 1 négyzetméter alapterülettel. km-re 47-szer érheti el a Holdat.
Mára a tengervízből előállított teljes nátrium-klorid-termelés elérte az évi 6-7 millió tonnát, ami a világ össztermelésének körülbelül egyharmada.
Az élő anyag átlagosan 0,02% nátriumot tartalmaz; Az állatokban több van, mint a növényekben.
Egy egyszerű anyag és a fémnátrium ipari előállításának jellemzői.
A nátrium ezüstös-fehér fém, vékony rétegben lila árnyalatú, műanyag, még puha (késsel könnyen vágható), a nátrium friss vágása fényes. A nátrium elektromos vezetőképességének és hővezető képességének értékei meglehetősen magasak, sűrűsége 0,96842 g/cm 3 (19,7 ° C-on), olvadáspontja 97,86 ° C, forráspontja 883,15 ° C.
A 12% nátriumot, 47% káliumot és 41% céziumot tartalmazó háromkomponensű ötvözet fémrendszereknél a legalacsonyabb olvadáspontja -78 °C.
A nátrium és vegyületei élénksárgára színezik a lángot. A nátrium-spektrum kettős vonala a 3-as átmenetnek felel meg s 1-3p 1 az elem atomjaiban.
A nátrium kémiai aktivitása magas. Levegőben gyorsan beborítja a peroxid, hidroxid és karbonát keverékéből álló filmréteget. A nátrium oxigénben, fluorban és klórban ég. Fém égetésekor a levegőben Na 2 O 2 peroxid képződik (Na 2 O oxid keverékével).
A nátrium habarcsban őrölve reagál a kénnel, és a kénsavat kénné vagy akár szulfiddá redukálja. A szilárd szén-dioxid („szárazjég”) nátriummal érintkezve felrobban (szén-dioxidos tűzoltó készülék nem használható nátriumtűz oltására!). Nitrogénnel a reakció csak elektromos kisülésben megy végbe. A nátrium nem csak inert gázokkal lép kölcsönhatásba.
A nátrium aktívan reagál vízzel:
2Na + 2H 2O = 2NaOH + H2
A reakció során felszabaduló hő elegendő a fém megolvadásához. Ezért ha egy kis nátriumdarabkát vízbe dobunk, az a reakció hőhatása miatt megolvad, és a reaktív erő hatására egy csepp, a víznél könnyebb fém „fut” végig a víz felszínén. a felszabaduló hidrogénből. A nátrium sokkal nyugodtabban reagál alkoholokkal, mint vízzel:
2Na + 2C 2 H 5 OH = 2 C 2 H 5 ONa + H 2
A nátrium könnyen feloldódik folyékony ammóniában, és szokatlan tulajdonságokkal rendelkező, élénkkék metastabil oldatokat képez. -33,8 °C-on legfeljebb 246 g fémnátrium oldódik 1000 g ammóniában. A híg oldatok kékek, a tömény oldatok bronzosak. Körülbelül egy hétig tárolhatók. Megállapítást nyert, hogy a folyékony ammóniában a nátrium ionizál:
Ennek a reakciónak az egyensúlyi állandója 9,9·10 -3. A kilépő elektront az ammónia molekulák szolvatálják és komplexet képeznek -. A kapott oldatok fémes elektromos vezetőképességgel rendelkeznek. Amikor az ammónia elpárolog, az eredeti fém megmarad. Ha az oldatot hosszú ideig tárolják, az fokozatosan elszíneződik a fémnek ammóniával való reakciója következtében, így NaNH 2 amid vagy Na 2 NH imid képződik, és hidrogén szabadul fel.
A nátriumot dehidratált folyadékréteg alatt (kerozin, ásványolaj) tárolják, és csak lezárt fémtartályokban szállítják.
A nátrium ipari előállítására szolgáló elektrolitikus módszert 1890-ben fejlesztették ki. Az elektrolízist olvadt nátrium-hidroxidon végezték, mint Davy kísérleteiben, de fejlettebb energiaforrások felhasználásával, mint a voltikus oszlop. Ebben a folyamatban a nátriummal együtt oxigén szabadul fel:
anód (nikkel): 4OH - - 4e - = O 2 + 2H 2 O.
A tiszta nátrium-klorid elektrolízise során komoly problémák merülnek fel, amelyek egyrészt a nátrium-klorid közeli olvadáspontjával és a nátrium forráspontjával, másrészt a nátrium folyékony nátrium-kloridban való nagy oldhatóságával kapcsolatosak. Kálium-klorid, nátrium-fluorid, kalcium-klorid hozzáadása a nátrium-kloridhoz lehetővé teszi az olvadék hőmérsékletének 600 °C-ra csökkentését. Nátrium előállítása olvadt eutektikus keverék (két legalacsonyabb olvadáspontú anyag ötvözete) elektrolízisével 40% NaCl és 60% CaCl 2 ~580°C-on egy G. Downs amerikai mérnök által kifejlesztett cellában, 1921-ben a DuPont indította el a Niagara Falls-i erőmű közelében.
Az elektródákon a következő folyamatok mennek végbe:
katód (vas): Na + + e - = Na
Ca 2+ + 2e - = Ca
anód (grafit): 2Cl - - 2e - = Cl 2.
A nátrium és a kalcium fémek hengeres acélkatódon képződnek, és egy lehűtött cső emeli fel őket, amelyben a kalcium megszilárdul és visszahullik az olvadékba. A központi grafit anódon keletkező klórt a nikkeltető alá gyűjtik, majd megtisztítják.
Jelenleg a fémnátrium termelési volumene több ezer tonna évente.
Hasonló cikkek
-
...Mesélnél erről, hány években éltél?
. Akhmatova A. Bátorság. Tudjuk, mi fekszik most a mérlegen És mi történik most. A bátorság órája ütött óránkon, S a bátorság nem hagy el bennünket. Nem ijesztő holt golyók alatt feküdni, Nem keserű hajléktalannak maradni, És mi meg fog menteni, orosz...
-
Egészségügyi okokból képtelenség miatt
1. A SZovjetunió ALELNÖK RENDELTETE Mihail Szergejevics Gorbacsovnak egészségügyi okokból a Szovjetunió elnöki tisztségének ellehetetlenítésével kapcsolatban, a Szovjetunió Alkotmányának 127/7. teljesíti a feladatait...
-
Mi a teendő, ha százan késik a javítást a kötelező gépjármű-biztosítás keretében
Azonnal állítsa meg a járművet (a továbbiakban: jármű), és kapcsolja be a vészvillogót. Elakadásjelző háromszög elhelyezése (lakott területen a járműtől legalább 15 m-re, lakott területen kívül legalább 30 m-re). Csatlakoztasd...
-
Van élet a Death Valleyben?
1959-ben Khalmer-Yu és Csementnozavodsky működő falvakat a szomszédos széntelepekkel: Vorgashorskoye, Syryaginskoye és Khalmer-Juskoye szénlelőhelyek áthelyezték a nyenyec NO-tól a Komi Autonóm Szovjet Szocialista Köztársaságba.
-
Hogyan készítsünk zebratortát a sütőben
A tojásokat a cukorral, a sóval és a vaníliás cukorral habosra keverjük. Majd a kapott masszához adjuk az olvasztott és kihűlt vajat és az ecettel locsolt szódát. A liszt teljes tömegéből különíts el 3 evőkanál...
-
Mit kell főzni körtéből gyorsan és ízletesen
Néha a receptek lapjait lapozgatva a fotóra fókuszálunk, és szemünkkel megesszük a képet. Pontosan a képen látható módon szeretnénk elkészíteni, de... a recepteket követve és próbálkozva néha azt vesszük észre, hogy a fotó és az igazi desszert nagyon más...
