Kako se dobija mlečna kiselina? Hemijska i fizička svojstva mliječne kiseline Priručnik o kemijskim tvarima mliječne kiseline
Kataloški broj za mliječnu kiselinu: CAS 50-21-5
Opis mliječne kiseline:
Gotovo prozirna, blago žućkasta higroskopna sirupasta tečnost sa blago kiselkast miris, koji podsjeća na miris usivljenog mlijeka. Rastvorljiv u vodi, etanolu, slabo rastvorljiv u benzenu, hloroformu i drugim halogenizovanim ugljovodonicima. Postoje različiti optički aktivni izomeri D i L oblika. I također optički neaktivna mješavina D i L. Potonji se dobiva kemijskom sintezom, a aktivni oblici bakterijskom sintezom. (enzimska metoda) U ljudskom organizmu u Krepsovom ciklusu učestvuje optički aktivan oblik L, zbog čega se preporučuje da se koristi kao aditiv (mliječna kiselina, E270), u drugim industrijama to nije igraju posebnu ulogu.
Globalni naziv Mliječna kiselina nije se ukorijenio u Rusiji, ali naziv njenih laktatnih soli nalazi se posvuda, mnogo češće od kalcijum mliječne kiseline, smanjujemo kalcijum laktat.
Specifikacija za mliječnu kiselinu 80%.
Tačka ključanja (100% rastvor) 122 °C (115 mm Hg)
Specifična težina (20 °C) 1.22
Rastvorljivost u vodi Potpuno rastvorljiv
Gustina (na 20°C) 1,18-1,20 g/ml
Teški metali, ne više od 0,001%
Sadržaj gvožđa, ne više od 0,001%
Sadržaj arsena, ne više od 0,0001%
Sadržaj hlorida, ne više od 0,002% (stvarno 0,0015%)
Sadržaj sulfata, ne više od 0,01% (stvarno 0,004%)
Ostatak nakon kalcinacije, ne više od 0,1% (stvarno 0,06%)
Proizvođač: kina
Pakovanje: Bačve od 25 kg ili kocke od 1200 kg
Osnovna fizička svojstva mliječne kiseline:
Tačka topljenja: 17°C Za optički neaktivne (racemske),
25-26 °C optički aktivna + ili - forma
(razlike u temperaturama topljenja omogućavaju kvalitativno i brzo razlikovanje skupljih optički aktivnih oblika od jeftinijih neaktivnih!!)
Relativna gustina(voda = 1): 1.2
Rastvorljivost u vodi: miješa se
Molekulska težina: 90,08 g/mol
Tačka paljenja: 110°C c.c.
Koeficijent raspodjele oktanol/voda kao log Pow: -0,6
Opasnost od eksplozije i požara:
Podržava sagorevanje na normalnim uslovima. spontano sagorevanje je malo verovatnoIzbjegavajte otvoreni plamen i pušenje.
Gašenje požara: prahom, penom otpornom na alkohol, vodom za prskanje,
ugljen-dioksid.
Hemijska stabilnost: Stabilno na normalne temperature i pritisak.
Uslovi koje treba izbegavati: Stvaranje prašine, prekomerna toplota.
Nekompatibilnost sa drugim materijalima: Jaki oksidanti, mineralne kiseline.
Opasni proizvodi raspadanja: dušikovi oksidi, ugljen monoksid, ugljen-dioksid, parovi
cijanid.
Opasna polimerizacija: Nije označeno.
Opasnost po ljude:
Putevi ulaska u organizam: Supstanca se može apsorbirati u tijelo udisanjem aerosola i kroz usta.
Kod kratkotrajnog izlaganja koncentracijama koje prelaze MPC: Supstanca iritira kožu i Airways, a također ima korozivnu
efekat na oči. Korozivno ako se proguta.
U slučaju kontakta očima: Crvenilo. Bol. Teške duboke opekotine. Zaštitne naočare-maska, ili
zaštitna maska. Prvo isperite veliki iznos vode za nekoliko
minuta (ukloniti Kontaktne leće, ako to nije teško), onda odnesite ljekaru.
Standardi radnog područja:
TLV (US TLV) nije utvrđen.
karcinogenost: Nije na listi ACGIH, IARC, NTP ili CA Prop 65.
epidemiologija: Nema informacija.
tetratogenost: Nema informacija.
Reproduktivni efekti: Nema informacija.
mutagenost: nema informacija
Neurotoksičnost: Nema informacija.
Eksperimenti na životinjama su pokazali:
LD50/LC50:
Draize test, zec, oči: 100 mg Teška;
Draize test, zec, koža: 500 mg/24H Blagi;
Udisanje, pacov: LC50 = >26 mg/m(cc)/1H;
Oralno, miš: LD50 = 1940 mg/kg;
Oralno, pacov: LD50 = 1700 mg/kg;
Koža, zec: LD50 = >10 gm/kg;
Pažnja. Daju se informacije o koncentratu supstance, u male količine i koncentracije mliječne kiseline, prema dostupnim podacima ovog trenutka podaci bezopasni!
Mliječna kiselina(2-hidroksipropionska kiselina) CH 3 CH(OH)COOH, molekulska težina 90,1; bezbojan. Poznate su L(+)-mliječna kiselina, D(-)-mliječna (mesno-mliječna) kiselina i mliječna kiselina fermentacije racemske mliječne kiseline. Za D, L- i D-mliječnu kiselinu, tačka topljenja odgovara 18 °C i 53 °C; t. bale odn. 85°C/1 mmHg i 103°C/2mmHg; za D-mliječnu kiselinu [α] D 20 -2,26 (koncentracija 1,24% u . Za D,L-mliječnu kiselinu D H 0 uzorak - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H isp 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Za L-mliječnu kiselinu D H 0 sagorijevanje - 1344,8 kJ/mol; D H 0 obp -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
Zbog visoke higroskopnosti mliječne kiseline, obično se koriste njene koncentrirane vodene otopine - sirupaste, bezbojne, bez mirisa. Za vodeni rastvori mlečne kiseline d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 i 28,5 mPa. s (25 0 C) odn. za 45,48 i 85,32% rastvora; g 46.0. 10 -3 N/m (25°C) za 1 M rastvor; e 22 (17°C). Mliječna kiselina je rastvorljiva u, ali slabo rastvorljiva u, i drugim halougljovodonicima; R K a 3,862 (25 °C); pH vodenih rastvora 1,23 (37,3%), 0,2 (84,0%).
Mliječna kiselina dehidrira do akrilne kiseline, kada se zagreje sa HBr formira 2-bromopropionsku kiselinu, kada Ca so reaguje sa PCl 5 ili SOCl 2 -2-hloropropionil hloridom. U prisustvu mineralnih kiselina dolazi do autoesterifikacije mliječne kiseline sa stvaranjem formule I, kao i linearnih poliestera. Kada mliječna kiselina reagira, nastaju hidroksi kiseline RCH 2 CH(OH)COOH, a kada mliječna kiselina reagira s alkoholima, nastaju estri. Soli i estri mliječne kiseline nazivaju se laktati (vidi tabelu).
mliječna kiselina nastaje kao rezultat mliječne kiseline (prilikom kiseljenja mlijeka, kiselog kupusa, kiseljenja povrća, zrenja sira, siliranja hrane); D-mliječna kiselina se nalazi u tkivima životinja, biljaka, a također i u mikroorganizmima.
U industriji se mliječna kiselina proizvodi od 2-kloropropionske kiseline i njene (100 °C) ili laktonitrila CH 3 CH(OH)CN (100 °C, H 2 SO 4) s naknadnim stvaranjem estera, izolacijom i hidrolizom što dovodi do visokokvalitetnog proizvoda. Poznate su i druge metode za proizvodnju mliječne kiseline: oksidacija propilena dušikovim oksidima (15-20°C) nakon čega slijedi tretman sa H 2 SO 4, interakcija CH 3 CHO sa CO (200 ° C, 20 MPa).
SVOJSTVA NEKIH LAKTATA

mliječna kiselina se koristi u Prehrambena industrija, u jedljivom bojenju, u štavljenju, u fermentacionim radnjama kao baktericidno sredstvo, za dobijanje lijekovi, plastifikatori. Etil i butil laktati se koriste kao rastvarači za celulozne etere, ulja za sušenje, biljna ulja; butil laktat - također kao rastvarač za neke sintetičke polimere.
Svjetska proizvodnja mliječne kiseline iznosi 40 hiljada tona (1983).
Lit.: Holten C.H., Mliječna kiselina. Svojstva i hemija. Mliječne kiseline i derivati, Weisheim, 1971. Yu. A. Treger.
Odaberite prvo slovo u naslovu članka:
Hidroksi kiseline (alkoholne kiseline) su derivati karboksilnih kiselina koji sadrže jednu, dvije ili više hidroksilnih grupa u radikalu povezanom s karboksilom.
U zavisnosti od broja karboksilnih grupa, hidroksi kiseline se dele na jednobazne, dvobazne itd.; Ovisno o ukupnom broju hidroksilnih grupa, hidroksi kiseline se dijele na mono- ili polihidrične.
Prema prirodi radikala, hidroksi kiseline su zasićene i nezasićene, aciklične, ciklične ili aromatične.
U hidroksi kiselinama se javljaju sljedeće vrste izomerizma:
strukturalni(izomerizam lanca radikala, izomerizam relativnih položaja karboksila i hidroksila);
optički(ogledalo) zbog prisustva asimetričnih atoma ugljika.
Hidroksi kiseline se nazivaju po imenu kiseline sa dodatkom "oksi" ili "dioksi" itd. Trivijalna nomenklatura je također u širokoj upotrebi.
HO–CH 2 –COOH
glikol (hidroksioctena kiselina)
mlijeko (α-hidroksipropionsko)
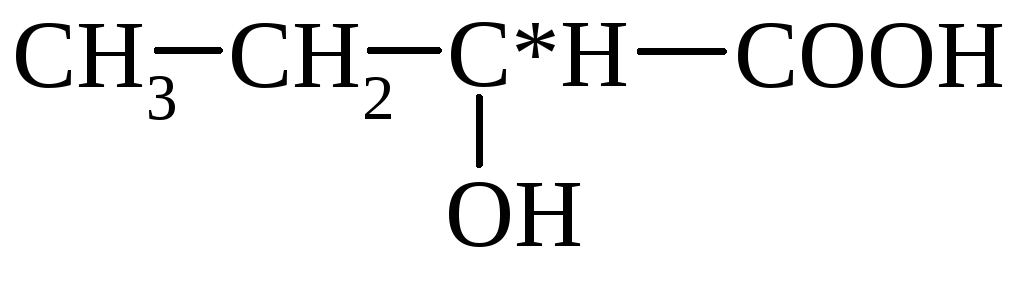

α-hidroksimaslačna β-hidroksibutirna
(2-hidroksibutan) (3-hidroksibutan)
Fizička svojstva. Niže hidroksi kiseline su najčešće guste, sirupaste supstance. Hidroksi kiseline se miješaju s vodom u bilo kojem omjeru, a s povećanjem molekularne težine, topljivost se smanjuje.
Hemijska svojstva.
1. Svojstva kiselina– hidroksi kiseline daju sve reakcije karakteristične za karboksil: stvaranje soli, estera, amida, kiselih halogenida itd. Hidroksi kiseline su jači elektroliti od odgovarajućih karboksilnih kiselina (učinak hidroksilne grupe).

2. Alkoholna svojstva– reakcije supstitucije vodonika u hidroksi grupi, formiranje etera i estera, zamena –OH halogenom, intramolekularna dehidratacija, oksidacija.
hlorocteni glikol glioksal
kiselina kiselina kiselina
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
estar glikolne kiseline i metil alkohola
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glikol metil metil eter
kiseli alkohol metoksisirćetna kiselina
(cijela emisija)
3. Odnos hidroksi kiselina prema zagrijavanju - kada se zagrije, α-hidroksi kiseline odvajaju vodu, formirajući ciklični estar, izgrađen od dva molekula α-hidroksi kiselina:

laktid α-hidroksipropionske kiseline
β-hidroksi kiseline pod istim uslovima lako gube vodu i formiraju nezasićene kiseline.
HO–CH 2 –CH 2 –COOH 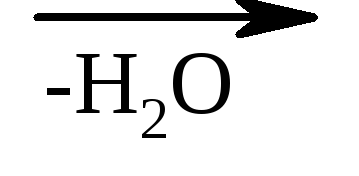 CH 2 =CH–COOH
CH 2 =CH–COOH
β-hidroksipropionska akrilna kiselina
γ-hidroksi kiseline takođe mogu izgubiti molekul vode da bi formirale intramolekularne estre - laktone.

HO–CH 2 –CH 2 –CH 2 –COOH
γ-hidroksibuterna kiselina
γ-butirolakton
Neke hidroksi kiseline se dobivaju iz prirodnih proizvoda. Tako se mliječna kiselina dobiva mliječno kiselom fermentacijom slatkih tvari. Sintetičke metode pripreme baziraju se na sljedećim reakcijama:
1) Cl–CH 2 –COOH + HOH  HO–CH 2 –COOH;
HO–CH 2 –COOH;
monohlorocteni glikol
kisela kiselina
2) CH 2 =CH–COOH + HOH  HO–CH 2 –CH 2 –COOH.
HO–CH 2 –CH 2 –COOH.
akrilna kiselina β-hidroksipropionska kiselina
Predstavnici hidroksi kiselina.
Glikolni (hidroksisirćetna) kiselina je kristalna supstanca koja se nalazi u nezrelom voću, soku cvekle, repi i drugim biljkama. U industriji se dobiva redukcijom oksalne kiseline. Koristi se za bojenje (kaliko štampa).
Mliječna kiselina (α-hidroksipropionska) – gusta tečna ili topiva kristalna masa. Mliječna kiselina nastaje mliječno kiselom fermentacijom šećera, pod djelovanjem bakterija mliječne kiseline. Sadrži u fermentisanim mlečnim proizvodima, kiselom kupusu, silaži. Koristi se u jedljivom bojenju, štavljenju i medicini.
Mliječna kiselina se nalazi u životinjskom mišićnom soku i mesnim ekstraktima.
Dijatomski glicerinska kiselina učestvuje u životnim procesima biljaka i životinja.

Askorbinska kiselina (vitamin C) je kristalna supstanca koja se nalazi u svežem voću, limunu, crnoj ribizli, sveže povrće- kupus, pasulj. Sintetički, vitamin C se dobija oksidacijom polihidričnog alkohola sorbitola.
 α-askorbinska kiselina
α-askorbinska kiselina
Askorbinska kiselina se lako razlaže atmosferskim kiseonikom, posebno kada se zagreje
Aciklično dva-i trobazične hidroksi kiseline.
Apple (hidroksisukcinska) kiselina (HOOC–CHOH–CH 2 –COOH) je kristalna supstanca, visoko rastvorljiva u vodi; koristi se u medicini, nalazi se u nezrelom čamcu, žutici, rabarbari, soku od grožđa, vinu.
Vino (vinska, dihidroksisukcinska) kiselina (HOOC–*CHOH–*CHOH–COOH) ima 2 asimetrična atoma ugljika i stoga ima 4 optička izomera. Formira kisele kalijeve soli, koje su slabo rastvorljive u vodi i talože se. U vinu (tartaru) mogu se uočiti kristali soli. Mešana kalijum-natrijumova so se zove Rochelle so. Soli vinske kiseline nazivaju se tartrati.


krema od tartara, seignette so
Vinska kiselina je česta u biljkama (oren, grožđe, itd.).
Limunova kiselina
 nalazi u citrusnom voću. U industriji se dobija iz plodova limuna oksidacijom šećera gljivice plijesni, pri obradi iglica smreke.
nalazi u citrusnom voću. U industriji se dobija iz plodova limuna oksidacijom šećera gljivice plijesni, pri obradi iglica smreke.
Limunska kiselina je biološki važan spoj koji učestvuje u metabolizmu. Koristi se u medicini, prehrambenoj i tekstilnoj industriji kao dodatak bojama.
Ciklične monobazne polihidrične hidroksi kiseline su dio žučnih kiselina i drugih fiziološki važnih spojeva; na primjer, auksin pospješuje rast biljaka.
Aromatične hidroksi kiseline dijele se na fenolne kiseline i aromatične masne kiseline koje sadrže hidroksil u bočnom lancu.


o-hidroksibenzojeva bademova kiselina
(salicilna kiselina
Salicilna kiselina nalazi se u nekim biljkama u slobodnom obliku (kalendula), ali češće u obliku estera. U industriji se dobiva zagrijavanjem natrijevog fenolata sa ugljičnim dioksidom. Koristi se kao dezinfekciono sredstvo i u sintezi boja. Mnogi derivati salicilne kiseline se koriste kao lijekovi (aspirin, salol).


aspirin salol (fenil ester
(acetilsalicilna kiselina) salicilna kiselina)
Galna kiselina (3,4,5-trioksibenzojev).

Sadrži se u listovima čaja, hrastovoj kori i stablu nara. Industrijski se dobiva iz tanina kuhanjem s razrijeđenim kiselinama. Koristi se za pravljenje mastila, u fotografiji i u medicini kao antiseptik. Galna kiselina i njeni derivati se naširoko koriste kao konzervansi za mnoge prehrambeni proizvodi(masti, visokokvalitetni sapuni, mliječni proizvodi), ima svojstva štavljenja i od posebnog je značaja u proizvodnji kože i jedljivom bojenju.
Mandelic acid odnosi se na aromatične masne kiseline (C 6 H 5 – CH (OH) – COOH), koje se nalaze u amigdalinu, senfu, bazgi itd.
Tanini često su derivati polihidričnih fenola. Oni su dio biljaka i dobivaju se iz ekstrakata kore, drveta, lišća, korijena, plodova ili izraslina (žuči).
Tanini su najvažniji tanini. Ovo je mješavina različitih kemijskih spojeva, od kojih su glavni estri galne i digalne kiseline i glukoze ili polihidričnih alkohola.

Dg-digalna kiselina

m-digalna kiselina
Tanin pokazuje svojstva fenola i estera. Sa otopinom željeznog hlorida formira crni kompleksni spoj. Tanini se široko koriste kao ekstrakti za štavljenje, jedila za bojenje pamučnih tkanina, kao adstringensi u medicini (imaju baktericidna i hemostatska svojstva), te su konzervansi.
Lipidi uključuju organske tvari, od kojih su mnoge estri masnih kiselina visoke molekularne težine i polihidričnih alkohola - masti, fosfatidi, voskovi, steroidi, masne kiseline visoke molekularne težine itd.
Lipidi se nalaze uglavnom u sjemenkama biljaka, jezgri orašastih plodova, te u životinjskim organizmima - u masnom i nervnom tkivu, posebno u mozgu životinja i ljudi.
Prirodne masti su mješavine estera trihidričnog alkohola glicerola i viših karboksilnih kiselina, tj. mješavine glicerida ovih kiselina.
O 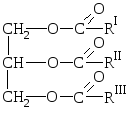 opšta formula masti:
opšta formula masti:
gdje su R I R II R III ugljikovodični radikali viših masnih kiselina normalna struktura sa parnim brojem atoma ugljika. Masti mogu sadržavati ostatke i zasićenih i nezasićenih kiselina.
Zasićene kiseline:
C 15 H 31 COOH – palmitinska;
C 17 H 35 COOH – stearinska;
C 3 H 7 COOH – ulje (sadržano u puter) i sl.
Nezasićene kiseline:
C 17 H 33 COOH – oleinska;
C 17 H 31 COOH – linolna;
C 17 H 29 COOH – linolenski itd.
Masti se dobijaju iz prirodnih izvora životinjskog i biljnog porekla.
Fizička svojstva masti su zbog njihovog kiselog sastava. Masti koje sadrže uglavnom ostatke zasićenih kiselina su čvrste ili pastozne supstance (jagnjeća, goveđa mast, itd.) Masti koje sadrže uglavnom ostatke nezasićenih kiselina imaju tečne konzistencije na sobnoj temperaturi i nazivaju se uljima. Masti se ne rastvaraju u vodi, ali se dobro rastvaraju u organskim rastvaračima: eter, benzol, hloroform itd.
Hemijska svojstva. Kao i svi estri, masti podležu hidrolizi. Hidroliza se može dogoditi u kiseloj, neutralnoj ili alkalnoj sredini.
1. Hidroliza kiseline.

Slični članci
-
Teorijske osnove selekcije Proučavanje novog gradiva
Predmet – biologija Čas – 9 „A“ i „B“ Trajanje – 40 minuta Nastavnik – Želovnikova Oksana Viktorovna Tema časa: „Genetičke osnove selekcije organizama“ Oblik nastavnog procesa: čas u učionici. Vrsta lekcije: lekcija o komuniciranju novih...
-
Divni Krai mlečni slatkiši "kremasti hir"
Svi znaju kravlje bombone - proizvode se skoro stotinu godina. Njihova domovina je Poljska. Originalni kravlji je mekani karamela sa filom od fudža. Naravno, vremenom je originalna receptura pretrpjela promjene, a svaki proizvođač ima svoje...
-
Fenotip i faktori koji određuju njegovo formiranje
Danas stručnjaci posebnu pažnju posvećuju fenotipologiji. Oni su u stanju da za nekoliko minuta “dođu do dna” osobe i ispričaju mnogo korisnih i zanimljivih informacija o njoj Osobitosti fenotipa Fenotip su sve karakteristike u cjelini,...
-
Genitiv množine bez završetka
I. Glavni završetak imenica muškog roda je -ov/(-ov)-ev: pečurke, teret, direktori, rubovi, muzeji itd. Neke riječi imaju završetak -ey (stanovnici, učitelji, noževi) i nulti završetak (čizme, građani). 1. Kraj...
-
Crni kavijar: kako ga pravilno servirati i ukusno jesti
Sastojci: Crni kavijar, prema vašim mogućnostima i budžetu (beluga, jesetra, jesetra ili drugi riblji kavijar falsifikovan kao crni) krekeri, beli hleb meki puter kuvana jaja svež krastavac Način pripreme: Dobar dan,...
-
Kako odrediti vrstu participa
Značenje participa, njegove morfološke osobine i sintaktička funkcija Particip je poseban (nekonjugirani) oblik glagola, koji radnjom označava svojstvo objekta, odgovara na pitanje koji? (šta?) i kombinuje osobine.. .
