Синдром дыхательных расстройств у новорожденных. Основные клинические синдромы при заболеваниях системы органов дыхания
Кафедра пропедевтики внутренних болезней
Методическая разработка
Для самостоятельной работы студентов III курса
Тема: «Основные клинические синдромы при заболеваниях органов дыхания»
Ставрополь
Основные клинические синдромы при заболеваниях
органов дыхания
Синдром – это совокупность симптомов, объединённых единым механизмом развития (патогенезом)
Выделяют следующие лёгочные синдромы:
1. Синдром нормальной лёгочной ткани
2. Синдром очагового уплотнения лёгочной ткани
3. Синдром долевого уплотнения лёгочной ткани
4. Синдром полости в лёгочной ткани
5. Синдром обтурационного ателектаза
6. Синдром компрессионного ателектаза
7. Синдром скопления жидкости в плевральной полости
8. Синдром скопления воздуха в плевральной полости
9. Синдром избыточного содержания воздуха в лёгких
10. Синдром сужения бронхов вязким экссудатом
11. Синдром бронхообструкции
12. Синдром фиброторакса или шварт
13. Синдром дыхательной недостаточности
Совокупность симптомов при том или ином лёгочном синдроме обнаруживается при использовании основных (общий осмотр, осмотр грудной клетки, пальпация, перкуссия, аускультация) и дополнительных (рентгенография органов грудной клетки, анализ крови и мокроты) методов исследования.
Синдром нормальной лёгочной ткани
^
Жалобы: нет
Осмотр грудной клетки : грудная клетка правильной формы, обе половины грудной клетки симметричны, принимают одинаковое участие в акте дыхания. Число дыхательных движений 16-18 в минуту. Дыхание ритмичное, тип дыхания – смешанный.
Пальпация
Перкуссия : над всей поверхностью лёгочной ткани определяется ясный лёгочный звук.
Аускультация : над всей поверхностью лёгочной ткани выслушивается везикулярное дыхание, побочных дыхательных шумов нет.
Рентгенологически : лёгочная ткань прозрачная.
Исследование крови и мокроты : нет изменений.
^
Синдром очагового уплотнения лёгочной ткани

Для этого синдрома характерно образование небольших очагов уплотнения, окружённых нормальной лёгочной тканью.
^ Встречается при:
А) очаговой пневмонии (бронхопневмонии), альвеолы заполняются воспалительной жидкостью и фибрином.
Б) инфаркте лёгкого (альвеолы заполняются кровью)
В) пневмосклерозе, карнификации (прораста-ние ткани лёгкого соединительной или опухолевой тканью)
Патоморфология: лёгочная ткань уплотнена, но содержит некоторое количество воздуха.
^ Жалобы : одышка, кашель.
Общий осмотр : нет изменений.
Осмотр грудной клетки : некоторое отставание «больной» половины грудной клетки при дыхании.
Пальпация : грудная клетка безболезненная, эластичная. Голосовое дрожание усилено при крупном пневмоническом очаге, расположенном поверхностно.
Перкуссия
Аускультация : бронховезикулярное дыхание, влажные мелко – и
Среднепузырчатые звучные хрипы, локализованные на определённом участке. Бронхофония усилена.
Рентгенологически : очаги воспалительной инфильтрации лёгочной
Ткани чередуются с участками нормальной ткани лёгкого, возможно усиление лёгочного рисунка в «поражённом сегменте».
^ Исследование крови : умеренный лейкоцитоз, ускоренная СОЭ.
Исследование мокроты
: мокрота слизистая, может быть с прожилками крови, содержит небольшое количество лейкоцитов, эритроцитов.
^
Синдром долевого уплотнения лёгочной ткани
П ри этом синдроме, в отличие от синдрома очагового уплотнения лёгочной ткани, в процесс вовлекается целая доля лёгкого.
ри этом синдроме, в отличие от синдрома очагового уплотнения лёгочной ткани, в процесс вовлекается целая доля лёгкого.
^
Встречается при:
а) крупозной пневмонии (плевропневмо-нии), альвеолы заполняются воспалительной жидкостью и фибрином.
б) пневмосклерозе, карнификации (прорастание доли лёгкого соединительной и опухолевой тканью).
Физикальные данные при крупозной пневмонии :
Патоморфология : лёгочная ткань уплотнена, но содержит некоторое количество воздуха (I-III стадия), лёгочная ткань плотная безвоздушная (II стадия).
^ Жалобы : боль в грудной клетке, одышка, кашель.
Общий осмотр : акроцианоз носогубного треугольника, герпетические высыпания на губах, носу.
Осмотр грудной клетки : отставание “больной“ половины грудной клетки при дыхании.
Пальпация : болезненность в поражённой половине грудной клетки, голосовое дрожание несколько усилено (I-III стадия), значительно усилено (II стадия).
Перкуссия : притупление перкуторного звука с тимпаническим оттенком в I-III стадию, тупость во II стадию (плотное безвоздушное лёгкое).
Аускультация : ослабленное везикулярное дыхание с бронхиальным оттенком в I-III стадию, бронхиальное во II стадию. Начальная крепитация (crepitatio indux) в I стадию, крепитация разрешения (crepitatio redux) в III стадию.
Бронхофония несколько или значительно усилена. Возможен шум трения плевры.
Рентгенологически : гомогенное затемнение лёгочной ткани, охватывающее сегмент или долю лёгкого.
^ Исследование крови : лейкоцитоз, ускоренная СОЭ.
Исследование мокроты
: мокрота слизисто-гнойная, с примесью крови («ржавая»), содержит много лейкоцитов, эритроцитов
^
Синдром полости в лёгочной ткани
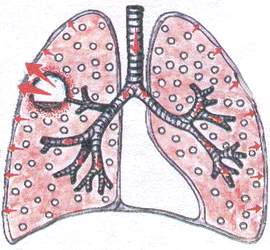
Для диагностики полости физикальными методами исследования, она должна отвечать следующим условиям:
диаметр полости должен быть не менее 4см.
полость должна быть связана с бронхом.
полость должна быть «пустой ».
полость «старая», с плотными краями.
полость должна быть расположена поверхностно.
Этот синдром встречается при:
а) абсцессе лёгкого
б) бронхоэктатической болезни
Г) при распаде лёгочной ткани
Жалобы : кашель с гнойной мокротой в большом количестве, чаще полным ртом, септическая температура с ночным проливным потом (характерны для абсцесса лёгкого, бронхоэктазов), кашель с кровянистой мокротой или с прожилками крови (при кавернозном туберкулёзе, распаде лёгочной ткани).
^ Общий осмотр : акроцианоз, диффузный цианоз, изменение концевых фаланг («барабанные палочки», «часовые стёкла»).
Осмотр грудной клетки : отставание «больной» половины грудной клетки при дыхании, тахипное.
Пальпация : иногда грудная клетка болезненна, голосовое дрожание усилено.
Перкуссия : притупленно-тимпанический звук, при крупной полости, расположенной на периферии – тимпанический звук с металлическим оттенком.
Аускультация: бронхиальное или амфорическое дыхание, влажные средне- и крупнопузырчатые звучные хрипы. Бронхофония усилена.
Рентгенологически: на фоне затемнения наблюдается просветление лёгочной ткани с горизонтальным уровнем жидкости.
^ Исследование крови : гиперлейкоцитоз, значительно ускоренная СОЭ, возможна анемии.
Исследование мокроты : мокрота гнойная, может быть с примесью крови, содержит большое количество лейкоцитов, могут быть эритроциты, эластические волокна.
^
Синдром обтурационного ателектаза
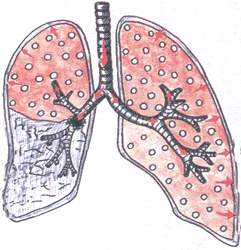
При этом синдроме наблюдается спадение лёгочной ткани в результате частичной или полной закупорки крупного бронха опухолью, увеличенными лимфатическими узлами, инородным телом.
Патоморфология : при полной закупорке бронха, воздух в лёгкие не поступает, лёгочная ткань – плотная. При частичной закупорке бронха, лёгочная ткань уплотнена, но содержит небольшое количество воздуха.
^ Жалобы : выраженная одышка, кашель, боль в грудной клетке.
Общий осмотр : бледность кожных покровов, умеренный цианоз.
Осмотр грудной клетки : при длительной закупорке наблюдается западение «больной» половины грудной клетки (спавшаяся лёгочная ткань занимает меньше места), тахипное, отставание «больной» половины при глубоком дыхании.
Пальпация : некоторая ригидность «поражённой половины грудной клетки. Голосовое дрожание ослаблено при частичной закупорке бронха, резко ослаблено или совсем не проводится при полной закупорке приводящего бронха (нет условий для проведения воздуха).
Перкуссия : при неполной закупорке бронха притуплённо-тимпанический звук, при полной закупорке – абсолютно тупой звук.
Аускультация : дыхание ослабленное везикулярное или совсем не выслушивается. Бронхофония резко ослаблена или совсем не проводится.
Рентгенологически : гомогенная тень в области ателектаза. Сердце и крупные сосуды перетянуты в «больную» сторону.
Исследование крови и мокроты : особых изменений не будет.
^
Синдром компрессионного ателектаза
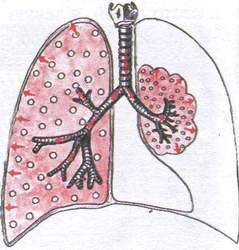
Этот синдром наблюдается при сдавлении лёгочной ткани из вне жидкостью (гидроторакс), либо воздухом (пневмоторакс).
Патоморфология : лёгочная ткань уплотнена, но содержит некоторое количество воздуха, так как связь с бронхом не нарушена и в легкие продолжает поступать воздух.
^ Жалобы : одышка, кашель, боль в грудной клетке.
Общий осмотр : цианоз, изменение концевых фаланг («барабанные палочки»).
Осмотр грудной клетки : выпячивание «больной» половины грудной клетки за счёт скопления жидкости или воздуха в плевральной полости, тахипное, отставание «больной» половины при дыхании.
Пальпация : ригидность «поражённой» половины грудной клетки, голосовое дрожание несколько усилено.
Перкуссия: притупление с тимпаническим оттенком.
Аускультация : дыхание ослабленное везикулярное с бронхиальным оттенком или бронхиальное (создались условия для его проведения- лёгочная ткань плотная).
Рентгенологически : в области ателектаза гомогенная тень, связанная с бронхом.
^ Исследование крови и мокроты : особых изменений не будет.
Синдром скопления жидкости в плевральной полости
(гидроторакс)
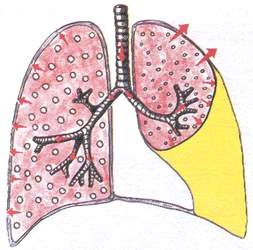
Для этого синдрома характерно скопление невоспалительной жидкости (транссудата) - при сердечной недостаточности или скопление воспалительной жидкости (экссудативный плеврит) или скопление крови (при травме грудной клетки, геморрагическом диатезе).
Жалобы : при экссудативном плеврите (боль в грудной клетке, одышка, кашель, повышение температуры), при сердечной недостаточности (боль в области сердца, сердцебиение, боль в правом подреберье, отёки).
^ Общий осмотр
Осмотр грудной клетки : выпячивание «больной» половины грудной клетки (степень выпячивания зависит от количества жидкости), тахипное, отставание «больной» половины при дыхании.
Пальпация: на стороне поражения грудная клетка болезненна, ригидна. Голосовое дрожание резко ослаблено или отсутствует, в зависимости от количества жидкости в полости плевры.
Перкуссия : чаще тупой (бедренный) звук. При застойных явлениях уровень жидкости невысокий горизонтальный с двух сторон. При экссудативном плеврите уровень жидкости может быть высоким, тупость определяется по косой линии Дамуазо с одной стороны.
Аускультация : дыхание резко ослаблено или отсутствует, в зависимости от количества жидкости в полости плевры. На здоровой стороне выслушивается усиленное везикулярное дыхание. Может быть шум трения плевры.
Бронхофония резко ослаблена или отсутствует.
Рентгенологически: гомогенное затемнение в поражённой части лёгочного поля, смещение органов средостения, чаще в противоположную сторону, при опухолевом плеврите органы средостения подтягиваются к «больной» стороне.
^ Исследование крови и мокроты : при экссудативном плеврите - лейкоцитоз, ускоренная СОЭ.
Синдром скопления воздуха в плевральной полости
(пневмоторакс)

Встречается при сообщении бронхов с плевральной полостью (субплевральное расположение туберкулёзной каверны, абсцесса), при травме грудной клетки, спонтанном пневмотораксе или при искусственном введении в полость плевры воздуха с лечебной целью больным с кавернозным туберкулёзом.
^ Жалобы
Общий осмотр : бледность кожных покровов, цианоз.
Осмотр грудной клетки : выпячивание «больной» половины грудной клетки, в которой произошло накопление воздуха, сглаживание межрёберных промежутков, тахипное, отставание «больной» половины при дыхании.
Пальпация: болезненность, ригидность поражённой половины грудной клетки. Голосовое дрожание резко ослаблено или не проводится.
Перкуссия : громкий тимпанический звук иногда с металлическим оттенком.
Аускультация: дыхание ослабленное везикулярное или не прослушивается. Бронхофония резко ослаблена или отсутствует.
Рентгенологически : светлое лёгочное поле без лёгочного рисунка, а ближе к корню - тень спавшегося лёгкого.
^ Исследование крови, мокроты : особых изменений не будет.
Синдром избыточного содержания воздуха в лёгких (эмфизема)
Этот синдром наблюдается при затруднении фазы выдоха (уменьшение просвета бронхов вследствие их спазма или заполнения экссудатом, уменьшение эластичности лёгочной ткани), лёгкие расширяются, содержание воздуха в них увеличивается, но дыхательная экскурсия их уменьшается.
Патоморфология : повышение воздушности лёгочной ткани.
Жалобы : одышка, кашель.
^ Общий осмотр : одутловатость лица, цианоз, набухание шейных вен.
Осмотр грудной клетки : грудная клетка бочкообразная,
Межрёберные промежутки расширены, сглаженность или выбухание под- и надключичных ямок, дыхательные движения грудной клетки уменьшены в объёме, тахипное.
Пальпация: грудная клетка ригидна. Голосовое дрожание ослаблено.
Перкуссия: на всём протяжении лёгочной ткани определяется коробочный звук, нижние границы лёгких опущены, экскурсия нижних краёв лёгких - ограничена.
Аускультация: равномерно ослабленное везикулярное дыхание, сухие и влажные хрипы.
Рентгенологически : повышение прозрачности лёгочных полей, ослабление лёгочного рисунка, низкое расположение и малая подвижность диафрагмы.
Исследование крови, мокроты : особых изменений не будет.
^
Синдром сужения бронхов вязким экссудатом
Э тот синдром наиболее характерен для острого или хронического бронхита, при котором наблюдается воспаление слизистой оболочки бронхов и заполнение просвета бронхов вязким секретом.
тот синдром наиболее характерен для острого или хронического бронхита, при котором наблюдается воспаление слизистой оболочки бронхов и заполнение просвета бронхов вязким секретом.
^ Жалобы: кашель, может быть боль в грудной клетке.
Общий осмотр : акроцианоз, бледность кожных покровов.
Осмотр грудной клетки: особых изменений не будет.
Пальпация : грудная клетка безболезненная, эластичная. Голосовое дрожание проводится хорошо, одинаково с обеих сторон.
Перкуссия : над всей поверхностью лёгочной ткани определяется ясный лёгочной звук.
Аускультация : дыхание жёсткое, сухие хрипы различной высоты и тембра.
Рентгенологически : усиление лёгочного рисунка.
^ Исследование крови: умеренный лейкоцитоз, ускоренная СОЭ.
Исследование мокроты: мокрота слизистая, слизисто - гнойная, содержит небольшое количество лейкоцитов.
^
Синдром бронхообструкции
Д ля этого синдрома характерно нарушение бронхиальной проходимости вследствие бронхоспазма, воспаления и отёка слизистой оболочки бронхов мелкого калибра (хронический обструктивный бронхит, бронхиальная астма).
ля этого синдрома характерно нарушение бронхиальной проходимости вследствие бронхоспазма, воспаления и отёка слизистой оболочки бронхов мелкого калибра (хронический обструктивный бронхит, бронхиальная астма).
^ Жалобы : кашель, одышка.
Общий осмотр : цианоз, «барабанные палочки» (изменение концевых фаланг).
Осмотр грудной клетки : тахипное, при длительной бронхообструкции – грудная клетка бочкообразная, дыхательные движения уменьшены в объёме.
Пальпация : грудная клетка несколько ригидна, голосовое дрожание ослаблено.
Перкуссия : незначительное притупление перкуторного звука с коробочным оттенком.
Аускультация : дыхание жёсткое или ослабленное везикулярное с массой рассеянных сухих, а в нижних отделах влажных мелкопузырчатых незвонких хрипов.
Рентгенологически : повышение прозрачности лёгочной ткани, низкое стояние купола диафрагмы и ограничение её подвижности.
^ Исследование крови : лейкоцитоз, ускоренная СОЭ, может быть эозинофилия, лимфоцитоз.
Исследование мокроты : мокрота слизистая, слизисто-гнойная, содержит небольшое количество лейкоцитов, эозинофилов.
^
Синдром фиброторакса или шварт
П ри этом синдроме наблюдается замещение лёгочной ткани соединительной тканью, вследствие длительно протекающего воспали-тельного процесса различной этиологии.
ри этом синдроме наблюдается замещение лёгочной ткани соединительной тканью, вследствие длительно протекающего воспали-тельного процесса различной этиологии.
^ Жалобы : одышка, боль в грудной клетке.
Общий осмотр : бледность кожных покровов, цианоз.
Осмотр грудной клетки : западение «больной» половины грудной клетки, тахипное, отставание «больной» половины при глубоком дыхании.
Перкуссия : притупление перкуторного звука.
Аускультация : дыхание ослабленное везикулярное или не прослушивается. Шум трения плевры. Бронхофония резко ослаблена или отсутствует.
Рентгенологически : в области фиброторакса – гомогенная тень.
Исследование крови, мокроты : особых изменений не будет.
^
Синдром дыхательной недостаточности
Дыхательная недостаточность (ДН) – это такое состояние организма, при котором не обеспечивается поддержание нормального газового состава крови или оно достигается за счёт более интенсивной работы аппарата внешнего дыхания и сердца, что приводит к снижению функциональных возможностей организма.
Нормальный газообмен в лёгких возможен при чёткой взаимосвязи трёх компонентов.
1)вентиляции
2)диффузии газов через альвеолярно-капиллярную мембрану
3)перфузии капиллярной крови в лёгких
Причинами ДН могут быть любые патологические процессы в организме или неблагоприятные факторы окружающей среды, которые влияют хотя бы на один из этих компонентов.
Различают две группы ДН:
с преимущественным поражением лёгочных механизмов
с преимущественным поражением внелёгочных механизм
Обструкция крупных дыхательных путей
Обструкция мелких дыхательных путей
Сокращение лёгочной ткани
Нарушение рестрикции альвеолярной ткани
Нарушение лёгочного кровотока
Нарушение вентиляционно-перфузионных соотношений
Утолщение альвеолярно-капиллярной мембраны
1.Нарушение центральной регуляции дыхания
2. Поражение дыхательных мышц
3.Поражение грудной клетки
В зависимости от причин и механизма ДН выделяют три типа нарушения вентиляционной функции лёгких:
-обструктивный
-рестриктивный
-смешанный
Для обструктивного типа (Рис. 1) характерно затруднение прохождения воздуха по бронхам вследствие воспаления бронхов, бронхоспазма, сужения или сдавления трахеи и крупных бронхов. Из фаз дыхания страдает преимущественно выдох.
При спирографическом исследовании наблюдается снижение максимальной вентиляции лёгких (МВЛ) и объёма форсированного выдоха за 1 с. (ФЖЕЛ) при незначительном снижении жизненной ёмкости лёгких (ЖЕЛ).
 Рис.1
Рис.1
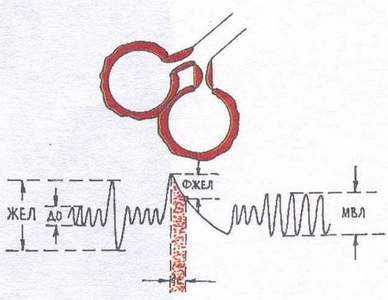
Рестриктивный тип (Рис. 2) нарушения вентиляции наблюдается при ограничении способности лёгких к расширению и спадению (гидроторакс, пневмоторакс, пневмосклероз, кифосколиоз, массивные плевральные спайки, окостенение рёберных хрящей, ограничение подвижности рёбер). Из фаз дыхания страдает преимущественно вдох. При спирографическом исследовании наблюдается снижение ЖЕЛ и МВЛ.
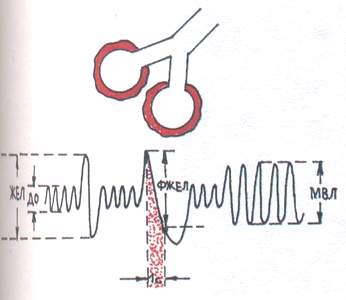 Рис.2
Рис.2
Смешанный тип (Рис. 3) встречается при длительно текущих лёгочных и сердечных заболеваниях и объединяет в себе признаки 2-х типов нарушения вентиляции (обструктивного и рестриктивного), часто с превалированием одного из них.
^
Рис.3
Различают три степени ДН
1ст. одышка возникает при доступных ранее физических нагрузках, цианоз отсутствует, утомляемость быстрая, вспомогательная дыхательная мускулатура в дыхании не участвует.
2ст . одышка возникает при привычных нагрузках, цианоз выражен нерезко, выражена утомляемость, при нагрузке в дыхании участвует вспомогательная мускулатура.
3ст. одышка в покое, цианоз, утомляемость выражена, в дыхании постоянно участвует вспомогательная мускулатура.
О наличие ДН и её степени судят по выраженности таких клинических признаков, как одышка, тахикардия, цианоз и по изменению дыхательных объёмов и ёмкостей. Данные физикальных методов исследования будут зависеть от основного заболевания, с которым связано развитие дыхательной недостаточности.
Н.А.Мухин, В.С.Моисеев. Пропедевтика внутренних болезней. – М., 2002г.
А.В. Струтынский «Основы семиотики заболеваний внутренних органов» - Москва -. МЕД- пресс-информ.- 2007 .
Контрольные вопросы
Какие основные лёгочные синдромы вы знаете?
Отличительные особенности аускультации в I, III и во II стадию крупозной пневмонии?
Для каких заболеваний наиболее характерен синдром очагового уплотнения лёгочной ткани?
Как будет изменяться общий анализ крови и мокроты при синдроме полости в лёгочной ткани?
Какая полость в лёгочной ткани выявляется физикальными методами исследования?
Почему при обтурационном ателектазе дыхание ослабленное везикулярное или совсем не прослушивается?
Какой перкуторный звук наиболее характерен для синдрома бронхообструкции?
Как изменяется голосовое дрожание при синдроме долевого уплотнения лёгочной ткани?
Почему при синдроме компрессионного ателектаза «поражённая» половина грудной клетки ригидна?
Какие жалобы предъявляет больной с синдромом гидроторакса?
Что значит бочкообразная грудная клетка и для каких заболеваний она характерна?
Каков механизм развития синдрома эмфиземы лёгких?
Какие изменения на рентгенограмме наблюдаются при экссудативном плеврите и застойной сердечной недостаточности?
Благодаря чему поддерживается нормальный газообмен в лёгких?
Назовите три типа нарушения вентиляционной функции лёгких?
Термины синдром дыхательных расстройств (СДР), респираторный дистресс-синдром (РДС) и болезнь гиалиновых мембран (БГМ) в зарубежной литературе - синонимы. Например, в наиболее популярных в США руководствах по неонаталогии используются для описания одного и того же состояния (болезни) термины: в 7-м издании Averys Diseases of the Newborn (1998) - болезнь гиалиновых мембран, а в 7-м издании Neonatal-Perinatal Medicine (Ed. AA.Fanaroff and R.J.Martin, 2002) - респираторный дистресс-синдром. Мы предпочитаем понятие синдром дыхательных расстройств.
Частота развития СДР в среднем зависит от степени недоношенности новорожденного и составляет в среднем 82-88% при рождении ребенка на сроке геста-ции менее 27 нед., 78-80% - при сроке 27-28 нед., 70% - при сроке 29-30 нед., 50-55% - при сроке 3 1 - 3 2 нед., 20-22% - при сроке 33-34 нед., 5 - 1 0 % - при сроке 35-36 нед. и менее 1 - 2 % - при сроке гестации 37 нед. и более.
БГМ (СДР I типа, РДС) и ее последствия - причина 30-50% неонатальных смертей.
Этиология. Причинными факторами развития Б Г М являются:
дефицит образования и выброса сурфактанта;
качественный дефект сурфактанта;
ингибирование и разрушение сурфактанта;
незрелость структуры легочной ткани. Всем этим процессам способствуют:
недоношенность;
внутриутробные инфекции;
перинатальная гипоксия, асфиксия и вызванные ими ишемия легкого и ацидоз;
ретинопатия недоношенных;
Местные, легочные:
синдромы утечки воздуха;
отек легких;
пневмонии;
кровоизлияния в легкие;
бронхолегочная дисплазия;
Расстройства, связанные с неправильным положением или закупоркой ды хательных трубок, поражения гортани и трахеи (сужение подсвязочного про странства, отеки, стенозы, эрозии, гранулема).
Ведение больных с БГМ требует от неонатолога сочетания глубоких знании возрастной физиологии, алгоритмов интенсивной терапии и владения искусством постоянного анализа динамики клинических симптомов, сочувствия, сопереживания ребенку. Необходимы постоянный мониторинг основных параметров жизнедеятельности и, как обратная связь, быстрое корректирование как параметров ИВЛ, так и ин-фузионной, медикаментозной терапии. Создается впечатление, что у многих детей с БГМ тяжесть состояния после первых суток жизни обусловлена не столько исходной тяжестью болезни легких, сколько их повреждениями (с вторичным дефицитом сурфактанта) при неадекватных (не варьирующих в зависимости от ответа ребенка) параметрах ИВЛ, избыточной или недостаточной инфузионной, медикаментозной терапии, охлаждении.
Диагноз ставится на основании клинической картины и рентгенологического исследования грудной клетки.
Рентгенологически для БГМ характерна появляющаяся в первые 6 часов жизни триада симптомов:
диффузные симметричные очаги пониженной прозрачности (симптом матового стекла без или с признаками сетчатых легких);
воздушная бронхограмма;
пониженная пневматизация периферических легочных полей.
Эти распространенные изменения лучше различимы в нижних отделах легких и на верхушках. Помимо этого видны уменьшение объема легких, разной выраженности кардиомегалия (увеличение кардиоторакального индекса), нодозно-ре-тикулярные изменения (разные авторы описывают их как сетчатые, мозаичные, зернистые, бисерные и т.д., но все же в настоящее время они чаще трактуются как рассеянные ателектазы).
Для отечно-геморрагического синдрома типично уменьшение размеров легочных полей, размытая рентгенологическая картина, что клинически нередко сочетается с выделением пенистой жидкости с кровью изо рта.
Если упомянутые признаки БГМ не выявляются на рентгенограммах через 3 ч после рождения, то диагноз БГМ - сомнителен. Рентгенологические признаки СДР неспецифичны (например, они аналогичны таковым при пневмонии, вызванной стрептококком В), но все же рентгенограммы грудной клетки необходимы, так как позволяют исключить другие состояния, иногда требующие хирургического вмешательства. Рентгенологические признаки БГМ исчезают через несколько часов или 1 - 3 дня в зависимости от тяжести заболевания, характера проводимой терапии, в частности от того, применялся или не применялся экзогенный сурфактант.
R.J.Rodrigues и соавт. (2002) подчеркивают, что даже в большинстве неонаталь-ных центров США при диагностике СДР ориентируются лишь на клинические и рентгенологические данные, хотя, безусловно, для корректного диагноза СДР важно получить доказательства дефицита сурфактанта. Поэтому иногда сегодня используют и термин респираторная недостаточность недоношенных, когда для лечения недоношенного ребенка необходима ИВЛ, дополнительный кислород, но на рентгенограмме грудной клетки отсутствуют типичные признаки СДР.
Пренатальный диагноз основан на том, что легочная жидкость плода из воздухоносных путей попадает в околоплодные воды, и по фосфолипидному составу ее можно судить о зрелости легких плода. Околоплодные воды получают либо путем амниоцентеза, либо собирают вытекающие воды из родовых путей матери. Если уровни лецитина и сфингомиелина, насыщенного фосфатидилхолина в околоплодных водах, превышают 5 мг/л или фосфатидилглицерина - 3 мкмоль/л, СДР развивается очень редко (менее 1% случаев). Если соотношение лецитин/сфинго-миелин (Л/С) более 2,0, вероятность СДР - 2%, если менее 2,0, но более 1 , 0 , - 50%, а если менее 1,0, -75%. При задержке внутриутробного развития отношение Л/С не всегда правильно отражает функциональную зрелость легких плода, а потому в этих случаях рекомендуют руководствоваться вышеупомянутыми абсолютными уровнями насыщенного фосфатидилхолина и фосфатидилглицерола, а также сурфактантных протеинов А. В некоторых неонатальных центрах для оценки зрелости легких плода прибегают к исследованию тромбопластической активности околоплодных вод и подсчету оранжевых клеток, но это не общепринято.
Пенный тест - наиболее простой тест на зрелость легких. Для производства теста используют околоплодные воды или 1 мл желудочного содержимого, полученного при помощи полиэтиленового катетера в первый час жизни. Тест выполняют следующим образом: к 0,5 мл околоплодных вод или желудочного содержимого добавляют 0,5 мл абсолютного этанола (95%). Стеклянную пробирку (диаметр 1 см) энергично встряхивают в течение 15 с, через 15 мин оценивают результат теста, приблизив пробирку к черной бумаге. Тест положительный, если на поверхности имеется одиночное или двойное кольцо пузырьков. Тест отрицательный, если пузырьков нет, и слабо положительный, если вокруг мениска имеются единичные мелкие пузырьки, заполняющие 1 / 3 окружности или менее. В случае положительного теста вероятность БГМ - около 4%, слабо положительного - 20%, отрицательного - 60%.
Объем обследования (мониторинга) у детей с РДС:
Непрерывный мониторинг частоты сердечных сокращений и АКД.
Чрескожная оксигемоглобинометрия, а лучше чрескожное определение Рао2 и Расо2 в артериальной крови. Очень опасно ориентироваться лишь на данные пульсоксиметра, ибо он неплохо отражает выраженность гипоксе-мии, но не реагирует на гипероксию, а уже при нижней границе нормы Раог оксигемоглобина 100%. Опасность же гипероксии велика: именно с ней связывают хронические поражения легких и глаз у новорожденных.
Оптимально определять Рао2 и Расо2 в крови, полученной при катетеризации пупочной, лучевой или большеберцовой артерии и из центральной вены, с анализом артериовенозной разницы напряжения кислорода, т.е. потребления кислорода тканями.
Каждые 3 - 4 ч необходимо измерять и фиксировать в карте наблюдения температуру кожи живота, артериальное давление, диурез, КОС, уровень гликемии и концентрацию кислорода во вдыхаемом воздухе (Fio2).
Во время острой фазы СДР ежедневно или через день производят:
рентгенографию грудной клетки;
определение гематокритного показателя;
клинический анализ крови;
посев крови и содержимого трахеи;
определение в сыворотке крови уровней азота мочевины, калия, натрия, кальция и магния, общего белка и альбуминов;
желательно определение объема циркулирующей крови, скорости мозгового кровотока и осмолярности крови;
коагулограмму с определением продуктов деградации фибриногена и фибрина (по показаниям);
определение уровня натрия в крови в начале - 2 - 4 раза в сутки, ибо велика опасность гипернатриемии из-за обезвоживания.
Дифференциальный диагноз проводят с дыхательными расстройствами как легочного (пневмонии, пороки развития легких и др.), так и нелегочного генеза (вторичные дыхательные расстройства - внутричерепная родовая травма головного или спинного мозга, врожденные пороки сердца, диафрагмальная грыжа, полици-темия, метаболические нарушения и др.). Дифференциальная диагностика с пневмониями изложена ниже.
Агенезияхоан обусловливает невозможность дышать носом и появление цианоза, расстройств дыхания после нормального первого вдоха. Типичны обильные слизистые выделения, заполняющие нос. Порок развития становится очевидным, когда не удается провести катетер или зонд через нос в носоглотку. Лечение хирургическое, но сразу же вводят воздуховод в рот.
Трахеопищеводные свищи клинически проявляются поперхиванием, приступами цианоза, кашлем, появлением хрипов в легких в момент кормления или сразу после него. Контрастное исследование пищевода (с водорастворимым контрастным веществом) и бронхоскопия подтвердят диагноз.
Диафрагмальная грыжа выявляется при рождении или вскоре после него нарастающим тяжелым расстройством дыхания. Типичен малый ладьевидный живот, втянутая передняя брюшная стенка при рождении. При осмотре обращают на себя внимание асинхронные движения правой и левой половины грудной клетки и смещение верхушечного толчка сердца, чаще вправо (ибо левосторонняя диаф-рагмальная грыжа встречается в 5 - 1 0 раз чаще, чем правосторонняя), резкое укорочение перкуторного тона в нижнем отделе легкого и отсутствие здесь же дыхательных шумов, внезапный цианоз при положении ребенка на здоровом боку. Решающее диагностическое значение имеет рентгенография грудной клетки, которая показывает наличие в грудной клетке структур, ей несвойственных (кишечник, печень и др.). Лечение хирургическое.
У детей с родовой травмой головного и спинного мозга, наряду с расстройствами дыхания, отмечаются и признаки поражения ЦНС. Помогают своевременной диагностике патологии мозга и вспомогательные исследования: нейросоногра-фия, рентгенография позвоночника, люмбальная пункция и др.
Врожденные пороки сердца синего типа и синдром персистирующей феталь-ной циркуляции иногда трудно отличить от СДР. Однако в первые часы жизни у детей с СДР зачастую обычный цвет кожных покровов. При использовании 100% кислорода для дыхания в течение 10-15 мин, особенно при постоянном положительном давлении в воздухоносных путях, у детей с СДР Раог повышается, иногда даже выше 100 торр, тогда как при пороках сердца синего типа этого не происходит. Безусловно, имеют значение и данные клинического осмотра, аускультации, оценка по шкале Сильвермана, а также дополнительных исследований (рентгенография грудной клетки, ЭКГ, результаты эхокардиографии).
Пневмонии, вызванные стрептококками В, другими стрептококками (пептост-рептококки, энтерококки), дают клиническую картину, практически не отличимую от БГМ, ибо вызывают ингибирование сурфактанта и отсюда его дефицит. Диагностическое значение в этом случае имеет выявление других инфекционных очагов { и др.), результаты клинических анализов крови, посевов крови, содержимого трахеи.
Лечение. Температурная защита. У х о д прежде всего направлен на профилактику охлаждения, ибо оно способствует снижению или даже прекращению (при температуре тела 35°С и ниже) синтеза сурфактанта и нарастанию метаболического ацидоза, развитию приступов апноэ. Ребенка сразу после рождения заворачивают в стерильную подогретую пеленку, удаляют околоплодные воды с кожи осторожным промоканием и помещают под лучистый источник тепла и далее в кувез (температура в кувезе зависит от массы тела при рождении; подробности - см. гл. VIII). Каждые 1 - 2 ч фиксируют температуру тела ребенка, и если она ниже 36, ГС, то температуру воздуха в кувезе повышают на 1- 2°С, а если выше 37°С, то снижают (обычно она должна быть не ниже 32°С). Подробнее в главе VIII.
Необходимо помнить, что ребенок, лежащий под лучистым источником тепла на реанимационном столе, тратит на поддержание температуры тела на 5-10% больше энергии, чем находящийся в кувезе. Поэтому недоношенных с очень малой массой тела целесообразно даже в кувезе помещать в пластиковую камеру, чтобы уменьшить потери тепла через конвекцию, а также неощутимые потери воды. Всем детям на голову надо надеть шапочку, ибо потери тепла и воды с головы очень велики.
Важно предупреждать колебания температуры внешней среды; осматривая ребенка в кувезе, свести до минимума травмирующие воздействия - болевые и др.
Осмотр врача должен быть как можно более коротким, особенно важно при необходимости поворотов ребенка поддерживать его голову, уменьшая пассивные движения в шейном отделе.
Поддержание проходимости дыхательных путей. При рождении ребенка в асфиксии, наличии мекония в околоплодных водах в виде горохового супа необходима интубация трахеи и нежное, но энергичное отсасывание содержимого дыхательных путей. Отсасывание повторяют в острую фазу болезни неоднократно, руководствуясь клинической картиной и аускультативными данными, но помня, что туалет трахеи вызывает преходящую, но значительную гипоксемию, брадикар-дию и гипертонию, существенное изменение интенсивности мозгового кровотока, что может провоцировать внутричерепные кровоизлияния, паравентрикуляр-ные поражения.
Положение ребенка с СДР на столике или в кувезе должно быть со слегка разогнутой головой (поза для чихания). Для этого под верхнюю часть грудной клетки подкладывают валик толщиной 3-4 см. Периодическая смена положения ребенка (поворот слегка набок, на живот и др.) стимулирует трахеальный дренаж. По окончании острого периода прибегают к вибрационному массажу, физиотерапии, аэрозольтерапии.
Инфузионная терапия и питание. Как правило, детей с СДР первые двое-трое суток жизни энтерально не кормят из-за риска сердечно-легочных осложнений, срыгиваний. Однако ребенок с первых часов жизни не должен голодать и испытывать жажду. Кроме того, крайне важно предотвратить развитие гипогликемии. Поэтому уже через 30-40 мин после рождения начинают плановую инфузионную терапию. Объем вводимой жидкости в первые сутки жизни - 50-60 мл/кг с дальнейшим увеличением по 20 мл/кг на каждый последующий день (на 7-й день около 140-150 мл/кг). Особенно осторожно надо вводить жидкость и расширять ее суточный объем при олигурии у ребенка. Когда появился диурез (более 2 ми/кг/ч), объем жидкости увеличивают смелее (до 40 мл/кг за сутки). В фазу олигурии избыточный объем жидкости может способствовать поддержанию открытого артериального протока, отечность легких, быть фактором повышенного риска последующего развития БЛД. Восстановление диуреза - вестник начала фазы выздоровления.
В первые сутки жизни переливаемая жидкость - 5 - 1 0 % раствор глюкозы, со вторых суток к ней добавляют натрий и хлор 2-3 моль/кг/сут. и калий, кальций по 2 моль/кг/сут. Состав инфузионного раствора корригируют в зависимости от монограммы крови, поддерживая уровень натриемии в пределах 135-145 ммоль/л плазмы. Для профилактики тромбирования катетера и регионарного сосуда, особенно у детей, находящихся на полном парентеральном питании, во вливаемые растворы добавляют гепарин в дозе 0 , 2 - 0 , 5 ЕД на 1 мл переливаемой жидкости.
Вообще, как известно, объем и характер инфузионной терапии определяется в зависимости от:
динамики массы тела;
динамики АКД и интенсивности мозгового кровотока;
состояния сердечно-сосудистой системы, в частности состояния периферической циркуляции;
КОС и ионограммы сыворотки крови;
условий выхаживания, в частности адекватности температурной защиты, методов ИВЛ или ВВЛ.
Учет всех этих параметров и коррекция объема - сложные задачи, требующие и знаний, и искусства врача, ибо до сих пор новорожденных не столько вылечивают, сколько выхаживают.
Кормление донорским, материнским молоком или адаптированной для недоношенных смесью начинают при улучшении состояния и уменьшении одышки до 60 в 1 мин, отсутствии длительных апноэ, срыгиваний, после контрольной дачи внутрь дистиллированной воды. Вид кормления (разовый или постоянный желудочный или транспилорический зонды, из бутылочки) зависит от наличия сосательного рефлекса, тяжести состояния. Расчет количества молока - см. главу VI, где также можно прочесть и о методике парентерального питания, если состояние больного не позволяет начать энтеральное питание.
Нормализация газового состава крови достигается обогащением кислородом вдыхаемого воздуха, различными вариантами создания повышенного давления в воздухоносных путях при спонтанном дыхании (СДППД - спонтанное дыхание с постоянным положительным давлением в воздухоносных путях) через нозаль-ные канюли (пСРАР - nose continiouse positive airway pressure - носовое постоянное давление воздухоносных путей) при постоянном повышенном давлении и ИВЛ.
Если признаков СДР нет, то недоношенного ребенка помещают в кувез, где содержание кислорода в в о з д у х е около 4 0 - 4 5 % . Если в течение 4 ч Р а о г артериальной крови (или при определении кожным датчиком) остается выше 8 кПа (60 торр=мм рт.сх), то концентрацию кислорода снижают на 5% в час до уровня 3 0 - 3 5 % . При Р а о 2 менее 6 , 6 7 кПа (5 0 торр=мм р т. с т.) концентрацию кислорода в о вдыхаемом воздухе увеличивают до максимальной, установив в кувезе над головой ребенка колпак. Если и это не приводит к нормализации Рао2 крови, то начинают СДППД (оптимального через нозальные канюли).
Другими показаниями к началу проведения СДППДявляются:
стойкая одышка и экспираторные шумы;
оценка по Сильверману 5 баллов и более (даже при нормальном цвете кожных покровов);
отрицательный пенный тест с околоплодными водами или содержимым желудка, полученным тотчас после рождения, отсутствие в них фосфатидил-глицерина.
Наиболее распространены в настоящее время пСРАР, гораздо реже используют метод Мартина (мешок Мартина). Мешок крепится на шее ребенка поролоновой лентой так, чтобы мизинец врача свободно проникал между мешком и шеей. Расширяющее давление на выдохе при СДППД обычно находится в пределах 4-6 см вод. ст. (т.е. на эту глубину погружается трубка, по которой выходит воздух из мешка), его редко приходится увеличивать при выраженной ригидности легких до 10 см вод. ст. Если ригидность легких невелика, то избыточное давление при выдохе приводит к нарушению оттока крови от мозга, уменьшению притока его к сердцу, способствует развитию сердечной недостаточности, отеку мозга.
Начинают СДППД с подачи подогретого до 32-34°С увлажненного кислорода, и далее под контролем клинического эффекта и Рао2 крови концентрацию его во вдыхаемой смеси постепенно снижают, добиваясь РаО2 артериальной крови 6,67-10,67 кПа (50-80 торр=мм рт.ст.), а артериализированной крови из пятки более 8 кПа считается потенциально токсичным, требующим снижения концентрации кислорода во вдыхаемом воздухе.
При выраженном беспокойстве ребенка, что отмечается особенно часто на фоне пСРАР, назначают оксибутират натрия или седуксен, но не фенобарбитал, который избирательно подавляет экспираторные структуры дыхательного центра, расположенные в продолговатом мозге.
Показаниями для ИВЛ являются:
Невозможность достичь нормализации Рао2 крови на фоне пСРАР, оценка по Сильверману более 5 баллов, не снижающаяся на фоне пСРАР;
Рао2 ниже 8,00 кПа (60 мм рт.ст.) при Fio2>0,7 (F1O2 -доля кислорода во вдыхаемой кислородо-воздушной смеси), но если масса тела при рождении менее 1250 г, то при Fio2>0,4;
Расо2 более 8,79 кПа (65 мм рт.ст.), а при массе тела менее 1250 г - Расо2>8,00 кПа (60 мм рт.ст.) и рН<7,25;
Методику проведения ИВЛ - см. гл. XXVI.
Экстракорпоральная мембранная оксигенация используется за рубежом для лечения детей с крайне тяжелым течением СДР при неэффективности традиционных методов ИВЛ и у детей с тяжелыми пороками сердца. Ввиду отсутствия соответствующего оборудования в России ее методики в данном учебнике мы не описываем.
Опасности кислородотерапии:
сухой и холодный кислород повреждает легкие, способствует спазму артериол, легочной гипертензии, ацидозу, торможению синтеза сурфактанта. Подогрев кислорода до 32-34°С является обязательным (при ИВЛ - до 36-37С), так же как и его увлажнение. При отсутствии специальных увлажнителей кислород пропускают через банку Боброва (высота водного столба не менее 15 см). Избыточное увлажнение (100% относительной влажности более 2 ч) ведет к перегреванию ребенка, водной перегрузке, способствует отеку легких опасность токсического действия кислорода реальна при Рао2 артериальной крови более 10,67 кПа, держащимся несколько часов, что ведет к повреждению глаз, легких и ЦНС. Поддержание КОС. Необходимо корригировать лишь патологический ацидоз (рН менее 7,25 и BE более минус 10 ммоль/л), причем только после налаживания ИВЛ или ВВЛ Если патология со стороны легких привела к столь существенному нарушению КОС, то это прямое показание для ИВЛ или ВВЛ. Количество натрия гидрокарбоната в ммолях (т.е. количество мл 8,4% раствора) χ (величина BE - 5) χ масса тела (кг) χ 0,4. Должное количество натрия гидрокарбоната вводят капельно в виде 4,2% раствора в течение 1 ч. Важно помнить, что алкалоз провоцирует внутричерепные кровоизлияния, остановки дыхания у недоношенных
Борьба с анемией и гиповолемией, гипотонией. В острую фазу болезни необходимо поддерживать гематокритный показатель не ниже 0,4, ибо анемия - фактор, поддерживающий тканевую гипоксию, а значит, дефицит сурфактанта, отечность тканей и т.д. Переливают эритроцитную массу. При тяжелой анемии и тяжелом течении СДР более показано прямое переливание крови, так как в свежих эритроцитах больше 2,3-дифосфоглицерата, что уменьшает тканевую гипоксию. Кроме того, свежая кровь более показана и для коррекции дефектов гемостаза при деком-пенсированном ДВС-синдроме, а также она иммунопротектор при инфекциях. В то же время от замененных переливаний крови при СДР в настоящее время отказались, ибо это способствует увеличению частоты и тяжести ретинопатии недоношенных. На 2-й неделе жизни и позднее показанием к трансфузии эритроцит-ной массы является гематокрит ниже 0,3. В настоящее время показания к переливанию цельной крови резко ограничивают в связи с опасностью инфекций (не только гепатиты В и С, ВИЧ, но и цитомегаловирус, ибо у 6-12% доноров имеется цитомегаловирус в крови), изосенсибилизации.
Гиповолемию (положительный симптом белого пятна - 3 с и более), особенно у детей с анемией, наиболее целесообразно корригировать переливанием изотонического раствора натрия хлорида, но можно также переливать свежезамороженную плазму или 10% раствор альбумина. Количество переливаемого препарата - 10-15 мл/кг массы тела. Переливают медленно струйно (1-2 мл/кг/мин).
Если после коррекции анемии и гиповолемии артериальное кровяное давление низкое (максимальное давление ниже 45 торр, т.е. мм рт.ст.), то начинают ми-кроструйно вводить допамин (стартовая доза 5 мкг/кг/мин с дальнейшим повышением ее по показаниям до 10-15-20 мкг/кг/мин) (подробности - см. гл. XIX).
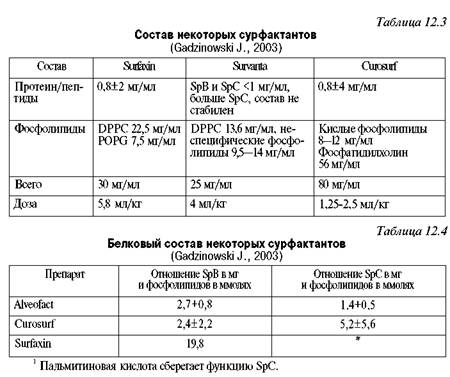
Замещение дефицита сурфактанта. С первых работ T.Fujiwara и соавт. в 1980 г. по замещению дефицита сурфактанта у глубоко недоношенных детей установлен положительный эффект такой терапии.
В настоящее время используют как естественные сурфактанты, полученные из легких быков (отечественный БЛ-сурфактант, разработанный в С.-Петербурге проф. О.А.Розенбергом, зарубежные - Survanta, Alveofact, Infrasurf), свиней (Curosurf), так и синтетические (ALEK, Exosurf, Surfaxin, "Sfenticute). Наиболее эффективны естественные сурфактанты, содержащие, помимо фосфолипидов, сур-фактантный протеин В (табл. 12.3, 12.4). Следует подчеркнуть, что препарат Surfaxin, разработанный в США лабораторией Discovery, содержит комбинацию фосфолипидов (дипальмитилфосфатидилхолин - DPPC, пальмитилолеил фосфа-тидилглицерол - POPG, пальмитиновую кислоту - Р А) и рекомбинантного, синтетического пептида, состоящего из фрагментов аминокислот лизина (К) и лейцина (L) в последовательности KLLLLKLLLLKLLLLKLLLL (КЦ). Этот рекомби-нантный пептид обладает свойствами сурфактантного протеина В. Препарат enticute содержит рекомбинантный сурфактантный протеин С.
В многочисленных рандомизированных исследованиях показано, что экзогенный сурфактант способствует:
увеличению легочной растяжимости и функциональной остаточной емкости, уменьшая тем самым работу дыхательных мышц;
снижению при ИВЛ Fio2 (доли кислорода во вдыхаемом воздухе), PIP (peak inspiratory pressure - пиковое инспираторное давление), MAP (mean airway pressure - среднее давление в дыхательных путях), PEEP (positive end-expiratory pressure - положительное давление в конце выдоха), улучшению индекса оксигенации альвеолокапилярного градиента кислорода;
снижению летальности при СДР (особенно эффективно профилактическое его применение у детей со сроком гестации менее 30 недель при сочетании
с антенатальным применением кортикостероидов), синдроме аспирации мекония, СДР взрослого типа;
укорочению времени ИВЛ и уменьшению частоты побочных эффектов ИВЛ (синдромы утечки воздуха и др.);
снижению частоты БДД, ВЖК, ретинопатии;
Не ингибирует синтез эндогенного сурфактанта.
Следует отметить, что естественные сурфактанты более эффективны, чем синтетические, но они могут быть антигенны; кроме того, они менее стабильны по составу, требуют более жестких условий хранения и имеют более ограниченный срок использования, потенциально могут содержать прионовые агенты.
Мы имеем опыт использования препаратов Curosurf и Exosurf в ДГБ №1 (СПб.). Оба препарата оказывали вышеперечисленные эффекты. Однако после введения Curosurf Fio2, PIP, MAP удавалось снизить примерно на 30% уже через 3 - 3 , 5 ч, тогда как после введения Exosurf- лишь через 6 часов. После введения Curosurf наблюдалось снижение легочного сосудистого сопротивления, уменьшение постнагрузки правого желудочка и рост преднагрузки левого желудочка. Одновременно отмечалось уменьшение альвеолярно-капиллярной разницы напряжения кислорода, улучшение индекса оксигенации. К сожалению, рандомизированных сравнительных исследований применения отечественного БЛ-сурфактан-та нет, а мы не имеем опыта его использования, но поданным коллег знаем, что он гораздо менее эффективен при тяжелых СДР, чем Curosurf.
По данным профессора J.Gadzinowski (2003), в многоцентровых европейских сравнительных рандомизированных исследованиях (в них принимают участие и неонатологи Санкт-Петербурга, но исследование - двойное слепое, и мы пока не знаем наших результатов) профилактического применения Surfaxin, Exosurf и S u r v a n t a у детей с массой тела при рождении менее 1 2 5 0 г, первый препарат оказался более эффективным, что, по его мнению, может быть связано с более ранним у л у ч ш е н и е м оксигенации (у ж е через несколько м и н у т, т о г д а как после применения других препаратов сурфактанта это отмечается через 3 - 6 ч), более длительным эффектом за счет резистентности синтетического препарата Surfaxin к инги-бированию компонентами сыворотки и оксидантами.
Побочные эффекты и осложнения терапии сурфактантом во многом иатроген-ны. При отсутствии адекватного мониторинга и варьирования параметров ИВЛ могут развиться баротравма и волюмотравма легких, синдромы утечки воздуха, легочное кровотечение, гипероксия, а отсюда ретинопатия недоношенных, легочное кровотечение, ВЖК. Пожалуй, единственное, что отмечено многими исследователями практически во всех центрах, это увеличение после применения экзогенного сурфактанта частоты функционирующего артериального протока и приступов апноэ. Частота функционирующего артериального протока у детей, леченных Curosurf, в наших наблюдениях была 7,6%.
Наиболее эффективно профилактическое введение сурфактанта при рождении или в первые 1 5 - 3 0 мин жизни. Предназначенную для введения дозу предварительно подогревают (в течение 1 ч до 37°С) и вливают через интубационную трубку в трахею толчками за 4 приема в течение 1 0 - 1 5 мин или микроструйно при помощи инфузатора за 2 0 - 3 0 мин, при следующе м вливании изменяют положение ребенка. При необходимости вливания повторяют через 12 ч. Тяжелых побочных эффектов не отмечено. Считается чрезвычайно важным как можно более ран нее прекращение И В Л и перевод ребенка на п С Р А Р. В р е з у л ь т а т е такой, в общем- то профилактической, терапии, частота и тяжесть СДР существенно снижаются. Лечение сурфактантом уже развившегося СДР или пневмонии гораздо менее эффективно, чем профилактическое. При этом чрезвычайно важно перед введением любого препарата сурфактанта стабилизировать состояние ребенка и по возможности корригировать основные параметры жизнедеятельности. После введения препарата необходим тщательный мониторинг, включающий: параметры ИВЛ, Fio2, визуальный анализ участия вспомогательной мускулатуры в акте дыхания, чрескожный анализ сатурации (Брог), ЧСС, АКД, КОС, рентгенографию грудной клетки до и спустя 3 - 6 ч после введения. Опять-таки необходимо гибко варьировать параметры И В Л и F 1 0 2 , не допуская баротравму и волюмотравму легких, гипероксию. S p o 2 н а д о поддерживать в п р е д е л а х 9 0 - 9 4 % , что предотвращает гипероксию. Желательно в течение 3 - 6 ч после введения сурфактанта не отсасывать содержимое трахеи.
Закрытие открытого артериального протока медикаментозно рассматривают у детей с СДР по данным эхокардиографии и допплеровского исследования на 4-5-й день жизни. Тактика применения индометацина или бруфена изложена в главе XIX.
Антибиотикотерапия. При постановке диагноза СДР и даже при подозрении на него назначают ампициллин в комбинации с одним из аминогликозидов (чаще гентамицином). Это обусловлено, с одной стороны, тем, что стрептококковая В-инфекция проявляется поражением легких, ничем (даже часто рентгенологически) не отличающимся от С Д Р, с другой - переводом больного на ИВЛ, что часто сопровождается инфицированием. Однако через 3 дня после получения результатов посевов крови и клинических анализов крови в динамике надо решить вопрос о наличии инфекции и, если ее нет, антибиотики отменить.
Витаминотерапия. Мнение о том, что профилактическое назначение витамина Ε снижает частоту развития бронхолегочных дисплазий, не подтвердилось. И все же назначение витамина Ε внутримышечно по 10 мг/кг ежедневно при использовании кислородно-воздушной смеси с Fio2 более 0 , 4 показано, ибо это снижает частоту развития и тяжесть ретинопатии недоношенных. Курс 7 - 1 0 инъекций. Витамин А, введенный энтерально по 2000 ЕД через день, следует назначать всем детям до начала энтерального питания, ибо это снижает частоту развития не-кротизирующего энтероколита и бронхолегочных дисплазий.
Мочегонные. Хотя назначение фуросемида и увеличивает диурез и улучшает состояние легких, но увеличивает частоту открытого артериального протока, каль-цификатов в почках, дисэлектролитемий, а потому не может рассматриваться как рутинное. Фуросемид назначают лишь при отеках легких, отечном синдроме.
Глюкокортикоиды. От планового назначения глюкокортикоидов и их производных (чаще использовали дексаметазон как оказывающий максимальный тканевой эффект) для стимуляции синтеза сурфактанта всем детям с СДР в настоящее время отказались. Это связано с введением в терапию и вторичную профилактику СДР препаратов сурфактанта, совершенствованием методов дыхательной поддержки, ИВЛ, а также с побочными эффектами терапии глюкокортикоидами, основными из которых даже при коротком курсе являются: гипергликемия, артериальная гипертония, желудочно-кишечные кровотечения, некротизирующий энтеро и другие инфекции. Глюкокортикоиды назначают больным СДР, у которых, по клинико-лабораторным данным, имеется надпочечниковая недостаточность.
Многие неонатологи за рубежом пришли к заключению, что назначение дек-саметазона при постинтубационном отечном ларингите или трахеите с выраженным стенозом оказывает положительный эффект. В Neonatal Formulary (BMJ, 2000) рекомендовано дать 4 дозы по 200 мкг с интервалом в 8 часов, причем, первую дозу дают за 4 часа до экстубации детям с отеком или травмой гортани.
Тиреоидные гормоны для лечения детей с СДР начали активно применять в некоторых неонатальных клиниках, исходя из нередкого выявления низкого уровня тиреоидных гормонов у глубоко недоношенных детей с БГМ. Однако общепризнанных данных, основанных на результатах рандомизированных исследований, бесспорно доказывающих пользу такого назначения, нет, а потому это исследуемая терапия. Более обоснованно интраамниотическое применение L-тироксина беременным с высоким риском преждевременных родов, но и здесь общепринятых схем и общепризнанных результатов нет.
Рибоксин и инозитол, назначаемые интрагастрально каждые 6 ч в дозе 40 мг/кг с конца п е р в ы х с у т о к до 1 0 - г о дня жизни, по мнению М. Х а л л м а н а и соавт. (1986-1989), снижают тяжесть СДР, увеличивают синтез сурфактанта, снижают частоту развития бронхолегочной дисплазии. Однако и этот метод, так же как и плановое введение недоношенным плазминогена, - исследуемый метод лечения детей с СДР.
Прогноз СДР зависит от степени его тяжести и наличия сопутствующей патологии, осложнений терапии. Летальность детей с массой тела при рождении более 1 0 0 0 г при рациональном ведении не превышает 5 - 1 0 % . На первом году жизни дети, перенесшие СДР, часто болеют пневмониями, повышена у них и частота сепсиса. Энцефалопатия (постгипоксическая) - одно из характерных сопутствующих состояний (или осложнений) у детей с СДР, причем у части детей они четко выявляются лишь в дошкольном и школьном возрасте в виде минимальных мозговых дисфункции, поведенческих расстройств, трудностей в учебе. В связи с этим в системе реабилитационных мероприятий детей с СДР необходимо предусмотреть раннее назначение (с 3 - 4 - г о дня) препаратов, у л у ч ш а ю щ и х трофику мозга (глиа-тилин 1 0 - 1 5 мг/кг/сут., ноотропил 50 мг/кг внутривенно или внутрь 2 - 3 раза в день), наблюдение невропатолога.
Профилактика. Антенатальная гормональная терапия. В в е д е н и е внутримышечно или дача внутрь матери при угрозе преждевременных родов на сроке 2 4 - 3 4 не-
бетаметазона в дозе 12 мг (2 раза с интервалом 24 ч) или
дексаметазона по 6 мг 4 раза с интервалом 12 ч.
Оптимально, чтобы срок между окончанием гормонотерапии и родами был более 24 ч. Эффект такого назначения сохраняется в течение 10 дней, и если роды не наступили, то показано однократное введение дексаметазона в дозе 6 - 1 2 м г.
Антенатальный курс кортикостероидов приводит не только к уменьшению частоты и тяжести С Д Р, но и снижает риск развития синдрома открытого артериального протока, внутрижелудочковых кровоизлияний, перивентрикулярной лейко-маляции, некротизирующего энтероколита, длительность и стоимость выхаживания глубоконедоношенного новорожденного.
Длительные катамнестические исследования показали, что курс антенатальной гормональной терапии не увеличивает частоту инфекционных заболеваний у новорожденных, не влияет на последующее физическое и психомоторное развитие (в том числе и на темпы прироста окружности головы), а также рост легких, не вызывает нарушений функции надпочечников, зрения или слуха.
В настоящее время наиболее перспективным считают отработку для практического применения схемы введения в околоплодные воды трийодтиронина, а оптимально - тиреотропинрилизинг-гормона (ТРГ). Препараты ТРГ и в эксперименте, и при ограниченных клинических испытаниях оказались очень эффективными в плане профилактики СДР. Однако два больших мультицентовых исследования, проведенных в США, не показали преимущества сочетания профилактического назначения беременной кортикостероидов в комбинации с тиреоидными гормонами и/или ТРГ (Ballard R.A. et al., 1998).
Полезно затягивание родов, ибо, если безводный промежуток продолжается более 2 суток, СДР обычно не развивается, хотя у таких детей чаще наблюдаются сепсис и, вероятно, внутричерепные кровоизлияния.
Заместительная терапия экзогенными сурфактантами в первые 30 минут жиз ни (см. выше) - высокоэффективный метод профилактики тяжелого СДР.
Термины «синдром дыхательных расстройств» (СДР), «респираторный дистресс-синдром» (РДС) и «болезнь гиалиновых мембран» (БГМ) в зарубежной литературе - синонимы. Например, в наиболее популярных в США руководствах по неонаталогии используются для описания одного и того же состояния (болезни) термины: в 7-м издании Avery"s Diseases of the Newborn (1998) - болезнь гиалиновых мембран, а в 7-м издании Neonatal-Perinatal Medicine (Ed. AA.Fanaroff and R.J.Martin, 2002) - респираторный дистресс-синдром. Мы предпочитаем понятие «синдром дыхательных расстройств».
Частота развития СДР в среднем зависит от степени недоношенности новорожденного и составляет в среднем 82-88% при рождении ребенка на сроке геста- ции менее 27 нед., 78-80% - при сроке 27-28 нед., 70% - при сроке 29-30 нед., 50-55% - при сроке 31-32 нед., 20-22% - при сроке 33-34 нед., 5-10% - при сроке 35-36 нед. и менее 1-2% - при сроке гестации 37 нед. и более.
БГМ (СДР I типа, РДС) и ее последствия - причина 30-50% неонатальных смертей.
Этиология. Причинными факторами развития БГМ являются:
дефицит образования и выброса сурфактанта;
качественный дефект сурфактанта;
ингибирование и разрушение сурфактанта; "
незрелость структуры легочной ткани.
Всем этим процессам способствуют:
недоношенность;
внутриутробные инфекции;
перинатальная гипоксия, асфиксия и вызванные ими ишемия легкого
и ацидоз;
сахарный диабет у матери;
острая кровопотеря в родах.
Кроме того, частота БГМ повышена у детей с:
внутрижелудочковыми кровоизлияниями и вообще перивентрикулярными поражениями, возникшими до родов и в родах;
транзиторной гипофункцией щитовидной железы и надпочечников;
гиповолемией;
гипероксией;
охлаждением (как при общем охлаждении, так и при дыхании не подогретой кислородно-воздушной смесью);
родившихся при помощи кесарева сечения;
у второго близнеца из двойни.
Острый перинатальный стресс, в частности удлинение времени родов, может снижать частоту и/или тяжесть БГМ. Отсюда понятно, почему фактором риска развития БГМ является плановое кесарево сечение, а увеличение длительности безводного промежутка уменьшает риск БГМ.
Патогенез. Ведущим звеном патогенеза - СДРIтипа (БГМ) является количественный дефицит и качественный дефект сурфактанта.
Сурфактант - поверхностно-активное вещество синтезируемое альвеолоцита- ми II типа (покрывающими около 3% поверхности альвеол) и безволосковыми бронхиолярными клетками (клетки Клара). Он на 90% состоит из липидов, из них 80% приходится на фосфолипиды: фосфатидилхолин (лецитин) - 70% (45-50% - окисленный, насыщенный и 20-25% - ненасыщенный), фосфатидилглицерол - 6% и другие фосфолипиды - 6%; 8% - нейтральные липиды. 8-10% сухого веса сурфактанта - белки: протеины А, В, С, D.
Сурфактант обладает следующими основными функциями:
препятствует спадению альвеол на выдохе;
защищает альвеолярный эпителий от повреждений и способствует мукоци- лиарному клиренсу;
обладает бактерицидной активностью против грамположительных микробов и стимулирует макрофагальную реакцию в легких;
участвует в регуляции микроциркуляции в легких и проницаемости стенок альвеол, препятствует развитию отека легких.
Важную роль в выполнении указанных функций сурфактанта играют белки, из которых A (SpA) и D (SpD) - гидрофильные - вовлекаются в защитные механизмы организма ребенка (не содержатся в сурфактантах легких животных), а протеины В (SpB) и С (SpC) - гидрофобные - снижают поверхностное натяжение альвеол за счет стимуляции абсорбции фосфолипидов на поверхности аэрогемати- ческого барьера и способствуют равномерному распределению сурфактанта на по-верхности альвеол (содержатся в сурфактантах, полученных из легких животных). Гены, определяющие синтез сурфактантных белков SpA и SpD, находятся на 10-й хромосоме, a SpB - на 2-й и SpC - на 8-й. SpA появляется в околоплодной жидкости человека на 19-й неделе гестации, a SpB - на 31-й; в дальнейшем уровень их непрерывно нарастает.
При этом, согласно современным представлениям, наиболее важным среди этих белков является сурфактантный протеин В, ибо его наследственный или врожденный дефицит является летальным для человека (de Mello D.E. et al., 1994; Nogee L.M., 1995; Chetcuti PAJ., Ball R.J., 1995). Наследуется дефицит SpB no ay- тосомно-рецессивному типу и проявляется у доношенных детей клиникой типичного СДР недоношенных с длительной потребностью в ИВЛ. Заместитльная терапия животными сурфактантами оказывает лишь транзиторный эффект. Возможное лечение - трансплантация легких.
Синтез сурфактантных протеинов стимулируют глюкокортикоиды, тиреоид- ные гормоны, эстрогены, адреналин и норадреналин, тормозит - инсулин.
Сурфактант начинает вырабатываться у плода с 20-24-й недели внутриутробного развития альвеолярными клетками II типа. Он накапливается в них в виде ос- миофильных гранул, мигрирующих на поверхности альвеол, где образует тонкую пленку в гипофазе. Особенно интенсивный сброс сурфактанта происходит в момент родов, что способствует процессу первичного расправления легких. Период полураспада сурфактанта - 10-20 ч.
Существуют два пути синтеза основного фосфолипидного компонента - фо- сфатидилхолина (лецитина): 1) метилированиефосфатидилэтаноламина (кефали на) при помощи метилтрансферазы (источник метильной группы метионин); 2) синтезирование из цитидиндифосфатхолина в присутствии фосфохолинтрансфе- разы, вступающего в реакцию с диглицеридом. Установлено, что до 33-35-й недели внутриутробного развития синтез сурфактанта в основном осуществляется путем метилирования этаноламина, а позднее - при помощи фосфатидилхолинт- рансферазы.
Первый путь синтеза сурфактанта легко истощается под влиянием гипоксии, ацидоза, гипотермии. Поэтому считают, что полностью система сурфактанта созревает к 35-36-й неделе внутриутробного развития. У ребенка, родившегося до этого срока, имеющиеся запасы сурфактанта обеспечивают начало дыхания и формирования функциональной остаточной емкости легких, но из-за отставания синтеза сурфактанта от темпов его распада возникает недостаток этого вещества, что приводит к спадению альвеол на выдохе, резкому возрастанию работы дыхательных мышц, поскольку из-за неустановившейся функциональной остаточной емкости легких, повышенной их «жесткости» усилия, необходимые для каждого последующего раздувания легких, должны быть такими же, как и для первого дыхания. Кроме того, вследствие спадения альвеол, непрерывного газообмена в легких не происходит, что провоцирует развитие гипоксемии и гиперкапнии.
Уточним, что наряду с фосфатидилхолином для нормального функционирования сурфактанта имеют значение и другие его компоненты, особенно фосфати- дилглицерин и фосфатидилинозитол. Например, в смывах с легких детей, умерших от СДР, родившихся от матерей с сахарным диабетомколичество лецитина и сфингомиелина и соотношения между ними нормальные, но имеется дефицит фосфатидилглщерина. С другой стороны, у глубоко недоношенного ребенка при низком уровне лецитина в околоплодных водах, но нормальном содержании фо- сфатидилглицерина СДР не развивается. При СДР, помимо исчезновения фосфа- тидилглицерина из сурфактанта, в нем снижено количество насыщенного фосфа- тидилхолина и увеличено содержание фосфатидилсерина и сфингомиелина.
Снижают синтез сурфактанта:
" холодовая травма, в том числе использование при ИВЛ не подогретой кислородно-воздушной смеси;
патологический ацидоз;
гиповолемия;
полицитемия;
гипоксемия;
гипероксия;
баротравма и волюмотравма легких;
инфекции, как анте-, так интра-, постнатальные. Перечисленные факторы повреждают альвеолы, активируют синтез провоспа- лительных цитокинов, систему комплемента и хемокинов (анафилотоксины, бра- дикинин и др.), что приводит к повышенной проницаемости эндотелия и отеку альвеол.
Инактивации сурфактанта, его разрушению способствуют:
инфекции (особенно грамотрицательные, микоплазменная);
белки плазмы, «протекшие» в альвеолы;
патологический ацидоз;
избыток оксидантов, перекисных соединений, провоспалительных цитоки- нов.
Важным предрасполагающим фактором к развитию СДР является незрелость легких у плодов, развивавшихся в неблагоприятных условиях. Гистологически незрелость легких проявляется широкими прослойками межуточной ткани в ацину- се, уменьшением количества альвеолярных ходов и альвеол, незаконченностью дифференцировки ацинусов, неплотным прилеганием капилляров к альвеолам. В легких у детей, умерших от СДР, одновременно в разных участках могут быть ателектазы, гиалиновые мембраны, отечно-геморрагические изменения.
Гиалиновые мембраны состоят из фибринового матрикса и клеточного детрита - конечного продукта осколков клеток крови и поврежденного эпителия. Период улучшения при СДР характеризуется регенерацией стенок альвеол, альвеоло- цитов, в том числе и пневмоцитов II типа и в результате - повышением синтеза сурфактанта. Гиалиновые мембраны сами по себе не вызывают развития ателектазов. У отдельных детей и клинически, и патоморфологически (в случае смерти) резко доминируют проявления болезни гиалиновых мембран, или первичных ателектазов, отечно-геморрагического синдрома. Поэтому, вероятно, за рубежом сейчас более популярен термин «синдром дыхательных расстройств», чем «болезнь гиалиновых мембран».
Провоцирующими факторами для проявления дефицита сурфактанта в виде БГМ являются:
аспирация околоплодных вод с меконием (дети от матерей, страдавших длительным - более 4 недель - гестозом);
отечно-геморрагический синдром легких (факторы повышенного его риска - перинатальная гипоксия, особенно смешанного генеза, сердечная недостаточность, дефицит прокоагулянтов, синтез которых зависит от витамина К, фибриногена, количественный и качественный дефект тромбоцитар- ного звена гемостаза);
дефицит плазминогена, а отсюда малая активность фибринолиза;
недостаточная активность антипротеаз (оц-антитрипсин и аг-макроглобу- лин, антитромбин III и др.);
декомпенсированный ДВС-синдром.
У больных с СДР развиваются:
снижение комплайнса, легочной растяжимости и функциональной остаточной емкости;
снижение минутной легочной вентиляции и утилизации (транспорта) кислорода в легких;
увеличение работы дыхания;
тяжелые гипоксемия и гипоксия; гиперкапния;
смешанный (респираторно-метаболический) ацидоз;
снижение синтеза фосфолипидов и сурфактантных белков;
выраженная легочная гипертензия и системная гипотензия;
снижение эффективного легочного кровотока;
гиповолемия, нарушения микроциркуляции, периферические отеки, т.е. явления шока;
компенсированная или декомпенсированная рассеянная внутрисосудистая коагуляция (компенсированнный или декомпенсированный ДВС-синд- ром);
обменные нарушения (гипопротеинемия, склонность к гипогликемии, гипокальциемия, но гиперкалиемия и др.);
мышечная гипотония;
расстройства функционального состояния головного мозга вследствие прежде всего ГИЭ;
дисфункции миокарда с сердечной недостаточностью (преимущественно по правожелудочковому типу с право-левыми шунтами);
температурная нестабильность со склонностью к охлаждению, обусловленная в частности свойственной им транзиторной гипотироксинемией;
бедность почечной и периферической перфузии с олигурией, отеками;
функциональная кишечная непроходимость (схема 12.1).
Клиническая картина. Первым признаком развивающегося СДР I типа (БГМ)
является одышка (более 60 дыханий в 1 мин), которая при болезни гиалиновых мембран и отечно-геморрагическом синдроме обычно проявляется в течение первого часа после рождения, а при первичных ателектазах - в первые минуты жизни. Появление одышки через 3 ч после рождения и позднее не характерно для БГМ. Цвет кожных покровов ребенка при появлении одышки - обычный. Причиной того, что одышка при СДР возникает на фоне розовых кожных покровов, является большее сродство фетального гемоглобина с кислородом. Гипоксемией считается снижение Рао2 крови до 8,67 кПа (65 торр, или мм рт.ст.). Цианоз у новорожденных появляется при уровне Рао2 крови 4,27-5,87 кПа (32-44 мм рт.ст.), а у взрослых - 5,6-6,93 кПа (42-52 мм рт.ст.). Следовательно, при нетяжелой ги- поксемии цвет кожных покровов новорожденного может быть и розовым, но вследствие раздражения хеморецепторов сосудов у ребенка уже развивается одышка.
Следующим симптомом являются экспираторные шумы, называемые «хрюкающим выдохом». Обусловлены экспираторные шумы тем, что на начальных этапах СДР в качестве компенсаторного механизма развивается спазм голосовой щели на выдохе (дыхание типа гасп), способствующего увеличению функциональной остаточной емкости легких и препятствующего спадению альвеол. При резком расслаблении надгортанника прохождение находящегося под повышенным давлением в дыхательных путях воздуха под голосовыми связками и вызывает экспираторные шумы.
Западение грудной клетки на вдохе (втягивание мечевидного отростка грудины, подложечной области, межреберий, надключичных ямок) - третий по времени появления признак СДР.
(л
I
I и
Схема 12.1. Патогенез синдрома дыхательных расстройств: ВУИ - внутриутробные инфекции; ДВС - диссеминированное внутрисосудистое свертывание. Одновременно или несколько позднее возникают напряжение крыльев носа, приступы апноэ, цианоз (периоральный, а позднее - акроцианоз или генерализованный) на фоне бледности кожных покровов,раздувание щек (дыхание «трубача»), ригидный сердечный ритм, парадоксальное дыхание (западение передней брюшной стенки на вдохе), пена у рта (у половины больных), отек кистей и стоп. Типична плоская грудная клетка (в виде «спичечного коробка»).
Аускультативно в первые часы жизни над легкими выслушивают резко ослабленное дыхание, далее на фоне ИВЛ - обычные, нормальные дыхательные шумы, и лишь позднее появляются высокие сухие хрипы на вдохе и выдохе, крепитирую- щие и мелкопузырчатые хрипы.
Из общих симптомов типичны:
температурная нестабильность со склонностью к гипотермии;
вялость, бедность движений, признаки угнетения ЦНС вплоть до адинамии, летаргии и даже комы (помнить о возможности гипогликемии, гипераммо- ниемии!);
периферические отеки подкожной клетчатки;
гипорефлексия и мышечная гипотония;
гиповолемия и артериальная гипотония;
олигурия;
срыгивания, вздутие живота и даже признаки кишечной непроходимости;
большие потери первоначальной массы тела;
нижние конечности часто находятся в «позе лягушки» (как при спинальной травме на уровне поясничного отдела).
Нередко у больного ребенка выявляют внутрижелудочковые кровоизлияния (ВЖК), обычно I-II степени, или УЗИ-признаки перивентрикулярной лейкома- ляции (ПВЛ). У конкретного ребенка иногда трудно решить, что первично - по-ражение легких (СДР) или мозга (ВЖК, ПВЛ). При прогрессировании СДР, несмотря на интенсивную терапию, развиваются признаки шока и декомпенсиро- ванного ДВС-синдрома, в том числе кровоточивость из мест инъекций, легочное кровотечение и др.
Сильверманом предложена шкала для оценки тяжести дыхательных расстройств у новорожденных (табл. 12.1).
Каждый симптом в графе «Стадия I» оценивается в 1 балл, в графе «СтадияII» - в 2 балла. Особенностью шкалы является то, что в ней не учитываются такие признаки дыхательной недостаточности, как одышка и цианоз, так как появление этих симптомов у новорожденного может быть обусловлено и нелегочными причинами дыхательных расстройств. По Сильверману, при суммарной оценке в 10 баллов у новорожденного наблюдается крайне тяжелый СДР, 6-9 балов - тяжелый, 5 баллов - средней тяжести, ниже 5 - начинающийся СДР.
Аускультативные и перкуторные данные в начальном периоде СДР не демонстративны, но в дальнейшем на фоне ослабленного дыхания появляются рассеянные крепитирующие и незвучные мелкопузырчатые хрипы.
Нарушения со стороны сердечно-сосудистой системы очень типичны для СДР. Вначале развиваются тахикардия, приглушение тонов сердца. Дальнейшие изменения определяются выраженностью легочной гипертензии и гемореологически- ми нарушениями. Шкала Сильвермана Стадия 0 Стадия I Стадия II Верхняя часть грудной клетки (при положении ре-бенка на спине) и передняя брюшная стенка синхронно участвуют в акте дыхания Отсутствие синхронности или минимальное опущение верхней части грудной клетки при подъеме пере-дней брюшной стенки на вдохе Заметное западание верхней части грудной клетки во время подъема передней брюшной стенки на вдохе Отсутствие втяжения меж- реберий на вдохе Легкое втяжение межре-берных промежутков на вдохе Заметное втяжение межре-берных промежутков на вдохе Отсутствие втяжения мече-видного отростка грудины на вдохе Небольшое втяжение мече-видного отростка грудины на вдохе Заметное западание мече-видного отростка грудины на вдохе Отсутствие движения под-бородка при дыхании Опускание подбородка на вдохе, рот закрыт Опускание подбородка на вдохе, рот открыт Отсутствие шумов на выдохе Экспираторные шумы («экспираторное хрюканье») слышны при аускуль- тации грудной клетки Экспираторные шумы («экспираторное хрюканье») слышны при поднесении фонендоскопа ко рту или даже без фонендоскопа Легочная гипертензия ведет к сохранению фетальных шунтов и сбросу крови справа налево через артериальный проток и овальное отверстие.
Из-за повышенной проницаемости сосудов отмечается гиповолемия, сгущение крови и возрастание гематокритного числа, концентрации гемоглобина. При истощении компенсаторных механизмов артериальное давление снижается и развиваются Пи ІІІстадии шока.
Другим осложнением СДР может быть лево-правый шунт (через открытый артериальный проток), являющийся следствием слишком быстрого расправления легких после рождения или ИВЛ. Обычно у таких детей признаки гипоксии и застойные явления в легких в конце первой - начале второй недели жизни нараста-ют, увеличено пульсовое давление, выслушивается систолодиастолический шум на сосудах.
Дифференциальный диагноз синдрома персистирующей фетальной циркуляции и открытого артериального протока представлен в таблице 12.2.
Наслоение вторичной инфекции представляет серьезную опасность для детей с СДР, пневмонии развиваются у 40-50% больных.
Течение СДР. При СДР средней тяжести и неосложненном его течении максимальная тяжесть состояния наблюдается в 1-й день жизни, а далее интенсивность западения грудины, втяжения межреберий, а также приступов апноэ, отечности, олигурии постепенно уменьшается. Повышается диурез, мышечный тонус и спон-танная двигательная активность, улучшается неврологический статус, уменьшается потребность в кислороде и ИВЛ. Если заболевание не осложнилось внутриже- лудочковым кровоизлиянием, перивентрикулярной лейкомаляцией, интерстици- альной эмфиземой и другими видами «утечки воздуха», персистирующей легоч-
Таблица 12.2
Дифференциально-диагностические признаки вторичных синдромов, обусловленных функционирующим артериальным протоком Признак Синдром персистирующей фетальной циркуляции (право-левый шунт) Синдром открытого артериального протока (лево-правый шунт) Асфиксия и аспирация в родах Типичны Не типичны ИВЛ в первые часы жизни Может быть Типична Ателектазы легких Типичны Редко Рецидивирующие апноэ в конце первой - начале второй недели жизни Могут быть Типичны Генерализованный цианоз В первые дни жизни с виш-невым оттенком В конце первой - на второй неделе жизни, с мраморным оттенком Дифференцированный цианоз (преимущественно ног) Типичен Не характерен Ответ на дыхание 100% кислородом Улучшения, как правило, не наблюдается, Рао2 остается ниже 9,33 кПа Улучшение, Раог становится выше 10,67 кПа В капиллярной крови рук Раог на 1,33 кПа, а рН - на 0,02 больше, чем в крови ног Типично Не характерно Обилие крепирующих хри-пов на вдохе, розовая пена Не характерно, но может быть в первые дни жизни Типично для конца первой недели жизни и старше Пульс Слабый и малый Большой и быстрый, ска-чущий Кровяное давление Повышено или снижено Увеличение пульсового при низком диастолическом Граница сердца Умеренно расширены пре-имущественно вправо Расширены преимуществен-но влево, полоса Гергарта Размеры печени Обычно увеличены не резко Увеличены резко Рентгенограмма органов грудной клетки Ателектазы, пневмония, но- дозно-ретикулярная сеть, сердце расширено преиму-щественно вправо, контуры его неровные, обеднение ма-лого круга кровообращения. При III стадии - отек легких Первоначально увеличено кровенаполнение легких, отечность центральных, а затем и периферических полей легких. Сердце рас-ширено преимущественно влево и вверх Шум в области сердца Чаще отсутствует или сис-толический во втором меж- реберье слева от грудины Электрокардиографически типичны признаки пере-грузки правых отделов сердца Типичен систолодиастоли- ческий шум, систолический шум может быть или отсутствовать
На ЭКГ вначале перегрузка левых отделов сердца, затем правых
Таблица 12.2 (продолжение)
Признак Синдром персистирующей феталъной циркуляции (право-левый шунт) Синдром открытого артериального протока (лево-правый шунт) Ультразвуковое исследование сердца (индекс: левое предсердие - аорта) Менее 1,0 Более 1,3 Клинический эффект лечения Сердечные гликозиды Может быть гемодинами- ческое ухудшение Положительный Толазолин (в вену головы) Улучшение Ухудшение Индометацин Изменений нет Улучшение Дроперидол Некоторое улучшение Усиление шума
ной гипертензией, то к середине первой недели жизни ребенка переводят вначале на ВВЛ (носовые канюли), и далее он дышит самостоятельно, кормится энтераль-
но.
У детей с массой тела при рождении менее 1500 г СДР, как правило, протекает с перечисленными ниже осложнениями (одним или несколькими), и тогда механическая вентиляция легких затягивается, иногда на несколько недель. Типичные осложнения у детей с СДР. Системные:
декомпенсированный тяжелый ацидоз, шок смешанного генеза, декомпен- сированный ДВС-синдром;
внугрижелудочковые кровоизлияния;
незаращение артериального протока;
синдром персистирующей фетальной циркуляции;
синдром открытого артериального протока;
транзиторная гипераммониемия;
гипогликемия;
некротизирующий энтероколит;
ретинопатия недоношенных;
почечная недостаточность. Местные, легочные:
синдромы «утечки воздуха»;
отек легких;
пневмонии;
кровоизлияния в легкие;
бронхолегочная дисплазия;
расстройства, связанные с неправильным положением или закупоркой дыхательных трубок, поражения гортани и трахеи (сужение подсвязочного пространства, отеки, стенозы, эрозии, гранулема).
Ведение больных с БГМ требует от неонатолога сочетания глубоких знании возрастной физиологии, алгоритмов интенсивной терапии и владения искусством постоянного анализа динамики клинических симптомов, сочувствия, сопереживания ре- бенку. Необходимы постоянный мониторинг основных параметров жизнедеятельности и, как обратная связь, быстрое корректирование как параметров ИВЛ, так и ин-фузионной, медикаментозной терапии. Создается впечатление, что у многих детей с БГМ тяжесть состояния после первых суток жизни обусловлена не столько исходной тяжестью болезни легких, сколько их повреждениями (с вторичным дефицитом сурфактанта) при неадекватных (не варьирующих в зависимости от «ответа» ребенка) параметрах ИВЛ, избыточной или недостаточной инфузионной, медикаментозной терапии, охлаждении.
Диагноз ставится на основании клинической картины и рентгенологического исследования грудной клетки.
Рентгенологически для БГМ характерна появляющаяся в первые 6 часов жизни триада симптомов:
диффузные симметричные очаги пониженной прозрачности (симптом «матового стекла» без или с признаками «сетчатых легких»);
воздушная бронхограмма;
пониженная пневматизация периферических легочных полей.
Эти распространенные изменения лучше различимы в нижних отделах легких и на верхушках. Помимо этого видны уменьшение объема легких, разной выраженности кардиомегалия (увеличение кардиоторакального индекса), нодозно-ре- тикулярные изменения (разные авторы описывают их как сетчатые, мозаичные, зернистые, бисерные и т.д., но все же в настоящее время они чаще трактуются как рассеянные ателектазы).
Для отечно-геморрагического синдрома типично уменьшение размеров легочных полей, «размытая» рентгенологическая картина, что клинически нередко сочетается с выделением пенистой жидкости с кровью изо рта.
Если упомянутые признаки БГМ не выявляются на рентгенограммах через 3 ч после рождения, то диагноз БГМ - сомнителен. Рентгенологические признаки СДР неспецифичны (например, они аналогичны таковым при пневмонии, вызванной стрептококком В), но все же рентгенограммы грудной клетки необходимы, так как позволяют исключить другие состояния, иногда требующие хирургического вмешательства. Рентгенологические признаки БГМ исчезают через несколько часов или 1-3 дня в зависимости от тяжести заболевания, характера проводимой терапии, в частности от того, применялся или не применялся экзогенный сурфактант.
RJ.Rodrigues и соавт. (2002) подчеркивают, что даже в большинстве неонаталь- ных центров США при диагностике СДР ориентируются лишь на клинические и рентгенологические данные, хотя, безусловно, для корректного диагноза СДР важно получить доказательства дефицита сурфактанта. Поэтому иногда сегодня используют и термин «респираторная недостаточность недоношенных», когда для лечения недоношенного ребенка необходима ИВЛ, дополнительный кислород, но на рентгенограмме грудной клетки отсутствуют типичные признаки СДР.
Пренатальний диагноз основан на том, что легочная жидкость плода из воздухоносных путей попадает в околоплодные воды, и по фосфолипидному составу ее можно судить о зрелости легких плода. Околоплодные воды получают либо путем амниоцентеза, либо собирают вытекающие воды из родовых путей матери. Если уровни лецитина и сфингомиелина, насыщенного фосфатидилхолина в околоплодных водах, превышают 5 мг/л или фосфатидилглицерина - 3 мкмоль/л, СДР развивается очень редко (менее 1% случаев). Если соотношение лецитин/сфинго- миелин (Л/С) более 2,0, вероятность СДР - 2%, если менее 2,0, но более 1,0, - 50%, а если менее 1,0, -75%. При задержке внутриутробного развития отношение Л/С не всегда правильно отражает функциональную зрелость легких плода, а потому в этих случаях рекомендуют руководствоваться вышеупомянутыми абсолютными уровнями насыщенного фосфатидилхолина и фосфатидилглицерола, а также сурфактантных протеинов А. В некоторых неонатальных центрах для оценки зрелости легких плода прибегают к исследованию тромбопластической активности околоплодных вод и подсчету «оранжевых клеток», но это не общепринято.
«Пенный тест» - наиболее простой тест на зрелость легких. Для производства теста используют околоплодные воды или 1 мл желудочного содержимого, полученного при помощи полиэтиленового катетера в первый час жизни. Тест выполняют следующим образом: к 0,5 мл околоплодных вод или желудочного содержимого добавляют 0,5 мл абсолютного этанола (95%). Стеклянную пробирку (диаметр 1 см) энергично встряхивают в течение 15 с, через 15 мин оценивают результат теста, приблизив пробирку к черной бумаге. Тест положительный, если на поверхности имеется одиночное или двойное кольцо пузырьков. Тест отрицательный, если пузырьков нет, и слабо положительный, если вокруг мениска имеются единичные мелкие пузырьки, заполняющие 1/3 окружности или менее. В случае положительного теста вероятность БГМ - около 4%, слабо положительного - 20%, отрицательного - 60%.
Объем обследования (мониторинга) у детей с РДС:
Непрерывный мониторинг частоты сердечных сокращений и АКД.
Чрескожная оксигемоглобинометрия, а лучше чрескожное определение Рао2 и Расо2 в артериальной крови. Очень опасно ориентироваться лишь на данные пульсоксиметра, ибо он неплохо отражает выраженность гипоксе- мии, но не реагирует на гипероксию, а уже при нижней границе нормы Раог оксигемоглобина 100%. Опасность же гипероксии велика: именно с ней связывают хронические поражения легких и глаз у новорожденных.
Оптимально определять Рао2 и Расо2 в крови, полученной при катетеризации пупочной, лучевой или большеберцовой артерии и из центральной вены, с анализом артериовенозной разницы напряжения кислорода, т.е. потребления кислорода тканями.
Каждые 3-4 ч необходимо измерять и фиксировать в карте наблюдения температуру кожи живота, артериальное давление, диурез, КОС, уровень гликемии и концентрацию кислорода во вдыхаемом воздухе (Fio2).
Во время острой фазы СДР ежедневно или через день производят:
рентгенографию грудной клетки;
определение гематокритного показателя;
ЭКГ;
клинический анализ крови;
посев крови и содержимого трахеи;
определение в сыворотке крови уровней азота мочевины, калия, натрия, кальция и магния, общего белка и альбуминов;
желательно определение объема циркулирующей крови, скорости мозгового кровотока и осмолярности крови;
коагулограмму с определением продуктов деградации фибриногена и фибрина (по показаниям);
определение уровня натрия в крови в начале - 2-4 раза в сутки, ибо велика опасность гипернатриемии из-за обезвоживания.
Дифференциальный диагноз проводят с дыхательными расстройствами как легочного (пневмонии, пороки развития легких и др.), так и нелегочного генеза (вторичные дыхательные расстройства - внутричерепная родовая травма головного или спинного мозга, врожденные пороки сердца, диафрагмальная грыжа, полици- темия, метаболические нарушения и др.). Дифференциальная диагностика с пнев-мониями изложена ниже.
Агенезияхоан обусловливает невозможность дышать носом и появление цианоза, расстройств дыхания после нормального первого вдоха. Типичны обильные слизистые выделения, заполняющие нос. Порок развития становится очевидным, когда не удается провести катетер или зонд через нос в носоглотку. Лечение хирур-гическое, но сразу же вводят воздуховод в рот.
Трахеопищеводные свищи клинически проявляются поперхиванием, приступами цианоза, кашлем, появлением хрипов в легких в момент кормления или сразу после него. Контрастное исследование пищевода (с водорастворимым контрастным веществом) и бронхоскопия подтвердят диагноз.
Диафрагмальная грыжа выявляется при рождении или вскоре после него нарастающим тяжелым расстройством дыхания. Типичен малый ладьевидный живот, втянутая передняя брюшная стенка при рождении. При осмотре обращают на себя внимание асинхронные движения правой и левой половины грудной клетки и смещение верхушечного толчка сердца, чаще вправо (ибо левосторонняя диаф- рагмальная грыжа встречается в 5-10 раз чаще, чем правосторонняя), резкое укорочение перкуторного тона в нижнем отделе легкого и отсутствие здесь же дыхательных шумов, внезапный цианоз при положении ребенка на здоровом боку. Решающее диагностическое значение имеет рентгенография грудной клетки, которая показывает наличие в грудной клетке структур, ей несвойственных (кишечник, печень и др.). Лечение хирургическое.
У детей с родовой травмой головного и спинного мозга, наряду с расстройствами дыхания, отмечаются и признаки поражения ЦНС. Помогают своевременной диагностике патологии мозга и вспомогательные исследования: нейросоногра- фия, рентгенография позвоночника, люмбальная пункция и др.
Врожденные пороки сердца «синего типа» и синдром персистирующей феталь- ной циркуляции иногда трудно отличить от СДР. Однако в первые часы жизни у детей с СДР зачастую обычный цвет кожных покровов. При использовании 100% кислорода для дыхания в течение 10-15 мин, особенно при постоянном положительном давлении в воздухоносных путях, у детей с СДР Раог повышается, иногда даже выше 100 торр, тогда как при пороках сердца синего типа этого не происходит. Безусловно, имеют значение и данные клинического осмотра, аускультации, оценка по шкале Сильвермана, а также дополнительных исследований (рентгено-графия грудной клетки, ЭКГ, результаты эхокардиографии).
Пневмонии, вызванные стрептококками В, другими стрептококками (пептост- рептококки, энтерококки), дают клиническую картину, практически не отличимую от БГМ, ибо вызывают ингибирование сурфактанта и отсюда его дефицит. Диагностическое значение в этом случае имеет выявление других инфекционных очагов {менингит и др.), результаты клинических анализов крови, посевов крови, содержимого трахеи.
Лечение. Температурная защита. Уход прежде всего направлен на профилактику охлаждения, ибо оно способствует снижению или даже прекращению (при температуре тела 35°С и ниже) синтеза сурфактанта и нарастанию метаболического ацидоза, развитию приступов апноэ. Ребенка сразу после рождения заворачивают в стерильную подогретую пеленку, удаляют околоплодные воды с кожи осторожным промоканием и помещают под лучистый источник тепла и далее в кувез (температура в кувезе зависит от массы тела при рождении; подробности - см. гл. VIII). Каждые 1-2 ч фиксируют температуру тела ребенка, и если она ниже 36, ГС, то температуру воздуха в кувезе повышают на 1- 2°С, а если выше 37°С, то снижают (обычно она должна быть не ниже 32°С). Подробнее в главе VIII.
Необходимо помнить, что ребенок, лежащий под лучистым источником тепла на реанимационном столе, тратит на поддержание температуры тела на 5-10% больше энергии, чем находящийся в кувезе. Поэтому недоношенных с очень малой массой тела целесообразно даже в кувезе помещать в пластиковую камеру, чтобы уменьшить потери тепла через конвекцию, а также неощутимые потери воды. Всем детям на голову надо надеть шапочку, ибо потери тепла и воды с головы очень велики.
Важно предупреждать колебания температуры внешней среды; осматривая ребенка в кувезе, свести до минимума травмирующие воздействия - болевые и др.
Осмотр врача должен быть как можно более коротким, особенно важно при необходимости поворотов ребенка поддерживать его голову, уменьшая пассивные движения в шейном отделе.
Поддержание проходимости дыхательных путей. При рождении ребенка в асфиксии, наличии мекония в околоплодных водах в виде «горохового супа» необходима интубация трахеи и нежное, но энергичное отсасывание содержимого дыхательных путей. Отсасывание повторяют в острую фазу болезни неоднократно, руководствуясь клинической картиной и аускультативными данными, но помня, что туалет трахеи вызывает преходящую, но значительную гипоксемию, брадикар- дию и гипертонию, существенное изменение интенсивности мозгового кровотока, что может провоцировать внутричерепные кровоизлияния, паравентрикуляр- ные поражения.
Положение ребенка с СДР на столике или в кувезе должно быть со слегка разогнутой головой («поза для чихания»). Для этого под верхнюю часть грудной клетки подкладывают валик толщиной 3-4 см. Периодическая смена положения ребенка (поворот слегка набок, на живот и др.) стимулирует трахеальный дренаж. По окончании острого периода прибегают к вибрационному массажу, физиотерапии, аэрозольтерапии.
Инфузионная терапия и питание. Как правило, детей с СДР первые двое-трое суток жизни энтерально не кормят из-за риска сердечно-легочных осложнений, срыгиваний. Однако ребенок с первых часов жизни не должен голодать и испытывать жажду. Кроме того, крайне важно предотвратить развитие гипогликемии. Поэтому уже через 30-40 мин после рождения начинают плановую инфузионную терапию. Объем вводимой жидкости в первые сутки жизни - 50-60 мл/кг с дальнейшим увеличением по 20 мл/кг на каждый последующий день (на 7-й день около 140-150 мл/кг). Особенно осторожно надо вводить жидкость и расширять ее су- точный объем при олигурии у ребенка. Когда появился диурез (более 2 ми/кг/ч), объем жидкости увеличивают смелее (до 40 мл/кг за сутки). В фазу олигурии избыточный объем жидкости может способствовать поддержанию открытого артериального протока, отечность легких, быть фактором повышенного риска последующего развития БЛД. Восстановление диуреза - вестник начала фазы выздоров-ления.
В первые сутки жизни переливаемая жидкость - 5-10% раствор глюкозы, со вторых суток к ней добавляют натрий и хлор 2-3 моль/кг/сут. и калий, кальций по 2 моль/кг/сут. Состав инфузионного раствора корригируют в зависимости от монограммы крови, поддерживая уровень натриемии в пределах 135-145 ммоль/л плазмы. Для профилактики тромбирования катетера и регионарного сосуда, особенно у детей, находящихся на полном парентеральном питании, во вливаемые растворы добавляют гепарин в дозе 0,2-0,5 ЕД на 1 мл переливаемой жидкости.
Вообще, как известно, объем и характер инфузионной терапии определяется в зависимости от:
ОЦК;
диуреза;
динамики массы тела;
динамики АКД и интенсивности мозгового кровотока;
состояния сердечно-сосудистой системы, в частности состояния периферической циркуляции;
КОС и ионограммы сыворотки крови;
условий выхаживания, в частности адекватности температурной защиты, методов ИВЛ или ВВЛ.
Учет всех этих параметров и коррекция объема - сложные задачи, требующие и знаний, и искусства врача, ибо до сих пор новорожденных не столько вылечивают, сколько выхаживают.
Кормление донорским, материнским молоком или адаптированной для недоношенных смесью начинают при улучшении состояния и уменьшении одышки до 60 в 1 мин, отсутствии длительных апноэ, срыгиваний, после контрольной дачи внутрь дистиллированной воды. Вид кормления (разовый или постоянный желудочный или транспилорический зонды, из бутылочки) зависит от наличия сосательного рефлекса, тяжести состояния. Расчет количества молока - см. главу VI, где также можно прочесть и о методике парентерального питания, если состояние больного не позволяет начать энтеральное питание.
Нормализация газового состава крови достигается обогащением кислородом вдыхаемого воздуха, различными вариантами создания повышенного давления в воздухоносных путях при спонтанном дыхании (СДППД - спонтанное дыхание с постоянным положительным давлением в воздухоносных путях) через нозаль- ные канюли (пСРАР - nose continiouse positive airway pressure - носовое постоянное давление воздухоносных путей) при постоянном повышенном давлении и ИВЛ.
Если признаков СДР нет, то недоношенного ребенка помещают в кувез, где содержание кислорода в воздухе около 40-45%. Если в течение 4 ч Раог артериальной крови (или при определении кожным датчиком) остается выше 8 кПа (60 торр=мм рт.сх), то концентрацию кислорода снижают на 5% в час до уровня 30-35%. При Рао2 менее 6,67 кПа (50 торр=мм рт.ст.) концентрацию кислорода во вдыхаемом воздухе увеличивают до максимальной, установив в кувезе над головой ребенка колпак. Если и это не приводит к нормализации Рао2 крови, то начинают СДППД (оптимального через нозальные канюли).
Другими показаниями к началу проведения СДППДявляются:
стойкая одышка и экспираторные шумы;
оценка по Сильверману 5 баллов и более (даже при нормальном цвете кож-ных покровов);
отрицательный «пенный тест» с околоплодными водами или содержимым желудка, полученным тотчас после рождения, отсутствие в них фосфатидил- глицерина.
Наиболее распространены в настоящее время пСРАР, гораздо реже используют метод Мартина (мешок Мартина). Мешок крепится на шее ребенка поролоновой лентой так, чтобы мизинец врача свободно проникал между мешком и шеей. Расширяющее давление на выдохе при СДППД обычно находится в пределах 4-6 см вод. ст. (т.е. на эту глубину погружается трубка, по которой выходит воздух из мешка), его редко приходится увеличивать при выраженной ригидности легких до 10 см вод. ст. Если ригидность легких невелика, то избыточное давление при выдохе приводит к нарушению оттока крови от мозга, уменьшению притока его к сердцу, способствует развитию сердечной недостаточности, отеку мозга.
Начинают СДППД с подачи подогретого до 32-34°С увлажненного кислорода, и далее под контролем клинического эффекта и Рао2 крови концентрацию его во вдыхаемой смеси постепенно снижают, добиваясь РаО2 артериальной крови 6,67-10,67 кПа (50-80 торр=мм рт.ст.), а артериализированной крови из пятки бо-лее 8 кПа считается потенциально токсичным, требующим снижения концентрации кислорода во вдыхаемом воздухе.
При выраженном беспокойстве ребенка, что отмечается особенно часто на фо-не пСРАР, назначают оксибутират натрия или седуксен, но не фенобарбитал, который избирательно подавляет экспираторные структуры дыхательного центра, расположенные в продолговатом мозге.
Показаниями для ИВЛ являются:
невозможность достичь нормализации Рао2 крови на фоне пСРАР, оценка по Сильверману более 5 баллов, не снижающаяся на фоне пСРАР;
Рао2 ниже 8,00 кПа (60 мм рт.ст.) при Fio2>0,7 (F1O2 -доля кислорода во вдыхаемой кислородо-воздушной смеси), но если масса тела при рождении менее 1250 г, то при Fio2>0,4;
Расо2 более 8,79 кПа (65 мм рт.ст.), а при массе тела менее 1250 г - Расо2>8,00 кПа (60 мм рт.ст.) и рН рН Методику проведения ИВЛ - см. гл. XXVI.
Экстракорпоральная мембранная оксигенация используется за рубежом для лечения детей с крайне тяжелым течением СДР при неэффективности традиционных методов ИВЛ и у детей с тяжелыми пороками сердца. Ввиду отсутствия соответствующего оборудования в России ее методики в данном учебнике мы не описываем.
Опасности кислородотерапии:
сухой и холодный кислород повреждает легкие, способствует спазму артериол, легочной гипертензии, ацидозу, торможению синтеза сурфактанта. Подогрев
кислорода до 32-34°С является обязательным (при ИВЛ - до 36-37°С), так же как и его увлажнение. При отсутствии специальных увлажнителей кислород пропускают через банку Боброва (высота водного столба не менее 15 см). Избыточное увлажнение (100% относительной влажности более 2 ч) ведет к перегреванию ребенка, водной перегрузке, способствует отеку легких; опасность токсического действия кислорода реальна при Рао2 артериальной крови более 10,67 кПа, держащимся несколько часов, что ведет к повреждению глаз, легких и ЦНС.
Поддержание КОС. Необходимо корригировать лишь патологический ацидоз (рН менее 7,25 и BE более минус 10 ммоль/л), причем только после налаживания ИВЛ или ВВЛ. Если патология со стороны легких привела к столь существенному нарушению КОС, то это прямое показание для ИВЛ или ВВЛ. Количество натрия гидрокарбоната в ммолях (т.е. количество мл 8,4% раствора) х (величина BE - 5) х масса тела (кг) х 0,4. Должное количество натрия гидрокарбоната вводят капельно в виде 4,2% раствора в течение 1 ч. Важно помнить, что алкалоз провоцирует внутричерепные кровоизлияния, остановки дыхания у недоношенных.
Борьба с анемией и гиповолемией, гипотонией. В острую фазу болезни необходимо поддерживать гематокритный показатель не ниже 0,4, ибо анемия - фактор, поддерживающий тканевую гипоксию, а значит, дефицит сурфактанта, отечность тканей и т.д. Переливают эритроцитную массу. При тяжелой анемии и тяжелом течении СДР более показано прямое переливание крови, так как в свежих эритроцитах больше 2,3-дифосфоглицерата, что уменьшает тканевую гипоксию. Кроме того, свежая кровь более показана и для коррекции дефектов гемостаза при деком- пенсированном ДВС-синдроме, а также она иммунопротектор при инфекциях. В то же время от замененных переливаний крови при СДР в настоящее время отказались, ибо это способствует увеличению частоты и тяжести ретинопатии недоношенных. На 2-й неделе жизни и позднее показанием к трансфузии эритроцит- ной массы является гематокрит ниже 0,3. В настоящее время показания к переливанию цельной крови резко ограничивают в связи с опасностью инфекций (не только гепатиты В и С, ВИЧ, но и цитомегаловирус, ибо у 6-12% доноров имеется цитомегаловирус в крови), изосенсибилизации.
Гиповолемию (положительный «симптом белого пятна» - 3 с и более), особенно у детей с анемией, наиболее целесообразно корригировать переливанием изотонического раствора натрия хлорида, но можно также переливать свежезамороженную плазму или 10% раствор альбумина. Количество переливаемого препарата - 10-15 мл/кг массы тела. Переливают медленно струйно (1-2 мл/кг/мин).
Если после коррекции анемии и гиповолемии артериальное кровяное давление низкое (максимальное давление ниже 45 торр, т.е. мм рт.ст.), то начинают ми- кроструйно вводить допамин (стартовая доза 5 мкг/кг/мин с дальнейшим повышением ее по показаниям до 10-15-20 мкг/кг/мин) (подробности - см. гл. XIX).
Замещение дефицита сурфактанта. С первых работ T.Fujiwara и соавт. в 1980 г. по замещению дефицита сурфактанта у глубоко недоношенных детей установлен положительный эффект такой терапии.
В настоящее время используют как естественные сурфактанты, полученные из легких быков (отечественный БЛ-сурфактант, разработанный в С.-Петербурге проф. ОАРозенбергом, зарубежные - Survanta, Alveofact, Infrasurf), свиней (Curosurf), так и синтетические (ALEK, Exosurf, Surfaxin, "Sfenticute). Наиболее эф- фективны естественные сурфактанты, содержащие, помимо фосфолипидов, сур- фактантный протеин В (табл. 12.3, 12.4). Следует подчеркнуть, что препарат Surfaxin, разработанный в США лабораторией Discovery, содержит комбинацию фосфолипидов (дипальмитилфосфатидилхолин - DPPC, пальмитилолеил фосфа- тидилглицерол - POPG, пальмитиновую кислоту - РА) и рекомбинантного, синтетического пептида, состоящего из фрагментов аминокислот лизина (К) и лейцина (L) в последовательности KLLLLKLLLLKLLLLKLLLL (КЦ). Этот рекомби- нантный пептид обладает свойствами сурфактантного протеина В. Препарат \enticute содержит рекомбинантный сурфактантный протеин С.
В многочисленных рандомизированных исследованиях показано, что экзогенный сурфактант способствует:
увеличению легочной растяжимости и функциональной остаточной емкости, уменьшая тем самым работу дыхательных мышц;
снижению при ИВЛ Fio2(доли кислорода во вдыхаемом воздухе), PIP (peak inspiratory pressure - пиковое инспираторное давление), MAP (mean airway pressure - среднее давление в дыхательных путях), PEEP (positive end-expiratory pressure - положительное давление в конце выдоха), улучшению индекса оксигенации альвеолокапилярного градиента кислорода;
снижению летальности при СДР (особенно эффективно профилактическое его применение у детей со сроком гестации менее 30 недель при сочетании
Таблица 12.3
Состав некоторых сурфактантов
(Gadzinowski J., 2003) Состав Surfaxin Survanta Curosurf Протеин/пептиды 0,8+2 мг/мл SpB и SpC Таблица 12.4
Белковый состав некоторых сурфактантов
(Gadzinowski J., 2003)
Препарат Отношение SpB в мг и фосфолипидов в ммолях Отношение SpC в мг и фосфолипидов в ммолях Alveofact 2,7+0,8 1,4+0,5 Curosurf 2,4+2,2 5,2+5,6 Surfaxin 19,8 * 1 Пальмитиновая кислота сберегает функцию SpC.
с антенатальным применением кортикостероидов), синдроме аспирации мекония, СДР взрослого типа;
укорочению времени ИВЛ и уменьшению частоты побочных эффектов ИВЛ (синдромы утечки воздуха и др.);
снижению частоты БДД, ВЖК, ретинопатии;
не ингибирует синтез эндогенного сурфактанта.
Следует отметить, что естественные сурфактанты более эффективны, чем синтетические, но они могут быть антигенны; кроме того, они менее стабильны по составу, требуют более жестких условий хранения и имеют более ограниченный срок использования, потенциально могут содержать прионовые агенты.
Мы имеем опыт использования препаратов Curosurf и Exosurf в ДГБ №1 (СПб.). Оба препарата оказывали вышеперечисленные эффекты. Однако после введения Curosurf Fio2, PIP, MAP удавалось снизить примерно на 30% уже через 3-3,5 ч, тогда как после введения Exosurf- лишь через 6 часов. После введения Curosurf наблюдалось снижение легочного сосудистого сопротивления, уменьшение постнагрузки правого желудочка и рост преднагрузки левого желудочка. Одновременно отмечалось уменьшение альвеолярно-капиллярной разницы напряжения кислорода, улучшение индекса оксигенации. К сожалению, рандомизированных сравнительных исследований применения отечественного БЛ-сурфактан- та нет, а мы не имеем опыта его использования, но поданным коллег знаем, что он гораздо менее эффективен при тяжелых СДР, чем Curosurf.
По данным профессора J.Gadzinowski (2003), в многоцентровых европейских сравнительных рандомизированных исследованиях (в них принимают участие и неонатологи Санкт-Петербурга, но исследование - двойное слепое, и мы пока не знаем наших результатов) профилактического применения Surfaxin, Exosurf и Survanta у детей с массой тела при рождении менее 1250 г, первый препарат оказался более эффективным, что, по его мнению, может быть связано с более ранним улучшением оксигенации (уже через несколько минут, тогда как после применения других препаратов сурфактанта это отмечается через 3-6 ч), более длительным эффектом за счет резистентности синтетического препарата Surfaxin к инги- бированию компонентами сыворотки и оксидантами.
Побочные эффекты и осложнения терапии сурфактантом во многом иатроген- ны. При отсутствии адекватного мониторинга и варьирования параметров ИВЛ могут развиться баротравма и волюмотравма легких, синдромы утечки воздуха, легочное кровотечение, гипероксия, а отсюда ретинопатия недоношенных, легочное кровотечение, ВЖК. Пожалуй, единственное, что отмечено многими исследователями практически во всех центрах, это увеличение после применения экзогенного сурфактанта частоты функционирующего артериального протока и приступов апноэ. Частота функционирующего артериального протока у детей, леченных Curosurf, в наших наблюдениях была 7,6%.
Наиболее эффективно профилактическое введение сурфактанта при рождении или в первые 15-30 мин жизни. Предназначенную для введения дозу предварительно подогревают (в течение 1 ч до 37°С) и вливают через интубационную трубку в трахею толчками за 4 приема в течение 10-15 мин или микроструйно при помощи инфузатора за 20-30 мин, при следующем вливании изменяют положение ребенка. При необходимости вливания повторяют через 12 ч. Тяжелых побочных эффектов не отмечено. Считается чрезвычайно важным как можно более ран- нее прекращение ИВЛ и перевод ребенка на пСРАР. В результате такой, в общем- то профилактической, терапии, частота и тяжесть СДР существенно снижаются.
Лечение сурфактантом уже развившегося СДР или пневмонии гораздо менее эффективно, чем профилактическое. При этом чрезвычайно важно перед введе-нием любого препарата сурфактанта стабилизировать состояние ребенка и по воз-можности корригировать основные параметры жизнедеятельности. После введения препарата необходим тщательный мониторинг, включающий: параметры ИВЛ, Fio2, визуальный анализ участия вспомогательной мускулатуры в акте дыхания, чрескожный анализ сатурации (Брог), ЧСС, АКД, КОС, рентгенографию грудной клетки до и спустя 3-6 ч после введения. Опять-таки необходимо гибко варьировать параметры ИВЛ и F102, не допуская баротравму и волюмотравму легких, гипероксию. Spo2 надо поддерживать в пределах 90-94%, что предотвращает гипероксию. Желательно в течение 3-6 ч после введения сурфактанта не отсасывать содержимое трахеи.
Закрытие открытого артериального протокамедикаментозно рассматривают у детей с СДР по данным эхокардиографии и допплеровского исследования на 4-5-й день жизни. Тактика применения индометацина или бруфена изложена в главе XIX.
Антибиотикотерапия. При постановке диагноза СДР и даже при подозрении на него назначают ампициллин в комбинации с одним из аминогликозидов (чаще гентамицином). Это обусловлено, с одной стороны, тем, что стрептококковая В- инфекция проявляется поражением легких, ничем (даже часто рентгенологически) не отличающимся от СДР, с другой - переводом больного на ИВЛ, что часто сопровождается инфицированием. Однако через 3 дня после получения результатов посевов крови и клинических анализов крови в динамике надо решить вопрос о наличии инфекции и, если ее нет, антибиотики отменить.
Витаминотерапия. Мнение о том, что профилактическое назначение витамина Е снижает частоту развития бронхолегочных дисплазий, не подтвердилось. И все же назначение витамина Е внутримышечно по 10 мг/кг ежедневно при использовании кислородно-воздушной смеси с Fio2более 0,4 показано, ибо это снижает частоту развития и тяжесть ретинопатии недоношенных. Курс 7-10 инъекций. Витамин А, введенный энтерально по 2000 ЕД через день, следует назначать всем детям до начала энтерального питания, ибо это снижает частоту развития не- кротизирующего энтероколита и бронхолегочных дисплазий.
Мочегонные. Хотя назначение фуросемида и увеличивает диурез и улучшает состояние легких, но увеличивает частоту открытого артериального протока, каль- цификатов в почках, дисэлектролитемий, а потому не может рассматриваться как рутинное. Фуросемид назначают лишь при отеках легких, отечном синдроме.
Глюкокортикоиды. От планового назначения глюкокортикоидов и их производных (чаще использовали дексаметазон как оказывающий максимальный тканевой эффект) для стимуляции синтеза сурфактанта всем детям с СДР в настоящее время отказались. Это связано с введением в терапию и вторичную профилактику СДР препаратов сурфактанта, совершенствованием методов дыхательной поддержки, ИВЛ, а также с побочными эффектами терапии глюкокортикоидами, основными из которых даже при коротком курсе являются: гипергликемия, артериальная гипертония, желудочно-кишечные кровотечения, некротизирующий энтероколит и другие инфекции. Глюкокортикоиды назначают больным СДР, у кото- рых, по клинико-лабораторным данным, имеется надпочечниковая недостаточность.
Многие неонатологи за рубежом пришли к заключению, что назначение дек- саметазона при постинтубационном отечном ларингите или трахеите с выраженным стенозом оказывает положительный эффект. В Neonatal Formulary (BMJ, 2000) рекомендовано дать 4 дозы по 200 мкг с интервалом в 8 часов, причем, первую дозу дают за 4 часа до экстубации детям с отеком или травмой гортани.
Тиреоидные гормоны для лечения детей с СДР начали активно применять в некоторых неонатальных клиниках, исходя из нередкого выявления низкого уровня тиреоидных гормонов у глубоко недоношенных детей с БГМ. Однако общепризнанных данных, основанных на результатах рандомизированных исследований, бесспорно доказывающих пользу такого назначения, нет, а потому это исследуемая терапия. Более обоснованно интраамниотическое применение L-тироксина беременным с высоким риском преждевременных родов, но и здесь общепринятых схем и общепризнанных результатов нет.
Рибоксин и инозитол, назначаемые интрагастрально каждые 6 ч в дозе 40 мг/кг с конца первых суток до 10-го дня жизни, по мнению М.Халлмана и соавт. (1986-1989), снижают тяжесть СДР, увеличивают синтез сурфактанта, снижают частоту развития бронхолегочной дисплазии. Однако и этот метод, так же как и плановое введение недоношенным плазминогена, - исследуемый метод лечения детей с СДР.
Прогноз СДР зависит от степени его тяжести и наличия сопутствующей патологии, осложнений терапии. Летальность детей с массой тела при рождении более 1000 г при рациональном ведении не превышает 5-10%. На первом году жизни дети, перенесшие СДР, часто болеют пневмониями, повышена у них и частота сепсиса. Энцефалопатия (постгипоксическая) - одно из характерных сопутствующих состояний (или осложнений) у детей с СДР, причем у части детей они четко выявляются лишь в дошкольном и школьном возрасте в виде минимальных мозговых дисфункции, поведенческих расстройств, трудностей в учебе. В связи с этим в системе реабилитационных мероприятий детей с СДР необходимо предусмотреть раннее назначение (с 3-4-го дня) препаратов, улучшающих трофику мозга (глиа- тилин 10-15 мг/кг/сут., ноотропил 50 мг/кг внутривенно или внутрь 2-3 раза в день), наблюдение невропатолога.
Профилактика. Антенатальная гормональная терапия. Введение внутримышечно или дача внутрь матери при угрозе преждевременных родов на сроке 24-34 неД.:
бетаметазона в дозе 12 мг (2 раза с интервалом 24 ч) или
дексаметазона по 6 мг 4 раза с интервалом 12 ч.
Оптимально, чтобы срок между окончанием гормонотерапии и родами был более 24 ч. Эффект такого назначения сохраняется в течение 10 дней, и если роды не наступили, то показано однократное введение дексаметазона в дозе 6-12 мг.
Антенатальный курс кортикостероидов приводит не только к уменьшению частоты и тяжести СДР, но и снижает риск развития синдрома открытого артериального протока, внутрижелудочковых кровоизлияний, перивентрикулярной лейко- маляции, некротизирующего энтероколита, длительность и стоимость выхаживания глубоконедоношенного новорожденного.
Длительные катамнестические исследования показали, что курс антенатальной гормональной терапии не увеличивает частоту инфекционных заболеваний у новорожденных, не влияет на последующее физическое и психомоторное развитие (в том числе и на темпы прироста окружности головы), а также рост легких, не вызывает нарушений функции надпочечников, зрения или слуха.
В настоящее время наиболее перспективным считают отработку для практического применения схемы введения в околоплодные воды трийодтиронина, а оптимально - тиреотропинрилизинг-гормона (ТРГ). Препараты ТРГ и в эксперименте, и при ограниченных клинических испытаниях оказались очень эффективными в плане профилактики СДР. Однако два больших мультицентовых исследования, проведенных в США, не показали преимущества сочетания профилактического назначения беременной кортикостероидов в комбинации с тиреоидными гормонами и/или ТРГ (Ballard RA et al., 1998).
Полезно «затягивание»родов, ибо, если безводный промежуток продолжается более 2 суток, СДР обычно не развивается, хотя у таких детей чаще наблюдаются сепсис и, вероятно, внутричерепные кровоизлияния.
Заместительная терапия экзогенными сурфактантами в первые 30 минут жи ни (см. выше) - высокоэффективный метод профилактики тяжелого СДР.
Под синдромом дыхательных расстройств (СДР) подразумевают любые патологические изменения в легких, возникающие у плода или новорожденного в первые 2-3 дня жизни, клинически проявляющиеся выраженной дыхательной недостаточностью.
СДР чаще наблюдается у недоношенных детей, особенно из двойни, преимущественно у мальчиков. Основными причинами его возникновения являются: а) пневмопатии - легких, гиалиновые мембраны, отечно-геморрагический синдром, кровоизлияние в легкие, пороки развития легких; ) внутриутробная - , сепсис; внутричерепные кровоизлияния.
Анатомическая и функциональная зрелость легких зависит от количества сурфактанта, который выстилает внутреннюю поверхность альвеол, создает поверхностно-альвеолярную пленку, препятствующую спадению альвеол и развитию ателектаза. Для нормального функционирования легких до статочное количество сурфактанта достигается к 35-й неделе . содержании его в ткани легких плода можно по уровню лецитина в околоплодных водах. Для этого используется «пенный» тест Клементса. Сущность его состоит в следующем.
«Пенный» тест проводится и с содержимым желудка новорожденного. СДР наиболее проявляется в первые 2 дня жизни и постепенно исчезает к 12-14-му дню. Степень тяжести его оценивается в баллах шкале Сильвермана 30 мин рождения ребенка, затем через 3-6-12 ч на протяжении 2-3 дней. и балла свидетельствуют о наличии синдрома. При 10 баллах состояние ребенка крайне тяжелое.
Шкала Сильвермана
|
Клинические симптомы |
|||
|
Неравномерное |
Парадоксальное |
||
|
Втяжение межреберий |
Отсутствует |
Умеренное |
Резко выраженное |
|
Втяжение грудины |
Отсутствует. |
Умеренное на вдохе |
Постоянное, резко выраженное |
Признаки СДР наблюдаются в первые жизни ребенка. К ним относятся: учащение дыхания (свыше 60-70 в 1 мин), втяжение при вдохе межреберных промежутков и мечевидного отростка, раздувание крыльев носа, затрудненный выдох, функционального состояния центральной нервной системы.
Первичные ателектазы могут быть мелкими, рассеянными по обеим легким или сгруппированными в обширные конгломераты, занимающие или несколько сегментов (полисегментарные ателектазы).
Дети становятся вялыми, наблюдаются снижение мышечного тонуса, адинамия. Появляется резкая , дыхание становится учащенным и затрудненным, парадоксальным типа «качелей». Грудная клетка бочкообразная, при пальпации ригидная. Отмечаются притупление или укорочение перкуторного звука и ослабленное дыхание на пораженной стороне, жесткое, усиленное дыхание - на остальных участках легких. Могут выслушиваться единичные, непостоянные крепитирующие хрипы. Неосложненная патологическим процессом спавшаяся легочная ткань расправляется в течение 4-5 дней. Рассеянные диссеминированные ателектазы чаще бывают первичными, наблюдаются у детей с малой массой и незрелой легочной тканью. нередко рождаются в состоянии асфиксии, вялые, со сниженным мышечным тонусом, выраженным цианозом . Синдром расстройства дыхания вначале выражен нерезко, на 2-4 балла шкале Сильвермана, но к концу 2- 3-х суток наступает разгар заболевания. учащается, ноздри раздуваются, появляются судорожные вздохи. Грудная клетка «тестоватая» на ощупь. Перкуторный звук укорочен на всем протяжении или на отдельных участках легких. жесткое, затрудненным звучным выдохом, на фоне которого выслушиваются единичные непостоянные крепитирующие хрипы. При благоприятном течении на 5-й наступает и к концу 2-й недели симптомы постепенно исчезают. Резкое состояния на 5-6-й день является признаком присоединения пневмонии.
С синдромом гиалиновых мембран могут родиться в удовлетворительном состоянии. промежуток продолжается иногда до 12 ч, после развивается тяжелая дыхательная недостаточность, учащается дыхание, появляется цианоз кожи, который при ингаляции кислорода не исчезает. Наблюдаются повторные приступы асфиксии; плотная, размеры увеличены; нарастает подкожной основы. При аускультации легких ослаблено, выслушиваются мелкие хрипы. В дальнейшем отмечаются функций центральной , полная и , частая остановка дыхания. бледная с серовато-цианотичным оттенком.
Отечно-геморрагический синдром - одна из самых тяжелых форм пневмопатий. Представляет собой локальное проявление патологической гидратации всего организма новорожденного, наступающей вследствие нарушения обменных процессов и внутриутробной асфиксии. Характерным признаком синдрома является выделение изо рта пенистой кровавой жидкости. Дыхательная и признаки СДР появляются рождения ребенка. На коже и подкожной основе часто возникают обширные кровоизлияния. В легких наблюдается тяжелого отека: при перкуссии звук укорочен, ослаблено, особенно и в нижних отделах, выслушивается большое количество - и мелкопузырчатых хрипов.
Отечно-геморрагический синдром почти всегда сочетается с рассеянными ателектазами легких, особенно у недоношенных детей.
Кровоизлияния в могут быть альвеолярные, интерстициальные и смешанные. В 50 % случаев отмечается
Синдром дыхательных расстройств
В.Ф. Демин, А.А. Михеева
Кафедра детских болезней №3, РГМУ.
Терминология
Термины респираторный дистресс-синдром (РДС), синдром дыхательных расстройств (СДР) и болезнь гиалиновых мембран (БГМ) часто применяются для описания одной и той же патологии. Последние годы многие авторы не используют термины СДР и РДС как синонимы БГМ, т.к. известны и другие патологические состояния, при которых происходит формирование гиалиновых мембран. В отечественной литературе применительно к одному и тому же состоянию встречается как термин синдром дыхательных расстройств, так и респираторный дистресс-синдром.
Этиология и патогенез
Синдром дыхательных расстройств развивается примерно у 20% недоношенных, но его частота в большой степени зависит от срока гестации и может варьировать от 5-10% у детей, рожденных на сроке 35-36 недель, и до 80-88% у детей при сроке гестации менее 27 недель. Синдром дыхательных расстройств возникает у доношенных детей в 1-2% и связан в основном с морфо-функциональной незрелостью, асфиксией в родах и некоторыми другими состояниями.
В основе развития синдрома дыхательных расстройств лежит структурно-функциональная незрелость легких и связанная с ней недостаточность образования сурфактанта. Кроме того, причиной развития СДР может являться нарушение строения сурфактанта, его повышенное разрушение или ингибирование.
Анатомо-физиологические особенности системы дыхания новорожденного предрасполагают к более быстрому развитию дыхательной недостаточности, чем у ребенка более старшего возраста и взрослого человека. Гортань расположена выше, чем у взрослых,а дыхательные пути очень узки, причем подскладочное пространство является самым узким местом, где утолщение слизистой даже на 1 мм приводит к сужению просвета на 75%. Легкие более полнокровны и менее эластичны, чем у взрослого. Количество альвеол у новорожденного в 10-15 раз меньше, чем у взрослого, что приводит к ограничению возможностей легочного газообмена. Грудная клетка новорожденного находится как бы в положении вдоха, обусловленном перпендикулярным по отношению к позвоночнику расположением ребер, поэтому увеличение объема вентиляции происходит в основном за счет частоты дыхания.
После прохождения ребенка через родовые пути легкие никогда не расправляются самостоятельно под действием эластической тяги. Силы поверхностного натяжения в слое жидкости между слипшимися альвеолами препятствуют этому. Для расправления альвеол необходимо разрежение в грудной клетке, при этом транспульмональное давление должно составлять до -40 см вод ст. Первый крик новорожденного представляет собой важный приспособительный механизм. Объем первого вдоха больше объема выдоха; чем громче крик, тем больше разница. Таким образом, создается режим положительного давления в конце выдоха, помогающий расправить легкие и создать повышенное внутрилегочное давление, благодаря которому быстрее закрывается открытое овальное окно и открытый артериальный проток, а легочный кровоток увеличивается, направляется через альвеолярную ткань. Продукция сурфактанта становится достаточной, легкие нормально расправляются.
При недостатке или при нарушении продукции сурфактанта поверхностное натяжение в альвеолах становится очень высоким. Если при первом вдохе транспульмональное давление должно быть до –40 см вод ст, то для последующих (сурфактант уже действует) оно составляет –5 см вод ст.При дефиците сурфактанта давление для раскрытия альвеол остается таким же высоким, как и при первом вдохе, легочный кровоток снижен, что нарушает продукцию сурфактанта, ишемизированная ткань становится более проницаемой, через альвеолокапиллярную мембрану происходит транссудация плазмы внутрь альвеол и инактивация даже того небольшого количества сурфактанта, которое содержатся в них с образованием пленки – гиалиновой мембраны. В 1959 году Avery и Meed первыми доказали недостаточность сурфактанта у новорожденных, умерших от БГМ.
Сурфактант представляет собой мономолекулярный слой на поверхности раздела между эпителием альвеол и воздухом. Он препятствует спадению альвеол на выдохе и развитию отека в легких (за счет регуляции проницаемости стенок альвеол и микроциркуляции в легких), защищает альвеолярный эпителий от повреждений, а также участвует в местных иммунологических реакциях. С химической точки зрения сурфактант является липопротеином – смесь на 90-95% состоит из липидов и на 5-10% из белковой фракции, представленной четырьмя специфическими протеинами – SP-A, SP-B, SP-C, SP-D. В липидный состав сурфактанта входят фосфолипиды (80%), основную часть которых составляет фосфатидилхолин, и нейтральные липиды.
Сурфактант синтезируется альвеолоцитами II типа начиная с 25-26 недели гестации, наиболее активный синтез отмечается с 34 недели гестации. Молекулы сурфактанта с одной стороны гидрофильны, закреплены в водной фазе, а с другой – липофильны, выпячены в газовую фазу, что и определяет активное поверхностное действие (за счет отталкивающих межмолекулярных сил липофильных частей).
Во внутриутробный период созревание системы сурфактанта происходит под влиянием многочисленных факторов. Общеизвестна важная роль стероидных гормонов в этом процессе, установлен синергизм действия кортизола и тиреоидных гормонов и β-адреноэргетиков. Существует несколько механизмов воздействия глюкокортикоидов на созревание легких. Эндогеные глюкокортикоиды влияют на адренергическую систему, которая играет важную роль в подготовке легких к их внеутробной функции, стимулируют адренергические рецепторы и секрецию адреналина в надпочечниках плода. Глюкокортикоиды непосредственно влияют на фибробласты интерстициальной ткани, которые в свою очередь выделяют «фибробласт-пневмоцитарный фактор» – олигопептид, который стимулирует синтез фосфолипидов в альвеолоцитах 2 типа.
Факторами, способствующими развитию СДР, являются:
- недоношенность и морфо-функциональная незрелость
- внутриутробные инфекции
- внутриутробная гипоксия и асфиксия в родах
- острая кровопотеря в родах
- сахарный диабет у матери (инсулин снижает выработку сурфактанта)
- роды путем кесарева сечения
- рождение вторым из двойни
- охлаждение ребенка, гипероксия, гиповолемия.
Основное звено патогенеза СДР – как первичный недостаток системы сурфактанта, так и патология, такая, как аспирация мекониальных околоплодных вод, дефицит плазминогена, отечно-гемор-рагический синдром легких, декомпенсированный ДВС-синдром, снижение активности антипротеаз, приводящая к снижению синтеза или увеличению деградации фосфатидилхолинов.
Гиповентиляция и неадекватная оксигенация, связанные с недостаточностью сурфактанта, податливостью грудной клетки, умень-шением дыхательного объема, низкой растяжимостью легких, одышкой, приводят к тяжелым нарушениям жизненно важных функций.
При недостаточной оксигенации тканей обменные процессы у новорожденных переходят на анаэробный путь окисления легче, чем у взрослых, что приводит к накоплению в организме недоокисленных продуктов обмена.
Гипоксия печени способствует потере ею способности утилизировать глюкозу, что приводит к нарушению ресинтеза углеводов из молочной кислоты. Увеличение уровня молочной кислоты в крови при гипоксии достигает 9,4-9,9 ммоль/л (в норме – 2,0-2,4 ммоль/л), рН крови снижается, развивается ацидоз. Повышение катаболизма углеводов и соответственное снижение их запаса способствует использованию белков как энергетического субстрата. Характерно наличие гипогликемии, гипопротеинемии, усиление экскреции азота, снижение массы тела.
На фоне гипоксии происходит повышение проницаемости капилляров, что приводит к выходу белка в интерстициальное пространство, онкотическое давление снижается, ограничивается резорбция жидкости. Гипоксия и гипоксемия оказывают влияние центральную нервную систему, повышая проницаемость сосудов мозга и способствуя возникновению кровоизлияний.
Очень опасны возникающие при синдроме дыхательных расстройств нарушения гемодинамики. Гиперкапния приводит к спазму легочных сосудов, что ведет к ухудшению легочного кровотока, увеличению давления в малом круге, повышению шунтирования крови через открытое овальное окно и артериальный проток. Серозная жидкость при повышении давления пропотевает в альвеолы, ухудшая регионарный кровоток и вентиляцию.
Анаэробный обмен отрицательно сказывается на энергообмене в миокарде, снижая сократительную способность сердца, сердечный выброс, повышая застойные явления в малом круге, что в свою очередь приводит к усилению гипоксии и гиперкапнии; продолжает нарастать метаболический ацидоз. Кислые продукты обмена препятствуют утилизации кислорода тканями, нарушают тканевое дыхание.
Накопление промежуточных продуктов метаболизма способствует снижению тонуса прекапиллярных сфинктеров. Кровь свободно проникает в капилляры, но тонус сфинктеров посткапиллярных вен более резистентен к ацидозу, что затрудняет отток крови. Она скапливается в микрокапиллярном русле, увеличивается внутрисосудистая свертываемость. По мере усиления дыхательной недостаточности развивается дефицит объема циркулирующей крови, чему способствует и экстравазация жидкости. Происходят структурные и функциональные нарушения эндотелия сосудов, пропотевание плазмы, возникают отеки.
Клиника .
Первым признаком развивающегося синдрома дыхательных расстройств является одышка. Хотя дыхательные мышцы развивают большое усилие, а трахея и бронхи проходимы, дыхательный объем снижаетсяпосле первых вдохов. Учащение дыхания отмечается сразу после рождения, причем в первое время одышка (более 60, у глубоко недоношенных детей – более 80 в минуту) не сопровождается цианозом кожных покровов, так как связана с раздражением хеморецепторов.
В симптомокомплекс синдрома дыхательных расстройств входят:
- Нарастание одышки
- Раздувание крыльев носа
- Втяжение уступчивых мест грудной клетки
- Участие в акте дыхания вспомогательной мускулатуры
- Цианоз, появляющийся при РаСО 2 более 30- 40 мм рт ст, вначале периоральный, далее - акроцианоз и генерализованный цианоз.
- Бледность кожных покровов
- Экспираторные шумы, обусловленные компенсаторным спазмом голосовой щели на выдохе, препятствующем спадению альвеол на начальном этапе развития синдрома дыхательных расстройств.
- При аускультации в легких выслушивается ослабление дыхания, позднее появляются высокие сухие, мелкопузырчатые и крепитирующие хрипы.
Тяжесть дыхательной недостаточности у недоношенных новорожденных определяется по шкале Сильвермана (табл.1)
Таблица 1. Шкала Сильвермана.
|
Стадия 0 |
Стадия 1 |
Стадия 2 |
|
Верхняя часть грудной клетки при положении ребенка на спине и передняя брюшная стенка синхронно участвуют в акте дыхания |
Отсутствие синхронности или минимальное опущение верхней части грудной клетки при подъеме передней брюшной стенки на вдохе |
Заметное западение грудной клетки во время подъема передней брюшной стенки на вдохе |
|
Нет втяжения межреберий на вдохе |
Легкое втяжение межреберных промежутков на вдохе |
Заметное втяжение межреберных промежутков на вдохе |
|
Нет втяжения мечевидного отростка грудины на вдохе |
Небольшое втяжение мечевидного отростка грудины на вдохе |
Заметное западание мечевидного отростка на вдохе |
|
Нет движения подбородка при дыхании |
Опускание подбородка на вдохе, рот закрыт |
Опускание подбородка на вдохе, рот открыт |
|
Нет шумов на выдохе |
Экспираторные шумы слышны при аускультации грудной клетки |
Экспираторные шу-мы слышны при по-днесении фонендоскопа ко рту или без фонендоскопа |
При сумме баллов менее 5 – начинающийся СДР, 5 баллов – СДР средней тяжести, 6-9 баллов – тяжелый и 10 баллов – крайне тяжелый СДР.
Для СДР типичны симптомы нарушения системы кровообраще-ния: снижение артериального давления, нарушения микроциркуляции, тахикардия. Аускультативно определяется приглушение тонов.
Может увеличиваться в размерах печень.Вследствие гипоксического повреждения эндотелия капилляров развивается гиповолемия, что часто приводит к периферическим отекам и задержке жидкости. Характерно угнетение ЦНС, нередко у ребенка обнаруживают перивентрикулярные кровоизлияния. Вопрос, что является первичным – поражение мозга или легких остается открытым. При дальнейшем прогрессировании синдрома дыхательных расстройств развивается декомпенсированный ДВС-синдром. Также существует высокий риск присоединения вторичной инфекции - пневмонии развиваются практически у каждого второго ребенка с синдромом дыхательных расстройств.
Течение СДР: наибольшая тяжесть состояния наблюдается на 1 сутки жизни, в дальнейшем выраженность клинических проявлений зависит от возникших осложнений (внутрижелудочковые кровоизлияния, синдромы «утечки воздуха», выраженная легочная гипертензия, декомпенсированный ДВС-синдром, некротизирующий энтероколит и др.)
Диагностика.
Диагноз СДР традиционно ставится на основании данных анамнеза, клинических и рентгенологических симптомов. Рентгенологически определяется характерная для СДР триада признаков, появляющаяся уже в первые часы заболевания:
- диффузное снижение прозрачности легочных полей
- ретикулогранулярная сетчатость
- наличие полосок просветления в области корня легкого (воздушная бронхограмма)
В тяжелых случаях возможно тотальное затемнение легочных полей, границы сердца могут не дифференцироваться.
В последнее время в арсенале медиков появились методы, определяющие степень зрелости как самой легочной ткани, так и системы сурфактанта. В качестве самого распространенного и информативного теста используется определение отношения лецитина к сфингомиелину в околоплодных водах, трахеальной жидкости или аспирате содержимого желудка при рождении. Если этот показатель больше 3, то легкие зрелые, а если менее 2, ториск развития СДР очень высок (50-75%).
Используется также «пенный» тест: при добавлении этанола в жидкость, содержащую сурфактант, и встряхивании образуется пена. Эти же методы могут использоваться и при пренатальной дианостике, но вопрос об амниоцентезе должен решаться индивидуально и при сроке беременности не менее 32 недель, так как в более ранние сроки гестации незрелость легких не вызывает сомнений, а ведение беременности предполагает минимум инвазивных исследований.
Дифференциальный диагноз проводится с пневмониями, другими пневмопатиями, пороками развития дыхательной системы и другими дыхательными расстройствами как легочного, так и внелегочного (ВПС, родовая травма, нарушения метаболизма, др.) генеза. Например, при атрезии хоан наблюдаются расстройства дыхания после первого вдоха, приступы цианоза, отсутствие носового дыхания. Диагноз ставится при невозможности проведения катетера из носа в носоглотку, но наиболее точным является рентгенологическое исследование с контрастным веществом.
При диафрагмальной грыже отмечаются дыхательные расстройства различной степени тяжести, связанные с размерами грыжи, приступы цианоза как спонтанные, так и после кормления или при перемене положения ребенка. Диагностическое значение имеет рентгенологическое исследование, когда в грудной полости обнаруживаются органы брюшной.
Пневмония , развившаяся в первые часы после рождения, практически неотличима от СДР, диагноз ставится порезультатам клинического анализа крови, посевов крови и содержимого трахеи, рентгенографии грудной клетки; могут присутствовать другие воспалительные очаги.
При наличии у ребенка родовой травмы ЦНС цианоз чаще носит приступообразный характер, отмечается неврологическая симптоматика (резкое снижение рефлексов, судороги, др.), при рентгенографии грудной клетки не обнаруживается характерных для СДР изменений. Для уточнения диагноза проводят нейросонографию, люмбальную пункцию, при симптомах травмы спинного мозга – рентгенографию позвоночника.
Симптомы врожденного порока сердца «синего» типа подчас трудно отличить от клинической картины СДР, в этом случае цианоз при ВПС отмечается с момента рождения, а при дыхании 100% кислородом у ребенка не отмечается повышение РаО 2 . Диагноз подтверждается с помощью рентгенографии грудной клетки, ЭКГ, эхокардиографии.
Лечение.
Этиологическим методом лечения является введение экзогенных сурфактантов . Применение их возможно как с профилактической, так и с терапевтической целью.
Препараты сурфактанта относятся к четырем категориям:
1. естественные препараты, полученные из амниотической жидкости человека (при разрешении доношенной беременности путем кесарева сечения)
2. естественные препараты, полученные из измельченных легких поросят и телят
3. полусинтетические смеси измельченных легких теленка с дипальмитоилфосфатидилхолином (ДПФХ)
4. полностью синтетические сурфактантные препараты.
При применении естественных сурфактантов быстрее наступает клинический эффект, но конечные результаты лечения не отличаются от таковых при назначении искусственных сурфактантов. Предполагается, что сурфактант, выделенный из легких телят и поросят,может вызвать иммунологическую реакцию на чужеродный белок, но убедительных данных получено не было. Наиболее естественный для ребенка сурфактант из амниотической жидкости не может широко использоваться, так как для лечения одного ребенка требуется использование амниотической жидкости от 10 операций кесарева сечения. Кроме того, есть риск инфицирования ВИЧ, цитомегаловирусной инфекцией, герпесом.
В нашей стране к клиническому применению разрешены и довольно широко используются: экзосурф неонатал – синтетический препарат и куросурф – естественный сурфактант из легких свиньи.
Профилактика СДР проводится в первые 2 часа жизни:
1. новорожденным с массой тела при рождении менее 1250г
2. новорожденным с массой более 1250г с подтвержденной незрелостью легких (например, по отношению лецитина к сфингомиелину в околоплодных водах)
Лечение СДР проводится в возрасте от 2 до 24 часов у детей с клинически и рентгенологически подтвержденным диагнозом СДР, интубированным и находящимся на ИВЛ.
Противопоказаний к применению сурфактанта нет.При тяжелой асфиксии требуется предварительная стабилизация центрального и легочного кровообращения.
Большое значение в лечении синдрома дыхательных расстро-йств имеет обеспечение адекватного ухода . Основа – техника «минимальных прикосновений». Осмотр врача не должен быть длительным, необходимо максимально уменьшить травмирующие воздействия. Важно поддерживать оптимальный температурный режим, так как охлаждение способствует снижению или прекращению синтеза сурфактанта. Чем ниже масса тела при рождени и чем меньше возраст ребенка, тем выше должна быть температура в инкубаторе. Важ-но поддержание не только оптимальной температуры, но и влажности для предотвращения потерь жидкости через кожу, особенно у детей с экстремально низкой массой тела при рождении (табл. 2).
|
Возраст /масса |
<1000г |
1000-1500г |
1501-2500г |
|||
|
температура |
влажность |
температура |
влажность |
температура |
влажность |
|
|
0-24 часа |
35-37 |
75-85 |
34-36 |
70-75 |
33-35 |
|
|
24-96 часов |
34-36 |
33-35 |
60-65 |
31-33 |
||
|
4-14 суток |
33-35 |
32-34 |
31-33 |
|||
|
2-4 недели |
32-34 |
50-60 |
31-33 |
30-32 |
40-50 |
|
Дети с синдромом дыхательных расстройств нуждаются в обязательном непрерывном мониторинге таких показателей, как частота сердечных сокращений, частота дыхания. Каждые4 часа определяется артериальное давление, температура, кислотно-основ-ное состояние, РаО 2 , РаСО 2 , уровень глюкозы и натрия в крови,
В остром периоде синдрома дыхательных расстройств необходимо не реже 1 раза в 2 дня производить клинический анализ крови, рентгенографию грудной клетки, ЭКГ, биохимический анализ крови, по возможности коагулограмму, определение ОЦК. Необходимо так же часто проводить посев крови и содержимого трахеи, нейросонографию.
Энтеральное питание в первые 2 суток жизни стараются не при-менять из-за риска срыгиваний и сердечно-легочных осложнений. Уже на первом часу жизни начинают плановое парентеральное питание . Абсолютным показанием для его применения являются нару-шения гемодинамики и гипоксемия (РаО 2 артериальной крови ниже 50мм.рт.ст). В первые сутки жизни объем вводимой жидкости соста-вляет 30-40 мл/кг, далее его постепенно увеличивают до 70-100 мл/кг к 7 суткам жизни и до 150-180 к 1 месяцу. Объем жидкости должен определяться индивидуально с учетом возраста ребенка, срока гестации, диуреза, ОЦК, динамики массы тела, состояния сердечно-сосудистой системы, периферического кровообращения, кислотно-основного состояния, способа выхаживания ребенка и режима ИВЛ.
Необходимо учитывать, что избыточное количество жидкости может привести к отекам, в том числе и отеку легких, и сохранению открытого артериального протока. В первые сутки жизни вводится 10% раствор глюкозы (у детей с массой тела при рождении менее 1000г – 5% раствор глюкозы). Аминокислоты могут применяться с конца первых – начала вторых суток жизни, в первые сутки введения количество белка не должно превышать 1,5 г/кг, далее постепенно его увеличивают до 2,5-3 г/кг, а у детей с массой тела при рождении менее 1000г – до 4 г/кг. Используются стандартные растворы аминокислот, по возможности, содержащиеаминокислоту таурин (аминовеноз), т.к. снижение ее уровня может привести к повреждениям головного мозга и сетчатки глаза.
Наличие легочной патологии является противопоказанием для парентерального введения жиров до 7 суток жизни; при сохраняющемся к этому возрасту парентеральном питаниижиры вводят начиная с 0,5г/кг, постепенно увеличивая до 2г/кг. Инфузию жировых эмульсий проводят с очень маленькой скоростью в течение суток. Потребности в минеральных веществах составляют: натрий – 1,2 ммоль/кг, калий – 0,8 ммоль/кг, хлориды – 0,86 ммоль/кг, кальций – 3,2 моль/кг, магний – 0,16 ммоль/кг. Используются хлориды натрия, калия, глюконат кальция, др. Следует учитывать, что введение только солей соляной кислоты может привести к гиперхлоремическому метаболическому ацидозу, в связи с чем применяют также лактаты, фосфаты и другие соли.
Сроки назначения энтерального питания индивидуальны, но следует заметить, что раннее его введение стимулирует созревание желудочно-кишечного тракта, уменьшает частоту холестаза, а при кормлении нативным грудным молоком – уменьшает риск развития язвенно-некротического колита, причем для этого достаточно вводить 0,5мл/кг/час. Остальные же потребности можно возмещать за счет парентерального питания. Показано использование нативного грудного молока или специализированных смесей для недоношенных. Пробно вводят 5мл молока через назогастральный зонд и при отсутствии вздутия живота, срыгиваний, апноэ постепенно увеличивают объем энтерального питания.
Важным звеном терапии СДР является обеспечение и поддержание свободной проходимости дыхательных путей . Необходимо при рождении ребенка в асфиксии или при мекониальной аспирации провести интубацию и отсасываниесодержимого дыхательных путей. При необходимости отсасывание повторяют в течение заболевания (учитывая клиническую и рентгенологическую картину), но нельзя забывать, что при проведении этой манипуляции возникает гипоксемия, брадикардия и гипертония, а также провоцируется развитие внутричерепных кровоизлияний. Трахеальный дренаж улучшается при периодическом изменении положения ребенка(повороты на бок, на живот).
В патогенезе СДР основное значение имеют гипоксия и гипоксемия, в связи с чем важнейшую роль в лечении синдрома дыхательных расстройств играет оксигенотерапия. При выборе способа введения кислорода и его концентрации в дыхательной смеси необходимо учитывать, что парциальное давление кислорода в крови выше 50 мм.рт.ст уже обеспечивает достаточную оксигенацию, а при РаО 2 выше 80 мм.рт.ст проявляются токсические свойства кислорода, о которых будет сказано ниже. Контроль парциального давления кислорода в артериальной крови и фракционной концентрации кислорода в дыхательной смеси позволяет врачу обеспечить достаточную оксигенацию ребенка и избежать возможных осложнений кислородотерапии. Необходимо также контролировать температуру дыхательной смеси и ее влажность. При дыхании холодной смесью развивается клиника охлаждения ребенка. Увлажнение дыхательной смеситребуется при концентрации кислорода более 40%, так как возможны потери жидкости в связи с перспирацией.
При оксигенотерапии широко используются носовые катетеры, маски, кислородные палатки, инкубаторы с подачей кислорода. При одинаковой концентрации кислорода в смеси максимальная концен-трация в дыхательных путях отмечается в кислородной палатке или кувезе, но расход кислорода при этих способах оксигенотерапии велик. Носовые катетеры не позволяют создать высокую концентрацию кислорода, а кроме того затрудняют носовое дыхание и раздражают слизистую носа. Лицевые маски могут поддерживать стабильные и довольно высокие концентрации кислорода;к их недостаткам относятся трудности фиксации и герметизации.
Спонтанное дыхание с постоянным положительным давлением (СДППД) препятствует экспираторному закрытию воздухоносных путей, компенсируя сниженный уровень сурфактанта, предотвращает слипание альвеол. Увеличивается газообмен, уменьшается отечность альвеолокапиллярной мембраны, повышается парциальное давление кислорода в артериальной крови при неизменной концентрации в дыхательной смеси. Нередко отмечается снижение РаСО 2 . Показаниями к проведению СДППД является гипоксемия (РаО 2 менее 50 мм.рт.ст) при использовании 50% дыхательной смеси, связаннаяс нарушением вентиляционно-перфузионных соотношений, высоким внутрилегочным шунтированием, сниженной растяжимостью легких, а также стойкая одышка, оценка по Сильверману 5 баллов и более. Противопоказания – бронхоплевральные свищи, пневмоторакс и другие синдромы «утечки воздуха».
В настоящее время наиболее распространено СДППД с помощью назальных канюль. СДППД с помощью мешка Мартина используется реже. Проведение начинают с ингаляцииподогретой до 32-34 0 С и увлажненной 80-100%дыхательной смеси.Далее под контролем РаО 2 уменьшают концентрацию смеси до 50%. Начальное положительное давление составляет 4см.вод.ст. Для недоношенных детей с массой при рождении менее 1500г давление должно быть 2- 3 см.вод.ст. Показание к прекращению СДППД – стабилизация РаО 2 выше 60 мм.рт.ст при дыхании 50% смесью и давлению равному атмосферному. После прекращения СДППД ребенка обычно помещают в кислородную палатку.
Если же при максимально возможном давлении (до 8- 10 см.вод.ст) и максимальной концентрации кислорода (100%) терапевтического эффекта нет, то ребенка необходимо перевести на искусственную вентиляцию легких (ИВЛ) . Используются различные режимы ИВЛ – принудительная вентиляция, принудительная вентиляция с постоянным положительным давлением в конце выдоха, вспомогательная и высокочастотная вентиляция.
Адекватная ИВЛ приводит к устранению гиперкапнии и гипоксии, что связано с увеличением объема вентиляции, улучшением вентиляционно-перфузионных соотношений, уменьшением внутрилего-чного шунтирования. Ликвидация респираторного ацидоза и постепе-нная нормализация рН способствует восстановлению обменных процессов. Улучшается микроциркуляция, нормализуется гемодинамика.
Тем не менее, необходимо упомянуть возможные неблагоприятные патофизиологические изменения – изменяется механика дыхания, снижается растяжимость легких, повышается аэродинамическое сопротивление дыхательных путей, ухудшается дренаж мокроты, что при снижении сурфактанта приводит к развитию микроателектазов. Повышенное давление в легочных путях приводит к нарушению легочного кровотока- развитие отеков, транссудация жидкости внутрь альвеол. К особенностям, осложняющим ИВЛ у новорожденных,относятся малые дыхательные объемы, большая скорость газового потока, высокое сопротивление дыхательных путей.
Абсолютными показаниями к проведению искусственной вентиляции легких являются отсутствие самостоятельного дыхания и патологические ритмы дыхания (поражение ЦНС, тяжелые интоксикации). При постоянно прогрессирующей гиповентиляции клиническими признаками необходимости ИВЛ являются: нарастание цианоза, увеличение частоты дыхания в 2 раза более нормы или выраженная брадикардия, участие вспомогательной мускулатуры, показатели КЩС (РаСО 2 выше 60 мм.рт.ст или прирост более, чем на 10 мм рт ст., РаО 2 ниже 50 при 50% дыхательной смеси, ацидоз – рН ниже 7,2 (несмотря на введение соды в дозе 2-4 ммоль на кг).
Начальные параметры ИВЛ: ЧД 30-40 в минуту, и такой дыхательный объем, чтобы максимальное давление на вдохе достигало 20- 25 см.вод.ст. Концентрацию кислорода устанавливают от 70-80%, от-ношение вдоха к выдоху 1:1. Через 10-15 мин проводят анализ КЩС и газов крови. ИВЛ может считаться адекватной, если парциальное давление кислорода в артериальной крови составляет 50- 80 мм.рт.ст, насыщение гемоглобина кислородом – 91-96%, транскутанное напряжение кислорода – 60- 90 мм.рт.ст, парциальное давление углекислого газа в артериальной крови – 35- 45 мм.рт.ст, транскутанное напряжение СО 2 –35- 50 мм.рт.ст. По мере улучшения состояния в первую очередь надо максимально быстро снизить концентрацию кислорода до нетоксического уровня – ниже 50%. Затем постепенно умень-шают положительное давление в конце выдоха, уменьшают соотношение вдох-выдох и только потом уменьшают частоту дыхания.
После ИВЛ ребенка переводят на СДППД с давлением 3- 5 см.вод.ст и концентрацией кислорода на 10% выше, чем при ИВЛ. Если в течение 12 часов признаки дыхательной недостаточности не нарастают, то ребенка экстубируют.
Коррекцию ацидоза проводят с помощью 4% раствора гидрокарбоната натрия, количество которого (в мл) определяется по формуле ВЕ х массу в кг / 4.
Также применяется ККБ в дозе 5-8 мг/кг. Кокарбоксилаза способствует нормализации рН клеток, усилению синтеза АТФ, утилизации глюкозы.
Антибактериальная терапия. Назначается с момента постановки диагноза СДР. Показана в связи с риском развития внутриутробной инфекции и присоединения вторичной инфекции, особенно при проведении искусственной вентиляции легких.. Обычно назначаются препараты пенициллинового ряда (ампициллин в дозе 150-300 тыс Ед/кг/сутки в 3-4 приема) или цефалоспорины (клафоран 50 мг/кг/сут в 2-3 приема, фортум в 30-50 мг/кг/сутки в 2 приема, лонгацеф или роцефин 50мг/кг один раз в сутки, др.) в сочетании с аминогликозидами (амикацин или селемицин в суточной дозе 10-15 мг/кг, разделенной на 2 приема). Длительность и характер антибактериальной терапии определяется после обследования на инфекцию и получения результатов клинического анализа крови в динамике.
В терапии также применяется витамин Е (α-токоферол), стимулирующий синтез цитохрома и оказывающий сурфактантсберегающее действие. Назначается α-токоферол из расчета 10-15 мг/сут, перорально или парентерально (в виде 5% раствора).
Назначение глюкокортикоидов детям с синдромом дыхательных расстройств показано при вторичной надпочечниковой недостаточности. Ранее эти препараты использовались в лечении СДР в плановом порядке с целью ускорения созревания легочной ткани. Широкое использование в практике экзогенных сурфактантов позволило избежать побочных эффектов терапии глюкокортикоидами (артериальная гипертония, желудочно-кишечные кровотечения, некротизирующий энтероколит, гипергликемия)
Осложнения СДР и оксигенотерапии: ретролентальная фиброплазия новорожденных, бронхо-легочная дисплазия, синдромы утечки воздуха из легких (пневмоторакс, пневмомедиастинум, пневмоперикард).
Ретролентальная фиброплазия (РЛФ) развивается на фоне гипероксемии и недостаточной васкуляризации. При высоких значениях РаО 2 (> 100 мм.рт.ст) возникает стойкое сужение сосудов сетчатки, что и является единственным клиническим проявлением начальной стадии заболевания. Через 1-2 месяца после окончания кислородотерапии сосуды сетчатки расширяются и начинается их пролиферация и отек сетчатки. При незначительных изменениях часто отмечается самопроизвольное восстановление сетчатки. В 25% случаев происходит отслойка сетчатки, рубцевание и слепота. При отслойке сетчатки более чем в половине случаев эффективно хирургическое вмешательство. При поздней диагностике и значительности поражения лечение неэффективно. Поэтому необходимо проводить строгий мониторинг РаО 2 во время оксигенотерапии и обязательный осмотр глазного дна при выписке из стационара.
Бронхолегочная дисплазия (БЛД) - хроническое прогрессиру-ющее заболевание легких, результат токсического воздействия кислорода на легочную ткань. Основными причинами ее развития являются концентрация кислорода выше 50% в дыхательной смеси и высокие уровни положительного давления (более 30 см вод.ст.) при ИВЛ. Важную роль также играет длительность ИВЛ (более 72 часов), степень недоношенности ребенка. При БЛД повреждаются практически все структуры легкого, растяжимость легкого падает, а аэродинамическое сопротивление дыхательных путей и дыхательная работа увеличиваются. Развивается гипоперфузия легких и легочная гипертензия, а в дальнейшем – гипертрофия правого желудочка и легочное сердце. Смертность при БЛД составляет 30-50%.
Синдромы утечки воздуха из легких. К этой группе осложнений относятся:
1. интерстициальная эмфизема, при которой воздух скапливается в интерстициальном пространстве. Клинически мало выражена, но может сопровождаться увеличением потребности в кислороде и повышением РаСО 2. Прогрессирование интерстициальной эмфиземы в половине случаев приводит к пневмотораксу. Диагностируется только рентгенологически. На рентгенограмме при этом появляются кистеобразные и линейные просветления. Поражение легких обычно двустороннее. При развитии эмфиземы проводят изменения параметров ИВЛ (снижение пикового давления вдоха и положительного давления в конце выдоха).
2. пневмоторакс может быть как спонтанным, связанным с незрелостью дыхательной системы и СДР, так и в результате проведения поддержки дыхания (ИВЛ, СДППД). Считается, что пневмоторакс возникает у 30-50% детей с СДР и находящихся на ИВЛ. Чаще всего это тяжелый пневмоторакс, что требует немедленного вмешательства. Диагноз ставится на основании клинических проявлений: резкое ухудшение состояния ребенка, ослабление дыхания, отсутствие синхронности дыхания, цианоз, тахикардия; подтверждается рентгенологически: скопление воздуха в плевральной полости, смещение средостения, спавшееся легкое. Требует дренирования плевральной полости.
3. Пневмомедиастинум. Встречается редко, может быть спонтанным. Обычно проявляется глухостью сердечных тонов, одышкой, возможен цианоз. Диагноз подтверждается рентгенологически: на боковом снимке грудной клетки видна зона просветления, располага-ющаяся за грудиной или в верхней части средостения. На прямой ре-нтгенограмме иногда скопившийся воздух отделяет тень сердца от вилочковой железы («крыло бабочки» или «парус»). Воздух рассасывается самостоятельно, специального лечения это осложнение не требует.
4. пневмоперикард встречается редко. При напряженном пне-вмоперикарде может возникнуть тампонада сердца. Проявляется резким ухудшением состояния, цианозом, выраженной глухостью сердечных тонов. Лечение: пункция перикарда.
Перивентрикулярные кровоизлияния (ПВК). Наиболее часто встречаются у детей с низкой массой тела при рождении и с высокой степенью вероятности могут явиться причиной смерти (у 40% больных). ПВК могут возникнуть как до клинического проявления СДР, так и на фоне синдрома дыхательных расстройств вследствие гипоксии, гиперкапнии, нарушений сердечной деятельности, респираторного и метаболического ацидоза и др. Чем тяжелее протекает синдром дыхательных расстройств, тем выше риск развития перивентрикулярных кровоизлияний. Нельзя также забывать о ятрогенных ПВК, возникающих при жестких режимах ИВЛ, струйном введении гиперосмолярных растворов, грубом проведении манипуляций, что связано с повышением или резким колебанием системного давления. Одним из частых механизмов возникновения ятрогенных ПВК является транспортировка в другое лечебное учреждение ребенка с СДР в остром периоде, особенно в первые трое суток жизни.
Профилактика СДР.
Основной метод - профилактика невынашивания беременности. Наиболее частыми причинами преждевременных родов являются урогенитальные инфекции, нейро-гормональные нарушения и воздействия экзогенных факторов. Возможно только комплексное решение этой проблемы, включающее подготовку женщины к беременности, санацию возможных очагов инфекции, правильное ведение беременности и родов. Нельзя также забывать о необходимости социальной защиты беременных женщин. Другим важным методом является применение препаратов, ускоряющих созревание легочной ткани у плода, таких как глюкокортикоиды, эуфиллин, тироксин, при отсутствии противопоказаний к их применению у беременной женщины. Глюкокортикоидная терапия при угрозе преждевременных родов получила широкое распространение. В настоящее время используется в основном дексаметазон (по 6 мг х 4 раза с интервалом в 12 часов) или бетаметазон (по 12мг х 2 раза с интервалом в 24 часа).
Похожие статьи
-
Этногенез и этническая история русских
Русский этнос - крупнейший по численности народ в Российской Федерации. Русские живут также в ближнем зарубежье, США, Канаде, Австралии и ряде европейских стран. Относятся к большой европейской расе. Современная территория расселения...
-
Людмила Петрушевская - Странствия по поводу смерти (сборник)
В этой книге собраны истории, так или иначе связанные с нарушениями закона: иногда человек может просто ошибиться, а иногда – посчитать закон несправедливым. Заглавная повесть сборника «Странствия по поводу смерти» – детектив с элементами...
-
Пирожные Milky Way Ингредиенты для десерта
Милки Вэй – очень вкусный и нежный батончик с нугой, карамелью и шоколадом. Название конфеты весьма оригинальное, в переводе означает «Млечный путь». Попробовав его однажды, навсегда влюбляешься в воздушный батончик, который принес...
-
Как оплатить коммунальные услуги через интернет без комиссии
Оплатить услуги жилищно-коммунального хозяйства без комиссий удастся несколькими способами. Дорогие читатели! Статья рассказывает о типовых способах решения юридических вопросов, но каждый случай индивидуален. Если вы хотите узнать, как...
-
Когда я на почте служил ямщиком Когда я на почте служил ямщиком
Когда я на почте служил ямщиком, Был молод, имел я силенку, И крепко же, братцы, в селенье одном Любил я в ту пору девчонку. Сначала не чуял я в девке беду, Потом задурил не на шутку: Куда ни поеду, куда ни пойду, Все к милой сверну на...
-
Скатов А. Кольцов. «Лес. VIVOS VOCO: Н.Н. Скатов, "Драма одного издания" Начало всех начал
Некрасов. Скатов Н.Н. М.: Молодая гвардия , 1994. - 412 с. (Серия "Жизнь замечательных людей") Николай Алексеевич Некрасов 10.12.1821 - 08.01.1878 Книга известного литературоведа Николая Скатова посвящена биографии Н.А.Некрасова,...
