Cum se obține acidul lactic? Proprietățile chimice și fizice ale acidului lactic. Cartea de referință pentru substanțele chimice ale acidului lactic
Număr de catalog pentru acid lactic: CAS 50-21-5
Descrierea acidului lactic:
Lichid siropos higroscopic aproape transparent, ușor gălbui, cu ușor miros acru, care amintește de mirosul de iaurt. Solubil în apă, etanol, slab - în benzen, cloroform și alte halocarburi. Există diferiți izomeri optic activi ai formei D și L. La fel ca și un amestec optic inactiv de D și L. Acesta din urmă se obține prin sinteză chimică, iar formele active pe cale bacteriană. (metoda enzimatică) În corpul uman, este forma optic activă L care participă la ciclul Kreps, motiv pentru care se recomandă utilizarea ca aditiv (acid lactic, E270), în alte industrii nu joacă un rol deosebit.
Denumirea mondială Acid lactic nu și-a prins rădăcini în Rusia, dar numele sărurilor sale de lactat se găsește peste tot, mult mai des decât lactat de calciu tăiem lactat de calciu.
Specificații pentru acid lactic 80%.
Punct de fierbere (soluție 100%) 122 °C (115 mm Hg)
Greutate specifică (20 °C) 1,22
Solubilitate în apă Complet solubil
Densitate (la 20°C) 1,18-1,20 g/ml
Metale grele, nu mai mult de 0,001%
Conținut de fier, nu mai mult de 0,001%
Conținut de arsenic, nu mai mult de 0,0001%
Conținut de clorură, nu mai mult de 0,002% (de fapt 0,0015%)
Conținutul de sulfați, nu mai mult de 0,01% (de fapt 0,004%)
Rezidu după calcinare, nu mai mult de 0,1% (de fapt 0,06%)
Producător: China
Ambalare: butoaie 25 kg sau cuburi 1200 kg
Principalele proprietăți fizice ale acidului lactic:
Punct de topire: 17°C Pentru inactiv optic (racematic),
25-26 °C optic activ + sau - formă
(diferențele de temperatură de topire fac posibilă distingerea calitativă și rapidă a formelor optic active mai scumpe de cele inactive mai ieftine !!)
Densitate relativa(apă = 1): 1,2
Solubilitate în apă: miscibil
Greutate moleculară: 90,08 g/mol
Punct de aprindere: 110°C c.c.
Coeficientul de partiție octanol/apă ca lg Pow: -0,6
Pericol de explozie și incendiu:
Sprijină arderea la conditii normale. arderea spontană este puțin probabilăNu lăsați flăcările deschise să fumeze.
Stingerea incendiilor: pulbere, spumă rezistentă la alcool, apă pulverizată,
dioxid de carbon.
Stabilitate chimică: Stabil la temperaturi normale si presiune.
Condiții de evitat: Formarea de praf, căldură excesivă.
Incompatibilitate cu alte materiale: Agenți oxidanți puternici, acizi minerali.
Produși de descompunere periculoși: oxizi de azot, monoxid de carbon, dioxid de carbon, cupluri
cianura.
Polimerizare periculoasă: Nu este marcat.
Pericol pentru oameni:
Căile de intrare în organism: Substanța poate fi absorbită în organism prin inhalarea aerosolului și prin ingestie.
Cu expunere pe termen scurt la concentrații care depășesc MPC: Substanța este iritante pentru piele și Căile aeriene, și are, de asemenea, un coroziv
acțiune asupra ochilor. Acțiune corozivă în caz de înghițire.
În cazul contactului cu ochii: Roşeaţă. Durere. Arsuri profunde severe. Ochelari-mască, sau
masca de protectie. Clătiți mai întâi o cantitate mare apă pentru mai mulți
minute (eliminați lentile de contact dacă nu este dificil), atunci du-te la medic.
Standarde pentru zona de lucru:
TLV (concentrația maximă de prag, SUA) nu a fost stabilită.
Carcinogenitate: Nu este listat de ACGIH, IARC, NTP sau CA Prop 65.
Epidemiologie: Fara informatii.
Tetragenicitate: Fara informatii.
efecte asupra reproducerii: Fara informatii.
Mutagenicitate: fara informatii
Neurotoxicitate: Fara informatii.
Experimentele pe animale au arătat:
LD50/LC50:
Test Draize, iepure, ochi: 100 mg Sever;
Test Draize, iepure, piele: 500 mg/24H Ușoară;
Inhalare, șobolan: LC50 = >26 mg/m(cc)/1H;
Orală, șoarece: DL50 = 1940 mg/kg;
Orală, șobolan: DL50 = 1700 mg/kg;
Piele, iepure: DL50 = >10 gm/kg;
Atenţie. Se oferă informații despre concentratul substanței, în cantități miciși concentrațiile de acid lactic, conform disponibile pe acest moment datele sunt inofensive!
Acid lactic(acid 2-hidroxipropionic) CH3CH(OH)COOH, greutate moleculară 90,1; incolor. Sunt cunoscute acidul L(+)-lactic, acidul D(-)-lactic (carne-lactic) și acidul lactic de fermentație racemică. Pentru acidul D,L- și D-lactic, punctul de topire corespunde la 18 °C și 53 °C; t. kip. resp. 85°C/1 mmHg şi 103°C/2mm Hg; pentru acid D-lactic [α] D 20 -2,26 (concentrație 1,24% in. Pentru acid D,L-lactic D H 0 arr - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H test 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). Pentru acidul L-lactic D H 0 ardere - 1344,8 kJ/mol; D H 0 arr -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
Datorită higroscopicității ridicate a acidului lactic, se folosesc de obicei soluțiile sale apoase concentrate - siropoase, incolore, inodore. Pentru solutii apoase acid lactic d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); nD 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 și 28,5 MPa. s (25 0 C) resp. pentru soluții 45,48 și 85,32%; g 46,0. 10-3 N/m (25°C) pentru soluţie 1 M; e 22 (17°C). Acidul lactic este solubil în, slab - în și alte halocarburi; R K a 3,862 (25°C); pH-ul soluţiilor apoase 1,23 (37,3%), 0,2 (84,0%).
Acid lactic este deshidratat la acid acrilic, când este încălzit cu HBr formează acid 2-bromopropionic, când sarea de Ca reacţionează cu clorură de PCl 5 sau SOCl 2 -2-clorpropionil. În prezența acizilor minerali, are loc autoesterificarea acidului lactic cu formarea formulei I, precum și a poliesterilor liniari. Când acidul lactic interacționează cu, se formează hidroxiacizii RCH 2 CH (OH) COOH, iar când acidul lactic interacționează cu alcoolii, se formează esteri. Sărurile și esterii acidului lactic se numesc lactați (vezi tabelul).
acidul lactic se formează ca urmare a acidului lactic (la acrișarea laptelui, varza murată, murarea legumelor, maturarea brânzei, însilozarea furajelor); Acidul D-lactic se găsește în țesuturile animalelor, plantelor și, de asemenea, în microorganisme.
În industrie, acidul lactic se obține din acidul 2-cloropropionic și din acidul 2-clorpropionic și al acestuia (100 ° C) sau lactonitril CH 3 CH (OH) CN (100 ° C, H 2 SO 4), urmat de formarea de esteri, izolarea și hidroliza ceea ce duce la un produs de înaltă calitate. Sunt cunoscute și alte metode de producere a acidului lactic: oxidarea propilenei cu oxizi de azot (15-20°C) urmată de tratarea cu H2SO4, interacțiunea CH3CHO cu CO (200°C, 20 MPa).
PROPRIETATI ALE UNOR LACTATE

acidul lactic este utilizat în Industria alimentară, în vopsirea decapate, în industria pielăriei, în magazinele de fermentație ca agent bactericid, pentru obtinerea medicamente, plastifianti. Lactații de etil și butii sunt utilizați ca solvenți pentru eterii de celuloză, ulei de uscare, uleiuri vegetale; lactat de butii - de asemenea ca solvent pentru unii polimeri sintetici.
Producția mondială de acid lactic este de 40 de mii de tone (1983).
Lit.: Holten C.H., Acid lactic. proprietăți și chimie. Acid lactic și derivați, Weisheim, 1971. Yu. A. Treger.
Alegeți prima literă din titlul articolului:
Hidroxiacizi (acizi alcoolici) sunt derivați ai acizilor carboxilici care conțin una, două sau mai multe grupări hidroxil în radicalul conectat la carboxil.
În funcție de numărul de grupări carboxil, hidroxiacizii se împart în monobazici, dibazici etc.; în funcție de numărul total de grupări hidroxil, hidroxiacizii se împart în mono- sau polihidroxi.
După natura radicalului, hidroxiacizii sunt saturați și nesaturați, aciclici, ciclici sau aromatici.
Următoarele tipuri de izomerie apar în hidroxiacizi:
structural(izomeria lanțului radical, izomeria poziției reciproce a carboxilului și hidroxilului);
optic(oglindă) datorită prezenței atomilor de carbon asimetrici.
Denumirile hidroxiacizilor sunt date de numele acidului cu adăugarea de „hidroxi” sau „dioxi”, etc. Nomenclatura trivială este, de asemenea, utilizată pe scară largă.
HO–CH2–COOH
glicolic (oxiacetic)
lactate (α-hidroxipropionice)
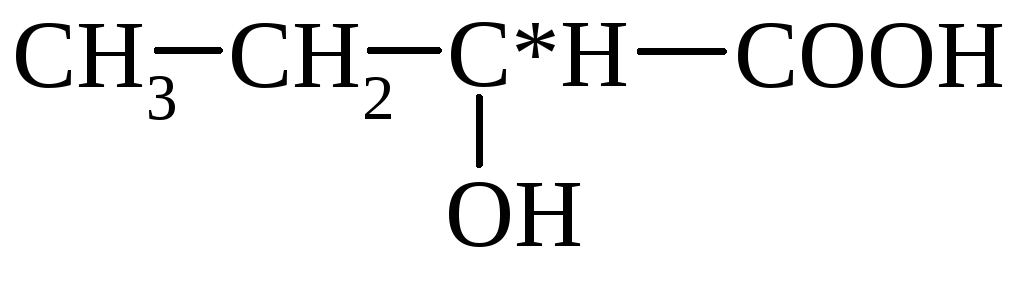

α-hidroxibutiric β-hidroxibutiric
(2-hidroxibutanoic) (3-hidroxibutanoic)
proprietăți fizice. Hidroxiacizii inferiori sunt cel mai adesea substanțe groase, siropoase. Hidroxiacizii sunt miscibili cu apa în orice raport, iar odată cu creșterea greutății moleculare, solubilitatea scade.
Proprietăți chimice.
1. Proprietăți acide- hidroxiacizii dau toate reactiile caracteristice carboxilului: formarea de saruri, esteri, amide, halogenuri acide etc. Hidroxiacizii sunt electroliți mai puternici decât acizii lor carboxilici corespunzători (efectul grupării hidroxil).

2. Proprietățile alcoolului– reacții de substituție cu hidrogen a grupării hidroxil, formare de eteri și esteri, substituție de –OH cu halogen, deshidratare intramoleculară, oxidare.
glioxal glicolic cloroacetic
acid acid acid
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
esterul acidului glicolic și al alcoolului metilic
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
metil metil eter glicolic
alcool acid acid metoxiacetic
(emisiune completă)
3. Raportul dintre hidroxiacizi și încălzire - atunci când sunt încălziți, α-hidroxiacizii desprind apa, formând un ester ciclic, construit ca id din două molecule de α-hidroxiacizi:

lactida acidului α-hidroxipropionic
β-hidroxiacizii în aceleași condiții pierd ușor apă cu formarea de acizi nesaturați.
NO–CH2–CH2–COOH 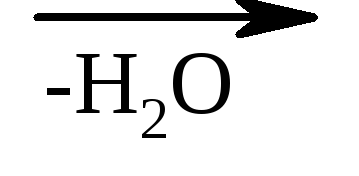 CH 2 \u003d CH - COOH
CH 2 \u003d CH - COOH
acid acrilic β-hidroxipropionic
γ-hidroxiacizii pot pierde și o moleculă de apă cu formarea de esteri intramoleculari - lactone.

NO–CH 2 –CH 2 –CH 2 –COOH
acid y-hidroxibutiric
y-butirolactonă
Unii hidroxiacizi sunt obținuți din produse naturale. Deci, acidul lactic se obține prin fermentarea acidului lactic a substanțelor zaharoase. Metodele de producție sintetică se bazează pe următoarele reacții:
1) Cl–CH 2 –COOH + HOH  HO–CH2-COOH;
HO–CH2-COOH;
glicolic monocloroacetic
acid acid
2) CH 2 \u003d CH - COOH + HOH  NO-CH2-CH2-COOH.
NO-CH2-CH2-COOH.
acid acrilic acid β-hidroxipropionic
reprezentanți ai hidroxiacizilor.
Glicolic Acidul (hidroxiacetic) este o substanță cristalină care se găsește în fructele necoapte, sucul de sfeclă, napi și alte plante. În industrie, se obține prin reducerea acidului oxalic. Este folosit pentru vopsire (imprimare calico).
Acid lactic (α-hidroxipropionic) - un lichid gros sau o masă cristalină cu punct de topire scăzut. Acidul lactic se formează în procesul de fermentare a acidului lactic al zaharurilor, sub acțiunea bacteriilor acidului lactic. Conținut în produse lactate fermentate, varză murată, siloz. Se foloseste la vopsirea cu mordanti, in productia de piele, in medicina.
Acidul lactic din carne se găsește în sucul muscular al animalelor și în extractele de carne.
diatomic acid gliceric participă la procesele de viață ale plantelor și animalelor.

Acid ascorbic (vitamina C) - o substanță cristalină care se găsește în fructe proaspete, lămâi, coacăze negre, legume proaspete- varză, fasole. Sintetic, vitamina C se obține prin oxidarea alcoolului polihidroxilic sorbitol.
 acid α-ascorbic
acid α-ascorbic
Acidul ascorbic se descompune ușor de oxigenul atmosferic, mai ales atunci când este încălzit.
Aciclic doi-și hidroxiacizi tribazici.
Măr acidul (hidroxisuccinic) (HOOS-CHOH-CH 2 -COOH) este o substanță cristalină care este foarte solubilă în apă; folosit în medicină, găsit în rowan necoapt, arpaș, rubarbă, suc de struguri, vin.
Vin acidul (tartric, dioxisuccinic) (HOOC–*CHOH–*CHOH–COOH) are 2 atomi de carbon asimetrici și, prin urmare, are 4 izomeri optici. Formează săruri acide de potasiu, care sunt slab solubile în apă și precipită. În vin (tartru) se pot observa cristale de sare. Sarea amestecată de potasiu-sodiu se numește sare Rochelle. Sărurile acidului tartric se numesc tartrați.


tartru, sare rochelle
Acidul tartric este frecvent în plante (cenusa de munte, struguri etc.).
Acid de lamaie
 găsite în citrice. Obținut industrial din fructe de lămâie, prin oxidarea zaharurilor mucegaiuri, la prelucrarea acelor de molid.
găsite în citrice. Obținut industrial din fructe de lămâie, prin oxidarea zaharurilor mucegaiuri, la prelucrarea acelor de molid.
Acidul citric este un compus important din punct de vedere biologic care participă la metabolism. Este folosit în medicină, alimentație, industria textilă ca aditiv la coloranți.
Hidroxiacizii polihidroxiacizi monobazici ciclici fac parte din acizii biliari și alți compuși importanți din punct de vedere fiziologic; de exemplu, auxina îmbunătățește creșterea plantelor.
Hidroxiacizi aromatici subdivizată în acizi fenolici și acizi grași aromatici care conțin hidroxil în lanțul lateral.


acid mandelic o-hidroxibenzoic
(acid salicilic
Acid salicilic găsit la unele plante sub formă liberă (calendula), dar mai des sub formă de esteri. În industrie, se obține prin încălzirea fenolatului de sodiu cu dioxid de carbon. Este folosit ca dezinfectant și în sinteza coloranților. Mulți derivați ai acidului salicilic sunt utilizați ca medicamente (aspirina, salol).


aspirina salol (eter fenilic
(acid acetilsalicilic) acid salicilic)
acid galic (3,4,5-trioxibenzoic).

Conținut în frunze de ceai, coajă de stejar, rodie. În industrie, se obține din tanin prin fierbere cu acizi diluați. Este folosit pentru fabricarea cernelii, în fotografie, în medicină ca antiseptic. Acidul galic și derivații săi sunt folosiți pe scară largă ca conservanți pentru mulți Produse alimentare(grăsimi, săpunuri de calitate superioară, produse lactate), are proprietăți tanice și are o importanță deosebită în fabricarea pieilor și în vopsirea petelor.
acid mandelic se refera la acizi grasi aromatici (C 6 H 5 -CH (OH) -COOH), se gaseste in amigdalina, mustar, soc etc.
Taninuri sunt adesea derivați ai fenolilor polihidroxilici. Ele fac parte din plante și sunt obținute din extracte de scoarță, lemn, frunze, rădăcini, fructe sau creșteri (gale).
Taninurile sunt cele mai importante taninuri. Acesta este un amestec de diferiți compuși chimici, dintre care principalii sunt esterii acizilor galic și digalic și glucoză sau alcooli polihidroxici.

Dg-acid digalic

acid m-digalic
Taninul prezintă proprietățile fenolilor și esterilor. Cu o soluție de clorură ferică, formează un compus complex negru. Taninurile sunt utilizate pe scară largă ca extracte bronzante, mordanți pentru vopsirea țesăturilor de bumbac, ca astringenți în medicină (au proprietăți bactericide, hemostatice) și sunt conservanți.
Lipidele includ substanțe organice, dintre care multe sunt esteri ai acizilor grași macromoleculari și alcooli polihidroxici - acestea sunt grăsimi, fosfatide, ceară, steroizi, acizi grași macromoleculari etc.
Lipidele se găsesc în principal în semințele de plante, sâmburii de nuci și în organismele animale - în țesuturile adipoase și nervoase, în special în creierul animalelor și al oamenilor.
Grăsimile naturale sunt amestecuri de esteri ai alcoolului trihidroxilic glicerol și acizi carboxilici superiori, de ex. amestecuri de gliceride ale acestor acizi.
DESPRE 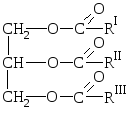 Formula generala pentru grasimi:
Formula generala pentru grasimi:
unde R I R II R III sunt radicali hidrocarburi ai acizilor grași superiori structura normala cu un număr par de atomi de carbon. Grăsimile pot conține reziduuri atât de acizi saturați, cât și de acizi nesaturați.
Acizi saturati:
С 15 H 31 COOH– palmitic;
C17H35COOH - stearic;
C 3 H 7 COOH - ulei (conținut în unt) si etc.
Acizi nesaturați:
C17H33COOH - oleic;
C17H31COOH - linoleic;
C 17 H 29 COOH - linolenic etc.
Obțineți grăsimi din surse naturale de origine animală și vegetală.
Proprietăți fizice grăsimile sunt acide. Grăsimile care conțin predominant reziduuri acide saturate sunt substanțe solide sau asemănătoare unguentului (grăsimi de oaie, de vită etc.) Grăsimile, care conțin în principal reziduuri de acizi nesaturate, au consistenta lichida la temperatura camerei și se numesc uleiuri. Grăsimile nu se dizolvă în apă, dar se dizolvă bine în solvenți organici: eter, benzen, cloroform etc.
Proprietăți chimice. Ca toți esterii, grăsimile sunt supuse hidrolizei. Hidroliza poate avea loc într-un mediu acid, neutru sau alcalin.
1. Hidroliza acidă.

Articole similare
-
Când un soț este împotriva unui copil, cum să rămâi însărcinată fără știrea lui?
Uneori poți rămâne însărcinată din neglijență. Pentru a preveni acest lucru, este important să știți cum puteți concepe un copil accidental și ce mijloace puteți utiliza pentru a evita o sarcină nedorită. De asemenea, în acest articol puteți găsi informații despre...
-
Ce pietre și amulete sunt potrivite pentru Taur în funcție de horoscop și data nașterii Talisman de elefant pentru Taur
Aprilie-mai Taurul (21 aprilie - 20 mai) sunt măsurați, nu mofturoși și colosal de productivi! Încăpăţânarea lor de invidiat îi poate aduce pe alţii la mâner, dar ştiu exact ce fac şi de ce au nevoie. Printre aspectele pozitive...
-
Restricții privind accesul la date în roluri 1c
Toate setările pentru drepturile utilizatorului pe care le vom face în cadrul acestui articol se află în secțiunea 1C 8.3 „Administrare” - „Setări pentru utilizatori și drepturi”. Acest algoritm este similar în majoritatea configurațiilor pe...
-
1c pornește un client subțire în loc de unul gros
Platforme: 1C: Enterprise 8.3, 1C: Enterprise 8.2, 1C: Enterprise 8.1 Configurații: Toate configurațiile2012-11-16 21362 Sunt lansate prin specificarea specială...
-
Dovezi despre modalități cunoscute de a fura energie electrică Cum să afli cine fură electricitate
Creșterea tarifelor la energie este una dintre trăsăturile izbitoare ale adâncirii crizei economice. În acest context, furtul de energie electrică și problemele asociate cu detectarea acesteia sunt de o importanță capitală. Modalități de a detecta furtul...
-
Caracteristici de montare prize și întrerupătoare pe diferite suprafețe
Salutări tuturor cititorilor blogului nostru.Astăzi, dragi cititori, vreau să subliniez subiectul cum se instalează prize. Această procedură este foarte des solicitată atunci când înlocuiți o priză veche cu una nouă în cazul unei defecțiuni, când ...
