Как се получава млечна киселина? Химични и физични свойства на млечната киселина Химически справочник на млечната киселина
Каталожен номер за млечна киселина: CAS 50-21-5
Описание на млечната киселина:
Почти прозрачна, леко жълтеникава хигроскопична сиропообразна течност с леко кисела миризма, напомнящ миризмата на кисело мляко. Разтворим във вода, етанол, слабо - в бензен, хлороформ и други халокарбони. Съществуват различни оптично активни изомери на D и L формата. Както и оптически неактивна смес от D и L. Последният се получава чрез химичен синтез, а активните форми чрез бактериален. (ензимен метод) В човешкото тяло оптически активната форма L участва в цикъла на Крепс, поради което се препоръчва използването й като добавка (Млечна киселина, E270), в други индустрии не играе роля специална роля.
Световното наименование млечна киселина не се е вкоренило в Русия, но името на нейните лактатни соли се среща навсякъде, много по-често от калциевия лактат ние нарязваме калциевия лактат.
Спецификация за млечна киселина 80%.
Точка на кипене (100% разтвор) 122 °C (115 mm Hg)
Специфично тегло (20 °C) 1.22
Разтворимост във вода Напълно разтворим
Плътност (при 20°C) 1.18-1.20 g/ml
Тежки метали, не повече от 0,001%
Съдържание на желязо, не повече от 0,001%
Съдържание на арсен не повече от 0,0001%
Съдържание на хлорид, не повече от 0,002% (в действителност 0,0015%)
Съдържанието на сулфати не повече от 0,01% (в действителност 0,004%)
Остатък след калциниране, не повече от 0,1% (в действителност 0,06%)
производител:Китай
Опаковане:варели 25 кг или кубове 1200 кг
Основните физични свойства на млечната киселина:
Точка на топене: 17°C За оптически неактивни (рацемични),
25-26 °C оптически активна + или - форма
(разликите в температурите на топене позволяват качествено и бързо да се разграничат по-скъпите оптически активни форми от по-евтините неактивни !!)
Относителна плътност(вода = 1): 1.2
Разтворимост във вода: смесваем
Молекулно тегло: 90,08 g/mol
Пламна точка: 110°C c.c.
Коефициент на разпределение октанол/вода като lg Pow: -0,6
Опасност от експлозия и пожар:
Подпомага горенето при нормални условия. спонтанно запалване е малко вероятноНе допускайте открит пламък за пушене.
Гасене на пожар: прах, устойчива на алкохол пяна, воден спрей,
въглероден двуокис.
Химична стабилност:Стабилен при нормални температурии натиск.
Условия, които трябва да се избягват: Образуване на прах, прекомерна топлина.
Несъвместимост с други материали:Силни окислители, минерални киселини.
Опасни продукти на разпадане: Азотни оксиди, въглероден окис, въглероден двуокис, двойки
цианид.
Опасна полимеризация:Не е отбелязано.
Опасност за хората:
Пътища на влизане в тялото:Веществото може да се абсорбира в тялото чрез вдишване на аерозола и чрез поглъщане.
При краткотрайна експозиция на концентрации, превишаващи ПДК:Веществото е дразнещо за кожата и Въздушни пътища, а също така има корозивен
действие върху очите. Корозивно действие при поглъщане.
В случай на контакт с очите:Зачервяване. болка. Тежки дълбоки изгаряния. Очила-маска, или
защитна маска. Първо изплакнете голяма сумавода за няколко
минути (премахнете контактни лещиако не е трудно), тогава заведете на лекар.
Стандарти за работна зона:
TLV (максимална прагова концентрация, САЩ) не е установена.
Канцерогенност:Не е посочено от ACGIH, IARC, NTP или CA Prop 65.
Епидемиология:Няма информация.
Тетрагенност:Няма информация.
репродуктивни ефекти:Няма информация.
Мутагенност:няма информация
Невротоксичност:Няма информация.
Опитите с животни са показали:
LD50/LC50:
Тест на Draize, заек, очи: 100 mg Тежко;
Тест на Draize, заек, кожа: 500 mg/24H Лек;
Вдишване, плъх: LC50 = >26 mg/m(cc)/1H;
Орално, мишка: LD50 = 1940 mg/kg;
Орално, плъх: LD50 = 1700 mg/kg;
Кожа, заек: LD50 = >10 gm/kg;
внимание. Информацията е дадена за концентрата на веществото, в малки количестваи концентрации на млечна киселина, според наличните на този моментданните са безвредни!
Млечна киселина(2-хидроксипропионова киселина) CH3CH(OH)COOH, молекулно тегло 90.1; безцветен. Известни са L(+)-млечна киселина, D(-)-млечна (месно-млечна) киселина и рацемична млечнокисела ферментационна млечна киселина. За D,L- и D-млечната киселина точката на топене съответства на 18 °C и 53 °C; т. кип. респ. 85°C/1 mmHg и 103°C/2mm Hg; за D-млечна киселина [α] д 20 -2,26 (концентрация 1,24% в. За D,L-млечна киселина D з 0 arr - 682,45 kJ/mol; д з 0 pl 11,35 kJ/mol; д зтест 110,95 kJ/mol (25°C), 65,73 kJ/mol (150°C). За L-млечна киселина D з 0 изгаряне - 1344,8 kJ/mol; д з 0 arr -694,54 kJ/mol; д з 0 pl 16,87 kJ/mol.
Поради високата хигроскопичност на млечната киселина обикновено се използват нейни концентрирани водни разтвори - сироповидни, безцветни, без мирис. За водни разтворимлечна киселина д 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1.3718 (37.3%), 1.4244 (88.6%); h 3,09 и 28,5 MPa. s (25 0 C) респ. за 45,48 и 85,32% разтвори; g 46.0. 10 -3 N/m (25°C) за 1 М разтвор; е 22 (17°С). Млечната киселина е разтворима в, слабо - в и други халокарбони; Р К а 3,862 (25°С); рН на водни разтвори 1,23 (37,3%), 0,2 (84,0%).
Млечна киселинадехидратира се до акрилова киселина, при нагряване с HBr образува 2-бромопропионова киселина, когато Ca-сол реагира с PCl 5 или SOCl 2 -2-хлоропропионил хлорид. В присъствието на минерални киселини настъпва самоестерификация на млечна киселина с образуването на формула I, както и линейни полиестери. Когато млечната киселина взаимодейства с, се образуват хидрокси киселини RCH 2 CH (OH) COOH, а когато млечната киселина взаимодейства с алкохоли, се образуват естери. Солите и естерите на млечната киселина се наричат лактати (виж таблицата).
млечна киселина се образува в резултат на млечна киселина (при подквасване на мляко, мариноване на зеле, мариноване на зеленчуци, зреене на сирене, силажиране на фураж); D-млечната киселина се намира в тъканите на животни, растения, а също и в микроорганизми.
В промишлеността млечната киселина се получава от 2-хлоропропионова киселина и нейния (100 ° C) или лактонитрил CH 3 CH (OH) CN (100 ° C, H 2 SO 4), последвано от образуване на естери, изолиране и хидролиза на което води до висококачествен продукт. Известни са и други методи за производство на млечна киселина: окисление на пропилен с азотни оксиди (15-20 ° C), последвано от обработка с H 2 SO 4, взаимодействие на CH 3 CHO с CO (200 ° C, 20 MPa).
СВОЙСТВА НА НЯКОИ ЛАКТАТИ

млечна киселина се използва в Хранително-вкусовата промишленост, при багрене за ецване, в кожарската промишленост, в цехове за ферментация като бактерицидно средство, за получаване лекарства, пластификатори. Етил и бутил лактати се използват като разтворители за целулозни етери, изсушаващо масло, растителни масла; бутил лактат - също и като разтворител за някои синтетични полимери.
Световното производство на млечна киселина е 40 хиляди тона (1983 г.).
Лит.: Holten C.H., Млечна киселина. свойства и химия. Млечна киселина и производни, Weisheim, 1971. Ю. А. Трегер.
Изберете първата буква от заглавието на статията:
Хидрокси киселини (алкохолни киселини) са производни на карбоксилни киселини, съдържащи една, две или повече хидроксилни групи в радикала, свързан с карбоксила.
В зависимост от броя на карбоксилните групи хидроксикиселините се делят на едноосновни, двуосновни и др.; в зависимост от общия брой на хидроксилните групи, хидрокси киселините се разделят на едно- или многовалентни.
Според природата на радикала хидроксикиселините са наситени и ненаситени, ациклични, циклични или ароматни.
В хидрокси киселините се срещат следните видове изомерия:
структурен(радикална верижна изомерия, изомерия на взаимното положение на карбоксил и хидроксил);
оптичен(огледало) поради наличието на асиметрични въглеродни атоми.
Имената на хидрокси киселините се дават от името на киселината с добавянето на "хидрокси" или "диокси" и т.н. Широко се използва и тривиалната номенклатура.
HO–CH 2 –COOH
гликолова (оксиоцетна)
млечни продукти (α-хидроксипропионова)
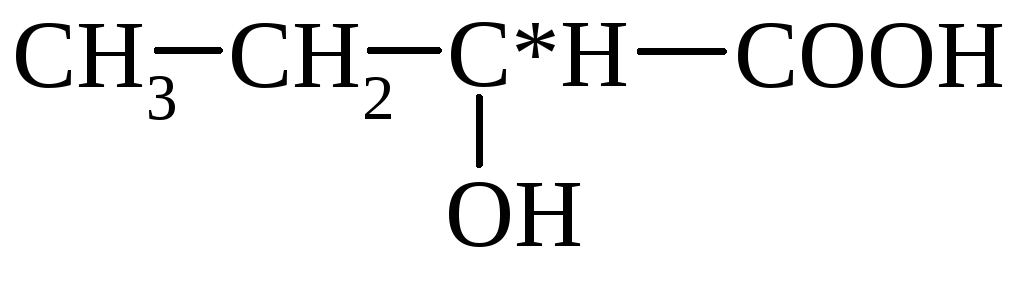

α-хидроксимаслена β-хидроксимаслена
(2-хидроксибутанова) (3-хидроксибутанова)
физични свойства.Нисшите хидрокси киселини най-често са гъсти сиропообразни вещества. Хидрокси киселините се смесват с вода във всяко съотношение и с увеличаване на молекулното тегло, разтворимостта намалява.
Химични свойства.
1. Киселинни свойства- хидрокси киселините дават всички реакции, характерни за карбоксил: образуване на соли, естери, амиди, киселинни халогениди и др. Хидрокси киселините са по-силни електролити от съответните им карбоксилни киселини (ефект на хидроксилната група).

2. Алкохолни свойства– реакции на водородно заместване на хидроксилната група, образуване на етери и естери, заместване на –OH с халоген, вътрешномолекулна дехидратация, окисление.
хлороцетен гликолов глиоксал
киселина киселина киселина
а) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
естер на гликолова киселина и метилов алкохол
б) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
гликолов метил метил етер
киселина алкохол метоксиоцетна киселина
(цяло предаване)
3. Съотношението на хидрокси киселините към нагряване - при нагряване α-хидрокси киселините отделят водата, образувайки цикличен естер, изграден като id от две молекули α-хидрокси киселини:

α-хидроксипропионова киселина лактид
β-хидрокси киселините при същите условия лесно губят вода с образуването на ненаситени киселини.
NO–CH 2 –CH 2 –COOH 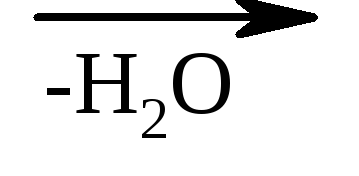 CH 2 \u003d CH - COOH
CH 2 \u003d CH - COOH
β-хидроксипропионова акрилова киселина
γ-хидрокси киселините също могат да загубят водна молекула с образуването на вътрешномолекулни естери - лактони.

NO–CH 2 –CH 2 –CH 2 –COOH
γ-хидроксимаслена киселина
γ-бутиролактон
Някои хидрокси киселини се получават от естествени продукти. И така, млечната киселина се получава чрез млечнокисела ферментация на захарни вещества. Методите за синтетично производство се основават на следните реакции:
1) Cl–CH 2 –COOH + HOH  HO–CH 2 –COOH;
HO–CH 2 –COOH;
монохлороцетна гликолова
киселина киселина
2) CH 2 \u003d CH - COOH + HOH  NO-CH2-CH2-COOH.
NO-CH2-CH2-COOH.
акрилова киселина β-хидроксипропионова киселина
представители на хидрокси киселините.
Гликолова (хидроксиоцетна) киселина е кристално вещество, намиращо се в неузрели плодове, сок от цвекло, ряпа и други растения. В промишлеността се получава чрез редукция на оксалова киселина. Използва се за боядисване (калико печат).
Млечна киселина (α-хидроксипропионова) - гъста течност или нискотопима кристална маса. Млечната киселина се образува в процеса на млечнокисела ферментация на захарите, под действието на млечнокисели бактерии. Съдържа се в ферментирали млечни продукти, кисело зеле, силаж. Използва се при боядисване с стъргане, в производството на кожи, в медицината.
Месо-млечната киселина се съдържа в мускулния сок на животните и месните екстракти.
двуатомна глицеринова киселина участва в жизнените процеси на растенията и животните.

Аскорбинова киселина (витамин С) - кристално вещество, намиращо се в пресни плодове, лимони, касис, свежи зеленчуци- зеле, боб. Синтетично витамин С се получава чрез окисление на поливалентния алкохол сорбитол.
 α-аскорбинова киселина
α-аскорбинова киселина
Аскорбиновата киселина лесно се разлага от атмосферния кислород, особено при нагряване.
Ациклични две-и триосновни хидрокси киселини.
Ябълка (хидроксиянтарна) киселина (HOOS-CHOH-CH 2 -COOH) е кристално вещество, което е силно разтворимо във вода; използва се в медицината, намира се в незряла офика, берберис, ревен, гроздов сок, вино.
Вино (винена, диоксиянтарна) киселина (HOOC–*CHOH–*CHOH–COOH) има 2 асиметрични въглеродни атома и следователно има 4 оптични изомера. Образува кисели калиеви соли, които са слабо разтворими във вода и се утаяват. Кристалите на солта могат да се наблюдават във виното (тартар). Смесената калиево-натриева сол се нарича Рошелска сол. Солите на винената киселина се наричат тартарати.


винен камък, рошелска сол
Винената киселина е често срещана в растенията (планинска пепел, грозде и др.).
Лимонена киселина
 намерени в цитрусовите плодове. Индустриално получен от лимонови плодове, чрез окисление на захари плесени, при обработка на смърчови игли.
намерени в цитрусовите плодове. Индустриално получен от лимонови плодове, чрез окисление на захари плесени, при обработка на смърчови игли.
Лимонената киселина е биологично важно съединение, което участва в метаболизма. Използва се в медицината, хранителната, текстилната промишленост като добавка към багрила.
Цикличните едноосновни полихидрокси киселини са част от жлъчните киселини и други физиологично важни съединения; например, ауксинът подобрява растежа на растенията.
Ароматни хидрокси киселиниподразделени на фенолни киселини и ароматни мастни киселини, съдържащи хидроксил в страничната верига.


о-хидроксибензоена бадемова киселина
(салицилова киселина
Салицилова киселина намира се в някои растения в свободна форма (невен), но по-често под формата на естери. В промишлеността се получава чрез нагряване на натриев фенолат с въглероден диоксид. Използва се като дезинфектант и при синтеза на багрила. Много производни на салициловата киселина се използват като лекарства (аспирин, салол).


аспирин салол (фенилов етер
(ацетилсалицилова киселина) салицилова киселина)
Галова киселина (3,4,5-триоксибензоена).

Съдържа се в чаени листа, дъбова кора, нар. В промишлеността се получава от танин чрез кипене с разредени киселини. Използва се за производството на мастило, във фотографията, в медицината като антисептик. Галовата киселина и нейните производни се използват широко като консерванти за много хора хранителни продукти(мазнини, висококачествени сапуни, млечни продукти), има танинови свойства и е от особено значение при производството на кожи и при боядисване на петна.
бадемова киселина се отнася до ароматни мастни киселини (C 6 H 5 -CH (OH) -COOH), намира се в амигдалин, горчица, бъз и др.
танини често са производни на поливалентни феноли. Те са част от растенията и се получават от екстракти от кора, дърво, листа, корени, плодове или израстъци (жлъчки).
Танините са най-важните танини. Това е смес от различни химични съединения, основните от които са естери на галова и дигалова киселина и глюкоза или многовалентни алкохоли.

Dg-дигалова киселина

m-дигалова киселина
Танинът проявява свойствата на феноли и естери. С разтвор на железен хлорид образува черно комплексно съединение. Танините се използват широко като дъбилни екстракти, стъргачи за боядисване на памучни тъкани, като адстрингенти в медицината (имат бактерицидни, хемостатични свойства) и са консерванти.
Липидите включват органични вещества, много от които са естери на макромолекулни мастни киселини и многовалентни алкохоли - това са мазнини, фосфатиди, восъци, стероиди, макромолекулни мастни киселини и др.
Липидите се намират главно в семената на растенията, ядките на ядките, а в животинските организми - в мастните и нервните тъкани, особено в мозъка на животните и хората.
Естествените мазнини са смеси от естери на тривалентния алкохол глицерол и висши карбоксилни киселини, т.е. смеси от глицериди на тези киселини.
ОТНОСНО 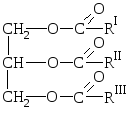 Обща формула за мазнини:
Обща формула за мазнини:
където R I R II R III са въглеводородни радикали на висши мастни киселини нормална структурас четен брой въглеродни атоми. Мазнините могат да съдържат остатъци както от наситени, така и от ненаситени киселини.
Наситени киселини:
С 15 H 31 COOH– палмитинова;
C 17 H 35 COOH - стеаринова;
C 3 H 7 COOH - масло (съдържа се в масло) и т.н.
Ненаситени киселини:
C 17 H 33 COOH - олеинова;
C 17 H 31 COOH - линолова;
C 17 H 29 COOH - линоленова и др.
Получавайте мазнини от естествени източници от животински и растителен произход.
Физически свойствамазнините са киселинни. Мазнините, съдържащи предимно наситени киселинни остатъци, са твърди или подобни на мехлем вещества (овнешко, телешка мазнина и др.) Мазнините, които съдържат главно ненаситени киселинни остатъци, имат течна консистенцияпри стайна температура и се наричат масла. Мазнините не се разтварят във вода, но се разтварят добре в органични разтворители: етер, бензол, хлороформ и др.
Химични свойства.Както всички естери, мазнините претърпяват хидролиза. Хидролизата може да протича в кисела, неутрална или алкална среда.
1. Киселинна хидролиза.

Подобни статии
-
Когато съпругът е против дете, как да забременеете без негово знание?
Понякога можете да забременеете по небрежност. За да не се случи това, е важно да знаете как можете да заченете дете случайно и какви средства можете да използвате, за да избегнете нежелана бременност. Също така в тази статия можете да намерите информация за...
-
Какви камъни и амулети са подходящи за Телец според хороскопа и датата на раждане Талисман на слон за Телец
Април-май Телците (21 април - 20 май) са премерени, не са суетливи и колосално продуктивни! Тяхната завидна упоритост може да доведе другите до дръжката, но те знаят точно какво правят и защо имат нужда от това. Сред положителните...
-
Ограничения за достъп до данни в роли 1c
Всички настройки на потребителските права, които ще направим в рамките на тази статия, се намират в раздел 1C 8.3 "Администриране" - "Настройки на потребител и права". Този алгоритъм е подобен в повечето конфигурации на ...
-
1c стартира тънък клиент вместо дебел
Платформи: 1C: Enterprise 8.3, 1C: Enterprise 8.2, 1C: Enterprise 8.1 Конфигурации: Всички конфигурации2012-11-16 21362 Те се стартират чрез указване на специални ...
-
Доказателства за известни начини за кражба на ток Как да разберете кой краде ток
Повишаването на енергийните тарифи е една от поразителните характеристики на задълбочаващата се икономическа криза. В този контекст кражбата на електроенергия и проблемите, свързани с разкриването й, са от първостепенно значение.Начини за разкриване на кражба ...
-
Характеристики на монтаж на контакти и превключватели на различни повърхности
Поздрави на всички читатели на нашия блог Днес, скъпи читатели, искам да подчертая темата как да инсталирам гнезда. Тази процедура е много често търсена при подмяна на стар контакт с нов в случай на повреда, когато ...
