Най-високата и най-ниската степен на окисление на натрия. Натрий и неговите съединения - файл n1.doc
Главна информацияи методи за получаване
Натрият (Na) е сребристо-бял алкален метал, който бързо потъмнява във въздуха, когато нормални условия. Съдържание в земната кора 2,5% (тегловни). Във водите на океаните средната му концентрация е 1,035%. Живите организми съдържат до 0,02% (по маса) натрий, съдържанието му в растенията е малко по-ниско.
Известни са повече от 220 минерала, които съдържат натрий. Най-често срещаният натриев хлорид или готварска сол, NaCl, халит NaCl или каменна сол, чилийска селитра NaN 0 3, тенардит Na 2 S 04, мираболит (сол на Глаубер) Na 2 SCv 10H 2 O, трон Na, H (C 0 3) 2 -2 H 2 0 и т.н.
Натрият присъства и в редица по-сложни минерали, съдържащи алуминий, силиций, сяра и други елементи. Например в яфелин Na [ A ] Si 0 4 ], лапис лазули (ултрамарин) Na 3 [ Al 3 Si 3 0| 2 ] Na 2 [S 0 4 ], жадеит NaCl [ Si 2 0 6 ] и др.
Редица натриеви съединения, предимно готварска сол и сода Na 2 C 0 3 10H 2 O, са известни на човека от древни времена.
IN древен Египетбил известен перилен препарат (сода), който се наричал нетер. При Аристотел се нарича vixpovj, а при Плутарх ( Древен Рим) - нитр. В ръкописите на арабските алхимици содата отговаря на термина натрон, от който постепенно през 17-18в. се формира терминът "натра", тоест основата, от която можете да получите готварска сол. От "натра" дойде съвременно имеелемент. Трябва да се отбележи, че в някои страни Западна Европа(Великобритания, Франция, Италия), както и САЩ, натрият се нарича натрий.
Металният натрий е получен за първи път през 1807 г. от английския химик Деви в резултат на електролиза ( алкален начин). Поради високата енергийна интензивност, алкалният метод получава индустриално разпространение едва в края на 19 век. Преди това е получен метален натрий химическа редукциянеговите съединения с въглерод или разтопено желязо, когато висока температура. От първата четвърт на настоящия век алкалният метод постепенно се заменя със солния метод, т.е. чрез електролиза на стопилката на натриев хлорид директно, заобикаляйки етапа на получаване на алкали. Електролизата на разтопена сол се извършва при 850-860 К. За да се намали точката на топене на NaCl, се използват добавки от редица соли, по-специално NaF, KCl, CaClg и др. При електролизата на натриев хлорид, още един ценен продукт- газообразен хлор. Следователно в момента солевият метод за получаване на натрий практически замени алкалния метод, да не говорим за химичните методи.
Физични свойства
Атомни характеристики. Атомен номер 11, атомна маса 22,98977 a.u. е. м., атомен обем 23,08 * 10 -6 m 3 / mol. Атомен радиус (метал) 0,192 nm, йонен радиус Na + 0,098 nm, ковалентен 0,157 nm. Конфигурацията на външните електронни обвивки на атома е 2 p 6 3 s 1 . Натрият притежава единствения стабилен изотоп 23 Na; известни пет радиоактивни изотопис масови числа от 20 до 25; полуживотът на изотопите варира от хилядни от секундата (20 Na) до 2,6 години за 22 Na. При стайна температура натрият има около. ° С. к. решетка с период a \u003d 0,42905 nm; енергия кристална решетка 108,8 μJ/kmol. При ниски температуриима модификация на натрия с gp. структура, чиито периоди при 5K: a = 0.3767 nm, c = 0.6154 nm. Йонизационни потенциали на натриевия атом J (eV) 5.138, 47.20, 71.8, електроотрицателност 0.9. Работната работа на електроните f 0 = = 2,35 eV. Работата на електроните за различни лица на единичен кристал е f -2,75 eV за (100), f = 3,10 eV за (110), f = 2,65 eV за (111).
Плътност. При стайна температура плътността на натрия е рентгенова p=0,966 Mg/m3, пикнометрична p=0,971 Mg/m3.
По време на топенето електрическото съпротивление на натрия се увеличава с коефициент 1,451. Температурен коефициент на електрическо съпротивление на натрий при 273 K a=4,34-10-3 K-1.
В натриево-платинова термодвойка, при температура на горещ преход от 173,16 К, т.е. д.с. £ \u003d 0,29 mV и при температура 373,16 K £ = -0,25 mV. Абсолютен коефициент te д.с. e \u003d - 4,4 μV / K. Константа на Хол при стайна температура /? \u003d 2,3-10 m 3 / C и /? \u003d - 2,2-10 m 3 / C при 371-383 K.
Магнитна чувствителност на натрий x= +0,70-10-9 при 293 K.
Топлинни и термодинамични. Точка на топене на натрий / P l = 98 ° C, точка на кипене? кипене = 878 ° C, характерна температура 6v = 160 K, специфична топлинатопене DYa PL \u003d P7 kJ / kg. Специфичната топлина на сублимация при 298 K DYa su bl = 4717 kJ/kg, специфичната топлина на изпарение на DYA Isp = 3869 kJ/kg. Топлината на изпаряване на натрия при нормално налягане DYAi<-п = 3869 кДж/кг. При плавлении происходит увеличение объема на ДУ- 27,82-Ю -6 м 3 /кг или AV / V 0 = 0,0265. При повышении давления возрастает температура плавления металла, достигая 515 К при 3 ГПа и 608 при 8 ГПа. Начальное значение углового коэффициента dT / dP = 85 К/ГПа, при 7 ГПа 33 К/ГПа. Фазовых превращений в натрии до давления 8,5 ГПа не обнаружено.
Механични свойства
Натриева твърдост по Бринел HB = 0,7 MPa. Модул на нормална еластичност при опън при стайна температура £=5,3 GPa. Свиваемост на натрия x= 15,99*10 -11 Pa -1.
Химични свойства
В химични съединения, включително хидриди, той показва степен на окисление + 1.
Натрият е един от най-реактивните метали, така че не се среща в природата в чист вид. Натрият е един от най-електроположителните метали; взаимодейства интензивно с атмосферния кислород, така че обикновено се съхранява под слой керосин. В поредица от напрежения натрият е далеч пред водорода и го измества от водата, образувайки хидроксид NaOH.
При преминаване на сух водород върху леко загрят натрий се образува натриев хидрид NaH, който е несъединение, в което натрият влиза под формата на катион, а водородът - под формата на анион.
Натриевият оксид се образува, когато натрият се изгаря в недостатъчно количество кислород, реагира бурно с вода, за да образува хидроксид и има кристална решетка от типа на флуорипат.
Натриевият пероксид се образува при изгаряне на натрий във въздух или в кислород, той е бледожълт прах, който се топи без разлагане; много силен окислител. Много органични вещества се запалват при контакт с него. Когато Na 2 0 2 взаимодейства с въглероден диоксид, се освобождава кислород. Тази реакция се използва в дихателни апарати, използвани от пожарникари и водолази, както и за регенерация на въздуха в затворени пространства, като подводници.
Натриевият хидроксид NaOH се образува под формата на бели, много хигроскопични кристали, топящи се при 318,3 °C; плътност 2,13 Mg / m 3.
Известно е съединение на натрий с въглерод Na 2 C 2, което може да се разглежда като сол на ацетилена. Поради това получава името натриев ацетамид. Натриевият нитрид е стабилен на сух въздух, но се разлага веднага с вода или алкохол, за да образува амоняк.
Натриев сулфид Na 2 S се получава чрез редукция на натриев сулфат с въглерод. В чистата си форма Na 2 S е безцветен, има кристална решетка от типа CaF 2. Много често срещано съединение на натрий със сяра и кислород е така наречената глауберова сол Na 2 S 0 4 - 10H 2 O. Натрият, заедно с обичайните химични съединения, които се подчиняват на правилото за валентност, също образува метални съединения. В сплави от системата Na - K се образува фаза на Лавес със състав KNa 2, която има комплексна о.д. ° С. до кристална решетка тип MgCu 2 (C15). Подобно метално съединение се наблюдава при взаимодействието на натрий с цезий. Редица метални съединения се образуват при взаимодействието на натрия с металите I и VII B група - сребро, злато, цинк, кадмий, живак, галий, калай, олово и други елементи. Има, разбира се, и изключения. И така, алуминият, елемент от подгрупата SHV, не взаимодейства с натрий нито в течно, нито в твърдо състояние. Елементите III - VIIA от подгрупите на Периодичната система практически не взаимодействат с натрия поради голямата разлика както в размера, така и в точките на топене.
Области на използване
Натрият се използва широко в различни области на техниката. Високата реактивност на този елемент предопредели използването му в металургията като редуциращ агент за производството на метали като титан, цирконий, хафний, ниобий и др., По натриево-термичен метод. натрият и неговите соли се използват като модификатори. В химическата промишленост натрият се използва в производството на цианидни соли, синтетичен каучук и синтетични детергенти (детергениди), фармацевтични продукти, както и оловен тетраетил, антидетонатор за производство на високооктаново гориво за двигатели. През последните години употребата на чист натрий и неговите сплави с калий в ядрената енергетика като охладители се разширява.
Химичните му съединения се използват широко в националната икономика. Това е предимно натриев хидроксид NaOH (сода каустик), който се използва в сапунената промишленост, в производството на бои, в целулозно-хартиената и петролната промишленост, в производството на изкуствени влакна и др. Сода - натриев карбонат Na 2 C 0 3 - използва се в стъкларската, целулозно-хартиената, хранително-вкусовата, текстилната, нефтената и други индустрии. В селското стопанство натриевата сол на азотната киселина NaN 0 3, известна като чилийски нитрат, се използва широко като тор.
n1.doc
Резюме.
Предмет: "Натрий и неговите съединения"
Въведение………………………………………………………………………………3
Наличието в природата на натрий и неговите съединения……………………….3 - 4
Физични и химични свойства……………………………….…….4 – 7
Получаване и използване…………………………………………….…….7 – 11
Токсичност…………………………………………………….…………….11
Препратки……………………………………………………….…….12
Въведение.
Натрий
- химичен елемент от основната подгрупа на група I на периодичната система на Менделеев. Неговият атомен номер е 11, а атомната му маса е 22,9898. Натрий- сребристо-бял мек метал, който бързо се окислява от повърхността във въздуха, лесно се реже с нож. Срезът в натрий веднага след срязването има ярък метален блясък, но бързо потъмнява поради изключително бързото окисление на метала. Естественият елемент се състои от един стабилен изотоп, Na.
Естествени натриеви съединения (трапезна сол NaCl, сода Na 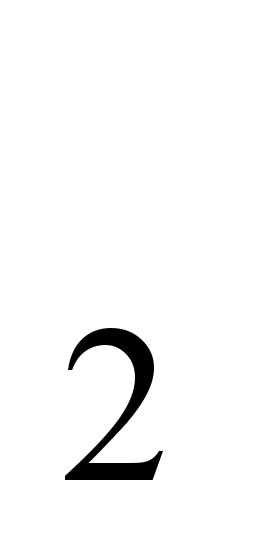 CO) са известни от древни времена. Име "натрий"
произлиза от арабски натрън, Гръцки нитрон, първоначално наричана натурална сода. Още през 18 век химиците познават много други натриеви съединения. Самият метал обаче е получен едва през 1807 г. от Г. Дейви чрез електролиза на сода каустик NaOH. Във Великобритания, САЩ, Франция елементът се нарича Натрий(от испанската дума soda - сода), в Италия - содио.
CO) са известни от древни времена. Име "натрий"
произлиза от арабски натрън, Гръцки нитрон, първоначално наричана натурална сода. Още през 18 век химиците познават много други натриеви съединения. Самият метал обаче е получен едва през 1807 г. от Г. Дейви чрез електролиза на сода каустик NaOH. Във Великобритания, САЩ, Франция елементът се нарича Натрий(от испанската дума soda - сода), в Италия - содио.
Наличието в природата на натрий и неговите съединения.
Натрий- типичен елемент от горната част на земната кора. Средното му съдържание в литосферата е 2,5% тегловни, в киселинни магмени скали (гранити и др.) 2,77%, в основни (базалти и др.) 1,94%, в ултраосновни (мантийни скали) 0,57% . Поради изоморфизма на Na 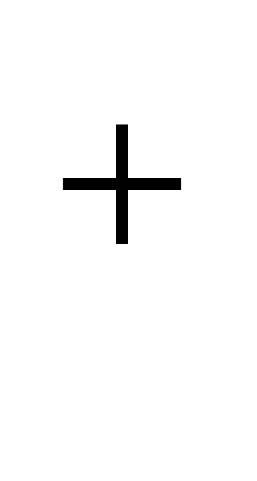 и Ca
и Ca 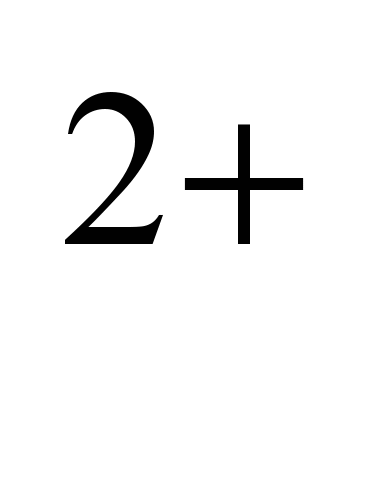 , поради близостта на техните йонни радиуси, в магмените скали се образуват натриево-калциеви фелдшпати
(плагиоклази)
. В биосферата има рязка диференциация на натрий: седиментните скали са средно обеднени на натрий (в глини и шисти 0,66%), той е нисък в повечето почви (средно 0,63%). Общият брой на натриевите минерали е 222. Натрият се задържа леко на континентите и се пренася от реките в моретата и океаните, където средното му съдържание е 1,035%. Na- основният метален елемент на морската пехота вода. Изпарението в крайбрежно-морските лагуни, както и в континенталните езера на степите и пустините, утаява натриеви соли, които образуват слоеве от солоносни скали. Основните минерали, които са източник на натрий и неговите съединения са халит
(каменна сол) NaCI,
чилийска селитра
NaNO,
тенардит
NaSO
, поради близостта на техните йонни радиуси, в магмените скали се образуват натриево-калциеви фелдшпати
(плагиоклази)
. В биосферата има рязка диференциация на натрий: седиментните скали са средно обеднени на натрий (в глини и шисти 0,66%), той е нисък в повечето почви (средно 0,63%). Общият брой на натриевите минерали е 222. Натрият се задържа леко на континентите и се пренася от реките в моретата и океаните, където средното му съдържание е 1,035%. Na- основният метален елемент на морската пехота вода. Изпарението в крайбрежно-морските лагуни, както и в континенталните езера на степите и пустините, утаява натриеви соли, които образуват слоеве от солоносни скали. Основните минерали, които са източник на натрий и неговите съединения са халит
(каменна сол) NaCI,
чилийска селитра
NaNO,
тенардит
NaSO  ,
мирабилит или глаубер
сол
NaSO
,
мирабилит или глаубер
сол
NaSO 10
HO,
трон
NaH(CO)2
HO,
бура
NaBO
10
HO,
трон
NaH(CO)2
HO,
бура
NaBO  10
HO, силвинитKCINaCI.
Световното производство на натрий се оценява на 110
10
HO, силвинитKCINaCI.
Световното производство на натрий се оценява на 110  тона. Na- важен биоелемент, живата материя съдържа средно 0,02% натрий. В животните го има повече, отколкото в растенията. Натрият е един от основните елементи, участващи в минералния метаболизъм на животните и хората. Съдържа се главно в извънклетъчните течности (в човешките еритроцити около 10 mmol / kg, в кръвния серум 143 mmol / kg); съдържанието на натрий в растителните тъкани е около 0,01% от мокро тегло.
тона. Na- важен биоелемент, живата материя съдържа средно 0,02% натрий. В животните го има повече, отколкото в растенията. Натрият е един от основните елементи, участващи в минералния метаболизъм на животните и хората. Съдържа се главно в извънклетъчните течности (в човешките еритроцити около 10 mmol / kg, в кръвния серум 143 mmol / kg); съдържанието на натрий в растителните тъкани е около 0,01% от мокро тегло.
Физични и химични свойства.
При обикновена температура натрият кристализира в кубична решетка, a = 4,28. Атомен радиус 1,86, йонен радиус Na 0,92. Плътност 0,968 g/cm  (19,7
(19,7 C), t
C), t 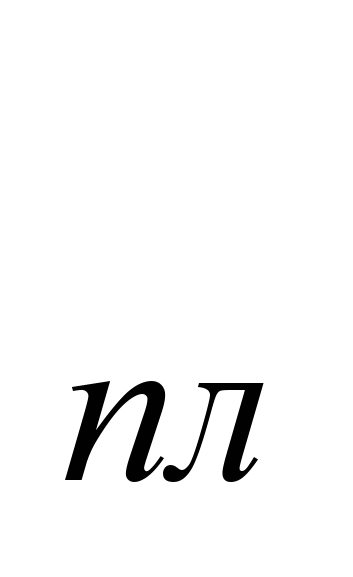 \u003d 97.83С, t
\u003d 97.83С, t  =882.9°С; специфичен топлинен капацитет (20С) 1.2310J/(kgK) или 0.295 cal/(gград); коефициент на топлопроводимост 1.3210
=882.9°С; специфичен топлинен капацитет (20С) 1.2310J/(kgK) или 0.295 cal/(gград); коефициент на топлопроводимост 1.3210  w/(mK) или 0,317 cal/(cmsecgrad); температурен коефициент на линейно разширение (20C) 7.110
w/(mK) или 0,317 cal/(cmsecgrad); температурен коефициент на линейно разширение (20C) 7.110  електрическо съпротивление (0C) 4.310
електрическо съпротивление (0C) 4.310 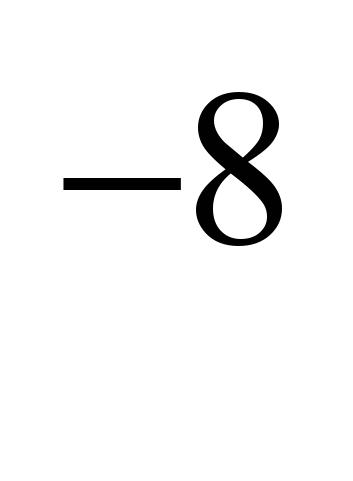 ома (4310
ома (4310  omsm). Натрият е парамагнитен, специфична магнитна чувствителност +9,210; много пластичен и мек (лесно се реже с нож).
omsm). Натрият е парамагнитен, специфична магнитна чувствителност +9,210; много пластичен и мек (лесно се реже с нож).
Натрият принадлежи към алкалните метали, тъй като неговият оксид има силно основен характер, а образуваният от него хидроксид е силен електролит - алкален. Нормалният електроден потенциал на натрия е -2,714 V; потенциалът на електрода в стопилката е 2,4 V. Натриевите пари оцветяват пламъка в характерен ярко жълт цвят ( качествена реакция към катиони на алкални метали). Електронна конфигурация на натриевия атом 1
с2
с2
стр  3
с
3
с  .
Натрият, както всички алкални метали, има такъв с- електрон на външния електронен слой, който лесно се губи по време на химични реакции, показващ степен на окисление +1
(във всички известни съединения натрият е едновалентен). Ето защо Naесилен редуциращ агент
. В твърдо състояние той е добър проводник на електричество. Тъй като натрият е стопим и бързо се окислява във въздуха, той се съхранява без достъп на въздух и влага, най-често под керосин. Натрият образува съединения с предимно йонна връзка, които обикновено са разтворими във вода и лесно се дисоциират на йони. За йони на алкални метали образуването на стабилни комплекси не е характерно. Реактивността на натрия е много висока. Редица соли кристализират от разтвора под формата на кристални хидрати: NaSO
.
Натрият, както всички алкални метали, има такъв с- електрон на външния електронен слой, който лесно се губи по време на химични реакции, показващ степен на окисление +1
(във всички известни съединения натрият е едновалентен). Ето защо Naесилен редуциращ агент
. В твърдо състояние той е добър проводник на електричество. Тъй като натрият е стопим и бързо се окислява във въздуха, той се съхранява без достъп на въздух и влага, най-често под керосин. Натрият образува съединения с предимно йонна връзка, които обикновено са разтворими във вода и лесно се дисоциират на йони. За йони на алкални метали образуването на стабилни комплекси не е характерно. Реактивността на натрия е много висока. Редица соли кристализират от разтвора под формата на кристални хидрати: NaSO  10HO, NaCO
10HO, NaCO  10HO, NaBO
10HO, NaBO  10HO, които по своята структура са тектохидрати. Тектохидратите имат структурата на лед, в чиито кухини са разположени равномерно противоположно заредени йони.
10HO, които по своята структура са тектохидрати. Тектохидратите имат структурата на лед, в чиито кухини са разположени равномерно противоположно заредени йони.
Химични свойства:
Взаимодействие с прости вещества:
1) Реакция с халогени: 2Na+CI= 2NaCI (натриев хлорид)
Натрият взаимодейства директно с флуора и хлора при обикновени температури (гори енергично в хлор, което е особено добре да се наблюдава в тръба от калциев хлорид, в която поток от хлор преминава през разтопен и силно нагрят натрий), с бром - само когато отопляем; няма пряко взаимодействие с йод.
Натриев хлорид(сол) NaCI
кристализира под формата на кубични кристали, няма мирис, има солен вкус, силно разтворим във вода. При промяна на температурата неговата разтворимост почти не се променя. Това е от особено значение при изолирането на трапезна сол от разтвори на други соли чрез прекристализация.
2) Реакция с кислород: 4Na+O= 2NaO (натриев оксид)
2Na+O=NaO (натриев пероксид)
При директно взаимодействие с кислорода в зависимост от условията се образува NaO оксид (окисляване в малко количество кислород при температура около 180С) или NaO пероксид - безцветни кристални вещества. натриев оксид- твърдо хигроскопично вещество, което лесно взаимодейства с вода, има силно основен характер. При взаимодействие с вода образува основа (сода каустик):
NaO+HO = 2NaOH
Натриев хидроксидили натриев хидроксид NaOHе много важно натриево съединение. Нарича се още сода каустик или просто каустик. За получаване на сода каустик се използва готварска сол - най-евтиното естествено натриево съединение. Тази сол се подлага на електролиза, но в този случай не се използва стопилка, а разтвор на сол. каустик натрият е бяло кристално твърдо вещество, силно разтворимо във вода. При разтваряне на сода каустик във вода се отделя голямо количество топлина и разтворът е много горещ. Содата каустик трябва да се съхранява в добре затворени съдове, за да се предпази от проникването на водни пари, под въздействието на които може да бъде силно овлажнена, както и от въглероден окис (IV), под въздействието на който содата каустик може постепенно да се превърне в натриев карбонат:
2NaOH + CO = NaCO + HO
натриев пероксид(жълтеникав прах) е най-силният окислител. Под действието на водата се образува алкален и водороден прекис (ако процесът се извършва при нагряване, кислородът се освобождава поради разлагането на H O):
NaO + 2HO = HO + 2NaOH
Под действието на разредени киселини върху натриев пероксид се образува водороден пероксид: NaO + HSO \u003d NaSO + HO
Натриевият пероксид реагира с въглеродния диоксид във въздуха съгласно уравнението:
2NaO + 2CO= 2NaCO +O
Поради това се използва в дихателни апарати за регенерация на въздуха - абсорбиране на въглероден окис (IV) и освобождаване на кислород.
Натрият бързо се окислява във въздуха. Следователно той се съхранява под слой от органични разтворители (керосин или парафин, като парафинът е за предпочитане, тъй като известно количество въздух все още се разтваря в керосин и натриевото окисление, макар и бавно, се случва).
При реакции с халогени и кислород натрият най-силно проявява редуциращи способности.
3) Реакция със сяра: 2Na + S = NaS (натриев сулфид)
Когато се смила в хаван със сяра, натрият реагира бурно и образува натриев сулфид. Реакцията е придружена от светкавици, така че хоросанът трябва да се държи далеч от очите, а ръката да се увие с кърпа. За реакцията се вземат малки парчета натрий.
4) Реакция с азот: 6Na+N= 2NaN (натриев нитрид)
Взаимодействието на натриевите пари с азота в полето на тих електрически разряд води до образуването на натриев нитрид.
5) Реакция с въглерод: 2Na+C=NaC
(натриев карбид)
Взаимодействието на натриеви пари с въглерод при 800-900C води до образуването на NaC карбид.
6) Реакция с фосфор: 3Na + P = NaP (натриев фосфид)
7) Реакция с водород: 2Na + H= 2NaH (натриев хидрид)
Реакцията на натрий с водород започва при 200°С и води до образуването на хидрид NaH - безцветно хигроскопично кристално вещество. Това е солеподобно съединение, което по естеството на химичната връзка и степента на окисление се различава от летливите водородни съединения на елементите от основните подгрупи на групи IV - VII.
Натрият е силен редуциращ агент, поради което редуцира водорода до степен на окисление -1.
Взаимодействие със сложни вещества:
1) С киселини: 2Na + 2HC1 = 2NaCI +H 
В електрохимичната серия от напрежения на металите натрият е преди водорода, следователно той възстановява водородните йони от разредени киселини.
Минералните киселини образуват съответните водоразтворими соли с натрия, но по отношение на 98-100% сярна киселина натрият е относително инертен.
2) С водни разтвори на соли:
Натрият, като метал със силни редуциращи свойства, при тези условия ще редуцира водорода на водата, а не метала на съответната сол.
3) С вода: 2Na + 2HOH = 2NaOH + H
Натрият реагира с вода, измествайки водорода от нея (тъй като е много активен метал, той е много вляво от водорода в поредицата от напрежения), при нормални условия, и в резултат на тази реакция се образува водоразтворим NaOH образува се база и Н се освобождава; реакцията може да бъде придружена от експлозия.
4) С амоняк:
Натрият се разтваря в течен амоняк (34,6 g на 100 g NH при 0°C), за да образува амонячни комплекси. Когато газообразният амоняк преминава през разтопен натрий при 300-350C, натриев амидNaNH- безцветно кристално вещество, лесно разлагащо се от вода.
5) С алкохоли: 2CHOH + 2Na = 2CHONa + H 
Когато натрият взаимодейства с алкохоли, водородът на хидроксилната група се заменя с натрий, за да се образуват алкохолати (натриев етоксид).
Известни са голям брой натриеви органични съединения, които са много сходни по химични свойства с органолитиевите съединения, но ги превъзхождат по реактивност. Натриевите органични съединения се използват в органичния синтез като алкилиращи агенти.
Сплави
.
Натрият е съставна част на много практически важни сплави. Сплавите на Na - K, съдържащи 40-90% K (по маса) при температура около 25 ° C, са сребристо-бели течности, характеризиращи се с висока химическа активност, запалими във въздуха. Електрическата и топлопроводимостта на Na-K течните сплави са по-ниски от съответните стойности за Na и K. Натриеви амалгамисе получават лесно чрез въвеждане на метален натрий в живак; със съдържание над 2,5% Na (по маса) при обикновена температура, те вече са твърди вещества.
Получаване и приложение.
Основният промишлен метод за получаване на натрий е електролиза на стопилка готварска солNaCIсъдържащи добавкиKCI,
NaF,
CaCIи други (пироелектрометалургия), които намаляват точката на топене на солта до 575-585 ° С. Електролизата на чист NaCl би довела до големи загуби на натрий от изпаряване, тъй като точките на топене на NaCl (801C) и точките на кипене на Na (882.9C) са много близки. Електролизата се извършва в електролизари с диафрагма (анодното и катодното пространство са разделени с диафрагма, която изолира получения хлор от натрия, за да не настъпи обратната реакция), катодите са от желязо или мед, анодите са изработени от графит. Едновременно с натрия се получава и хлор. Електродите се потапят в разтопена сол. Положителният натриев йон приема електрон от катода и се превръща в неутрален натриев атом. Неутралните натриеви атоми се събират на катода под формата на разтопен метал. Процесът, протичащ на катода, може да бъде представен чрез диаграмата: Na+


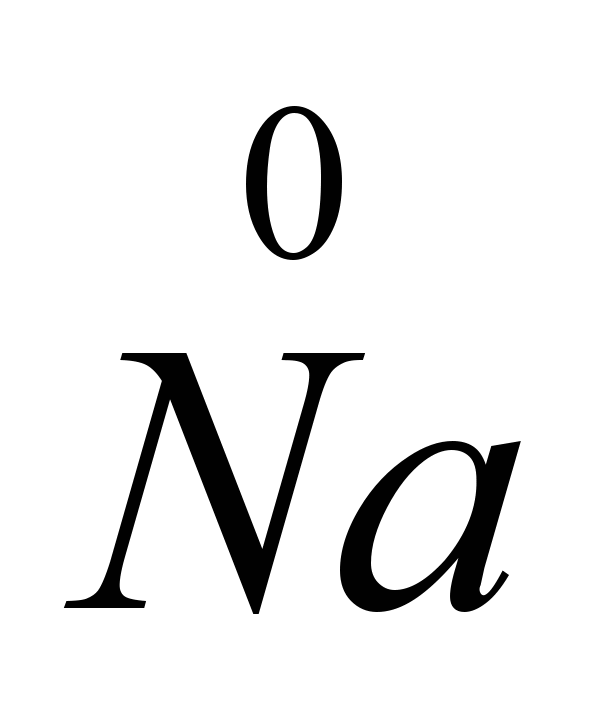
Тъй като електроните се приемат на катода и всяко приемане на електрони от атом или йон е редукция, натриевите йони на катода намаляват. На анода хлоридните йони отдават електрони, т.е. има процес на окисляване и освобождаване на свободен газообразен хлор, който може да бъде представен със следната диаграма: CI  -
-
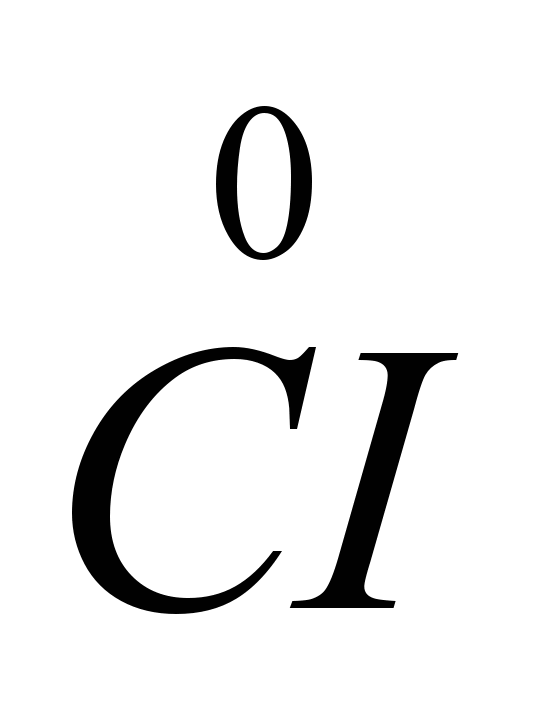
Запазен е и старият метод за получаване на натрий - електролиза на стопен натриев хидроксидNaOH, който е много по-скъп от NaCI, но се разлага електролитно при по-ниска температура (320-330C).
Натрият и неговите сплави се използват широко като охладители за процеси, изискващи равномерно нагряване в диапазона 450-650C - в клапаните на самолетни двигатели и особено в атомни електроцентрали. В последния случай Na-K сплавите служат като охладители от течен метал (и двата елемента имат малки сечения на абсорбция за топлинни неутрони, за Na 0,49 barn); тези сплави се отличават с високи точки на кипене и коефициенти на топлопреминаване и не взаимодействат със структурни материали при високи температури, развити в ядрени енергийни реактори. Съединението NaPb (10% Na от масата) се използва при производството на тетраетил олово- най-ефективният антидетонационен. В сплав на основата на олово (0,73% Ca, 0,58% Na и 0,04% Li), използвана за направата на лагери на мотриси, натрият е втвърдяваща добавка. В металургията натрият служи като активен редуциращ агент при производството на някои редки метали (Ti, Zr, Ta) чрез металотермични методи; в органичния синтез - в реакции на редукция, кондензация, полимеризация и др. Понякога натрият се заменя в електротехниката с мед, който е 9 пъти по-тежък от този метал; гумите за големи токове са направени от стоманени тръби, пълни с натрий. Първият в света синтетичен каучук, получен през 1928 г. от академик С. В. Лебедев, е наречен натриев бутадиенов каучук, тъй като натрият е катализатор за процеса на полимеризация на бутадиен. Натрият се използва като редуциращ агент в органичния синтез, по-специално за редукция на мастни киселини във висши алкохоли, използвани в производството на синтетични детергенти.
В медицината най-често се използват натриеви препарати натриев сулфатNaSO, хлоридNaCI(със загуба на кръв, загуба на течности, повръщане и др.), боратNaBO10
HO(като антисептик) бикарбонатNaHCO(като отхрачващо средство, както и за измиване и изплакване при ринит, ларингит, диабет и др.), тиосулфатNaSO (сода) е необходима за производството на стъкло, алуминий, почистващи препарати и бои).
NaCIO + HO + CO= NaHCO + HC10
NaOH използва се и в хартиената промишленост, в производството на сапун, в производството на изкуствени влакна, в галванопластиката, за пречистване на петролни продукти и фракции от каменовъглен катран. NaOH се използва за алкално почистване на плодове и зеленчуци (кореноплоди, цитрусови плодове, домати и др.), Което се улеснява поради алкална хидролиза на определени вещества, което води до нарушаване на връзката между кората и пулпата. Бойлерите и радиаторите се почистват от котлен камък със силен разтвор на NaOH. Натриев хлорид NaCI използвани в химическата промишленост за производство на хлор, сода каустик, сода, белина, някои видове пластмаси и органични съединения. натриев нитратNaNOизползва се като минерален тор. натриев силикатNaSiO - един от малкото водоразтворими силикати. Наричат го водно стъкло, и решението течно стъкло. Разтворимото стъкло се импрегнира с дърво и тъкани, за да се предотврати запалването им. Течното стъкло влиза в състава на огнеупорни шпакловки за лепене на стъкло, порцелан, камък. натриев нитритNaNOизползва се като инхибитор, който забавя корозията на стоманата във вода и солни разтвори (създава защитен филм върху металната повърхност).
натриев амидNaNH, получен при взаимодействието на течен амоняк с натрий, е необходим за производството на синя боя - индиго и витамин А.
Най-вече натриев пероксидNaOизползва се за избелване на хартия и регенерация на въздух в подводници; преди това е бил широко използван за избелване на сламени шапки.
За да се определи съдържанието на влага в органичните вещества, те се смесват с натриева амалгама (разтвор на живак). В резултат на взаимодействие с водата се отделя еквивалентно количество Н, чийто обем се използва за определяне на съдържанието на влага във взетата проба.
Натриеви съединения като солNaCI И Газирани напиткиNaCO. Дневната нужда на човека от натриев хлорид варира от 2 до 10 g и зависи от количеството на тази сол, загубено с потта.
Изкуствено произведени радиоактивни изотопи  Na (полуживот T
Na (полуживот T  =2,64 g) и
=2,64 g) и 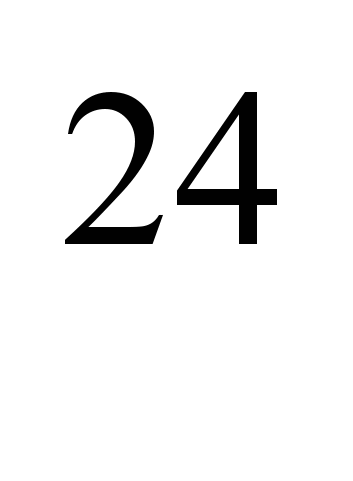 Na (T = 15 h) се използва за определяне на скоростта на кръвния поток в определени части на кръвоносната система при сърдечно-съдови и белодробни заболявания, облитериращ ендартериит и др. Радиоактивни разтвори на натриеви соли (например NaCI) също се използват за определяне на съдови пропускливост, изследване на общото съдържание на обменния натрий в организма, водно-солевия метаболизъм, абсорбцията от червата, процесите на нервната дейност и в някои други експериментални изследвания.
Na (T = 15 h) се използва за определяне на скоростта на кръвния поток в определени части на кръвоносната система при сърдечно-съдови и белодробни заболявания, облитериращ ендартериит и др. Радиоактивни разтвори на натриеви соли (например NaCI) също се използват за определяне на съдови пропускливост, изследване на общото съдържание на обменния натрий в организма, водно-солевия метаболизъм, абсорбцията от червата, процесите на нервната дейност и в някои други експериментални изследвания.
Натрият е един от основните елементи, участващи в минералния метаболизъм на животните и хората. Участва в поддържането осмотичното наляганеИ киселинно-алкален балансв провеждането на нервните импулси. Концентрацията на натриеви йони в тялото се регулира главно от хормона на надбъбречната кора - алдостерон. Въпреки сравнително високото съдържание на натрий в растителните тъкани (около 0,01% мокро тегло), ролята му в живота на растенията не е добре разбрана. При халофити(видове, растящи на силно солени почви), натрият създава високо осмотично налягане в клетъчния сок и по този начин помага за извличането на вода от почвата.
Токсичност.
Поради високата реактивност на натрия, работата с него изисква повишено внимание. Особено опасно е излагането на натриева вода, което може да доведе до пожар и експлозия. Очите трябва да бъдат защитени с очила, ръцете с дебели гумени ръкавици; контактът на натрий с мокра кожа или дрехи може да причини сериозни изгаряния.
Запален алкален метал не може да се гаси с вода. Най-добре е да го напълните с калцинирана сода на прах.
Содата каустик, ако влезе в контакт с кожата, може да причини тежки изгаряния, така че кристалната основа не трябва да се взема с ръце, а само с клещи или пинсети. Ако алкален разтвор влезе в контакт с кожата, е необходимо първо да се измие разтворът, докато усещането за сапуненост изчезне с много вода и след това да се неутрализира с разтвор на борна киселина.
Библиография.
Sittig M. "Натрий, неговото производство, свойства и приложения", прев. от английски, 1961 г.
- Рипан Р., Четяну И. "Неорганична химия", т.1, прев. от Румъния, 1971г.
Павлов Н.Н. "Обща и неорганична химия", издателство "Дрофа", 2002г.
Крючкова-Чернобелская Г.М. "Неорганична химия", 3-то издание, издателство "Медицина", 1980 г.
НАТРИЙ- (Натрий) Na, химичен елемент от 1-ва (Iа) група на периодичната таблица, принадлежи към алкалните елементи. Атомен номер 11, относителна атомна маса 22,98977. В природата има един стабилен изотоп 23 Na. Известни са шест радиоактивни изотопа на този елемент, два от които представляват интерес за науката и медицината. Натрий-22 с период на полуразпад 2,58 години се използва като източник на позитрони. Натрий-24 (полуживотът му е около 15 часа) се използва в медицината за диагностика и лечение на някои форми на левкемия.
+1 степен на окисление.
Натриевите съединения са известни от древни времена. Натриевият хлорид е основен компонент на човешката храна. Смята се, че човекът е започнал да го използва през неолита, т.е. преди около 5-7 хиляди години.
В Стария завет се споменава определено вещество "нетер". Това вещество се използва като детергент. Най-вероятно нетерът е сода, натриев карбонат, който се е образувал в солените египетски езера с варовити брегове. Гръцките автори Аристотел и Диоскорид по-късно пишат за същото вещество, но под името "нитрон", а древноримският историк Плиний Стари, споменавайки същото вещество, вече го нарича "нитрум".
През 18 век химиците вече познаваха много различни натриеви съединения. Натриевите соли се използват широко в медицината, при обработката на кожи и при боядисването на тъкани.
Металният натрий е получен за първи път от английския химик и физик Хъмфри Дейви чрез електролиза на разтопен натриев хидроксид (използвайки волтова колона от 250 чифта медни и цинкови пластини). Името "натрий", избрано от Дейви за този елемент, отразява неговия произход от сода Na 2 CO 3 . Латинското и руското име на елемента произлизат от арабското "натрун" (естествена сода).
Разпространение на натрия в природата и промишленото му извличане.
Натрият е седмият най-разпространен елемент и петият най-разпространен метал (след алуминия, желязото, калция и магнезия). Съдържанието му в земната кора е 2,27%. По-голямата част от натрия е в състава на различни алумосиликати.
Огромни находища на натриеви соли в сравнително чиста форма съществуват на всички континенти. Те са резултат от изпарението на древните морета. Този процес все още продължава в Солт Лейк (Юта), Мъртво море и другаде. Натрият се намира под формата на NaCl хлорид (халит, каменна сол), както и карбонат Na 2 CO 3 NaHCO 3 2H 2 O (трона), NaNO 3 нитрат (нитрат), Na 2 SO 4 10H 2 O сулфат (мирабилит ), тетраборат Na 2 B 4 O 7 10 H 2 O (боракс) и Na 2 B 4 O 7 4H 2 O (кернит) и други соли.
Съществуват неизчерпаеми запаси от натриев хлорид в естествените разсоли и океанските води (около 30 kg m -3). Изчислено е, че каменната сол в количество, еквивалентно на съдържанието на натриев хлорид в океаните, би заела обем от 19 милиона кубични метра. km (50% повече от общия обем на северноамериканския континент над морското равнище). Призма с този обем с основна площ от 1 кв. km може да достигне луната 47 пъти.
Сега общото производство на натриев хлорид от морска вода е достигнало 6-7 милиона тона годишно, което е около една трета от общото световно производство.
Живата материя съдържа средно 0,02% натрий; има повече от него в животните, отколкото в растенията.
Характеристика на просто вещество и промишлено производство на метален натрий.
Натрият е сребристо-бял метал, на тънки слоеве с виолетов оттенък, пластичен, дори мек (лесно се реже с нож), блести прясно изрязан натрий. Стойностите на електрическата проводимост и топлопроводимостта на натрия са доста високи, плътността е 0,96842 g / cm 3 (при 19,7 ° C), точката на топене е 97,86 ° C, точката на кипене е 883,15 ° C.
Тройната сплав, съдържаща 12% натрий, 47% калий и 41% цезий, има най-ниската точка на топене за метални системи, равна на -78 ° C.
Натрият и неговите съединения оцветяват пламъка в ярко жълто. Двойната линия в спектъра на натрия съответства на преход 3 с 1-3стр 1 в атомите на елемента.
Реактивността на натрия е висока. Във въздуха той бързо се покрива с филм от смес от пероксид, хидроксид и карбонат. Натрият гори в кислород, флуор и хлор. Когато металът се изгаря във въздуха, се образува Na 2 O 2 пероксид (с примес на Na 2 O оксид).
Натрият реагира със сярата още при смилане в хаван, сярната киселина се редуцира до сяра или дори до сулфид. Твърдият въглероден диоксид („сух лед“) експлодира при контакт с натрий (пожарогасителите с въглероден диоксид не могат да се използват за гасене на горящ натрий!). С азота реакцията протича само при електрически разряд. Натрият не взаимодейства само с инертни газове.
Натрият реагира активно с вода:
2Na + 2H 2 O \u003d 2NaOH + H 2
Отделената по време на реакцията топлина е достатъчна, за да разтопи метала. Следователно, ако малко парче натрий се хвърли във вода, то се стопява поради термичния ефект на реакцията и капка метал, която е по-лека от водата, "тича" по повърхността на водата, задвижвана от реактивната сила от отделения водород. Натрият взаимодейства много по-спокойно с алкохолите, отколкото с водата:
2Na + 2C 2 H 5 OH \u003d 2C 2 H 5 ONa + H 2
Натрият лесно се разтваря в течен амоняк, за да образува ярко сини метастабилни разтвори с необичайни свойства. При -33,8 ° C в 1000 g амоняк се разтварят до 246 g метален натрий. Разредените разтвори са сини, концентрираните разтвори са бронзови. Те могат да се съхраняват около седмица. Установено е, че натрият се йонизира в течен амоняк:
Равновесната константа на тази реакция е 9,9·10 -3 . Изходящият електрон се солватира от амонячни молекули и образува комплекс - . Получените разтвори имат метална електропроводимост. Когато амонякът се изпари, оригиналният метал остава. При дългосрочно съхранение на разтвора той постепенно се обезцветява поради реакцията на метала с амоняка, за да се образува NaNH2 амид или Na2NH имид и да се освободи водород.
Натрият се съхранява под слой дехидратирана течност (керосин, минерално масло), транспортирана само в запечатани метални съдове.
Електролитен метод за промишлено производство на натрий е разработен през 1890 г. Разтопена сода каустик е подложена на електролиза, както в експериментите на Дейви, но с помощта на по-модерни енергийни източници от волтов стълб. При този процес кислородът се освобождава заедно с натрия:
анод (никел): 4OH - - 4e - \u003d O 2 + 2H 2 O.
При електролизата на чист натриев хлорид има сериозни проблеми, свързани, първо, с близката точка на топене на натриевия хлорид и точката на кипене на натрия, и второ, с високата разтворимост на натрия в течен натриев хлорид. Добавянето на калиев хлорид, натриев флуорид, калциев хлорид към натриев хлорид прави възможно понижаването на температурата на стопилка до 600 ° C. Производство на натрий чрез електролиза на разтопена евтектична смес (сплав от две вещества с най-ниска точка на топене) 40% NaCl и 60% CaCl2 при ~ 580 ° C в клетка, проектирана от американския инженер G. Downs, е започната през 1921 г. от DuPont близо до електроцентралата в Ниагарския водопад.
Върху електродите протичат следните процеси:
катод (желязо): Na + + e - = Na
Ca 2+ + 2e - = Ca
анод (графит): 2Cl - - 2e - = Cl 2.
Металните натрий и калций се образуват върху цилиндричен стоманен катод и се повдигат от охладена тръба, в която калцият се втвърдява и пада обратно в стопилката. Хлорът, образуван в централния графитен анод, се събира под никелов купол и след това се пречиства.
Сега обемът на производството на метален натрий е няколко хиляди тона годишно.
Подобни статии
-
Когато съпругът е против дете, как да забременеете без негово знание?
Понякога можете да забременеете по небрежност. За да не се случи това, е важно да знаете как можете да заченете дете случайно и какви средства можете да използвате, за да избегнете нежелана бременност. Също така в тази статия можете да намерите информация за...
-
Какви камъни и амулети са подходящи за Телец според хороскопа и датата на раждане Талисман на слон за Телец
Април-май Телците (21 април - 20 май) са премерени, не са суетливи и колосално продуктивни! Тяхната завидна упоритост може да доведе другите до дръжката, но те знаят точно какво правят и защо имат нужда от това. Сред положителните...
-
Ограничения за достъп до данни в роли 1c
Всички настройки на потребителските права, които ще направим в рамките на тази статия, се намират в раздел 1C 8.3 „Администриране“ - „Настройки на потребител и права“. Този алгоритъм е подобен в повечето конфигурации на ...
-
1c стартира тънък клиент вместо дебел
Платформи: 1C: Enterprise 8.3, 1C: Enterprise 8.2, 1C: Enterprise 8.1 Конфигурации: Всички конфигурации2012-11-16 21362 Те се стартират чрез указване на специални ...
-
Доказателства за известни начини за кражба на ток Как да разберете кой краде ток
Повишаването на енергийните тарифи е една от поразителните характеристики на задълбочаващата се икономическа криза. В този контекст кражбата на електроенергия и проблемите, свързани с разкриването й, са от първостепенно значение.Начини за разкриване на кражба ...
-
Характеристики на монтаж на контакти и превключватели на различни повърхности
Поздрави на всички читатели на нашия блог Днес, скъпи читатели, искам да подчертая темата как да инсталирам гнезда. Тази процедура е много често търсена при подмяна на стар контакт с нов в случай на повреда, когато ...
