Cele mai ridicate și cele mai scăzute stări de oxidare ale sodiului. Sodiul și compușii săi - dosar n1.doc
Informații generaleși metodele de obținere
Sodiul (Na) este un metal alcalin alb-argintiu care se patează rapid în aer atunci când este expus conditii normale. Conținut în Scoarta terestra 2,5% (în greutate). În apele oceanelor lumii, concentrația sa medie este de 1,035%. Organismele vii conțin până la 0,02% (în greutate) sodiu, conținutul său în plante este puțin mai mic.
Se știe că peste 220 de minerale conțin sodiu. Cele mai frecvente sunt clorura de sodiu, sau sare de masă, NaCl, halit NaCl, sau sarea gemă, salitrul chilian NaN 0 3, tenardita Na 2 S 04, mirabolitul (sare Glauber) Na 2 SCv 10H 2 O, trona Na, H (C) 0 3) 2 -2 H 2 0 etc.
Sodiul este prezent și într-o serie de minerale mai complexe care conțin aluminiu, siliciu, sulf și alte elemente. De exemplu, în jafeline Na [ A ] Si 0 4 ], lapis lazuli (ultramarin) Na 3 [ Al 3 Si 3 0| 2] Na 2 [S 0 4], jadeit NaCl [Si 2 0 6] etc.
O serie de compuși ai sodiului, în primul rând sarea de masă și soda Na 2 C 0 3 10H 2 O, sunt cunoscuți omului încă din cele mai vechi timpuri.
ÎN Egiptul antic era cunoscut un detergent (sodă), care se numea neter. La Aristotel se numește vixpovj, iar la Plutarh ( Roma antică) - nitru. În manuscrisele alchimiștilor arabi, termenul natron corespunde cu sifon, din care treptat în secolele XVII-XVIII. se formează termenul „natra”, adică baza de la care se poate obține sare de masă. Din „natra” a venit nume modern element. Trebuie remarcat faptul că într-un număr de țări Europa de Vest(Marea Britanie, Franța, Italia), precum și SUA, sodiul se numește sodiu.
Sodiul metalic a fost obținut pentru prima dată în 1807 de chimistul englez Dewi ca rezultat al electrolizei ( metoda alcalina). Datorită intensității sale energetice mari, metoda alcalină s-a industrializat abia la sfârșitul secolului al XIX-lea. Anterior se obținea sodiu metalic reducerea chimică compușii săi cu carbon sau fontă topită la temperatura ridicata. Începând cu primul sfert al secolului curent, metoda alcalină a fost înlocuită treptat cu metoda sărurilor, adică electroliza directă a topiturii de clorură de sodiu, ocolind etapa producerii alcaline. Electroliza sării topite se efectuează la 850-860 K. Pentru a reduce punctul de topire al NaCl, se utilizează adăugarea unui număr de săruri, în special NaF, KCl, CaClg etc. Prin electroliza clorurii de sodiu, un alt produs valoros- clor gazos. De aceea, in prezent, metoda sarii de producere a sodiului a inlocuit practic metoda alcalina, ca sa nu mai vorbim de metodele chimice.
Proprietăți fizice
Caracteristici atomice. Numărul atomic 11, masa atomică 22,98977 a. e.m., volum atomic 23,08* 10 -6 m3/mol. Raza atomică (metalic) 0,192 nm, rază ionică Na + 0,098 nm, rază covalentă 0,157 nm. Configurația învelișurilor de electroni exterioare ale atomului este 2 p 6 3 s 1. Sodiul are un singur izotop stabil, 23 Na; cinci cunoscute izotopi radioactivi cu numere de masă de la 20 la 25; Timpul de înjumătățire al izotopilor variază de la miimi de secundă (20 Na) la 2,6 ani pentru 22 Na. La temperatura camerei, sodiul are aproximativ. c. k. reţele cu perioada a = 0,42905 nm; energie rețea cristalină 108,8 uJ/kmol. La temperaturi scăzute Există o modificare a sodiului cu g.p.u. structură, ale căror perioade la 5K: a = 0,3767 nm, c = 0,6154 nm. Potențialele de ionizare ale atomului de sodiu J (eV) 5,138, 47,20, 71,8, electronegativitate 0,9. Funcția de lucru a electronilor φ 0 = 2,35 eV. Funcția de lucru a electronilor pentru diferite fețe ale unui singur cristal este φ -2,75 eV pentru (100), φ = 3,10 eV pentru (110), φ = 2,65 eV pentru (111).
Densitate. La temperatura camerei, densitatea razelor X de sodiu p = 0,966 Mg/m3, densitatea picnometrică p = 0,971 Mg/m3.
La topire, rezistivitatea electrică a sodiului crește de 1.451 de ori. Coeficientul de temperatură al rezistenței electrice a sodiului la 273 K a = 4,34-10-3 K -1.
Într-un termocuplu sodiu-platină la o temperatură fierbinte a joncțiunii de 173,16 K, se dezvoltă, i.e. d.s. £=0,29 mV, iar la o temperatură de 373,16 K £=-0,25 mV. Coeficient absolut de ex. d.s. e=-4,4 uV/K. Constanta Hall la temperatura camerei /? = 2,3-10 m3/K și /? = - 2,2-10 m3/K la 371-383 K.
Sensibilitatea magnetică a sodiului x = +0,70 - 10 -9 la 293 K.
Termica si termodinamica. Punctul de topire al sodiului / P l = = 98 ° C, punctul de fierbere? fierbere = 878 ° C, temperatura caracteristică 6v = 160 K, căldura specifică topire DN PL = P7 kJ/kg. Căldura specifică de sublimare la 298 K DYa su bl = 4717 kJ/kg, căldura specifică de evaporare DYA I sp = 3869 kJ/kg. Căldura de vaporizare a sodiului la presiune normală DYAI<-п = 3869 кДж/кг. При плавлении происходит увеличение объема на ДУ- 27,82-Ю -6 м 3 /кг или AV / V 0 = 0,0265. При повышении давления возрастает температура плавления металла, достигая 515 К при 3 ГПа и 608 при 8 ГПа. Начальное значение углового коэффициента dT / dP = 85 К/ГПа, при 7 ГПа 33 К/ГПа. Фазовых превращений в натрии до давления 8,5 ГПа не обнаружено.
Proprietăți mecanice
Duritatea sodiului conform Brinell HB = 0,7 MPa. Modul normal de întindere la temperatura camerei £=5,3 GPa. Compresibilitatea sodiului x = 15,99*10 -11 Pa -1.
Proprietăți chimice
În compușii chimici, inclusiv hidruri, prezintă o stare de oxidare de + 1.
Sodiul este unul dintre cele mai reactive metale și, prin urmare, nu se găsește în natură în forma sa pură. Sodiul este unul dintre cele mai electropozitive metale; interacționează intens cu oxigenul din aer, deci este depozitat de obicei sub un strat de kerosen. În seria de tensiuni, sodiul se află cu mult înaintea hidrogenului și îl înlocuiește din apă, formând astfel hidroxid NaOH.
Când hidrogenul uscat este trecut peste sodiu ușor încălzit, se formează hidrură de sodiu NaH, care este un compus nononic în care sodiul intră ca cation și hidrogenul ca anion.
Oxidul de sodiu se formează atunci când sodiul arde într-o cantitate insuficientă de oxigen, reacționează violent cu apa pentru a forma hidroxid și are o rețea cristalină ca spatul fluor.
Peroxidul de sodiu se formează atunci când sodiul este ars în aer sau oxigen și este o pulbere galben pal care se topește fără a se descompune; agent oxidant foarte puternic. Multe substanțe organice se aprind la contactul cu acesta. Când Na 2 0 2 interacționează cu dioxidul de carbon, se eliberează oxigen. Această reacție este utilizată în aparatele de respirație folosite de pompieri și scafandri, precum și pentru regenerarea aerului în spații închise, cum ar fi submarinele.
Hidroxidul de sodiu NaOH se formează sub formă de cristale albe, foarte higroscopice, topindu-se la 318,3 °C; densitate 2,13 Mg/m3.
Este cunoscut un compus de sodiu cu carbon Na2C2, care poate fi considerat o sare de acetilenă. Prin urmare, a primit denumirea de sodium ace-tnlide. Nitrura de sodiu este stabilă în aer uscat, dar este descompusă instantaneu de apă și alcool pentru a forma amoniac.
Sulfura de sodiu Na 2 S se obţine prin reducerea sulfatului de sodiu cu carbon. În forma sa pură, Na 2 S este incolor și are o rețea cristalină de tip CaF 2. Un compus foarte comun de sodiu cu sulf și oxigen este așa-numita sare Glauber Na 2 S 0 4 - 10H 2 O. Sodiul, împreună cu compușii chimici obișnuiți care respectă regula valenței, formează și compuși metalici. În aliajele sistemului Na-K se formează o fază Laves de compoziție KNa 2, care are un complex o. c. k. rețea cristalină de tip MgCu 2 (C15). Un compus metalic similar este observat atunci când sodiul reacţionează cu cesiul. O serie de compuși metalici se formează prin interacțiunea sodiului cu metalele din grupele I și VII B - argint, aur, zinc, cadmiu, mercur, galiu, staniu, plumb și alte elemente. Există, desigur, și excepții. Astfel, aluminiul, un element al subgrupului SHV, nu interacționează cu sodiul nici în stare lichidă, nici în stare solidă. Subgrupurile elementelor III - VIIIA ale Tabelului Periodic practic nu interacționează cu sodiul din cauza diferenței mari atât a factorului de dimensiune, cât și a punctelor de topire.
Domenii de utilizare
Sodiul este utilizat pe scară largă în diferite domenii ale tehnologiei. Reactivitatea ridicată a acestui element a predeterminat utilizarea sa în metalurgie ca agent reducător pentru producerea sodio-termică a metalelor precum titanul, zirconiul, hafniul, niobiul etc. În producția unor tipuri de aliaje de aluminiu turnate, sodiul și sărurile sale sunt folosite ca modificatori. În industria chimică, sodiul este utilizat în producția de săruri cu cianură, cauciuc sintetic și detergenți sintetici (detergenide), produse farmaceutice, precum și tetraetil de plumb, un agent antidetonant pentru producerea de combustibil cu octan mare pentru motoare. În ultimii ani, utilizarea sodiului pur și a aliajelor sale cu potasiu în energia nucleară ca agenți de răcire s-a extins.
Compușii săi chimici sunt utilizați pe scară largă în economia națională. Acesta este în primul rând hidroxid de sodiu NaOH (sodă caustică), care este utilizat în industria săpunului, în producția de vopsele, în industria celulozei și hârtiei și a uleiului, în producția de fibre artificiale etc. Sodă - carbonat de sodiu Na 2 C 0 3 - este utilizat în sticlă, celuloză și hârtie, alimente, textile, petrol și alte industrii. În agricultură, sarea de sodiu a acidului azotic NaN 0 3, cunoscută sub numele de nitrat chilian, este utilizată pe scară largă ca îngrășământ.
n1.doc
Abstract.
Subiect: „Sodiul și compușii săi”
Introducere………………………………………………………………….………3
Apariția sodiului și a compușilor săi în natură…………….3 – 4
Proprietăți fizice și chimice………………………………………….…….4 – 7
Pregătire și utilizare………………………………………………………….7 – 11
Toxicitate………………………………………………………………………………….11
Referințe…………………………………………………….…….12
Introducere.
Sodiu
– element chimic al subgrupului principal al grupei I a sistemului periodic al lui Mendeleev. Numărul său atomic este 11 și masa atomică este 22,9898. Sodiu– un metal moale alb-argintiu care se oxidează rapid de la suprafață în aer și poate fi tăiat cu ușurință cu un cuțit. Tăierea de sodiu imediat după tăiere are un luciu metalic strălucitor, dar se estompează rapid datorită oxidării extrem de rapide a metalului. Elementul natural constă dintr-un izotop stabil, Na.
Compuși naturali de sodiu (sare de masă NaCl, sodă Na  CO) sunt cunoscute din cele mai vechi timpuri. Nume "sodiu"
, derivat din arabă natrun, greacă nitron, inițial referit la sifon natural. Deja în secolul al XVIII-lea, chimiștii cunoșteau mulți alți compuși ai sodiului. Cu toate acestea, metalul în sine a fost obținut abia în 1807 de către G. Davy prin electroliza sodei caustice NaOH. În Marea Britanie, SUA, Franța, elementul este numit Sodiu(de la cuvântul spaniol soda - soda), în Italia - sodiu.
CO) sunt cunoscute din cele mai vechi timpuri. Nume "sodiu"
, derivat din arabă natrun, greacă nitron, inițial referit la sifon natural. Deja în secolul al XVIII-lea, chimiștii cunoșteau mulți alți compuși ai sodiului. Cu toate acestea, metalul în sine a fost obținut abia în 1807 de către G. Davy prin electroliza sodei caustice NaOH. În Marea Britanie, SUA, Franța, elementul este numit Sodiu(de la cuvântul spaniol soda - soda), în Italia - sodiu.
Apariția sodiului și a compușilor săi în natură.
Sodiu- un element tipic al părții superioare a scoarței terestre. Conținutul său mediu în litosferă este de 2,5% în masă, în roci magmatice acide (granite etc.) 2,77%, în bazal (bazalți etc.) 1,94%, în ultrabazice (roci de manta) 0,57%. Datorită izomorfismului Na  si Ca
si Ca  , datorită apropierii razelor lor ionice, în rocile magmatice se formează feldspați de sodiu-calciu
(plagioclaze)
. În biosferă există o diferențiere accentuată a sodiului: rocile sedimentare sunt în medie sărăcite în sodiu (0,66% în argile și șisturi); există puțin din acesta în majoritatea solurilor (media 0,63%). Numărul total de minerale de sodiu este de 222. Sodiul este slab reținut pe continente și adus de râuri în mări și oceane, unde conținutul său mediu este de 1,035%. N / A– principalul element metalic al mării apă. În timpul evaporării, sărurile de sodiu se depun în lagunele maritime de coastă, precum și în lacurile continentale de stepă și deșerturi, formând straturi de roci purtătoare de sare. Principalele minerale care sunt o sursă de sodiu și compușii săi sunt halit
(sare gema) NaCI,
salitrul chilian
NaNO,
tenardită
NaSO
, datorită apropierii razelor lor ionice, în rocile magmatice se formează feldspați de sodiu-calciu
(plagioclaze)
. În biosferă există o diferențiere accentuată a sodiului: rocile sedimentare sunt în medie sărăcite în sodiu (0,66% în argile și șisturi); există puțin din acesta în majoritatea solurilor (media 0,63%). Numărul total de minerale de sodiu este de 222. Sodiul este slab reținut pe continente și adus de râuri în mări și oceane, unde conținutul său mediu este de 1,035%. N / A– principalul element metalic al mării apă. În timpul evaporării, sărurile de sodiu se depun în lagunele maritime de coastă, precum și în lacurile continentale de stepă și deșerturi, formând straturi de roci purtătoare de sare. Principalele minerale care sunt o sursă de sodiu și compușii săi sunt halit
(sare gema) NaCI,
salitrul chilian
NaNO,
tenardită
NaSO  ,
mirabilite sau glauberian
sare
NaSO
,
mirabilite sau glauberian
sare
NaSO 10
HO,
tron
NaH(CO)2
HO,
borax
NaBO
10
HO,
tron
NaH(CO)2
HO,
borax
NaBO  10
HO, silvinităKCINaCI.
Producția mondială de sodiu este estimată la 110
10
HO, silvinităKCINaCI.
Producția mondială de sodiu este estimată la 110  tone N / A– un bioelement important, materia vie conține în medie 0,02% sodiu. Există mai mult la animale decât la plante. Sodiul este unul dintre principalele elemente implicate în metabolismul mineral al animalelor și al oamenilor. Conținut în principal în lichidele extracelulare (aproximativ 10 mmol/kg în eritrocitele umane, 143 mmol/kg în serul sanguin); Conținutul de sodiu din țesutul vegetal este de aproximativ 0,01% din greutatea umedă.
tone N / A– un bioelement important, materia vie conține în medie 0,02% sodiu. Există mai mult la animale decât la plante. Sodiul este unul dintre principalele elemente implicate în metabolismul mineral al animalelor și al oamenilor. Conținut în principal în lichidele extracelulare (aproximativ 10 mmol/kg în eritrocitele umane, 143 mmol/kg în serul sanguin); Conținutul de sodiu din țesutul vegetal este de aproximativ 0,01% din greutatea umedă.
Proprietati fizice si chimice.
La temperaturi obișnuite, sodiul cristalizează într-o rețea cubică, a = 4,28. Raza atomică 1,86, raza ionică Na 0,92. Densitate 0,968 g/cm  (19,7
(19,7 CT
CT  =97,83С, t
=97,83С, t  =882,9C; capacitate termică specifică (20C) 1,2310 J/(kgK) sau 0,295 cal/(ggrad); coeficient de conductivitate termică 1,3210
=882,9C; capacitate termică specifică (20C) 1,2310 J/(kgK) sau 0,295 cal/(ggrad); coeficient de conductivitate termică 1,3210  W/(mK) sau 0,317 cal/(cmsecgrad); coeficient de temperatură de dilatare liniară (20C) 7.110
W/(mK) sau 0,317 cal/(cmsecgrad); coeficient de temperatură de dilatare liniară (20C) 7.110  rezistivitate electrică (0C) 4.310
rezistivitate electrică (0C) 4.310 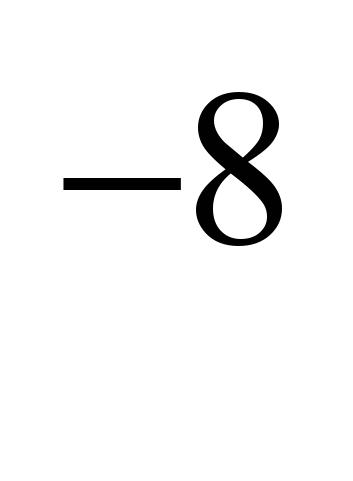 ohmi (4.310
ohmi (4.310  omsm). Sodiul este paramagnetic, susceptibilitate magnetică specifică +9.210; foarte plastic și moale (se taie ușor cu un cuțit).
omsm). Sodiul este paramagnetic, susceptibilitate magnetică specifică +9.210; foarte plastic și moale (se taie ușor cu un cuțit).
Sodiul aparține metalelor alcaline, deoarece oxidul său este puternic bazic în natură, iar hidroxidul pe care îl formează este un electrolit puternic - un alcalin. Potențialul normal al electrodului de sodiu este de -2,714 V; Potențialul electrodului din topitură este de 2,4 V. Vaporii de sodiu colorează flacăra într-o culoare galben strălucitor caracteristică ( reacție calitativă la cationii metalelor alcaline). Configurația electronică a atomului de sodiu 1
s2
s2
p  3
s
3
s  .
Sodiul, ca toate metalele alcaline, are unul s-un electron pe stratul exterior de electroni, care se pierde cu ușurință în timpul reacțiilor chimice, expunând stare de oxidare +1
(În toți compușii cunoscuți, sodiul este monovalent). De aceea N / Aesteagent reducător puternic
. În stare solidă, conduce bine electricitatea. Deoarece sodiul este fuzibil și se oxidează rapid în aer, este depozitat fără acces la aer și umiditate, cel mai adesea sub kerosen. Sodiul formează compuși cu predominant legătură ionică, care sunt în general solubile în apă și se disociază ușor în ioni. Formarea de complexe stabili nu este tipică pentru ionii de metale alcaline. Activitatea chimică a sodiului este foarte mare. Din soluție cristalizează un număr de săruri sub formă de hidrați cristalini: NaSO
.
Sodiul, ca toate metalele alcaline, are unul s-un electron pe stratul exterior de electroni, care se pierde cu ușurință în timpul reacțiilor chimice, expunând stare de oxidare +1
(În toți compușii cunoscuți, sodiul este monovalent). De aceea N / Aesteagent reducător puternic
. În stare solidă, conduce bine electricitatea. Deoarece sodiul este fuzibil și se oxidează rapid în aer, este depozitat fără acces la aer și umiditate, cel mai adesea sub kerosen. Sodiul formează compuși cu predominant legătură ionică, care sunt în general solubile în apă și se disociază ușor în ioni. Formarea de complexe stabili nu este tipică pentru ionii de metale alcaline. Activitatea chimică a sodiului este foarte mare. Din soluție cristalizează un număr de săruri sub formă de hidrați cristalini: NaSO  10HO, NaCO
10HO, NaCO  10HO, NaBO
10HO, NaBO  10HO, care sunt tectohidrați în structură. Tectohidrații au structura gheții, în cavitățile căreia ionii încărcați opus sunt distribuiți uniform.
10HO, care sunt tectohidrați în structură. Tectohidrații au structura gheții, în cavitățile căreia ionii încărcați opus sunt distribuiți uniform.
Proprietăți chimice:
Interacțiunea cu substanțe simple:
1) Reacția cu halogeni: 2Na + CI= 2NaCI (clorura de sodiu)
Sodiul interacționează cu fluorul și clorul direct la temperaturi obișnuite (arde viguros în clor, ceea ce este deosebit de bine de observat într-un tub de clorură de calciu în care trece un curent de clor prin sodiu topit și foarte încălzit), cu brom - doar când este încălzit ; nu se observă nicio interacțiune directă cu iodul.
Clorura de sodiu(sare) NaCI
cristalizează sub formă de cristale cubice, nu are miros, are gust sărat și este foarte solubil în apă. Solubilitatea sa rămâne aproape neschimbată odată cu schimbările de temperatură. Acest lucru este de o importanță deosebită atunci când izolarea sării de masă din soluții de alte săruri prin recristalizare.
2) Reacția cu oxigenul: 4Na + O= 2NaO (oxid de sodiu)
2Na + O= NaO (peroxid de sodiu)
La interacțiunea directă cu oxigenul, în funcție de condiții, se formează oxid de NaO (oxidare în cantitate mică de oxigen la o temperatură de aproximativ 180C) sau peroxid de NaO - substanțe cristaline incolore. Oxid de sodiu– o substanță solidă higroscopică care interacționează ușor cu apa și are un caracter puternic bazic. Când interacționează cu apa, formează un alcali (sodă caustică):
NaO +HO = 2NaOH
Hidroxid de sodiu sau hidroxid de sodiu NaOH este un compus de sodiu foarte important. Se mai numește și sodă caustică sau pur și simplu caustică. Pentru a obține soda caustică se folosește sare de masă - cel mai ieftin compus natural de sodiu. Această sare este supusă electrolizei, dar în acest caz nu se folosește o topitură, ci o soluție de sare. Caustic sodiul este un solid cristalin alb, foarte solubil în apă. Când soda caustică este dizolvată în apă, se eliberează o cantitate mare de căldură, iar soluția devine foarte fierbinte. Soda caustică trebuie depozitată în recipiente bine închise pentru a o proteja de pătrunderea vaporilor de apă, sub influența cărora poate deveni foarte umedă, precum și monoxidul de carbon (IV), sub influența căruia soda caustică se poate transforma treptat. în carbonat de sodiu:
2NaOH + CO = NaCO +HO
Peroxid de sodiu(pulbere gălbuie) este un agent oxidant puternic. Când este expus la apă, formează alcali și peroxid de hidrogen (dacă procesul se desfășoară cu încălzire, oxigenul este eliberat din cauza descompunerii HO):
NaO+2HO = HO + 2NaOH
Când acizii diluați acționează asupra peroxidului de sodiu, se formează peroxid de hidrogen: NaO + HSO = NaSO + HO
Peroxidul de sodiu reacţionează cu dioxidul de carbon atmosferic conform ecuaţiei:
2NaO + 2CO= 2NaCO +O
Prin urmare, este utilizat în aparatele de respirație pentru regenerarea aerului - absorbția monoxidului de carbon (IV) și eliberarea de oxigen.
În aer, sodiul se oxidează instantaneu. Prin urmare, este depozitat sub un strat de solvenți organici (kerosen sau parafină, iar parafina este de preferat, deoarece o anumită cantitate de aer încă se dizolvă în kerosen și oxidarea sodiului, deși lent, are loc).
În reacțiile cu halogeni și oxigen, sodiul își manifestă cel mai viguros abilități reducătoare.
3) Reacția cu sulful: 2Na + S = NaS (sulfura de sodiu)
Când măcinat într-un mortar cu sulf, sodiul reacţionează violent, formând sulfură de sodiu. Reacția este însoțită de focare, așa că ar trebui să țineți mortarul departe de ochi și să vă înfășurați mâna într-un prosop. Pentru reacție, luați bucăți mici de sodiu.
4) Reacția cu azotul: 6Na + N= 2NaN (nitrură de sodiu)
Interacțiunea vaporilor de sodiu cu azotul în câmpul unei descărcări electrice liniștite duce la formarea nitrurii de sodiu.
5) Reacția cu carbonul: 2Na + C = NaC
(carbură de sodiu)
Interacțiunea vaporilor de sodiu cu carbonul la 800-900C duce la producerea de carbură de NaC.
6) Reacția cu fosforul: 3Na + P = NaP (fosfura de sodiu)
7) Reacția cu hidrogenul: 2Na + H= 2NaH (hidrură de sodiu)
Reacția sodiului cu hidrogenul începe la 200C și duce la producerea de hidrură. NaH – o substanță cristalină higroscopică incoloră. Acesta este un compus asemănător sării, care, în ceea ce privește natura legăturii chimice și gradul de oxidare, diferă de compușii volatili cu hidrogen ai elementelor principalelor subgrupe ale grupelor IV - VII.
Sodiul este un agent reducător puternic, deci reduce hidrogenul la starea de oxidare –1.
Interacțiunea cu substanțe complexe:
1) Cu acizi: 2Na + 2HCI = 2NaCI +H 
În seria de tensiune electrochimică a metalelor, sodiul vine înaintea hidrogenului, deci reduce ionii de hidrogen din acizii diluați.
Acizii minerali formează săruri solubile în apă corespunzătoare cu sodiul, dar sodiul este relativ inert în raport cu acidul sulfuric 98-100%.
2) Cu soluții apoase de săruri:
Sodiul, ca metal cu proprietăți reducătoare puternice, în aceste condiții va reduce hidrogenul apei, și nu metalul sării corespunzătoare.
3) Cu apă: 2Na + 2HOH = 2NaOH + H
Sodiul reacționează cu apa, deplasând hidrogenul din aceasta (deoarece este un metal foarte activ, în seria de tensiuni este mult la stânga hidrogenului), în condiții normale, iar ca urmare a acestei reacții, baza solubilă în apă NaOH se formează și se eliberează H; reacția poate fi însoțită de o explozie.
4) Cu amoniac:
Sodiul se dizolvă în amoniac lichid (34,6 g la 100 g NH la 0C) pentru a forma complexe de amoniac. Când amoniacul gazos este trecut prin sodiu topit la 300-350C, se formează amida de sodiuNaNH- o substanta cristalina incolora, usor descompusa de apa.
5) Cu alcooli: 2CHOH + 2Na = 2CHONa + H 
Când sodiul reacţionează cu alcoolii, hidrogenul hidroxil este înlocuit cu sodiu pentru a forma alcoolaţi (etoxid de sodiu).
Se cunosc un număr mare de compuși organosodici, care în proprietăți chimice sunt foarte asemănătoare cu compușii organolitici, dar sunt superiori acestora ca reactivitate. Compușii organosodici sunt utilizați în sinteza organică ca agenți de alchilare.
Aliaje
.
Sodiul este o componentă a multor aliaje practic importante. Aliajele Na – K, care conțin 40-90% K (în greutate) la o temperatură de aproximativ 25C, sunt lichide de culoare alb-argintie, caracterizate prin activitate chimică ridicată, inflamabile în aer. Conductivitatea electrică și conductibilitatea termică a aliajelor lichide Na-K sunt mai mici decât valorile corespunzătoare pentru Na și K. Amalgame de sodiu se obține ușor prin introducerea de sodiu metalic în mercur; cu un conținut de peste 2,5% Na (în greutate) la temperaturi obișnuite sunt deja substanțe solide.
Chitanța și cererea.
Principala metodă industrială de producere a sodiului este electroliza topiturii sare de masăNaCIcare conțin aditiviKCI,
NaF,
CaCIși altele (piroelectrometalurgie), care reduc punctul de topire al sării la 575-585C. Electroliza NaCI pur ar duce la pierderi mari de sodiu din evaporare, deoarece punctele de topire ale NaCI (801C) și punctele de fierbere ale Na (882,9C) sunt foarte apropiate. Electroliza se realizează în electrolizoare cu diafragmă (spațiile anodului și catodic sunt separate printr-o diafragmă, care izolează clorul rezultat de sodiu, astfel încât să nu aibă loc o reacție inversă), catozii sunt din fier sau cupru, anozii sunt din grafit. Clorul este produs simultan cu sodiul. Electrozii sunt scufundați în sare topită. Ionul de sodiu pozitiv acceptă un electron din catod și devine un atom de sodiu neutru. Atomii de sodiu neutri se colectează la catod sub formă de metal topit. Procesul care are loc la catod poate fi reprezentat prin diagrama: N / A+


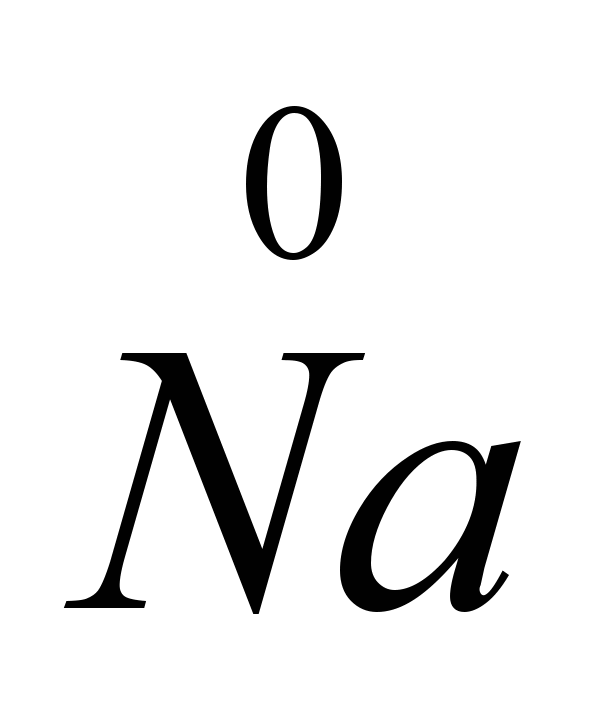
Deoarece acceptarea electronilor are loc la catod și orice acceptare a electronilor de către un atom sau ion este o reducere, ionii de sodiu la catod sunt reduse. La anod, ionii de clor renunță la electroni, adică. are loc procesul de oxidare și eliberare a clorului liber, care poate fi reprezentat prin următoarea diagramă: C.I.  -
-
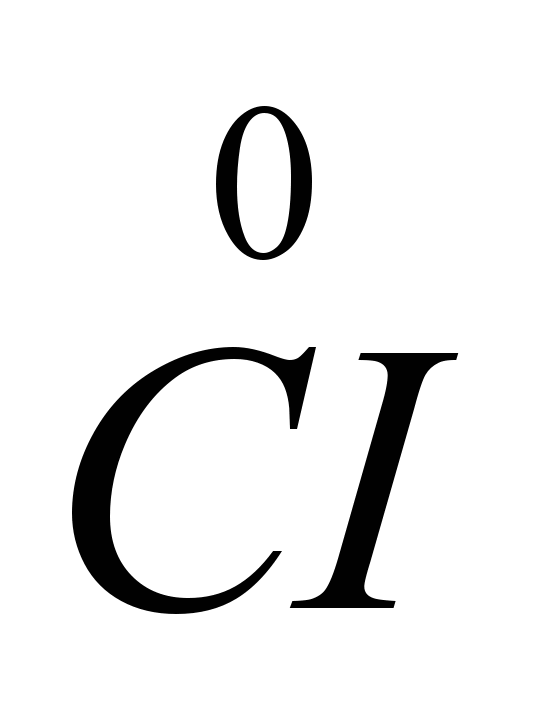
S-a păstrat și vechea metodă de obținere a sodiului - electroliza sodei caustice topiteNaOH, care este mult mai scump decât NaCI, dar se descompune electrolitic la o temperatură mai scăzută (320-330C).
Sodiul și aliajele sale sunt utilizate pe scară largă ca agenți de răcire pentru procesele care necesită încălzire uniformă în intervalul 450-650C - în supapele motoarelor de aeronave și în special în centralele nucleare. În ultimul caz, aliajele Na–K servesc ca lichide de răcire a metalelor (ambele elemente au secțiuni transversale mici de absorbție a neutronilor termici, pentru barn Na 0,49); aceste aliaje se caracterizează prin puncte de fierbere ridicate și coeficienți de transfer de căldură și nu interacționează cu materialele structurale la temperaturi ridicate dezvoltate în reactoarele nucleare. Compusul NaPb (10% Na în greutate) este utilizat în producție plumb tetraetil– cel mai eficient agent antidetonant. În aliajul pe bază de plumb (0,73% Ca, 0,58% Na și 0,04% Li) utilizat pentru fabricarea rulmenților de osie pentru vagoane de cale ferată, sodiul este un aditiv de întărire. În metalurgie, sodiul servește ca agent reducător activ în producerea unor metale rare (Ti, Zr, Ta) prin metode metaloterme; în sinteza organică - în reacții de reducere, condensare, polimerizare etc. Uneori, sodiul este înlocuit în electrotehnică cu cuprul, care este de 9 ori mai greu decât acest metal; Barele colectoare pentru curenți mari sunt realizate din țevi de oțel umplute cu sodiu. Primul cauciuc sintetic din lume, obținut în 1928 de academicianul S.V. Lebedev, a fost numit cauciuc butadien de sodiu, deoarece sodiul a fost catalizatorul pentru polimerizarea butadienei. Sodiul este utilizat ca agent reducător în sinteza organică, în special pentru reducerea acizilor grași în alcooli superiori utilizați la producerea detergenților sintetici.
Cel mai frecvent utilizat preparat de sodiu în medicină este sulfat de sodiuNaSO, clorurăNaCI(pentru pierderi de sânge, pierderi de lichide, vărsături etc.), boratNaBO10
HO(ca antiseptic) bicarbonatNaHCO(ca expectorant, precum și pentru spălare și clătire pentru rinită, laringită, diabet etc.), tiosulfatNaSO (sodă) este necesar pentru producția de sticlă, aluminiu, detergenți și vopsele).
NaCIO + HO + CO= NaHCO +HCIO
NaOH Se mai foloseste in industria hartiei, in fabricarea sapunului, in productia de fibre artificiale, in galvanoplastie, pentru purificarea produselor petroliere si a fractiunilor de gudron de carbune. NaOH este utilizat pentru curățarea alcalină a fructelor și legumelor (rădăcinoase, citrice, roșii etc.), care este facilitată datorită hidrolizei alcaline a anumitor substanțe, ducând la întreruperea conexiunii dintre coajă și pulpă. O soluție puternică de NaOH este utilizată pentru a curăța cazanele și radiatoarele de calcar. Clorura de sodiu NaCI utilizat în industria chimică pentru a produce clor, sodă caustică, sodă, înălbitor, unele tipuri de materiale plastice și compuși organici. Nitrat de sodiuNaNO folosit ca îngrășământ mineral. Silicat de sodiuNaSiO - unul dintre puținii silicați solubili în apă. El este numit sticla solubila, iar soluția este sticla lichida. Lemnul și țesăturile sunt impregnate cu sticlă solubilă pentru a le proteja de aprindere. Sticla lichidă este inclusă în chiturile ignifuge pentru lipirea sticlei, porțelanului și pietrei. Nitrat de sodiuNaNO folosit ca inhibitor care încetinește coroziunea oțelului în soluții de apă și sare (creează o peliculă protectoare pe suprafața metalului).
Amida de sodiuNaNH, obținut prin reacția amoniacului lichid cu sodiu, este necesar pentru producerea colorantului albastru - indigo și vitamina A.
Mai ales peroxid de sodiuNaO folosit pentru albirea hârtiei și regenerarea aerului în submarine; anterior a fost folosit pe scară largă pentru albirea pălăriilor de paie.
Pentru a determina conținutul de umiditate al substanțelor organice, acestea sunt amestecate cu amalgam de sodiu (soluție în mercur). Ca urmare a interacțiunii cu apa, se eliberează o cantitate echivalentă de H, al cărei volum este utilizat pentru a determina conținutul de umiditate din proba prelevată.
Astfel de compuși de sodiu sunt utilizați pe scară largă în viața de zi cu zi ca sareNaCI Și sifonNaCO. Necesarul zilnic de clorură de sodiu al unei persoane variază de la 2 la 10 g și depinde de cantitatea de sare pierdută prin transpirație.
Izotopi radioactivi produși artificial  Na (timp de înjumătățire T
Na (timp de înjumătățire T  =2,64 g) și
=2,64 g) și 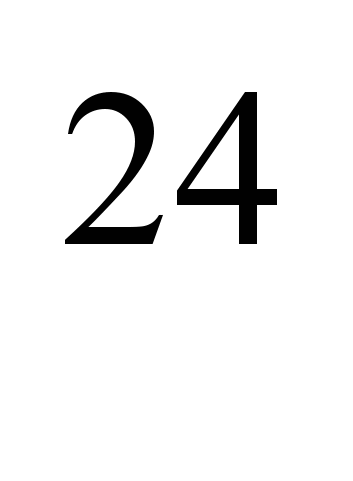 Na (T= 15 h) este utilizat pentru determinarea vitezei fluxului sanguin în anumite părți ale sistemului circulator în boli cardiovasculare și pulmonare, endarterita obliterantă etc. Pentru a determina, de asemenea, se folosesc soluții radioactive de săruri de sodiu (de exemplu, NaCI). permeabilitatea vasculară, studiază conținutul metabolic total de sodiu din organism, metabolismul apă-sare, absorbția din intestine, procesele activității nervoase și în alte studii experimentale.
Na (T= 15 h) este utilizat pentru determinarea vitezei fluxului sanguin în anumite părți ale sistemului circulator în boli cardiovasculare și pulmonare, endarterita obliterantă etc. Pentru a determina, de asemenea, se folosesc soluții radioactive de săruri de sodiu (de exemplu, NaCI). permeabilitatea vasculară, studiază conținutul metabolic total de sodiu din organism, metabolismul apă-sare, absorbția din intestine, procesele activității nervoase și în alte studii experimentale.
Sodiul este unul dintre principalele elemente implicate în metabolismul mineral al animalelor și al oamenilor. Participă la întreținere presiune osmoticaȘi echilibrul acido-bazic, în conducerea impulsurilor nervoase. Concentrația ionilor de sodiu în organism este reglată în principal de hormonul cortexului suprarenal - aldosteronului. În ciuda conținutului relativ ridicat de sodiu din țesuturile plantelor (aproximativ 0,01% din greutatea umedă), rolul său în viața plantelor nu este bine înțeles. U halofite(specie care crește pe soluri foarte saline) sodiul creează o presiune osmotică ridicată în seva celulară și, prin urmare, promovează extragerea apei din sol.
Toxicitate.
Datorită activității chimice ridicate a sodiului, manipularea acestuia necesită prudență. Contactul cu sodiul prin apă este deosebit de periculos, care poate duce la incendiu și explozie. Ochii trebuie protejați cu ochelari de protecție, mâinile cu mănuși groase de cauciuc; Contactul sodiului cu pielea sau îmbrăcămintea umedă poate provoca arsuri grave.
Un foc de metal alcalin nu poate fi stins cu apă. Cel mai bine este să-l umpleți cu pulbere de sodă.
Soda caustică poate provoca arsuri grave dacă intră în contact cu pielea, așa că alcalii cristalin nu trebuie luate cu mâinile, ci doar cu clești sau pensete. Dacă o soluție alcalină ajunge pe piele, trebuie mai întâi să spălați soluția până când senzația de săpun dispare cu o cantitate mare de apă, apoi să o neutralizați cu o soluție de acid boric.
Bibliografie.
Sittig M. „Sodiu, producția, proprietățile și aplicațiile sale”, trad. din engleză, 1961.
- Ripan R., Ceteanu I. „Chimie anorganică”, vol. 1, trad. din română, 1971.
Pavlov N.N. „Chimie generală și anorganică”, editura „Drofa”, 2002.
Kryuchkova-Chernobelskaya G.M. „Chimie anorganică”, ed. a III-a, Editura „Medicina”, 1980.
SODIU- (Natrium) Na, un element chimic din grupa I (Ia) din Tabelul Periodic, aparține elementelor alcaline. Numărul atomic 11, masa atomică relativă 22,98977. În natură există un izotop stabil 23 Na. Sunt cunoscuți șase izotopi radioactivi ai acestui element, dintre care doi sunt de interes pentru știință și medicină. Sodiu-22, cu un timp de înjumătățire de 2,58 ani, este folosit ca sursă de pozitroni. Sodium-24 (timp de înjumătățire este de aproximativ 15 ore) este utilizat în medicină pentru diagnosticul și tratamentul unor forme de leucemie.
Stare de oxidare +1.
Compușii de sodiu sunt cunoscuți din cele mai vechi timpuri. Clorura de sodiu este o componentă esențială a alimentelor umane. Se crede că oamenii au început să-l folosească în neolitic, adică. acum vreo 5-7 mii de ani.
Vechiul Testament menționează o substanță numită „neter”. Această substanță a fost folosită ca detergent. Cel mai probabil, neter este soda, un carbonat de sodiu care s-a format în lacurile sărate egiptene cu maluri calcaroase. Autorii greci Aristotel și Dioscoride au scris mai târziu despre aceeași substanță, dar sub numele de „nitron”, iar istoricul roman antic Pliniu cel Bătrân, menționând aceeași substanță, a numit-o „nitrum”.
În secolul al XVIII-lea Chimiștii cunoșteau deja o mulțime de compuși diferiți ai sodiului. Sărurile de sodiu au fost utilizate pe scară largă în medicină, în tăbăcirea pieilor și în vopsirea țesăturilor.
Sodiul metalic a fost obținut pentru prima dată de chimistul și fizicianul englez Humphry Davy prin electroliza hidroxidului de sodiu topit (folosind o coloană voltaică de 250 de perechi de plăci de cupru și zinc). Denumirea „sodiu” aleasă de Davy pentru acest element reflectă originea sa din soda Na 2 CO 3 . Denumirile latină și rusă ale elementului sunt derivate din arabul „natrun” (sodă naturală).
Distribuția sodiului în natură și extracția sa industrială.
Sodiul este al șaptelea element cel mai abundent și al cincilea cel mai abundent metal (după aluminiu, fier, calciu și magneziu). Conținutul său în scoarța terestră este de 2,27%. Cea mai mare parte a sodiului se găsește în diferiți aluminosilicați.
Depozite uriașe de săruri de sodiu în formă relativ pură există pe toate continentele. Ele sunt rezultatul evaporării mărilor antice. Acest proces este încă în desfășurare în Salt Lake (Utah), Marea Moartă și în alte locuri. Sodiul se găsește sub formă de clorură de NaCl (halit, sare gemă), precum și carbonat Na 2 CO 3 NaHCO 3 2H 2 O (trona), azotat NaNO 3 (salpetru), sulfat Na 2 SO 4 10H 2 O (mirabilitate). ), tetraborat Na 2 B 4 O 7 10 H 2 O (borax) şi Na 2 B 4 O 7 4H 2 O (kernit) şi alte săruri.
Există rezerve inepuizabile de clorură de sodiu în saramurele naturale și apele oceanice (aproximativ 30 kg m -3). Se estimează că sarea gemă într-o cantitate echivalentă cu conținutul de clorură de sodiu din Oceanul Mondial ar ocupa un volum de 19 milioane de metri cubi. km (cu 50% mai mult decât volumul total al continentului nord-american deasupra nivelului mării). O prismă a acestui volum cu o suprafață de bază de 1 mp. km poate ajunge pe Lună de 47 de ori.
Acum, producția totală de clorură de sodiu din apa de mare a ajuns la 6-7 milioane de tone pe an, ceea ce reprezintă aproximativ o treime din producția totală mondială.
Materia vie conține în medie 0,02% sodiu; Există mai mult la animale decât la plante.
Caracteristicile unei substanțe simple și producția industrială de sodiu metalic.
Sodiul este un metal alb-argintiu, în straturi subțiri cu o tentă violet, plastic, chiar moale (tăiat ușor cu un cuțit), o tăietură proaspătă de sodiu este strălucitoare. Valorile conductivității electrice și ale conductivității termice a sodiului sunt destul de mari, densitatea este de 0,96842 g/cm 3 (la 19,7 ° C), punctul de topire este de 97,86 ° C, punctul de fierbere este de 883,15 ° C.
Aliajul ternar, care conține 12% sodiu, 47% potasiu și 41% cesiu, are cel mai scăzut punct de topire pentru sistemele metalice, egal cu -78 ° C.
Sodiul și compușii săi colorează flacăra în galben strălucitor. Linia dublă din spectrul de sodiu corespunde tranziției 3 s 1-3p 1 în atomii elementului.
Activitatea chimică a sodiului este ridicată. În aer, devine rapid acoperit cu o peliculă dintr-un amestec de peroxid, hidroxid și carbonat. Sodiul arde în oxigen, fluor și clor. Când un metal este ars în aer, se formează peroxid de Na 2 O 2 (cu un amestec de oxid de Na 2 O ).
Sodiul reacționează cu sulful atunci când este măcinat într-un mortar și reduce acidul sulfuric la sulf sau chiar sulfură. Dioxidul de carbon solid („gheață carbonică”) explodează la contactul cu sodiul (extinctoarele cu dioxid de carbon nu pot fi folosite pentru a stinge un incendiu cu sodiu!). Cu azot, reacția are loc numai într-o descărcare electrică. Sodiul nu interacționează doar cu gazele inerte.
Sodiul reacţionează activ cu apa:
2Na + 2H2O = 2NaOH + H2
Căldura eliberată în timpul reacției este suficientă pentru a topi metalul. Prin urmare, dacă o bucată mică de sodiu este aruncată în apă, aceasta se topește datorită efectului termic al reacției și o picătură de metal, care este mai ușoară decât apa, „curge” de-a lungul suprafeței apei, condusă de forța reactivă. a hidrogenului eliberat. Sodiul reacționează mult mai calm cu alcoolii decât cu apa:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2
Sodiul se dizolvă ușor în amoniacul lichid pentru a forma soluții metastabile de un albastru strălucitor, cu proprietăți neobișnuite. La -33,8°C, până la 246 g de sodiu metalic se dizolvă în 1000 g de amoniac. Soluțiile diluate sunt albastre, soluțiile concentrate sunt bronzul. Ele pot fi păstrate aproximativ o săptămână. S-a stabilit că în amoniacul lichid, sodiul ionizează:
Constanta de echilibru a acestei reacții este 9,9·10 -3. Electronul ieșitor este solvatat de molecule de amoniac și formează un complex -. Soluțiile rezultate au conductivitate electrică metalică. Când amoniacul se evaporă, metalul original rămâne. Când soluția este depozitată pentru o perioadă lungă de timp, se decolorează treptat datorită reacției metalului cu amoniacul pentru a forma amida NaNH 2 sau imida Na 2 NH și eliberarea de hidrogen.
Sodiul este depozitat sub un strat de lichid deshidratat (kerosen, ulei mineral) și transportat numai în recipiente metalice închise.
Metoda electrolitică pentru producția industrială de sodiu a fost dezvoltată în 1890. Electroliza a fost efectuată pe hidroxid de sodiu topit, ca în experimentele lui Davy, dar folosind surse de energie mai avansate decât coloana voltaică. În acest proces, împreună cu sodiul, se eliberează oxigen:
anod (nichel): 4OH - - 4e - = O2 + 2H2O.
În timpul electrolizei clorurii de sodiu pure apar probleme serioase, asociate, în primul rând, cu punctul de topire apropiat al clorurii de sodiu și punctul de fierbere al sodiului și, în al doilea rând, cu solubilitatea ridicată a sodiului în clorură de sodiu lichidă. Adăugarea de clorură de potasiu, fluorură de sodiu, clorură de calciu la clorura de sodiu vă permite să reduceți temperatura de topire la 600° C. Producerea de sodiu prin electroliza unui amestec eutectic topit (un aliaj de două substanțe cu cel mai mic punct de topire) 40% NaCl și 60% CaCl 2 la ~580° C într-o celulă dezvoltată de inginerul american G. Downs, a fost începută în 1921 de către DuPont lângă centrala electrică de la Cascada Niagara.
Pe electrozi au loc următoarele procese:
catod (fier): Na + + e - = Na
Ca 2+ + 2e - = Ca
anod (grafit): 2Cl - - 2e - = Cl 2.
Metalele de sodiu și calciu se formează pe un catod cilindric de oțel și sunt ridicate de un tub răcit în care calciul se solidifică și cade înapoi în topitură. Clorul generat la anodul central de grafit este colectat sub acoperișul de nichel și apoi purificat.
În prezent, volumul de producție de sodiu metalic este de câteva mii de tone pe an.
Articole similare
-
Îngrijire de urgență pentru cactuși Resuscitarea și tratamentul cactușilor
Chirurgie de urgență. Cum să salvezi un cactus putred? Semne externe ale bolilor cactusilor, care ar trebui să vă alerteze și să vă determine să studiați specimenul mai detaliat. Cactusul „a devenit palid”, epiderma a început să se îngălbenească și s-a oprit...
-
Cum să eliminați hogweed de pe site
Sfârșitul lunii iunie, momentul în care vrei să evadezi din oraș în natură, să alergi printr-un câmp, să culegi flori, să-ți scufundi capul într-un râu. Spune să ne relaxăm și să ne bucurăm de natură, iar aici ne așteaptă, fluturând primitor un buchet alb....
-
Cactusul Zeko își pierde frunzele ce să facă
Este general acceptat că cactușii sunt cele mai ușor de îngrijit. De parcă chiar și un grădinar fără experiență ar putea crește un animal de companie înțepător fără probleme. Până la urmă, cu toată înfățișarea lui arată: „Sunt o plantă puternică și sănătoasă, bolile nu sunt ale mele,...
-
Țesuturi de semințe și semințe oleaginoase țesuturi tegumentare – învelișuri de fructe și semințe
Semințele plantelor oleaginoase sunt formațiuni multicelulare complexe construite din mai multe tipuri de țesuturi. Țesutul este o colecție de celule care îndeplinesc o funcție specifică în corpul plantei și sunt similare ca structură. Țesături...
-
Ce reprezintă fructul? Făt. Structura fructului. Clasificarea fructelor. Fructe suculente și uscate. Inima îi bate deja
FRUIT, a (fructul învechit), plural. ы́, m. 1. Parte a unei plante care se dezvoltă dintr-o floare (în principal din ovar) ca urmare a polenizării și care conține semințe (bot.). Fructe cu o singură sămânță, cu mai multe semințe. 2. Partea comestibilă suculentă a anumitor plante...
-
Taraxacum officinale (Taraxacum) - păpădie Dandelion officinalis descrierea botanică a plantei
Papadie - Taraxacum officinale Wigg. s.l. - o plantă erbacee perenă din familia Asteraceae, sau Composifae, cu rădăcina pivotantă cărnoasă care pătrunde adânc în sol (până la 60 cm)....
