Najviša i najniža oksidaciona stanja natrijuma. Natrijum i njegova jedinjenja - fajl n1.doc
Opće informacije i metode dobijanja
Natrijum (Na) je srebrno-beli alkalni metal koji brzo tamni na vazduhu kada je izložen normalnim uslovima. Sadržaj u zemljine kore 2,5% (težinski). U vodama svjetskih okeana njegova prosječna koncentracija je 1,035%. Živi organizmi sadrže do 0,02% (težinski) natrijuma, njegov sadržaj u biljkama je nešto manji.
Poznato je da više od 220 minerala sadrži natrijum. Najčešći su natrijum hlorid, ili kuhinjska so, NaCl, halit NaCl, ili kamena so, čileanska salitra NaN 0 3, thenardite Na 2 S 04, mirabolit (Glauberova so) Na 2 SCv 10H 2 O, trona Na, H (C 0 3) 2 -2 H 2 0, itd.
Natrijum je takođe prisutan u nizu složenijih minerala koji sadrže aluminijum, silicijum, sumpor i druge elemente. Na primjer, u jafelinu Na [ A ] Si 0 4 ], lapis lazuli (ultramarin) Na 3 [ Al 3 Si 3 0| 2] Na 2 [S 0 4], jadeit NaCl [Si 2 0 6], itd.
Brojna jedinjenja natrijuma, prvenstveno kuhinjska so i soda Na 2 C 0 3 10H 2 O, poznata su čoveku od davnina.
IN drevni Egipat bio je poznat deterdžent (soda) koji se zvao neter. Kod Aristotela se to zove vixpovj, a kod Plutarha ( Drevni Rim) - nitrum. U rukopisima arapskih alhemičara, izraz natron odgovara sodi, od koje se postepeno u 17.-18. formira se pojam “natra”, tj. baza iz koje se može dobiti kuhinjska so. Iz "natre" je došao moderno ime element. Treba napomenuti da u nizu zemalja zapadna evropa(Velika Britanija, Francuska, Italija), kao i SAD, natrijum se naziva natrijum.
Metalni natrijum je prvi put dobio engleski hemičar Dewi 1807. godine kao rezultat elektrolize ( alkalna metoda). Zbog visokog energetskog intenziteta, alkalna metoda je postala industrijalizovana tek krajem 19. veka. Ranije se dobijao metalni natrijum hemijska redukcija njegova jedinjenja sa ugljenikom ili rastopljenim livenim gvožđem na visoke temperature. Od prve četvrtine ovog veka alkalna metoda je postepeno zamenjena metodom soli, odnosno elektrolizom direktno taline natrijum hlorida, zaobilazeći fazu proizvodnje alkalija. Elektroliza rastaljene soli vrši se na 850-860 K. Da bi se smanjila tačka topljenja NaCl, koristi se dodavanje niza soli, posebno NaF, KCl, CaClg, itd. Elektrolizom natrijum hlorida, drugi vrijedan proizvod- gasni hlor. Stoga je trenutno solna metoda proizvodnje natrijuma praktički zamijenila alkalnu, a da ne spominjemo kemijske metode.
Fizička svojstva
Atomske karakteristike. Atomski broj 11, atomska masa 22,98977 a. e.m., atomska zapremina 23,08* 10 -6 m 3 /mol. Atomski radijus (metalni) 0,192 nm, ionski radijus Na + 0,098 nm, kovalentni polumjer 0,157 nm. Konfiguracija vanjskih elektronskih omotača atoma je 2 p 6 3 s 1. Natrijum ima jedan stabilan izotop, 23 Na; pet poznatih radioaktivnih izotopa sa masenim brojevima od 20 do 25; Vreme poluraspada izotopa varira od hiljaditih delova sekunde (20 Na) do 2,6 godina za 22 Na. Na sobnoj temperaturi, natrijum ima oko. c. k.rešetka sa periodom a = 0,42905 nm; energije kristalna rešetka 108,8 µJ/kmol. At niske temperature Postoji modifikacija natrijuma sa g.p.u. strukture, čiji periodi na 5K: a = 0,3767 nm, c = 0,6154 nm. Jonizacijski potencijali atoma natrija J (eV) 5,138, 47,20, 71,8, elektronegativnost 0,9. Radna funkcija elektrona φ 0 = 2,35 eV. Radna funkcija elektrona za različite površine jednog kristala je φ -2,75 eV za (100), φ = 3,10 eV za (110), φ = 2,65 eV za (111).
Gustina. Na sobnoj temperaturi, gustina rendgenskih zraka natrijuma p = 0,966 Mg/m 3 , piknometrijska gustina p = 0,971 Mg/m 3 .
Prilikom topljenja, električna otpornost natrijuma se povećava za 1.451 puta. Temperaturni koeficijent električnog otpora natrijuma na 273 K a = 4,34-10-3 K -1.
U termoparu natrijum-platina na temperaturi vrućeg spoja od 173,16 K razvija se tj. d.s. £=0,29 mV, a na temperaturi od 373,16 K £=-0,25 mV. Apsolutni koeficijent tj. d.s. e=- 4,4 µV/K. Holova konstanta na sobnoj temperaturi /? = 2,3-10 m 3 /K i /? = - 2,2-10 m 3 /K na 371-383 K.
Magnetna osetljivost natrijuma x = +0,70 - 10 -9 na 293 K.
Toplotni i termodinamički. Tačka topljenja natrijuma / P l = = 98 °C, tačka ključanja? ključanja = 878 °C, karakteristična temperatura 6v = 160 K, specifična toplota topljenje DN PL = P7 kJ/kg. Specifična toplota sublimacije na 298 K DYa su bl = 4717 kJ/kg, specifična toplota isparavanja DYA I sp = 3869 kJ/kg. Toplota isparavanja natrijuma pri normalan pritisak DYAI<-п = 3869 кДж/кг. При плавлении происходит увеличение объема на ДУ- 27,82-Ю -6 м 3 /кг или AV / V 0 = 0,0265. При повышении давления возрастает температура плавления металла, достигая 515 К при 3 ГПа и 608 при 8 ГПа. Начальное значение углового коэффициента dT / dP = 85 К/ГПа, при 7 ГПа 33 К/ГПа. Фазовых превращений в натрии до давления 8,5 ГПа не обнаружено.
Mehanička svojstva
Tvrdoća natrijuma prema Brinellu HB = 0,7 MPa. Normalni modul zatezanja na sobnoj temperaturi £=5,3 GPa. Kompresibilnost natrijuma x = 15,99*10 -11 Pa -1.
Hemijska svojstva
U hemijskim jedinjenjima, uključujući hidride, pokazuje oksidaciono stanje od +1.
Natrijum je jedan od najreaktivnijih metala i stoga se ne pojavljuje u prirodi u svom čistom obliku. Natrijum je jedan od najelektropozitivnijih metala; intenzivno stupa u interakciju s kisikom u zraku, pa se obično skladišti ispod sloja kerozina. U nizu napona, natrijum stoji daleko ispred vodonika i istiskuje ga iz vode, formirajući tako hidroksid NaOH.
Kada se suvi vodonik prođe preko blago zagrijanog natrijuma, formira se natrijum hidrid NaH, koji je nenonično jedinjenje u koje natrijum ulazi kao kation, a vodonik kao anjon.
Natrijum oksid nastaje kada natrijum sagoreva u nedovoljnoj količini kiseonika, burno reaguje sa vodom da formira hidroksid i ima kristalnu rešetku poput fluorovog šparta.
Natrijev peroksid nastaje kada se natrij sagori u zraku ili kisiku i predstavlja blijedožuti prah koji se topi bez raspadanja; veoma jak oksidant. Mnoge organske tvari se pale u dodiru s njim. Kada Na 2 0 2 stupi u interakciju s ugljičnim dioksidom, oslobađa se kisik. Ova reakcija se koristi u aparatima za disanje koje koriste vatrogasci i ronioci, kao i za regeneraciju zraka u zatvorenim prostorima, kao što su podmornice.
Natrijum hidroksid NaOH formira se u obliku bijelih, vrlo higroskopnih kristala, koji se tope na 318,3 °C; gustina 2,13 Mg/m3.
Poznato je jedinjenje natrija sa ugljenikom Na 2 C 2, koje se može smatrati acetilenskom solju. Zbog toga je dobio naziv natrijum ace-tnlid. Natrijum nitrid je stabilan na suvom vazduhu, ali se trenutno razlaže vodom i alkoholom da bi se formirao amonijak.
Natrijum sulfid Na 2 S se dobija redukcijom natrijum sulfata ugljenikom. U svom čistom obliku, Na 2 S je bezbojan i ima kristalnu rešetku tipa CaF 2. Vrlo uobičajeno jedinjenje natrijuma sa sumporom i kiseonikom je takozvana Glauberova so Na 2 S 0 4 - 10H 2 O. Natrijum, zajedno sa običnim hemijskim jedinjenjima koja se pridržavaju pravila valencije, takođe formira metalna jedinjenja. U legurama Na-K sistema formira se Lavesova faza sastava KNa 2, koja ima kompleks o. c. k.kristalna rešetka tipa MgCu 2 (C15). Slično metalno jedinjenje se uočava kada natrijum reaguje sa cezijem. Brojna jedinjenja metala nastaju interakcijom natrijuma sa metalima grupa I i VII B - srebrom, zlatom, cinkom, kadmijumom, živom, galijumom, kalajem, olovom i drugim elementima. Postoje, naravno, izuzeci. Dakle, aluminijum, element podgrupe SHV, ne stupa u interakciju sa natrijumom ni u tekućem ni u čvrstom stanju. Elementi III - VIIIA podgrupe periodnog sistema praktično nemaju interakciju sa natrijumom zbog velike razlike u faktoru veličine i tačkama topljenja.
Područja upotrebe
Natrijum se široko koristi u različitim oblastima tehnologije. Visoka reaktivnost ovog elementa predodredila je njegovu upotrebu u metalurgiji kao redukcionog sredstva za natrijum-termalnu proizvodnju metala kao što su titan, cirkonijum, hafnij, niobij itd. U proizvodnji nekih vrsta livenih aluminijskih legura, natrijum i njegove soli koriste se kao modifikatori. U hemijskoj industriji natrijum se koristi u proizvodnji cijanidnih soli, sintetičke gume i sintetičkih deterdženata (detergenida), farmaceutskih proizvoda, kao i olovnog tetraetila, antidetonacionog sredstva za proizvodnju visokooktanskog goriva za motore. Posljednjih godina sve je veća upotreba čistog natrijuma i njegovih legura s kalijem u nuklearnoj energiji kao rashladnih tečnosti.
Njegova hemijska jedinjenja se široko koriste u nacionalnoj ekonomiji. To je prvenstveno natrijum hidroksid NaOH (kaustična soda) koji se koristi u industriji sapuna, u proizvodnji boja, u industriji celuloze i papira i ulja, u proizvodnji umjetnih vlakana itd. Soda - natrijum karbonat Na 2 C 0 3 - koristi se u industriji stakla, celuloze i papira, prehrambenoj, tekstilnoj, naftnoj i drugim industrijama. U poljoprivredi se natrijumova so azotne kiseline NaN 0 3, poznata kao čileanski nitrat, široko koristi kao đubrivo.
n1.doc
Abstract.
Predmet: "Natrijum i njegova jedinjenja"
Uvod………………………………………………………………………………3
Pojava natrijuma i njegovih spojeva u prirodi……………………….3 – 4
Fizička i hemijska svojstva…………………………………….4 – 7
Priprema i upotreba…………………………………………………………….7 – 11
Toksičnost………………………………………………………………………….11
Reference…………………………………………………………….12
Uvod.
Natrijum
– hemijski element glavne podgrupe grupe I periodnog sistema Mendeljejeva. Njegov atomski broj je 11, a atomska masa 22,9898. Natrijum– srebrno-bijeli mekani metal koji brzo oksidira s površine na zraku i lako se može rezati nožem. Rez natrijuma odmah nakon reza ima svijetli metalni sjaj, ali brzo blijedi zbog izuzetno brze oksidacije metala. Prirodni element sastoji se od jednog stabilnog izotopa, Na.
Prirodna jedinjenja natrijuma (kuhinjska so NaCl, soda Na 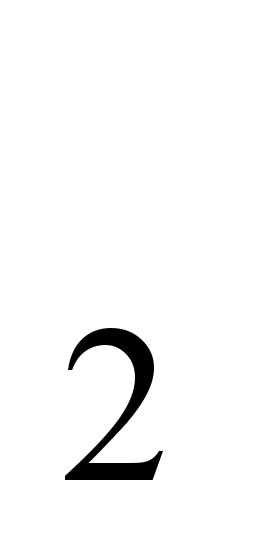 CO) su poznati od davnina. Ime "natrijum"
, izvedeno iz arapskog natrun, grčki nitron, izvorno se nazivala prirodna soda. Već u 18. veku, hemičari su poznavali mnoga druga jedinjenja natrijuma. Međutim, sam metal je tek 1807. dobio G. Davy elektrolizom kaustične sode NaOH. U Velikoj Britaniji, SAD-u, Francuskoj element se zove Natrijum(od španske reči soda - soda), u Italiji - sodio.
CO) su poznati od davnina. Ime "natrijum"
, izvedeno iz arapskog natrun, grčki nitron, izvorno se nazivala prirodna soda. Već u 18. veku, hemičari su poznavali mnoga druga jedinjenja natrijuma. Međutim, sam metal je tek 1807. dobio G. Davy elektrolizom kaustične sode NaOH. U Velikoj Britaniji, SAD-u, Francuskoj element se zove Natrijum(od španske reči soda - soda), u Italiji - sodio.
Pojava natrijuma i njegovih spojeva u prirodi.
Natrijum- tipičan element gornjeg dijela zemljine kore. Njegov prosječni sadržaj u litosferi iznosi 2,5% mase, u kiselim magmatskim stijenama (graniti i dr.) 2,77%, u bazičnim (bazalti i dr.) 1,94%, u ultrabaznim (stene plašta) 0,57%. Zbog izomorfizma Na 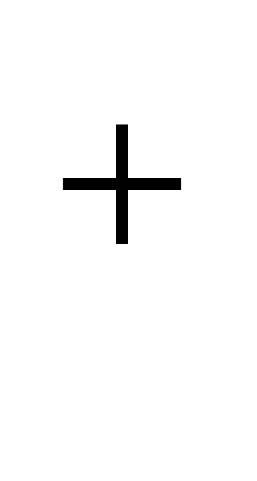 i Ca
i Ca 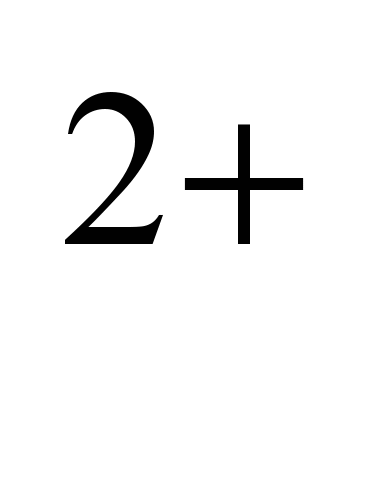 , zbog blizine njihovih jonskih radijusa, u magmatskim stijenama nastaju natrijum-kalcijum feldspat
(plagioklasi)
. U biosferi postoji oštra diferencijacija natrijuma: sedimentne stijene su u prosjeku osiromašene natrijumom (0,66% u glinama i škriljcima), malo ga ima u većini tla (prosječno 0,63%). Ukupan broj minerala natrijuma je 222. Natrijum se slabo zadržava na kontinentima i rijekama donosi u mora i okeane, gdje je njegov prosječan sadržaj 1,035%. N / A– glavni metalni element mora vode. Tokom isparavanja, natrijeve soli se talože u obalnim morskim lagunama, kao iu kontinentalnim jezerima stepa i pustinja, formirajući slojeve stijena koje sadrže soli. Glavni minerali koji su izvor natrijuma i njegovih spojeva su halit
(kamena so) NaCI,
Čileanska salitra
NaNO,
ondanarditis
NaSO
, zbog blizine njihovih jonskih radijusa, u magmatskim stijenama nastaju natrijum-kalcijum feldspat
(plagioklasi)
. U biosferi postoji oštra diferencijacija natrijuma: sedimentne stijene su u prosjeku osiromašene natrijumom (0,66% u glinama i škriljcima), malo ga ima u većini tla (prosječno 0,63%). Ukupan broj minerala natrijuma je 222. Natrijum se slabo zadržava na kontinentima i rijekama donosi u mora i okeane, gdje je njegov prosječan sadržaj 1,035%. N / A– glavni metalni element mora vode. Tokom isparavanja, natrijeve soli se talože u obalnim morskim lagunama, kao iu kontinentalnim jezerima stepa i pustinja, formirajući slojeve stijena koje sadrže soli. Glavni minerali koji su izvor natrijuma i njegovih spojeva su halit
(kamena so) NaCI,
Čileanska salitra
NaNO,
ondanarditis
NaSO  ,
mirabilit ili glauberijski
sol
NaSO
,
mirabilit ili glauberijski
sol
NaSO 10
HO,
tron
NaH(CO)2
HO,
boraks
NaBO
10
HO,
tron
NaH(CO)2
HO,
boraks
NaBO  10
HO, silvinitKCINaCI.
Svjetska proizvodnja natrijuma procjenjuje se na 110
10
HO, silvinitKCINaCI.
Svjetska proizvodnja natrijuma procjenjuje se na 110  tona N / A– važan bioelement, živa tvar sadrži u prosjeku 0,02% natrijuma. Više ga ima u životinjama nego u biljkama. Natrijum je jedan od glavnih elemenata uključenih u mineralni metabolizam životinja i ljudi. Sadrži uglavnom u ekstracelularnim tečnostima (oko 10 mmol/kg u ljudskim eritrocitima, 143 mmol/kg u krvnom serumu); Sadržaj natrijuma u biljnom tkivu je oko 0,01% po vlažnoj težini.
tona N / A– važan bioelement, živa tvar sadrži u prosjeku 0,02% natrijuma. Više ga ima u životinjama nego u biljkama. Natrijum je jedan od glavnih elemenata uključenih u mineralni metabolizam životinja i ljudi. Sadrži uglavnom u ekstracelularnim tečnostima (oko 10 mmol/kg u ljudskim eritrocitima, 143 mmol/kg u krvnom serumu); Sadržaj natrijuma u biljnom tkivu je oko 0,01% po vlažnoj težini.
Fizička i hemijska svojstva.
Na uobičajenim temperaturama, natrijum kristališe u kubnoj rešetki, a = 4,28. Atomski radijus 1,86, ionski radijus Na 0,92. Gustina 0,968 g/cm  (19,7
(19,7 C), t
C), t 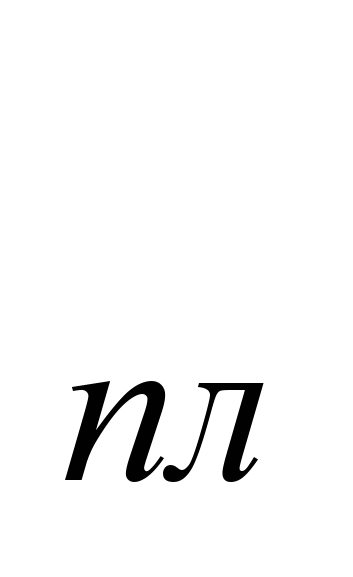 =97,83S, t
=97,83S, t  =882,9C; specifični toplotni kapacitet (20C) 1,2310 J/(kgK) ili 0,295 cal/(ggrad); koeficijent toplotne provodljivosti 1,3210
=882,9C; specifični toplotni kapacitet (20C) 1,2310 J/(kgK) ili 0,295 cal/(ggrad); koeficijent toplotne provodljivosti 1,3210  W/(mK) ili 0,317 cal/(cmsecgrad); temperaturni koeficijent linearne ekspanzije (20C) 7.110
W/(mK) ili 0,317 cal/(cmsecgrad); temperaturni koeficijent linearne ekspanzije (20C) 7.110  električna otpornost (0C) 4.310
električna otpornost (0C) 4.310 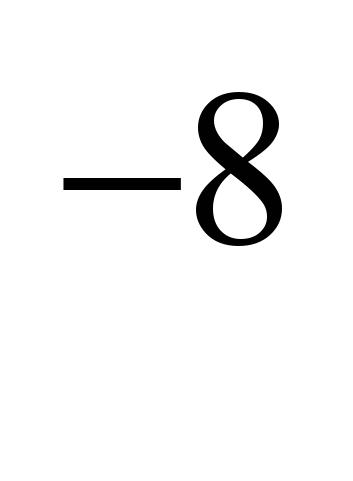 ohm (4.310
ohm (4.310  omsm). Natrijum je paramagnetski, specifična magnetna osetljivost +9,210; vrlo plastična i mekana (lako se reže nožem).
omsm). Natrijum je paramagnetski, specifična magnetna osetljivost +9,210; vrlo plastična i mekana (lako se reže nožem).
Natrijum spada u alkalne metale, jer je njegov oksid jako bazične prirode, a hidroksid koji formira je jak elektrolit - alkal. Normalni elektrodni potencijal natrijuma je -2,714 V; potencijal elektrode u talini je 2,4 V. Natrijumova para boji plamen u karakterističnu jarko žutu boju ( kvalitativna reakcija na katjone alkalnih metala). Elektronska konfiguracija atoma natrija 1
s2
s2
str  3
s
3
s  .
Natrijum, kao i svi alkalni metali, ima jedan s-elektron na spoljašnjem elektronskom sloju, koji se lako gubi tokom hemijskih reakcija, pokazujući oksidacijsko stanje +1
(U svim poznatim jedinjenjima, natrijum je jednovalentan). Zbog toga N / Ajejak redukcioni agens
. U čvrstom stanju, dobro provodi struju. Budući da je natrijum topljiv i brzo oksidira na zraku, skladišti se bez pristupa zraku i vlazi, najčešće pod kerozinom. Natrijum formira jedinjenja sa pretežno jonska veza, koji su uglavnom rastvorljivi u vodi i lako se disociraju u jone. Formiranje stabilnih kompleksa nije tipično za jone alkalnih metala. Hemijska aktivnost natrijuma je veoma visoka. Brojne soli kristaliziraju iz otopine u obliku kristalnih hidrata: NaSO
.
Natrijum, kao i svi alkalni metali, ima jedan s-elektron na spoljašnjem elektronskom sloju, koji se lako gubi tokom hemijskih reakcija, pokazujući oksidacijsko stanje +1
(U svim poznatim jedinjenjima, natrijum je jednovalentan). Zbog toga N / Ajejak redukcioni agens
. U čvrstom stanju, dobro provodi struju. Budući da je natrijum topljiv i brzo oksidira na zraku, skladišti se bez pristupa zraku i vlazi, najčešće pod kerozinom. Natrijum formira jedinjenja sa pretežno jonska veza, koji su uglavnom rastvorljivi u vodi i lako se disociraju u jone. Formiranje stabilnih kompleksa nije tipično za jone alkalnih metala. Hemijska aktivnost natrijuma je veoma visoka. Brojne soli kristaliziraju iz otopine u obliku kristalnih hidrata: NaSO  10HO, NaCO
10HO, NaCO  10HO, NaBO
10HO, NaBO  10HO, koji su po strukturi tektohidrati. Tektohidrati imaju strukturu leda u čijim su šupljinama ravnomjerno raspoređeni suprotno nabijeni ioni.
10HO, koji su po strukturi tektohidrati. Tektohidrati imaju strukturu leda u čijim su šupljinama ravnomjerno raspoređeni suprotno nabijeni ioni.
Hemijska svojstva:
Interakcija sa jednostavnim supstancama:
1) Reakcija sa halogenima: 2Na + CI= 2NaCI (natrijum hlorida)
Natrijum stupa u interakciju sa fluorom i hlorom direktno na uobičajenim temperaturama (snažno gori u hloru, što je posebno dobro primetiti u cevi od kalcijum hlorida u kojoj se struja hlora propušta kroz rastopljeni i jako zagrejani natrijum), sa bromom - samo kada se zagreje ; nije primećena direktna interakcija sa jodom.
Natrijum hlorida(sol) NaCI
kristalizira u obliku kubnih kristala, nema miris, slanog je okusa i vrlo je rastvorljiv u vodi. Njegova topljivost ostaje gotovo nepromijenjena s promjenama temperature. Ovo je posebno važno kada se kuhinjska sol izoluje iz rastvora drugih soli rekristalizacijom.
2) Reakcija sa kiseonikom: 4Na + O= 2NaO (natrijum oksid)
2Na + O= NaO (natrijum peroksid)
U direktnoj interakciji sa kiseonikom, zavisno od uslova, nastaje NaO oksid (oksidacija u maloj količini kiseonika na temperaturi od oko 180C) ili NaO peroksid - bezbojne kristalne supstance. Natrijum oksid– čvrsta higroskopna tvar koja lako stupa u interakciju s vodom i ima izrazito bazičan karakter. U interakciji s vodom stvara alkalije (kaustičnu sodu):
NaO +HO = 2NaOH
Natrijev hidroksid ili natrijev hidroksid NaOH je veoma važno jedinjenje natrijuma. Naziva se i kaustična soda ili jednostavno kaustična. Za dobivanje kaustične sode koristi se kuhinjska sol - najjeftiniji prirodni natrijev spoj. Ova sol se podvrgava elektrolizi, ali u ovom slučaju se ne koristi talina, već otopina soli. Caustic natrijum je bela kristalna čvrsta supstanca, veoma rastvorljiva u vodi. Kada se kaustična soda otopi u vodi, oslobađa se velika količina topline i otopina postaje vrlo vruća. Kaustična soda se mora čuvati u dobro zatvorenim posudama kako bi se zaštitila od prodiranja vodene pare, pod čijim uticajem može postati veoma vlažna, kao i ugljen monoksida (IV) pod čijim uticajem se kaustična soda postepeno pretvara u u natrijum karbonat:
2NaOH + CO = NaCO +HO
Natrijum peroksid(žućkasti prah) je jako oksidaciono sredstvo. Kada je izložen vodi, stvara alkalije i vodikov peroksid (ako se proces provodi zagrijavanjem, kisik se oslobađa zbog razgradnje HO):
NaO+2HO = HO + 2NaOH
Kada razrijeđene kiseline djeluju na natrijum peroksid, nastaje vodikov peroksid: NaO + HSO = NaSO + HO
Natrijev peroksid reagira s atmosferskim ugljičnim dioksidom prema jednadžbi:
2NaO + 2CO= 2NaCO +O
Stoga se koristi u aparatima za disanje za regeneraciju zraka – apsorpciju ugljičnog monoksida (IV) i oslobađanje kisika.
U vazduhu, natrijum trenutno oksidira. Stoga se skladišti ispod sloja organskih rastvarača (kerozin ili parafin, a parafin je poželjniji, jer se određena količina zraka još uvijek otapa u kerozinu i oksidacija natrijuma, iako sporo, dolazi).
U reakcijama sa halogenima i kiseonikom, natrijum najsnažnije pokazuje svoje redukcione sposobnosti.
3) Reakcija sa sumporom: 2Na + S = NaS (natrijum sulfid)
Kada se melje u malteru sa sumporom, natrijum burno reaguje, formirajući natrijum sulfid. Reakcija je praćena izbijanjem, tako da malter treba držati dalje od očiju i umotati ruku u peškir. Za reakciju uzmite male komadiće natrijuma.
4) Reakcija sa azotom: 6Na + N= 2NaN (natrijum nitrid)
Interakcija natrijeve pare sa dušikom u polju tihog električnog pražnjenja dovodi do stvaranja natrijevog nitrida.
5) Reakcija sa ugljenikom: 2Na + C = NaC
(natrijum karbid)
Interakcija natrijumove pare sa ugljenikom na 800-900C dovodi do proizvodnje NaC karbida.
6) Reakcija sa fosforom: 3Na + P = NaP (natrijum fosfid)
7) Reakcija sa vodonikom: 2Na + H= 2NaH (natrijum hidrid)
Reakcija natrijuma sa vodikom počinje na 200C i dovodi do stvaranja hidrida NaH – bezbojna higroskopna kristalna supstanca. Ovo je jedinjenje slično soli, koje se po prirodi hemijske veze i stepenu oksidacije razlikuje od hlapljivih vodoničnih jedinjenja elemenata glavnih podgrupa grupa IV - VII.
Natrijum je jako redukciono sredstvo, tako da redukuje vodonik u oksidaciono stanje –1.
Interakcija sa složenim supstancama:
1) Sa kiselinama: 2Na + 2HCI = 2NaCI +H 
U elektrohemijskom naponskom nizu metala, natrijum dolazi prije vodonika, tako da reducira ione vodika iz razrijeđenih kiselina.
Mineralne kiseline formiraju odgovarajuće soli rastvorljive u vodi sa natrijumom, ali je natrijum relativno inertan u odnosu na 98-100% sumpornu kiselinu.
2) Sa vodenim rastvorima soli:
Natrijum, kao metal sa jakim redukcionim svojstvima, pod ovim uslovima će redukovati vodonik vode, a ne metal odgovarajuće soli.
3) sa vodom: 2Na + 2HOH = 2NaOH + H
Natrijum reaguje sa vodom, istiskujući iz nje vodonik (budući da je veoma aktivan metal, u naponskom nizu je mnogo levo od vodonika), u normalnim uslovima, i kao rezultat ove reakcije, u vodi rastvorljiva baza NaOH se formira i H se oslobađa; reakcija može biti praćena eksplozijom.
4) Sa amonijakom:
Natrijum se rastvara u tečnom amonijaku (34,6 g na 100 g NH na 0C) da bi se formirali kompleksi amonijaka. Kada se gasoviti amonijak propušta kroz rastopljeni natrijum na 300-350C, formira se natrijum amidNaNH- bezbojna kristalna supstanca, lako se razlaže vodom.
5) Sa alkoholima: 2CHOH + 2Na = 2CHONa + H 
Kada natrijum reaguje sa alkoholima, hidroksilni vodonik se zamenjuje natrijumom da bi se formirali alkoholati (natrijum etoksid).
Poznat je veliki broj natrijum-organskih jedinjenja, koja su po hemijskim svojstvima veoma slična organolitijumskim jedinjenjima, ali su superiornija od njih po reaktivnosti. Natrijum-organska jedinjenja se koriste u organskoj sintezi kao agensi za alkilaciju.
Legure
.
Natrijum je komponenta mnogih praktično važnih legura. Na – K legure, koje sadrže 40-90% K (težinski) na temperaturi od oko 25C, su srebrno-bijele tečnosti, koje se odlikuju visokom hemijskom aktivnošću, zapaljive na vazduhu. Električna provodljivost i toplinska provodljivost tekućih Na-K legura niže su od odgovarajućih vrijednosti za Na i K. Natrijum amalgami lako se dobija uvođenjem metalnog natrijuma u živu; sa sadržajem većim od 2,5% Na (težinski) na uobičajenim temperaturama već su čvrste tvari.
Prijem i prijava.
Glavna industrijska metoda za proizvodnju natrijuma je elektroliza taline kuhinjska soNaCIkoji sadrže aditiveKCI,
NaF,
CaCI i drugi (piroelektrometalurgija), koji smanjuju tačku topljenja soli na 575-585C. Elektroliza čistog NaCl bi dovela do velikih gubitaka natrijuma isparavanjem, jer su tačke topljenja NaCl (801C) i tačke ključanja Na (882.9C) veoma blizu. Elektroliza se izvodi u elektrolizerima sa dijafragmom (anodni i katodni prostori su odvojeni dijafragmom, koja izoluje nastali hlor od natrijuma tako da ne dođe do obrnute reakcije), katode su od gvožđa ili bakra, anode od grafit. Hlor se proizvodi istovremeno s natrijem. Elektrode su uronjene u rastopljenu so. Pozitivni natrijev ion prima elektron sa katode i postaje neutralni atom natrijuma. Neutralni atomi natrijuma skupljaju se na katodi u obliku rastopljenog metala. Proces koji se odvija na katodi može se predstaviti dijagramom: N / A+


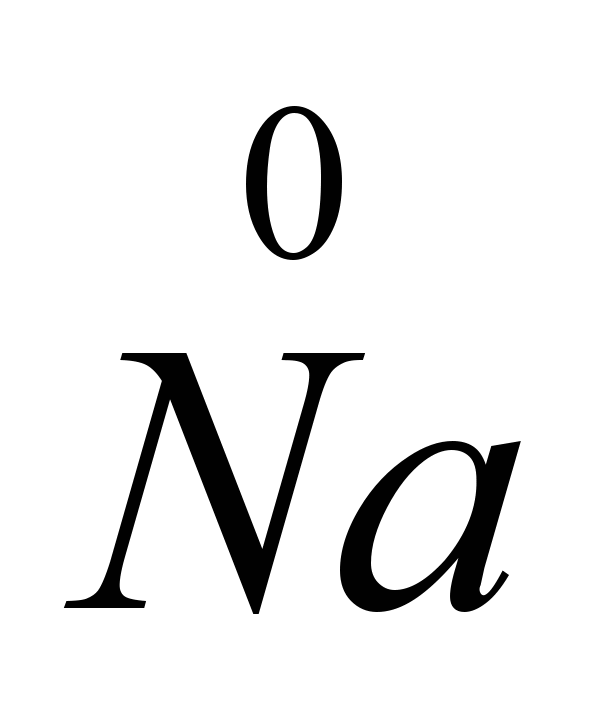
Pošto se prihvatanje elektrona dešava na katodi, a svako prihvatanje elektrona od strane atoma ili jona je redukcija, joni natrijuma na katodi se smanjuju. Na anodi joni hlora daju elektrone, tj. dolazi do procesa oksidacije i oslobađanja plina slobodnog klora, što se može prikazati sljedećim dijagramom: C.I.  -
-
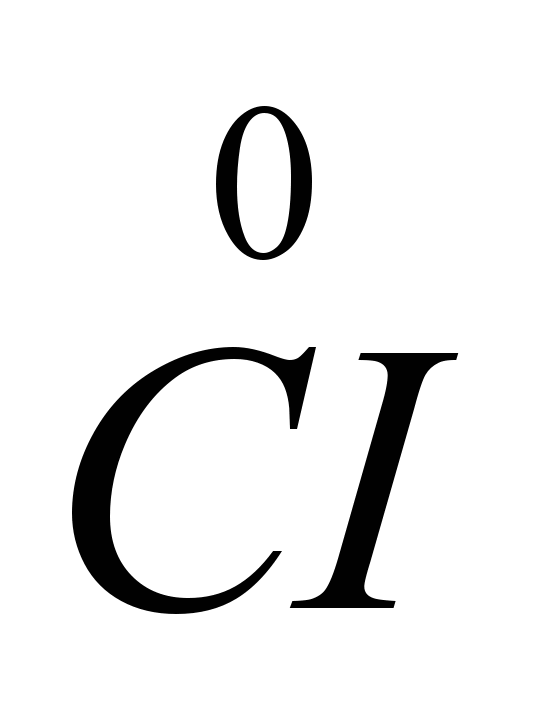
Sačuvan je i stari način dobijanja natrijuma - elektroliza rastaljene kaustične sodeNaOH, koji je mnogo skuplji od NaCI, ali se elektrolitički razgrađuje na nižoj temperaturi (320-330C).
Natrijum i njegove legure se široko koriste kao rashladne tečnosti za procese koji zahtevaju ravnomerno zagrevanje u opsegu od 450-650C - u ventilima motora aviona i posebno u nuklearnim elektranama. U potonjem slučaju, legure Na–K služe kao tečne metalne rashladne tečnosti (oba elementa imaju male poprečne preseke apsorpcije toplotnih neutrona, za Na 0,49 barn); ove legure karakteriziraju visoke točke ključanja i koeficijenti prijenosa topline i ne stupaju u interakciju sa strukturnim materijalima na visokim temperaturama razvijenim u nuklearnim reaktorima. U proizvodnji se koristi jedinjenje NaPb (10% Na po težini). tetraetil olovo– najefikasniji sredstvo protiv detonacije. U leguri na bazi olova (0,73% Ca, 0,58% Na i 0,04% Li) koja se koristi za proizvodnju osovinskih ležajeva za željeznička vagona, natrijum je aditiv za jačanje. U metalurgiji, natrijum služi kao aktivni redukcioni agens u proizvodnji nekih retkih metala (Ti, Zr, Ta) metalotermnim metodama; u organskoj sintezi - u reakcijama redukcije, kondenzacije, polimerizacije itd. Ponekad se natrijum u elektrotehnici zamenjuje bakrom, koji je 9 puta teži od ovog metala; Sabirnice za velike struje izrađene su od čeličnih cijevi punjenih natrijem. Prva sintetička guma na svijetu, koju je 1928. nabavio akademik S.V. Lebedev, nazvana je natrijum-butadienska guma, jer je natrijum bio katalizator polimerizacije butadiena. Natrijum se koristi kao redukciono sredstvo u organskoj sintezi, posebno za redukciju masnih kiselina u više alkohole koji se koriste u proizvodnji sintetičkih deterdženata.
Najčešći preparat natrijuma u medicini je natrijum sulfatNaSO, hloridNaCI(za gubitak krvi, gubitak tečnosti, povraćanje, itd.), boratNaBO10
HO(kao antiseptik) bikarbonatNaHCO(kao ekspektorans, kao i za pranje i ispiranje kod rinitisa, laringitisa, dijabetesa itd.), tiosulfatNaSO (soda) je potrebna za proizvodnju stakla, aluminijuma, deterdženata i boja).
NaCIO + HO + CO= NaHCO +HCIO
NaOH Koristi se i u industriji papira, u proizvodnji sapuna, u proizvodnji umjetnih vlakana, u galvanizaciji, za prečišćavanje naftnih derivata i frakcija katrana ugljena. NaOH se koristi za alkalno čišćenje voća i povrća (korenasto povrće, citrusno voće, paradajz i dr.), što je olakšano alkalnom hidrolizom određenih supstanci, što dovodi do prekida veze između kore i pulpe. Jaka otopina NaOH se koristi za čišćenje kotlova i radijatora od kamenca. Natrijum hlorida NaCI koristi se u hemijskoj industriji za proizvodnju hlora, kaustične sode, sode, izbeljivača, nekih vrsta plastike i organskih jedinjenja. Natrijum nitratNaNO koristi se kao mineralno đubrivo. Natrijum silikatNaSiO - jedan od rijetkih vodotopivih silikata. On je zvao rastvorljivo staklo, a rješenje je tečno staklo. Drvo i tkanine su impregnirani rastvorljivim staklom kako bi se zaštitili od paljenja. Tečno staklo je uključeno u vatrostalne kitove za lijepljenje stakla, porculana i kamena. Natrijum nitritNaNO koristi se kao inhibitor koji usporava koroziju čelika u vodi i otopinama soli (stvara zaštitni film na metalnoj površini).
Natrijum amidNaNH, dobijen reakcijom tečnog amonijaka sa natrijumom, potreban je za proizvodnju plave boje - indiga i vitamina A.
Uglavnom natrijum peroksidNaO koristi se za izbjeljivanje papira i regeneraciju zraka u podmornicama; ranije se široko koristio za izbjeljivanje slamnatih šešira.
Da bi se odredio sadržaj vlage u organskim tvarima, miješaju se s natrijevim amalgamom (rastvorom u živi). Kao rezultat interakcije s vodom, oslobađa se ekvivalentna količina H, čija se zapremina koristi za određivanje sadržaja vlage u uzetom uzorku.
Takva jedinjenja natrijuma se široko koriste u svakodnevnom životu kao solNaCI I sodaNaCO. Dnevna potreba osobe za natrijum hloridom kreće se od 2 do 10 g i zavisi od količine ove soli koja se gubi znojenjem.
Umjetno proizvedeni radioaktivni izotopi  Na (poluživot T
Na (poluživot T  =2,64 g) i
=2,64 g) i 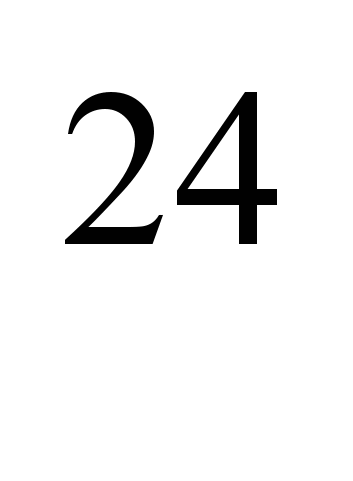 Na (T= 15 h) se koristi za određivanje brzine protoka krvi u pojedinim dijelovima krvožilnog sistema kod kardiovaskularnih i plućnih bolesti, obliterirajućeg endarteritisa i dr. Za određivanje se koriste i radioaktivni rastvori natrijumovih soli (npr. NaCI). vaskularnu permeabilnost, proučavanje ukupnog metaboličkog sadržaja natrijuma u organizmu, metabolizam vode i soli, apsorpciju iz crijeva, procese nervnog djelovanja i u nekim drugim eksperimentalnim istraživanjima.
Na (T= 15 h) se koristi za određivanje brzine protoka krvi u pojedinim dijelovima krvožilnog sistema kod kardiovaskularnih i plućnih bolesti, obliterirajućeg endarteritisa i dr. Za određivanje se koriste i radioaktivni rastvori natrijumovih soli (npr. NaCI). vaskularnu permeabilnost, proučavanje ukupnog metaboličkog sadržaja natrijuma u organizmu, metabolizam vode i soli, apsorpciju iz crijeva, procese nervnog djelovanja i u nekim drugim eksperimentalnim istraživanjima.
Natrijum je jedan od glavnih elemenata uključenih u mineralni metabolizam životinja i ljudi. Učestvuje u održavanju osmotski pritisak I acido-baznu ravnotežu, u provođenju nervnih impulsa. Koncentraciju jona natrijuma u tijelu reguliše uglavnom hormon kore nadbubrežne žlijezde - aldosteron. Uprkos relativno visokom sadržaju natrijuma u biljnim tkivima (oko 0,01% po vlažnoj težini), njegova uloga u životu biljaka nije dobro shvaćena. U halofiti(vrste koje rastu na visoko zaslanjenim tlima) natrijum stvara visok osmotski pritisak u ćelijskom soku i na taj način potiče ekstrakciju vode iz tla.
Toksičnost.
Zbog visoke hemijske aktivnosti natrijuma, rukovanje njime zahteva oprez. Posebno je opasan kontakt sa natrijem vodom, koji može dovesti do požara i eksplozije. Oči treba zaštititi zaštitnim naočalama, ruke debelim gumenim rukavicama; Kontakt natrijuma sa mokrom kožom ili odjećom može uzrokovati teške opekotine.
Požar alkalnog metala ne može se ugasiti vodom. Najbolje je napuniti ga sodom u prahu.
Kaustična soda može izazvati teške opekotine ako dođe u dodir s kožom, pa kristalnu lužinu ne treba uzimati rukama, već samo hvataljkama ili pincetom. Ako vam alkalna otopina dospije na kožu, prvo morate isprati otopinu dok osjećaj sapunice ne nestane velikom količinom vode, a zatim ga neutralizirati otopinom borne kiseline.
Bibliografija.
Sittig M. “Natrijum, njegova proizvodnja, svojstva i primjena”, trans. sa engleskog, 1961.
- Ripan R., Ceteanu I. “Neorganska hemija”, tom 1, trans. sa rumunskog, 1971.
Pavlov N.N. “Opšta i neorganska hemija”, izdavačka kuća “Drofa”, 2002.
Kryuchkova-Chernobelskaya G.M. “Neorganska hemija”, 3. izdanje, Izdavačka kuća “Medicina”, 1980.
NATRIJUM- (Natrijum) Na, hemijski element 1. (Ia) grupe periodnog sistema, pripada alkalnim elementima. Atomski broj 11, relativna atomska masa 22,98977. U prirodi postoji jedan stabilan izotop 23 Na. Poznato je šest radioaktivnih izotopa ovog elementa, od kojih su dva od interesa za nauku i medicinu. Natrijum-22, sa poluživotom od 2,58 godina, koristi se kao izvor pozitrona. Natrijum-24 (njegovo poluvrijeme je oko 15 sati) koristi se u medicini za dijagnozu i liječenje nekih oblika leukemije.
Oksidacijsko stanje +1.
Jedinjenja natrijuma poznata su od davnina. Natrijum hlorid je esencijalna komponenta ljudske hrane. Smatra se da su ga ljudi počeli koristiti u neolitu, tj. prije otprilike 5-7 hiljada godina.
Stari zavjet spominje supstancu koja se zove "neter". Ova supstanca je korištena kao deterdžent. Najvjerovatnije je neter soda, natrijum karbonat koji se formirao u slanim egipatskim jezerima sa vapnenačkim obalama. O istoj supstanci su kasnije pisali i grčki autori Aristotel i Dioskorid, ali pod imenom „nitron“, a starorimski istoričar Plinije Stariji, pominjući istu supstancu, nazvao ju je „nitrum“.
U 18. vijeku Hemičari su već poznavali mnogo različitih jedinjenja natrijuma. Natrijumove soli bile su široko korištene u medicini, u štavljenju kože i bojanju tkanina.
Metalni natrijum je prvi dobio engleski hemičar i fizičar Humphry Davy elektrolizom rastopljenog natrijum hidroksida (koristeći naponsku kolonu od 250 pari bakarnih i cinkovanih ploča). Naziv "natrijum" koji je Davy odabrao za ovaj element odražava njegovo porijeklo od sode Na 2 CO 3 . Latinski i ruski nazivi elementa izvedeni su iz arapskog "natrun" (prirodna soda).
Rasprostranjenost natrijuma u prirodi i njegova industrijska ekstrakcija.
Natrijum je sedmi element po zastupljenosti i peti najzastupljeniji metal (posle aluminijuma, gvožđa, kalcijuma i magnezijuma). Njegov sadržaj u zemljinoj kori iznosi 2,27%. Većina natrijuma se nalazi u raznim aluminosilikatima.
Ogromne naslage natrijumovih soli u relativno čistom obliku postoje na svim kontinentima. Oni su rezultat isparavanja drevnih mora. Ovaj proces još uvijek traje u Salt Lakeu (Utah), Mrtvom moru i drugim mjestima. Natrijum se nalazi u obliku NaCl hlorida (halit, kamena so), kao i karbonata Na 2 CO 3 NaHCO 3 2H 2 O (trona), nitrata NaNO 3 (solitra), sulfata Na 2 SO 4 10H 2 O (mirabilit ) , tetraborat Na 2 B 4 O 7 10 H 2 O (boraks) i Na 2 B 4 O 7 4H 2 O (kernit) i druge soli.
U prirodnim slanama i okeanskim vodama postoje neiscrpne rezerve natrijum hlorida (oko 30 kg m -3). Procjenjuje se da bi kamena sol u količini koja je ekvivalentna sadržaju natrijum hlorida u Svjetskom okeanu zauzela zapreminu od 19 miliona kubnih metara. km (50% više od ukupnog volumena sjevernoameričkog kontinenta iznad razine mora). Prizma ovog volumena sa osnovnom površinom od 1 sq. km može doći do Mjeseca 47 puta.
Sada je ukupna proizvodnja natrijum hlorida iz morske vode dostigla 6-7 miliona tona godišnje, što je oko trećine ukupne svetske proizvodnje.
Živa materija sadrži u proseku 0,02% natrijuma; Više ga ima u životinjama nego u biljkama.
Karakteristike jednostavne supstance i industrijska proizvodnja metalnog natrijuma.
Natrijum je srebrno-bijeli metal, u tankim slojevima sa ljubičastom nijansom, plastičan, čak i mekan (lako se seče nožem), svježi rez natrijuma je sjajan. Vrijednosti električne provodljivosti i toplinske provodljivosti natrijuma su prilično visoke, gustina je 0,96842 g/cm 3 (na 19,7 ° C), tačka topljenja je 97,86 ° C, tačka ključanja je 883,15 ° C.
Ternarna legura, koja sadrži 12% natrijuma, 47% kalijuma i 41% cezijuma, ima najnižu tačku topljenja metalnih sistema, jednaku -78°C.
Natrijum i njegova jedinjenja boje plamen jarko žuto. Dvostruka linija u spektru natrijuma odgovara tranziciji 3 s 1-3str 1 u atomima elementa.
Hemijska aktivnost natrijuma je visoka. Na zraku se brzo prekriva filmom mješavine peroksida, hidroksida i karbonata. Natrijum gori u kiseoniku, fluoru i hloru. Kada se metal sagorijeva na zraku, nastaje Na 2 O 2 peroksid (sa primjesom Na 2 O oksida).
Natrijum reaguje sa sumporom kada se melje u malteru i redukuje sumpornu kiselinu u sumpor ili čak sulfid. Čvrsti ugljični dioksid („suhi led”) eksplodira u kontaktu s natrijumom (aparati za gašenje požara ugljičnim dioksidom ne mogu se koristiti za gašenje natrijuma!). Sa dušikom, reakcija se događa samo u električnom pražnjenju. Natrijum ne reaguje samo sa inertnim gasovima.
Natrijum aktivno reaguje sa vodom:
2Na + 2H 2 O = 2NaOH + H 2
Toplota koja se oslobađa tokom reakcije dovoljna je da se metal otopi. Stoga, ako se mali komadić natrijuma baci u vodu, on se topi zbog termičkog efekta reakcije i kapljica metala, koja je lakša od vode, „trči“ po površini vode, vođena reaktivnom silom. oslobođenog vodonika. Natrijum mnogo mirnije reaguje sa alkoholima nego sa vodom:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2
Natrijum se lako otapa u tečnom amonijaku da bi formirao svetlo plave metastabilne rastvore sa neobičnim svojstvima. Na -33,8°C, do 246 g metalnog natrijuma rastvara se u 1000 g amonijaka. Razblaženi rastvori su plave boje, koncentrirani rastvori su bronzani. Mogu se čuvati oko nedelju dana. Utvrđeno je da u tečnom amonijaku natrijum jonizuje:
Konstanta ravnoteže ove reakcije je 9,9·10 -3. Odlazeći elektron je solvatiran molekulima amonijaka i formira kompleks -. Rezultirajuća rješenja imaju metalnu električnu provodljivost. Kada amonijak ispari, originalni metal ostaje. Kada se otopina skladišti duže vrijeme, ona postepeno gubi boju zbog reakcije metala s amonijakom da nastane amid NaNH 2 ili imid Na 2 NH i oslobađanje vodika.
Natrijum se skladišti ispod sloja dehidrirane tečnosti (kerozin, mineralno ulje) i transportuje se samo u zatvorenim metalnim kontejnerima.
Elektrolitička metoda za industrijsku proizvodnju natrijuma razvijena je 1890. Elektroliza je provedena na rastopljenom natrijum hidroksidu, kao u Davyjevim eksperimentima, ali koristeći naprednije izvore energije od voltaičnog stupa. U tom procesu, zajedno s natrijem, oslobađa se kisik:
anoda (nikl): 4OH - - 4e - = O 2 + 2H 2 O.
Tokom elektrolize čistog natrijum hlorida javljaju se ozbiljni problemi, povezani, prvo, sa bliskom tačkom topljenja natrijum hlorida i tačkom ključanja natrijuma i, kao drugo, sa visokom rastvorljivošću natrijuma u tečnom natrijum hloridu. Dodavanje kalijum hlorida, natrijum fluorida, kalcijum hlorida u natrijum hlorid omogućava vam da smanjite temperaturu taljenja na 600°C. Proizvodnja natrijuma elektrolizom rastopljene eutektičke mešavine (legura dve supstance sa najnižom tačkom topljenja) 40% NaCl i 60% CaCl 2 na ~580° C u ćeliji koju je razvio američki inženjer G. Downs, pokrenuo ju je 1921. DuPont u blizini elektrane na Nijagarinim vodopadima.
Na elektrodama se dešavaju sljedeći procesi:
katoda (gvožđe): Na + + e - = Na
Ca 2+ + 2e - = Ca
anoda (grafit): 2Cl - - 2e - = Cl 2.
Natrijum i kalcijum metali se formiraju na cilindričnoj čeličnoj katodi i podižu ih hlađena cijev u kojoj se kalcij stvrdnjava i pada natrag u talinu. Hlor koji nastaje na centralnoj grafitnoj anodi sakuplja se ispod niklovanog krova i zatim se pročišćava.
Trenutno, obim proizvodnje metalnog natrijuma iznosi nekoliko hiljada tona godišnje.
Slični članci
-
Istorija ruskih predsedničkih izbora
Od 1. septembra 2011. GOLOS sprovodi dugoročni monitoring izbornih kampanja 2011-2012. od strane ekspertske grupe u Moskvi i dugoročnih posmatrača u 48 regiona Rusije. Posebno kreirana medijska grupa vodi...
-
Ruski program istraživanja Mjeseca Lunarna stanica
Spoljni linkovi će se otvoriti u posebnom prozoru O tome kako deliti Zatvori prozor Autorska prava na sliku RIA Novosti Natpis na slici Istraživanje Meseca je privlačna tema za političare, ali još nema novca u budžetu za to...
-
Ruska lunarna stanica: postoji ideja, nema novca Ruska lunarna orbitalna stanica
Program je sastavio Institut za svemirska istraživanja Ruske akademije nauka u ime Roskosmosa 2014. godine. IKI predlaže korištenje Mjeseca kao naučnog poligona za velika astronomska i geofizička istraživanja. Predlaže se kreiranje...
-
"Najveći zatvor na svijetu": Putovanje u pojas Gaze Plač Palestine i pojasa Gaze
Mislio sam da je sada vrijeme da pišem o nesretnom (ili nesretnom, kako hoćete) palestinskom pojasu Gaze, koji ne silazi sa novinskih stranica. Čini se da se tamo dešava nešto što uzbuđuje umove više od milion...
-
San Marino je jedna od najmanjih država u svijetu Vojne organizacije i policije
Prošlog ljeta, moja supruga i ja smo otišli na odmor u Italiju na tjedan dana. Rano ujutro (u 04:40) avion sa srebrnim krilom odvezao nas je u Rimini, na aerodrom Federico Fellini. Inače, vredi napomenuti da smo leteli iz Sankt Peterburga, pa...
-
Šta se desilo sa decom Moamera Gadafija
Moamer Gadafi je vladao Libijom više od 40 godina. On se sada obračunava sa opozicijom, dok antivladini demonstranti i dalje traže njegovu ostavku. Muamer Gadafi...
