Высшая и низшая степень окисления натрия. Натрий и его соединения - файл n1.doc
Общие сведения и методы получения
Натрий (Na) -серебристо-белый щелочной металл, быстро тускнеющий на воздухе при обычных условиях. Содержание в земной коре 2,5 % (по массе). В водах мирового океана средняя его концентрация 1,035 %. В живых организмах содержится до 0,02 % (по массе) натрия, содержание его в растениях несколько ниже.
Известно более 220 минералов, в состав которых входит натрий. Наиболее распространены, хлорид натрия, или поваренная соль, NaCl , галит NaCl , или каменная соль, чилийская селитра NaN 0 3 , тенардит Na 2 S 04, мираболит (глауберова соль) Na 2 SCv 10Н 2 О, трона Na , H (C 0 3) 2 -2 H 2 0 и др.
Натрий присутствует также в ряде более сложных минералов, содержащих алюминий, кремний, серу и другие элементы. Например, в иафелине Na [ A ] Si 0 4 ], лазурите (ультрамарин) Na 3 [ Al 3 Si 3 0| 2 ] Na 2 [ S 0 4 ], жадеите NaCl [ Si 2 0 6 ] и др.
Ряд соединений натрия, в первую очередь поваренная соль и сода Na 2 C 0 3 10Н 2 О, известны человеку с глубокой древности.
В древнем Египте было известно моющее вещество (сода), ко:орое называли neter . У Аристотеля оно носит название vixpovj , а у Плутарха (Древний Рим) - nitrum . В рукописях арабских алхимиков соде отвечает термин natron , от которого постепенно в XVII-XVIII вв. образуется термин «натра», т. е. основание, из которого можно получить поваренную соль. От «натра» произошло современное название элемента. Надо отметить, что в ряде стран Западной Европы (Великобритания, Франция, Италия), а также США натрий носит название sodium .
Металлический натрий впервые был получен в 1807 г. английским химиком Деви в результате электролиза (щелочной способ). Из-за большой энергоемкости щелочной способ получил промышленное распространение лишь в конце XIX в. До этого металлический натрий получали химическим восстановлением его соединений углеродом или расплавленным чугуном при высокой температуре. С первой четверти текущего века щелочной способ постепенно вытесняется солевым, т. е. электролизом непосредственно расплава хлористого натрия, минуя стадию получения щелочи. Электролиз расплавленной соли ведут при 850-860 К. Для снижения температуры плавления NaCl используют добавки ряда солей, в частности NaF , KCI , СаС1г и др. При электролизе хлористого натрия получают также еще один ценный продукт - газообразный хлор. Поэтому в настоящее время солевой способ получения натрия практически вытеснил щелочной, не говоря уже о химических способах.
Физические свойства
Атомные характеристики. Атомный номер 11, атомная масса 22,98977 а. е. м., атомный объем 23,08* 10 -6 м 3 /моль. Атомный радиус (металлический) 0 ,192 нм, ионный радиус Na + 0,098 нм, ковалентный 0 ,157 нм. Конфигурация внешних электронных оболочек атома 2 p 6 3 s 1 . Натрий обладает единственным стабильным изотопом 23 Na ; известно пять радиоактивных изотопов с массовыми числами от 20 до 25; период полураспада изотопов изменяется от тысячных долей секунды (20 Na) до 2,6 года у 22 Na . При комнатной температуре натрий имеет о. ц. к. решетку с периодом а =0,42905 нм; энергия кристаллической решетки 108,8 мкДж/кмоль. При низких температурах существует модификация натрия с г. п. у. структурой, периоды которой при 5К: а=0,3767 нм, с =0 ,6154 нм. Потенциалы ионизации атома натрия J (эВ) 5,138, 47,20, 71,8, электроотрицательность 0,9. Работа выхода электронов ф 0 = =2,35 эВ. Работа выхода электронов для различных граней монокристалла ф -2,75эВ для {100}, ф =3,10эВ для {110}, ф =2,65эВ для {111}.
Плотность. При комнатной температуре плотность натрия рентгеновская р=0,966 Мг/м 3 , пикнометрическая р=0,971 Мг/м 3 .
При плавлении удельное электрическое сопротивление натрия возрастает в 1,451 раза. Температурный коэффициент электрического сопротивления натрия при 273 К а=4,34-10- 3 К -1 .
В термопаре натрий - платина прн температуре горячего спая 173,16 К развивается т. э. д. с. £=0,29 мВ, а при температуре 373,16 К £=-0,25 мВ. Абсолютный коэффициент т. э. д. с. е=- 4,4 мкВ/К. Постоянная Холла при комнатной температуре /? = 2,3- Ю -10 м 3 /Кл и /?=- 2,2-Ю- 10 м 3 /Кл при 371-383 К.
Магнитная восприимчивость натрия х= +0,70- Ю -9 при 293 К.
Тепловые и термодинамические. Температура плавления натрия / П л = =98 °С, температура кипения?кип =878°С, характеристическая температура 6в = 160К, удельная теплота плавления ДЯ ПЛ = П7 кДж/кг. Удельная теплота сублимации при 298 К ДЯ су бл = 4717 кДж/кг, удельная теплота испарения ДЯ И сп = 3869 кДж/кг. Теплота испарения натрия при нормальном давлении ДЯи<-п = 3869 кДж/кг. При плавлении происходит увеличение объема на ДУ- 27,82-Ю -6 м 3 /кг или AV / V 0 = 0,0265. При повышении давления возрастает температура плавления металла, достигая 515 К при 3 ГПа и 608 при 8 ГПа. Начальное значение углового коэффициента dT / dP = 85 К/ГПа, при 7 ГПа 33 К/ГПа. Фазовых превращений в натрии до давления 8,5 ГПа не обнаружено.
Механические свойства
Твердость натрия по Бринеллю НВ = 0,7 МПа. Модуль нормальной упругости при растяжении при комнатной температуре £=5,3 ГПа. Сжимаемость натрия х= 15,99*10 -11 Па -1 .
Химические свойства
В химических соединениях, включая гидриды, проявляет степень окисления + 1.
Натрий относится к числу наиболее реакционноспособных металлов, поэтому в чистом виде в природе не встречается. Натрий - один из наиболее электроположительных металлов; интенсивно взаимодействует с кислородом воздуха, поэтому его обычно хранят под слоем керосина. В ряду напряжений натрий стоит далеко впереди водорода и вытесняет его из воды, образуя при этом гидрокснд NaOH .
При пропускании сухого водорода над слегка нагретым натрием образуется гидрид натрия NaH , представляющий собой нонное соединение, в которое натрнн входит в виде катиона, а водород - в виде аниона.
Оксид натрия образуется при горении натрия в недостаточном количестве кислорода, бурно реагирует с водой с образованием гидроксида, имеет кристаллическую решетку типа плавикового шпата.
Пероксид натрия образуется при сжигании натрия на воздухе или в кислороде, представляет собой бледно-желтый порошок, который плавится без разложения; очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. При взаимодействии Na 2 0 2 с углекислым газом выделяется кислород. Эту реакцию используют в дыхательных аппаратах, применяемых пожарными и водолазами, а также для регенерации воздуха в закрытых помещениях, например на подводных лодках.
Гидроксид натрня NaOH образуется в виде белых очень гигроскопических кристаллов, плавящихся при 318,3 °С; плотность 2,13 Мг/м 3 .
Известно соединение натрия с углеродом Na 2 C 2 , которое можно рассматривать как соль ацетилена. Поэтому оно получило название аце-тнлида натрия. Нитрид натрия устойчив в сухом воздухе, но моментально разлагается водой илн спиртом с образованием аммиака.
Сульфид натрия Na 2 S получают путем восстановления сульфата натрия углеродом. В чистом виде Na 2 S бесцветен, обладает кристаллической решеткой типа CaF 2 . Очень распространенное соединение натрия с серой и кислородом - так называемая глауберова соль Na 2 S 0 4 - 10Н 2 О. Натрий наряду с обычными химическими соединениями, подчиняющимися правилу валентности, образует также металлические соединения. В сплавах системы Na - К образуется фаза Лавеса состава KNa 2 , имеющая сложную о. ц. к. кристаллическую решетку типа MgCu 2 (С15). Аналогичное металлическое соединение наблюдается при взаимодействии натрия с цезием. Ряд металлических соединений образуется при взаимодействии натрия с металлами I и VII В групп - серебром, золотом, цинком, кадмием, ртутью, галлием, оловом, свинцом и другими элементами. Имеются, конечно, и исключения. Так, алюминий, элемент ШВ подгруппы, не взаимодействует с натрием ни в жидком, нн в твердом состояниях. Элементы III - VIIIA подгрупп Периодической системы практически с натрием не взаимодействуют из-за большого различия как размерного фактора, так и температур плавления.
Области применения
Натрий достаточно широко применяется в различных областях техники. Высокая реакционная способность этого элемента предопределила его использование в металлургии в качестве восстановителя для получения натрийтермическим способом таких металлов, как титан, цирконий, гафний, ниобий и др. При производстве некоторых сортов литейных алюминиевых сплавов натрий и его соли используют в качестве модификаторов. В химической промышленности натрий применяют при производстве цианистых солен, синтетического каучука и синтетических моющих средств (детергенидов), фармацевтических препаратов, а также тетраэтила свинца - антидетонатора прн получении высокооктанового топлива для двигателей. В последние годы расширяется использование чистого натрия и его сплавов с калием в атомной энергетике в качестве теплоносителей.
Широко применяются в народном хозяйстве его химические соединения. Это прежде всего гндроксид натрия NaOH (каустическая сода), который используют в мыловаренной промышленности, при производстве красок, в целлюлозно-бумажной и нефтяной промышленности, при производстве искусственного волокна и др. Сода - карбонат натрия Na 2 C 0 3 - применяется в стекольной, целлюлозно-бумажной, пищевой, текстильной, нефтяной и других отраслях промышленности. В сельском хозяйстве в качестве удобрения широко используется натриевая соль азотной кислоты NaN 0 3 , известная под названием чилийской селитры.
n1.doc
Реферат.
Тема: «Натрий и его соединения»
Введение………………………………………………………….……………3
Нахождение в природе натрия и его соединений……………………….3 – 4
Физические и химические свойства……………………………….…….4 – 7
Получение и применение………………………………………….…….7 – 11
Токсичность…………………………………………………….…………….11
Список литературы…………………………………………………….…….12
Введение.
Натрий
– химический элемент главной подгруппы I группы периодической системы Менделеева. Его атомный номер 11, атомная масса 22,9898. Натрий
– серебристо-белый мягкий металл, на воздухе быстро окисляющийся с поверхности, легко режется ножом. Срез у натрия сразу после разреза имеет яркий металлический блеск, но быстро тускнеет вследствие крайне быстрого окисления металла. Природный элемент состоит из одного стабильного изотопа Na.
Природные соединения натрия (поваренная соль NaCI, сода Na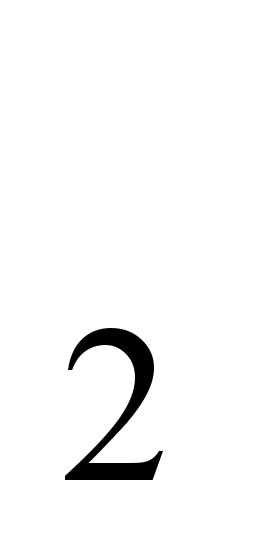 CO) известны с глубокой древности. Название «натрий»
, происходящее от арабского натрун
, греческого nitron
, первоначально относилось к природной соде. Уже в 18 веке химики знали много других соединений натрия. Однако сам металл был получен лишь в 1807 году Г.Дэви электролизом едкого натра NaOH. В Великобритании, США, Франции элемент называется Sodium
(от испанского слова soda – сода), в Италии – sodio
.
CO) известны с глубокой древности. Название «натрий»
, происходящее от арабского натрун
, греческого nitron
, первоначально относилось к природной соде. Уже в 18 веке химики знали много других соединений натрия. Однако сам металл был получен лишь в 1807 году Г.Дэви электролизом едкого натра NaOH. В Великобритании, США, Франции элемент называется Sodium
(от испанского слова soda – сода), в Италии – sodio
.
Нахождение в природе натрия и его соединений.
Натрий
– типичный элемент верхней части земной коры. Среднее содержание его в литосфере 2,5% по массе, в кислых изверженных породах (граниты и др.) 2,77%, в основных (базальты и др.) 1,94%, в ультраосновных (породы мантии) 0,57%. Благодаря изоморфизму Na и Ca
и Ca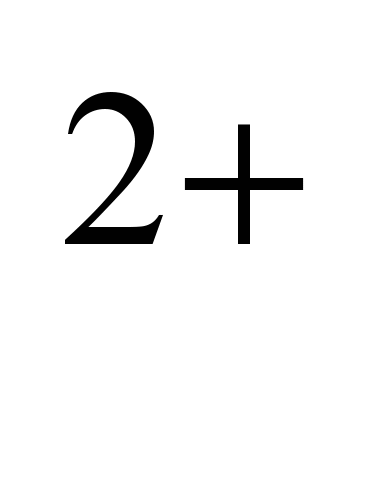 , обусловленному близостью их ионных радиусов, в магматических породах образуются натриево-кальциевые полевые шпаты
(плагиоклазы)
. В биосфере происходит резкая дифференциация натрия: осадочные породы в среднем обеднены натрием (в глинах и сланцах 0,66%), мало его в большинстве почв (среднее 0,63%). Общее число минералов натрия 222. Натрий слабо задерживается на континентах и приносится реками в моря и океаны, где его среднее содержание 1,035%. Na
– главный металлический элемент морской
воды
. При испарении в прибрежно-морских лагунах, а также в континентальных озёрах степей и пустынь осаждаются соли натрия, формирующие толщи соленосных пород. Главные минералы, являющиеся источником натрия и его соединений, - галит
(каменная соль) NaCI
,
чилийская селитра
NaNO
,
тенардит
NaSO
, обусловленному близостью их ионных радиусов, в магматических породах образуются натриево-кальциевые полевые шпаты
(плагиоклазы)
. В биосфере происходит резкая дифференциация натрия: осадочные породы в среднем обеднены натрием (в глинах и сланцах 0,66%), мало его в большинстве почв (среднее 0,63%). Общее число минералов натрия 222. Натрий слабо задерживается на континентах и приносится реками в моря и океаны, где его среднее содержание 1,035%. Na
– главный металлический элемент морской
воды
. При испарении в прибрежно-морских лагунах, а также в континентальных озёрах степей и пустынь осаждаются соли натрия, формирующие толщи соленосных пород. Главные минералы, являющиеся источником натрия и его соединений, - галит
(каменная соль) NaCI
,
чилийская селитра
NaNO
,
тенардит
NaSO ,
мирабилит или глауберова
соль
NaSO
,
мирабилит или глауберова
соль
NaSO
 10
HO
,
трона
NaH
(CO
)2
HO
,
бура
NaBO
10
HO
,
трона
NaH
(CO
)2
HO
,
бура
NaBO 10
HO
, сильвинит
KCI
NaCI
.
Мировая добыча натрия оценивается 110
10
HO
, сильвинит
KCI
NaCI
.
Мировая добыча натрия оценивается 110 тонн. Na
– важный биоэлемент
, в живом веществе в среднем содержится 0,02% натрия. В животных его больше, чем в растениях. Натрий – один из основных элементов, участвующих в минеральном обмене животных и человека. Содержится главным образом во внеклеточных жидкостях (в эритроцитах человека около 10 ммоль/кг, в сыворотке крови 143 ммоль/кг); содержание натрия в тканях растений около 0,01% на сырую массу.
тонн. Na
– важный биоэлемент
, в живом веществе в среднем содержится 0,02% натрия. В животных его больше, чем в растениях. Натрий – один из основных элементов, участвующих в минеральном обмене животных и человека. Содержится главным образом во внеклеточных жидкостях (в эритроцитах человека около 10 ммоль/кг, в сыворотке крови 143 ммоль/кг); содержание натрия в тканях растений около 0,01% на сырую массу.
Физические и химические свойства.
При обычной температуре натрий кристаллизуется в кубической решётке, а=4,28. Атомный радиус 1,86, ионный радиус Na 0,92. Плотность 0,968 г/см (19,7
(19,7 С), t
С), t =97,83С, t
=97,83С, t =882,9С; удельная теплоёмкость (20С) 1,2310дж/(кгК) или 0,295 кал/(гград); коэффициент теплопроводности 1,3210
=882,9С; удельная теплоёмкость (20С) 1,2310дж/(кгК) или 0,295 кал/(гград); коэффициент теплопроводности 1,3210 вт/(мК) или 0,317 кал/(смсекград); температурный коэффициент линейного расширения (20С) 7,110
вт/(мК) или 0,317 кал/(смсекград); температурный коэффициент линейного расширения (20С) 7,110 удельное электрическое сопротивление (0С) 4,310
удельное электрическое сопротивление (0С) 4,310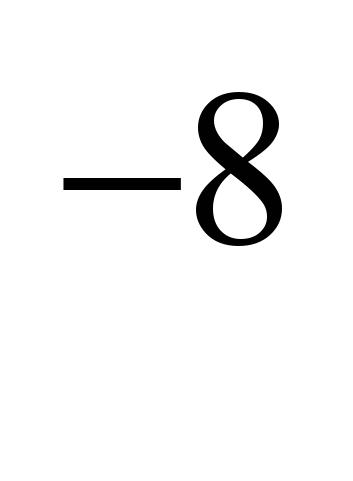 омм (4,310
омм (4,310 омсм). Натрий парамагнитен, удельная магнитная восприимчивость +9,210; весьма пластичен и мягок (легко режется ножом).
омсм). Натрий парамагнитен, удельная магнитная восприимчивость +9,210; весьма пластичен и мягок (легко режется ножом).
Натрий относится к щелочным металлам, так как его оксид имеет сильноосновный характер, и образуемый им гидроксид является сильным электролитом – щелочью. Нормальный электродный потенциал натрия -2,714 В; электродный потенциал в расплаве – 2,4 В. Пары натрия окрашивают пламя в характерный ярко-жёлтый цвет (качественная реакция на катионы щелочных металлов
). Электронная конфигурация атома натрия 1
s
2
s
2
p 3
s
3
s .
Натрий, как все щелочные металлы, имеет один s
-электрон на внешнем электронном слое, который при химических реакциях легко теряет, проявляя степень окисления +1
(во всех известных соединениях натрий одновалентен
). Поэтому Na
является
сильным восстановителем
. В твёрдом состоянии хорошо проводит электрический ток. Так как натрий легкоплавок и быстро окисляется на воздухе, его хранят без доступа воздуха и влаги, чаще всего под керосином. Натрий образует соединения с преимущественно ионной связью
, которые, как правило, растворимы в воде и легко диссоциируют на ионы. Для ионов щелочных металлов образование устойчивых комплексов нехарактерно. Химическая активность натрия очень высока
. Ряд солей кристаллизуется из раствора в форме кристаллогидратов: NaSO
.
Натрий, как все щелочные металлы, имеет один s
-электрон на внешнем электронном слое, который при химических реакциях легко теряет, проявляя степень окисления +1
(во всех известных соединениях натрий одновалентен
). Поэтому Na
является
сильным восстановителем
. В твёрдом состоянии хорошо проводит электрический ток. Так как натрий легкоплавок и быстро окисляется на воздухе, его хранят без доступа воздуха и влаги, чаще всего под керосином. Натрий образует соединения с преимущественно ионной связью
, которые, как правило, растворимы в воде и легко диссоциируют на ионы. Для ионов щелочных металлов образование устойчивых комплексов нехарактерно. Химическая активность натрия очень высока
. Ряд солей кристаллизуется из раствора в форме кристаллогидратов: NaSO 10HO, NaCO
10HO, NaCO 10HO, NaBO
10HO, NaBO 10HO, являющихся по своей структуре тектогидратами. Тектогидраты имеют строение льда, в полостях которого равномерно расположены противоположно заряженные ионы.
10HO, являющихся по своей структуре тектогидратами. Тектогидраты имеют строение льда, в полостях которого равномерно расположены противоположно заряженные ионы.
Химические свойства:
Взаимодействие с простыми веществами:
1) Реакция с галогенами : 2Na + CI= 2NaCI (хлорид натрия)
С фтором и хлором натрий взаимодействует непосредственно при обычной температуре (энергично сгорает в хлоре, что особенно хорошо наблюдать в хлоркальциевой трубке, в которой через расплавленный и сильно разогретый натрий пропускают ток хлора), с бромом – только при нагревании; с йодом прямого взаимодействия не наблюдается.
Хлорид натрия
(поваренная соль) NaCI
кристаллизуется в виде кубических кристаллов, не имеет запаха, обладает солёным вкусом, хорошо растворим в воде. С изменением температуры его растворимость почти не меняется. Это имеет определенное значение при выделении поваренной соли из растворов других солей методом перекристаллизации.
2) Реакция с кислородом:
4Na + O= 2NaO (оксид натрия)
2Na + O= NaO(пероксид натрия)
При непосредственном взаимодействии с кислородом в зависимости от условий образуются окись NaO (окисление в небольшом количестве кислорода при температуре около 180С) или перекись NaO - бесцветные кристаллические вещества. Оксид натрия – твёрдое гигроскопичное вещество, легко взаимодействующее с водой, имеет сильноосновный характер. При взаимодействии с водой образует щелочь (едкий натр):
NaO +HO = 2NaOH
Гидроксид натрия или едкий натр NaOH является очень важным соединением натрия. Его называют также каустической содой или просто каустиком. Для получения едкого натра используют поваренную соль – наиболее дешёвое природное соединение натрия. Эту соль подвергают электролизу, но в этом случае применяют не расплав, а раствор соли. Едкий натр – твёрдое кристаллическое вещество белого цвета, прекрасно растворимое в воде. При растворении едкого натра в воде выделяется большое количество тепла, и раствор сильно разогревается. Едкий натр необходимо хранить в хорошо закупоренных сосудах, чтобы предохранить его от проникновения водяных паров, под действием которых он может сильно увлажниться, а также оксида углерода (IV), под действием которого едкий натр может постепенно превратиться в карбонат натрия:
2NaOH + CO = NaCO +HO
Пероксид натрия (желтоватый порошок) является сильнейшим окислителем. При действии воды он образует щелочь и пероксид водорода (если процесс вести при нагревании, то вследствие разложения HO выделяется кислород):
NaO+2HO = HO + 2NaOH
При действии разбавленных кислот на пероксид натрия образуется пероксид водорода: NaO +HSO= NaSO+HO
С углекислым газом воздуха пероксид натрия реагирует по уравнению:
2NaO + 2CO= 2NaCO +O
Поэтому его используют в дыхательных аппаратах для регенерации воздуха – поглощения оксида углерода (IV) и выделения кислорода.
На воздухе натрий мгновенно окисляется. Поэтому его хранят под слоем органических растворителей (керосин или парафин, причем парафин предпочтительнее, так как в керосине всё же растворяется некоторое количество воздуха и окисление натрия, хотя и медленно, но происходит).
В реакциях с галогенами и кислородом натрий наиболее энергично проявляет восстановительные способности.
3) Реакция с серой:
2Na + S = NaS (сульфид натрия)
При растирании в ступке с серой натрий реагирует бурно, образуя натрия сульфид. Реакция сопровождается вспышками, поэтому ступку нужно держать подальше от глаз и обернуть руку полотенцем. Для реакции берут небольшие кусочки натрия.
4) Реакция с азотом:
6Na + N= 2NaN (нитрид натрия)
Взаимодействие паров натрия с азотом в поле тихого электрического разряда приводит к образованию нитрида натрия.
5) Реакция с углеродом:
2Na + C = NaC
(карбид натрия)
Взаимодействие паров натрия с углеродом при 800-900С приводит к получению карбида NaC.
6) Реакция с фосфором:
3Na + P = NaP (фосфид натрия)
7) Реакция с водородом:
2Na + H= 2NaH (гидрид натрия)
Реакция натрия с водородом начинается при 200С и приводит к получению гидрида NaH – бесцветного гигроскопичного кристаллического вещества. Это солеподобное соединение, которое по характеру химической связи и величине степени окисления отличается от летучих водородных соединений элементов главных подгрупп IV – VII группы.
Натрий является сильным восстановителем, поэтому восстанавливает водород до степени окисления –1.
Взаимодействие со сложными веществами:
1) С кислотами:
2Na + 2HCI = 2NaCI +H
В электрохимическом ряду напряжений металлов натрий находится до водорода, поэтому восстанавливает ионы водорода из разбавленных кислот.
Минеральные кислоты образуют с натрием соответствующие растворимые в воде соли, однако по отношению к 98-100%-ной серной кислоте натрий сравнительно инертен.
2) С водными растворами солей:
Натрий, как металл с сильными восстановительными свойствами, в этих условиях будет восстанавливать водород воды, а не металл соответствующей соли.
3) С водой:
2Na + 2HOH = 2NaOH + H
Натрий реагирует с водой, вытесняя из неё водород (так как является весьма активным металлом, в ряду напряжений стоит намного левее водорода), при обычных условиях, и в результате этой реакции образуется растворимое в воде основание NaOH и выделяется H; реакция может сопровождаться взрывом.
4) С аммиаком:
Натрий растворяется в жидком аммиаке (34,6 г на 100 г NH при 0С) с образованием аммиачных комплексов. При пропускании газообразного аммиака через расплавленный натрий при 300-350С образуется амид натрия
NaNH
- бесцветное кристаллическое вещество, легко разлагаемое водой.
5) Со спиртами:
2CHOH + 2Na = 2CHONa + H
При взаимодействии натрия со спиртами водород гидроксила замещается натрием с образованием алкоголятов (этилат натрия).
Известно большое число натрийорганических соединений, которые по химическим свойствам весьма сходны с литийорганическими соединениями, но превосходят их по реакционной способности. Применяют натрийорганические соединения в органическом синтезе, как алкилирующие агенты.
Сплавы
.
Натрий входит в состав многих практически важных сплавов. Сплавы Na – K, содержащие 40-90% K (по массе) при температуре около 25С, - серебристо-белые жидкости, отличающиеся высокой химической активностью, воспламеняющиеся на воздухе. Электропроводность и теплопроводность жидких сплавов Na – K ниже соответствующих величин для Na и K. Амальгамы натрия
легко получаются при введении металлического натрия в ртуть; при содержании свыше 2,5% Na (по массе) при обычной температуре являются уже твёрдыми веществами.
Получение и применение.
Основной промышленный метод получения натрия – электролиз расплава
поваренной соли
NaCI
, содержащей добавки
KCI
,
NaF
,
CaCI
и др. (пироэлектрометаллургия), которые снижают температуру плавления соли до 575-585С. Электролиз чистого NaCI привёл бы к большим потерям натрия от испарения, так как температуры плавления NaCI (801С) и кипения Na (882,9С) очень близки. Электролиз проводят в электролизёрах с диафрагмой (анодное и катодное пространство разделено диафрагмой, которая изолирует образующийся хлор от натрия, чтобы не произошло обратной реакции), катоды изготовляют из железа или меди, аноды – из графита. Одновременно с натрием получают хлор. В расплавленную соль опускают электроды. Положительный ион натрия принимает с катода электрон и превращается в нейтральный атом натрия. Нейтральные атомы натрия собираются на катоде в виде расплавленного металла. Происходящий на катоде процесс можно изобразить схемой: Na
+


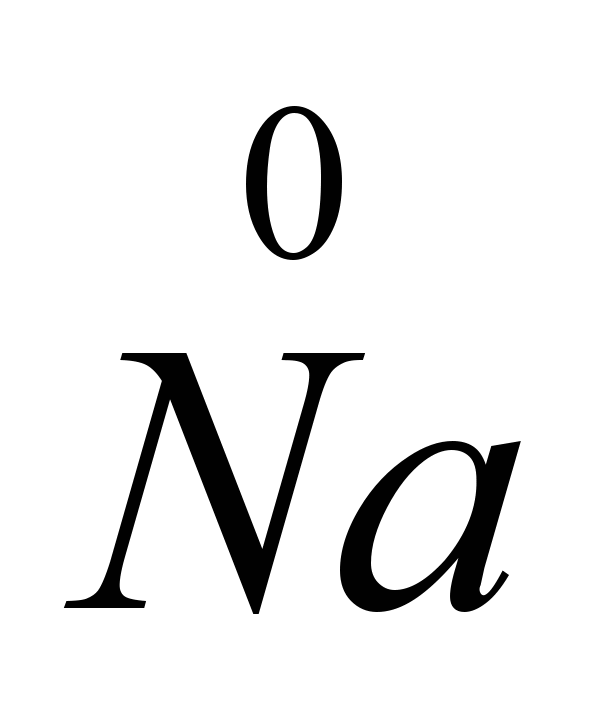
Поскольку на катоде происходит принятие электронов, а всякое принятие электронов атомом или ионом является восстановлением, то ионы натрия на катоде восстанавливаются. На аноде ионы хлора отдают электроны, т.е. происходит процесс окисления и выделения свободного газообразного хлора, что можно изобразить следующей схемой: CI -
-
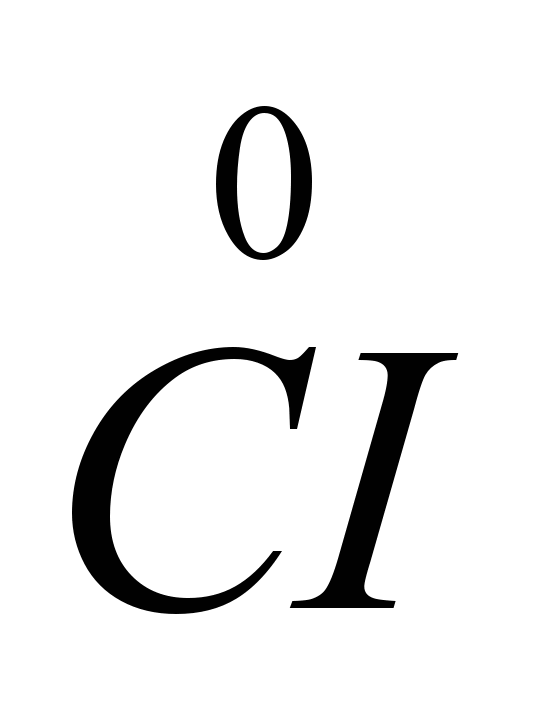
Сохранился и старый способ получения натрия – электролиз расплавленного едкого натра NaOH , который значительно дороже NaCI, однако электролитически разлагается при более низкой температуре (320-330С).
Натрий и его сплавы широко применяются как теплоносители для процессов, требующих равномерного обогрева в интервале 450-650С – в клапанах авиационных двигателей и особенно в ядерных энергетических установках. В последнем случае жидкометаллическими теплоносителями служат сплавы Na – K (оба элемента имеют малые сечения поглощения тепловых нейтронов, для Na 0,49 барн); эти сплавы отличаются высокими температурами кипения и коэффициентами теплопередачи и не взаимодействуют с конструкционными материалами при высоких температурах, развиваемых в энергетических ядерных реакторах. Соединение NaPb (10% Na по массе) применяется в производстве тетраэтилсвинца – наиболее эффективного антидетонатора . В сплаве на основе свинца (0,73% Ca, 0,58% Na и 0,04% Li), применяемом для изготовления осевых подшипников железнодорожных вагонов, натрий является упрочняющей добавкой. В металлургии натрий служит активным восстановителем при получении некоторых редких металлов (Ti, Zr, Ta) методами металлотермии; в органическом синтезе – в реакциях восстановления, конденсации, полимеризации и др. Иногда натрием заменяют в электротехнике медь, которая в 9 раз тяжелее этого металла; шины для больших токов делают из стальных труб, заполненных натрием. Первый в мире синтетический каучук, полученный в 1928 году академиком С. В. Лебедевым, был назван натрийбутадиеновым, так как натрий явился катализатором процесса полимеризации бутадиена. Натрий используют как восстановитель в органическом синтезе, в частности для восстановления жирных кислот в высшие спирты, применяемые в производстве синтетических моющих средств.
В медицине из препаратов натрия наиболее часто применяют натрия сульфат
NaSO
, хлорид
NaCI
(при кровопотерях, потерях жидкости, рвоте и т.п.), борат
NaBO
10
HO
(как антисептическое средство), гидрокарбонат
NaHCO
(как отхаркивающее средство, а также для промываний и полосканий при ринитах, ларингитах, диабете и др.), тиосульфат
NaSO (сода) нужен для производства стекла, алюминия, моющих средств и красок).
NaCIO + HO + CO= NaHCO +HCIO
NaOH применяется также в бумажной промышленности, в мыловарении, в производстве искусственных волокон, в гальванотехнике, для очистки нефтяных продуктов и фракций каменноугольной смолы. NaOH применяют для щелочной очистки плодов и овощей (корнеплодов, цитрусовых, помидоров и др.), которая облегчается из-за щелочного гидролиза некоторых веществ, приводящего к нарушению связи кожуры с мякотью. Крепким раствором NaOH очищают котлы и радиаторы от накипи. Хлорид натрия NaCI используют в химической промышленности для получения хлора, едкого натра, соды, хлорной извести, некоторых видов пластмасс и органических соединений. Натриевую селитру NaNO используют как минеральное удобрение. Силикат натрия NaSiO - один из немногих растворимых в воде силикатов. Его называют растворимым стеклом , а раствор – жидким стеклом . Растворимым стеклом пропитывают древесину и ткани, чтобы предохранить их от воспламенения. Жидкое стекло входит в состав огнеупорных замазок для склеивания стекла, фарфора, камня. Нитрит натрия NaNO применяют в качестве ингибитора, замедляющего коррозию стали в воде и растворах солей (создаёт на поверхности металла защитную плёнку).
Амид натрия NaNH , получаемый при взаимодействии жидкого аммиака с натрием, нужен для производства синего красителя – индиго и витамина А.
В основном пероксид натрия NaO используют для отбелки бумаги и регенерации воздуха в подводных лодках; ранее он широко применялся для отбеливания соломенных шляп.
Для определения содержания влаги в органических веществах их смешивают с амальгамой (раствором в ртути) натрия. В результате взаимодействия с водой выделяется эквивалентное количество H, по объёму которого находят содержание влаги во взятой пробе.
Широкое применение в быту имеют такие соединения натрия как поваренная соль NaCI и сода NaCO . Суточная потребность человека в хлористом натрии колеблется от 2 до 10г и зависит от количества этой соли, теряемой с потом.
Искусственно полученные радиоактивные изотопы  Na (период полураспада T
Na (период полураспада T =2,64 г) и
=2,64 г) и 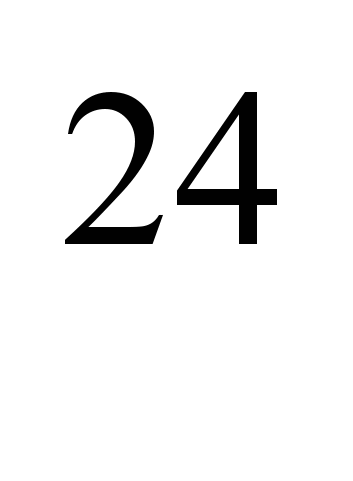 Na (T= 15 ч) применяют для определения скорости кровотока в отдельных участках кровеносной системы при сердечно-сосудистых и лёгочных заболеваниях, облитерирующем эндартериите и др. Радиоактивные растворы солей натрия (например, NaCI) используют также для определения сосудистой проницаемости, изучения общего содержания обменного натрия в организме, водно-солевого обмена, всасывания из кишечника, процессов нервной деятельности и в некоторых др. экспериментальных исследованиях.
Na (T= 15 ч) применяют для определения скорости кровотока в отдельных участках кровеносной системы при сердечно-сосудистых и лёгочных заболеваниях, облитерирующем эндартериите и др. Радиоактивные растворы солей натрия (например, NaCI) используют также для определения сосудистой проницаемости, изучения общего содержания обменного натрия в организме, водно-солевого обмена, всасывания из кишечника, процессов нервной деятельности и в некоторых др. экспериментальных исследованиях.
Натрий – один из основных элементов, участвующих в минеральном обмене животных и человека. Участвует в поддержании осмотического давления
и кислотно-щелочного равновесия
, в проведении нервных импульсов. Концентрация ионов натрия в организме регулируется в основном гормоном коры надпочечников – альдостероном
. Несмотря на относительно высокое содержание натрия в тканях растений (около 0,01% на сырую массу), его роль в жизни растений изучена недостаточно. У галофитов
(виды, произрастающие на сильно засоленных почвах) натрий создаёт высокое осмотическое давление в клеточном соке и тем самым способствует извлечению воды из почвы.
Токсичность.
Вследствие большой химической активности натрия обращение с ним требует осторожности. Особенно опасно попадание на натрий воды, которое может привести к пожару и взрыву. Глаза должны быть защищены очками, руки – толстыми резиновыми перчатками; соприкосновение натрия с влажной кожей или одеждой может вызвать тяжёлые ожоги.
Загоревшийся щелочной металл нельзя тушить водой. Лучше всего засыпать его порошком кальцинированной соды.
Едкий натр при попадании на кожу может причинить сильные ожоги, поэтому кристаллическую щелочь следует брать не руками, а только щипцами или пинцетом. При попадании на кожу раствора щелочи необходимо, прежде всего, смыть раствор до исчезновения ощущения мылкости большим количеством воды, а затем нейтрализовать раствором борной кислоты.
Список литературы.
Ситтиг М. «Натрий, его производство, свойства и применение», пер. с англ.,1961.
- Рипан Р., Четяну И. «Неорганическая химия», т.1, пер. с рум., 1971.
Павлов Н.Н. «Общая и неорганическая химия», издательство «Дрофа», 2002.
Крючкова-Чернобельская Г.М. «Неорганическая химия», 3-е изд., издательство «Медицина», 1980.
НАТРИЙ - (Natrium) Na, химический элемент 1-й (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 11, относительная атомная масса 22,98977. В природе имеется один стабильный изотоп 23 Na. Известны шесть радиоактивных изотопов этого элемента, причем два из них представляют интерес для науки и медицины. Натрий-22 с периодом полураспада 2,58 года используют в качестве источника позитронов. Натрий-24 (его период полураспада около 15 часов) применяют в медицине для диагностики и для лечения некоторых форм лейкемии.
Степень окисления +1.
Соединения натрия известны с древних времен. Хлорид натрия - необходимейший компонент человеческой пищи. Cчитается, что человек начал употреблять его в неолите, т.е. около 5-7 тыс. лет назад.
В Ветхом завете упоминается некое вещество «нетер». Это вещество использовалось как моющее средство. Скорее всего, нетер - это сода, карбонат натрия, который образовывался в соленых египетских озерах с известковыми берегами. Об этом же веществе, но под названием «нитрон» писали позже греческие авторы Аристотель и Диоскорид, а древнеримский историк Плиний Старший, упоминая это же вещество, называл его уже «нитрум».
В 18 в. химикам было известно уже очень много различных соединений натрия. Соли натрия широко применялись в медицине, при выделке кож, при крашении тканей.
Металлический натрий получил впервые английский химик и физик Гемфри Дэви электролизом расплавленного гидроксида натрия (с использованием вольтова столба из 250 пар медных и цинковых пластин). Название «sodium», выбранное Дэви для этого элемента, отражает его происхождение из соды Na 2 CO 3 . Латинское и русское названия элемента произведены от арабского «натрун» (природная сода).
Распространение натрия в природе и его промышленное извлечение.
Натрий - седьмой из наиболее распространенных элементов и пятый из наиболее распространенных металлов (после алюминия, железа, кальция и магния). Его содержание в земной коре составляет 2,27%. Большая часть натрия находится в составе различных алюмосиликатов.
Огромные отложения солей натрия в сравнительно чистом виде существуют на всех континентах. Они являются результатом испарения древних морей. Этот процесс по-прежнему продолжается в озере Солт-Лейк (штат Юта), Мертвом море и других местах. Натрий встречается в виде хлорида NaCl (галит, каменная соль), а также карбоната Na 2 CO 3 ·NaHCO 3 ·2H 2 O (трона), нитрата NaNO 3 (селитра), сульфата Na 2 SO 4 ·10H 2 O (мирабилит), тетрабората Na 2 B 4 O 7 ·10 H 2 O (бура) и Na 2 B 4 O 7 ·4H 2 O (кернит) и других солей.
Неиссякаемые запасы хлорида натрия есть в природных рассолах и океанических водах (около 30 кг м -3). Подсчитано, что каменная соль в количестве, эквивалентном содержанию хлорида натрия в Мировом океане, занимала бы объем 19 млн. куб. км (на 50% больше, чем общий объем Североамериканского континента выше уровня моря). Призма такого объема с площадью основания 1 кв. км может достичь Луны 47 раз.
Сейчас суммарное производство хлорида натрия из морской воды достигло 6-7 млн. т в год, что составляет около трети общей мировой добычи.
В живом веществе в среднем содержится 0,02% натрия; в животных его больше, чем в растениях.
Характеристика простого вещества и промышленное получение металлического натрия.
Натрий - серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см 3 (при 19,7° С), температура плавления 97,86° С, температура кипения 883,15° С.
У тройного сплава, содержащего 12% натрия, 47% калия и 41% цезия, - самая низкая температура плавления для металлических систем, равная -78° С.
Натрий и его соединения окрашивают пламя в ярко-желтый цвет. Двойная линия в спектре натрия отвечает переходу 3s 1-3p 1 в атомах элемента.
Химическая активность натрия высока. На воздухе он быстро покрывается пленкой из смеси пероксида, гидроксида и карбоната. В кислороде, фторе и хлоре натрий горит. При сжигании металла на воздухе образуется пероксид Na 2 O 2 (с примесью оксида Na 2 O).
С серой натрий реагирует уже при растирании в ступке, серную кислоту восстанавливает до серы или даже до сульфида. Твердый диоксид углерода («сухой лед») при контакте с натрием взрывается (углекислотные огнетушители для тушения горящего натрия применять нельзя!). С азотом реакция идет только в электрическом разряде. Не взаимодействует натрий лишь с инертными газами.
Натрий активно реагирует с водой:
2Na + 2H 2 O = 2NaOH + H 2
Тепла, которое выделяется при реакции, достаточно, чтобы расплавить металл. Поэтому, если маленький кусочек натрия бросить в воду, он за счет теплового эффекта реакции плавится и капелька металла, который легче воды, «бегает» по поверхности воды, подгоняемая реактивной силой выделяющегося водорода. Со спиртами натрий взаимодействует намного спокойнее, чем с водой:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2
Натрий легко растворяется в жидком аммиаке с образованием ярко-голубых метастабильных растворов с необычными свойствами. При -33,8° С в 1000 г аммиака растворяется до 246 г металлического натрия. Разбавленные растворы имеют синий цвет, концентрированные - цвет бронзы. Они могут храниться около недели. Установлено, что в среде жидкого аммиака натрий ионизуется:
Константа равновесия этой реакции равна 9,9·10 -3 . Уходящий электрон сольватируется молекулами аммиака и образует комплекс - . Полученные растворы обладают металлической электропроводностью. При испарении аммиака остается исходный металл. При длительном хранении раствора он постепенно обесцвечивается за счет реакции металла с аммиаком с образованием амида NaNH 2 или имида Na 2 NH и выделением водорода.
Хранят натрий под слоем обезвоженной жидкости (керосин, минеральное масло), перевозят только в запаянных металлических сосудах.
Электролитический способ промышленного получения натрия был разработан в 1890. Электролизу подвергали расплав едкого натра, как в опытах Дэви, но с использованием более совершенных источников энергии, чем вольтов столб. В этом процессе наряду с натрием выделяется кислород:
анод (никелевый): 4OH - - 4e - = O 2 + 2H 2 O.
При электролизе чистого хлорида натрия возникают серьезные проблемы, связанные, во-первых, с близкими температурой плавления хлорида натрия и температурой кипения натрия и, во-вторых, с высокой растворимостью натрия в жидком хлориде натрия. Добавление к хлориду натрия хлорида калия, фторида натрия, хлорида кальция позволяет снизить температуру расплава до 600° С. Производство натрия электролизом расплавленной эвтектической смеси (сплав двух веществ с самой низкой температурой плавления) 40% NaCl и 60% CaCl 2 при ~580° С в ячейке, разработанной американским инженером Г.Даунсом, было начато в 1921 Дюпоном вблизи электростанции у Ниагарского водопада.
На электродах протекают следующие процессы:
катод (железный): Na + + e - = Na
Ca 2+ + 2e - = Ca
анод (графитовый): 2Cl - - 2e - = Cl 2 .
Металлические натрий и кальций образуются на цилиндрическом стальном катоде и поднимаются с помощью охлаждаемой трубки, в которой кальций затвердевает и падает обратно в расплав. Хлор, образующийся на центральном графитовом аноде, собирается под никелевым сводом и затем очищается.
Сейчас объем производства металлического натрия составляет несколько тысяч тонн в год.
Похожие статьи
-
Этногенез и этническая история русских
Русский этнос - крупнейший по численности народ в Российской Федерации. Русские живут также в ближнем зарубежье, США, Канаде, Австралии и ряде европейских стран. Относятся к большой европейской расе. Современная территория расселения...
-
Людмила Петрушевская - Странствия по поводу смерти (сборник)
В этой книге собраны истории, так или иначе связанные с нарушениями закона: иногда человек может просто ошибиться, а иногда – посчитать закон несправедливым. Заглавная повесть сборника «Странствия по поводу смерти» – детектив с элементами...
-
Пирожные Milky Way Ингредиенты для десерта
Милки Вэй – очень вкусный и нежный батончик с нугой, карамелью и шоколадом. Название конфеты весьма оригинальное, в переводе означает «Млечный путь». Попробовав его однажды, навсегда влюбляешься в воздушный батончик, который принес...
-
Как оплатить коммунальные услуги через интернет без комиссии
Оплатить услуги жилищно-коммунального хозяйства без комиссий удастся несколькими способами. Дорогие читатели! Статья рассказывает о типовых способах решения юридических вопросов, но каждый случай индивидуален. Если вы хотите узнать, как...
-
Когда я на почте служил ямщиком Когда я на почте служил ямщиком
Когда я на почте служил ямщиком, Был молод, имел я силенку, И крепко же, братцы, в селенье одном Любил я в ту пору девчонку. Сначала не чуял я в девке беду, Потом задурил не на шутку: Куда ни поеду, куда ни пойду, Все к милой сверну на...
-
Скатов А. Кольцов. «Лес. VIVOS VOCO: Н.Н. Скатов, "Драма одного издания" Начало всех начал
Некрасов. Скатов Н.Н. М.: Молодая гвардия , 1994. - 412 с. (Серия "Жизнь замечательных людей") Николай Алексеевич Некрасов 10.12.1821 - 08.01.1878 Книга известного литературоведа Николая Скатова посвящена биографии Н.А.Некрасова,...
