Hogyan nyerhető a tejsav? Tejsav kémiai és fizikai tulajdonságok Tejsav kémiai kézikönyv
A tejsav katalógusszáma: CAS 50-21-5
A tejsav leírása:
Szinte átlátszó, enyhén sárgás, higroszkópos, szirupos folyadék, enyhén savanykás szaggal, amely aludttejre emlékeztet. Oldódik vízben, etanolban, rosszul oldódik benzolban, kloroformban és más halogénezett szénhidrogénekben. Különféle optikailag aktív D és L izomerek léteznek. Valamint a D és L optikailag inaktív keveréke. Ez utóbbit kémiai szintézissel, az aktív formákat pedig bakteriális szintézissel nyerik. (enzim módszer) Az emberi szervezetben az L optikailag aktív formája vesz részt a Kreps-ciklusban, ezért adalékanyagként javasolt (tejsav, E270), más iparágakban ez nem különleges szerepet játszanak.
A tejsav globális elnevezés Oroszországban nem honosodott meg, de laktátsóinak neve mindenhol megtalálható, a kalcium-tejsavnál sokkal gyakrabban vágjuk a kalcium-laktátot.
80%-os tejsavra vonatkozó előírás.
Forráspont (100%-os oldat) 122 °C (115 Hgmm)
Fajsúly (20 °C) 1.22
Vízben való oldhatóság Teljesen oldódik
Sűrűség (20°C-on) 1,18-1,20 g/ml
Nehézfémek, legfeljebb 0,001%
Vastartalom, legfeljebb 0,001%
Arzéntartalom, legfeljebb 0,0001%
Kloridtartalom legfeljebb 0,002% (valójában 0,0015%)
Szulfáttartalom, legfeljebb 0,01% (valójában 0,004%)
A kalcinálás utáni maradék legfeljebb 0,1% (valójában 0,06%)
Gyártó: Kína
Csomagolás: 25 kg-os hordók vagy 1200 kg-os kockák
A tejsav alapvető fizikai tulajdonságai:
Olvadáspont: 17°C Optikailag inaktív (racematikus),
25-26 °C optikailag aktív + vagy - forma
(Az olvadási hőmérséklet különbségei lehetővé teszik a drágább optikailag aktív formák minőségi és gyors megkülönböztetését az olcsóbb inaktívaktól!!)
Relatív sűrűség (víz = 1): 1.2
Vízben való oldhatóság: elegyedik
Molekulatömeg: 90,08 g/mol
Lobbanáspont: 110°C c.c.
Oktanol/víz megoszlási hányados log Pow: -0,6
Robbanás- és tűzveszély:
Támogatja az égést normál körülmények között. spontán égés nem valószínűKerülje a nyílt lángot és a dohányzást.
Tűzoltás: porral, alkoholálló habbal, vízpermettel,
szén-dioxid.
Kémiai stabilitás: Normál hőmérsékleten és nyomáson stabil.
Kerülendő körülmények: Porképződés, túlzott hőség.
Összeférhetetlenség más anyagokkal: Erős oxidálószerek, ásványi savak.
Veszélyes bomlástermékek: Nitrogén-oxidok, szén-monoxid, szén-dioxid, gőzök
cianid.
Veszélyes polimerizáció: Nincs megjelölve.
Veszély az emberre:
A szervezetbe jutás módjai: Az anyag bejuthat a szervezetbe az aeroszol belégzésével és a szájon keresztül.
Az MPC-t meghaladó koncentrációknak való rövid távú expozíció esetén: Az anyag irritálja/izgatja a bőrt és a légutakat és maró hatású is.
hatása a szemre. Lenyelve maró hatású.
Szembe kerülés esetén: Vörösség. Fájdalom. Súlyos mély égési sérülések. Védőszemüveg-maszk, ill
védőmaszk. Először öblítse le bő vízzel több alkalommal
perc (ha ez nem nehéz, távolítsa el a kontaktlencsét), majd vigye el orvoshoz.
A munkaterület szabványai:
A TLV-t (US TLV) nem állapították meg.
Rákkeltő hatás: Az ACGIH, az IARC, az NTP vagy a CA Prop 65 nem tartalmazza.
Járványtan: Nincs információ.
Tetratogenitás: Nincs információ.
Reproduktív hatások: Nincs információ.
Mutagenitás: nincs információ
Neurotoxicitás: Nincs információ.
Az állatkísérletek kimutatták:
LD50/LC50:
Draize-teszt, nyúl, szemek: 100 mg Súlyos;
Draize teszt, nyúl, bőr: 500 mg/24H Enyhe;
Belégzés, patkány: LC50 = >26 mg/m(kocka)/1H;
Orális, egér: LD50 = 1940 mg/kg;
Orális, patkány: LD50 = 1700 mg/kg;
Bőr, nyúl: LD50 = >10 g/kg;
Figyelem. Az információ az anyag koncentrátumáról kis mennyiségben és koncentrációban van megadva, a jelenleg rendelkezésre álló adatok szerint a tejsav ártalmatlan!
Tejsav(2-hidroxi-propionsav) CH 3 CH(OH)COOH, molekulatömeg 90,1; színtelen. Ismeretes az L(+)-tejsav, a D(–)-tejsav (hús-tejsav) és a racém tejsavas fermentációs tejsav. D, L- és D-tejsav esetében az olvadáspont 18 °C és 53 °C; t ill. 85°C/1 Hgmm és 103 °C/2 Hgmm; D-tejsavhoz [α] D 20 -2,26 (koncentráció 1,24% in. D,L-tejsav D esetén H 0 minta - 682,45 kJ/mol; D H 0 pl 11,35 kJ/mol; D H isp 110,95 kJ/mol (25 °C), 65,73 kJ/mol (150 °C). Az L-tejsav D esetében H 0 égés - 1344,8 kJ/mol; D H 0 obp -694,54 kJ/mol; D H 0 pl 16,87 kJ/mol.
A tejsav nagy higroszkópossága miatt általában tömény vizes oldatait használják - szirupos, színtelen, szagtalan. Tejsav vizes oldataihoz d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 és 28,5 mPa. s (25 0 C) ill. 45,48 és 85,32%-os oldatokhoz; g 46,0. 10-3 N/m (25°C) 1 M oldatra; e 22 (17 °C). A tejsav oldódik más halogénezett szénhidrogénekben, de rosszul oldódik; r K a 3,862 (25 °C); A vizes oldatok pH-ja 1,23 (37,3%), 0,2 (84,0%).
Tejsav akrilsavvá dehidratálódik, HBr-mal hevítve 2-bróm-propionsavat képez, amikor a Ca-só reagál PCl 5-tel vagy SOCl 2 -2-klór-propionil-kloriddal. Ásványi savak jelenlétében a tejsav autoészterezése megtörténik az (I) általános képletű vegyület, valamint a lineáris poliészterek képződésével. A tejsav reakciója során RCH 2 CH(OH)COOH hidroxisavak képződnek, ha pedig a tejsav alkoholokkal reagál, észterek keletkeznek. A tejsav sóit és észtereit laktátoknak nevezzük (lásd a táblázatot).
tejsav keletkezik a tejsav hatására (tej savanyítása, savanyú káposzta, zöldségek savanyítása, sajt érlelése, takarmány silózása során); A D-tejsav megtalálható az állatok, növények szöveteiben és mikroorganizmusokban is.
Az iparban a tejsavat 2-klór-propionsavból és annak (100 °C) vagy laktonitrilből CH 3 CH(OH)CN-ből (100 °C, H 2 SO 4) állítják elő, majd észterképzéssel, izolálással és hidrolízissel. ami kiváló minőségű termékhez vezet. Más módszerek is ismertek a tejsav előállítására: propilén oxidációja nitrogén-oxidokkal (15-20 °C), majd H 2 SO 4-gyel, CH 3 CHO kölcsönhatása CO-val (200 ° C, 20 MPa).
EGYES LAKTÁTOK TULAJDONSÁGAI

A tejsavat az élelmiszeriparban, pácfestésben, cserzésben, fermentációs műhelyekben baktériumölőként, gyógyszergyártáshoz, lágyítószerként használják. Az etil- és butil-laktátokat cellulóz-éterek, szárítóolajok és növényi olajok oldószereként használják; butil-laktát – egyes szintetikus polimerek oldószereként is.
A világ tejsavtermelése 40 ezer tonna (1983).
Megvilágított.: Holten C.H., Tejsav. Tulajdonságok és kémia. Tejsavak és származékai, Weisheim, 1971. Yu A. Treger.
Válassza ki a cikk címének első betűjét:
Hidroxi savak (alkoholsavak) a karbonsavak származékai, amelyek a karboxilcsoporthoz kapcsolódó gyökben egy, két vagy több hidroxilcsoportot tartalmaznak.
A karboxilcsoportok számától függően a hidroxisavakat egybázisú, kétbázisú stb. A hidroxilcsoportok teljes számától függően a hidroxisavakat egy- vagy többértékű savakra osztják.
A gyök természetétől függően a hidroxisavak telítettek és telítetlenek, aciklusosak, ciklusosak vagy aromásak.
A hidroxisavakban a következő típusú izoméria fordul elő:
szerkezeti(a gyöklánc izomériája, a karboxil és hidroxil relatív helyzetének izomériája);
optikai(tükör) aszimmetrikus szénatomok jelenléte miatt.
A hidroxisavakat a sav nevével nevezik el „oxi” vagy „dioxi” stb. hozzáadásával. A triviális nómenklatúrát is széles körben használják.
HO–CH 2 –COOH
glikolsav (hidroxi-ecetsav)
tej (α-hidroxi-propion)
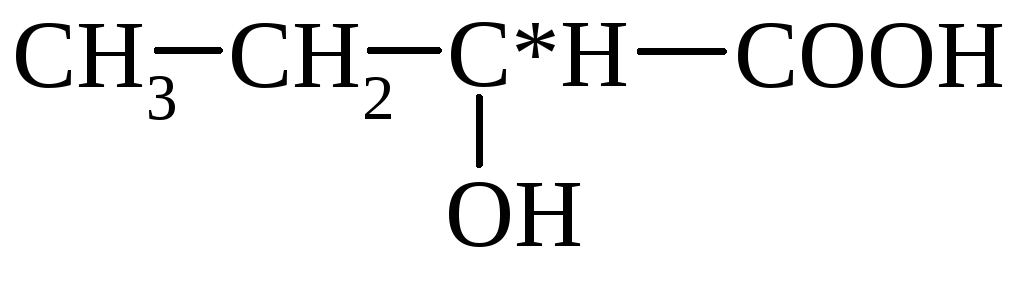

α-hidroxi-vajsav β-hidroxi-vajsav
(2-hidroxibután) (3-hidroxibután)
Fizikai tulajdonságok. Az alsóbbrendű hidroxisavak leggyakrabban sűrű, szirupos anyagok. A hidroxisavak bármilyen arányban elegyednek vízzel, és a molekulatömeg növekedésével az oldhatóság csökken.
Kémiai tulajdonságok.
1. Savas tulajdonságok - a hidroxisavak a karboxilra jellemző összes reakciót adják: sók, észterek, amidok, savhalogenidek képződését stb. A hidroxisavak erősebb elektrolitok, mint a megfelelő karbonsavak (a hidroxilcsoport hatása).

2. Az alkohol tulajdonságai – a hidroxicsoport hidrogénszubsztitúciós reakciói, éterek és észterek képződése, –OH halogénnel való helyettesítése, intramolekuláris dehidratáció, oxidáció.
klór-ecetsav-glikol-glioxál
sav sav sav
a) HO–CH 2 –COOH + CH 3 OHNO–CH 2 –CO–O–CH 3 + H 2 O
glikolsav és metil-alkohol észtere
b) HO–CH 2 –COOH + 2CH 3 ONCH 3 –O–CH 2 –COOCH 3 + 2H 2 O
glikol-metil-metil-éter
savas alkohol metoxi-ecetsav
(teljes adás)
3. A hidroxisavak kapcsolata a melegítéssel - hevítéskor az α-hidroxisavak leválasztják a vizet, két α-hidroxisav-molekulából felépülő ciklikus észtert képezve:

α-hidroxi-propionsav laktid
A β-hidroxisavak azonos körülmények között könnyen veszítenek vizet, és telítetlen savakat képeznek.
HO–CH 2 –CH 2 –COOH 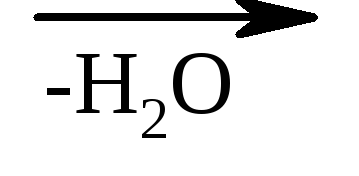 CH 2 =CH–COOH
CH 2 =CH–COOH
β-hidroxi-propion-akrilsav
A γ-hidroxisavak egy vízmolekulát is elveszíthetnek, így intramolekuláris észtereket - laktonokat - képezhetnek.

HO–CH 2 –CH 2 –CH 2 –COOH
γ-hidroxi-vajsav
γ-butirolakton
Egyes hidroxisavakat természetes termékekből nyerik. Így a tejsavat a cukros anyagok tejsavas fermentációjából nyerik. A szintetikus előállítási módszerek a következő reakciókon alapulnak:
1) Cl–CH 2 –COOH + HOH  HO–CH2–COOH;
HO–CH2–COOH;
monoklór-ecetsav-glikol
savas sav
2) CH 2 =CH–COOH + HOH  HO–CH 2 –CH 2 –COOH.
HO–CH 2 –CH 2 –COOH.
akrilsav β-hidroxi-propionsav
A hidroxisavak képviselői.
glikolos (hidroxi-ecetsav) egy kristályos anyag, amely éretlen gyümölcsökben, céklában, fehérrépában és más növényekben található. Az iparban oxálsav redukálásával nyerik. Festésre (kalikónyomtatás) használják.
Tejsav (α-hidroxi-propionos) – sűrű folyékony vagy olvadó kristályos massza. A tejsav a cukrok tejsavas fermentációja során keletkezik, tejsavbaktériumok hatására. Erjesztett tejtermékekben, savanyú káposztában, szilázsban található. Marófestésben, cserzésben és gyógyászatban használják.
A tejsav az állati izomlében és a húskivonatokban található.
Kétatomos glicerinsav részt vesz a növények és állatok életfolyamataiban.

Aszkorbinsav (C-vitamin) egy kristályos anyag, amely friss gyümölcsben, citromban, fekete ribizliben és friss zöldségekben – káposztában, babban – található. Szintetikusan a C-vitamint a többértékű alkohol szorbit oxidációjával nyerik.
 α-aszkorbinsav
α-aszkorbinsav
Az aszkorbinsavat a légköri oxigén könnyen lebontja, különösen melegítés közben
Aciklikus kettő-és hárombázisú hidroxisavak.
Alma (hidroxi-borostyánkősav) (HOOC–CHOH–CH 2 –COOH) kristályos anyag, vízben jól oldódik; gyógyászatban használják, éretlen berkenye, borbolya, rebarbara, szőlőlében, borban található.
Bor (borkő-, dihidroxi-borostyánkő)sav (HOOC–*CHOH–*CHOH–COOH) 2 aszimmetrikus szénatomot tartalmaz, ezért 4 optikai izomerje van. Savas káliumsókat képez, amelyek vízben rosszul oldódnak és kicsapódnak. A borban (tartárban) sókristályok figyelhetők meg. A vegyes kálium-nátriumsót Rochelle-sónak nevezik. A borkősav sóit tartarátoknak nevezzük.


tartárkrém, seignette só
A borkősav gyakori a növényekben (berkenye, szőlő stb.).
Citromsav
 megtalálható a citrusfélékben. Az iparban citromgyümölcsből, cukrok penészgombák általi oxidációjával, valamint fenyőtűk feldolgozásával nyerik.
megtalálható a citrusfélékben. Az iparban citromgyümölcsből, cukrok penészgombák általi oxidációjával, valamint fenyőtűk feldolgozásával nyerik.
A citromsav biológiailag fontos vegyület, amely részt vesz az anyagcserében. A gyógyászatban, élelmiszeriparban és textiliparban használják színezékek adalékaként.
A ciklikus egybázisú többértékű hidroxisavak az epesavak és más fiziológiailag fontos vegyületek részét képezik; például az auxin fokozza a növények növekedését.
Aromás hidroxisavak fenolsavakra és aromás zsírsavakra oszlanak, amelyek oldalláncában hidroxilt tartalmaznak.


o-hidroxi-benzoe mandulasav
(szalicilsav
Szalicilsav egyes növényekben szabad formában (calendula), de gyakrabban észterek formájában találhatók meg. Az iparban nátrium-fenolát szén-dioxiddal történő hevítésével nyerik. Fertőtlenítőszerként és színezékek szintézisében használják. Számos szalicilsav származékot használnak gyógyszerként (aszpirin, szalol).


aszpirin-szalol (fenil-észter
(acetilszalicilsav) szalicilsav)
Galluszsav (3,4,5-trioxi-benzoesav).

Tealevelekben, tölgy kéregben és gránátalmafában található. Iparilag tanninból nyerik híg savakkal forralva. Tinta készítésére, fotózásra, gyógyászatban fertőtlenítőként használják. A gallusavat és származékait széles körben használják számos élelmiszer (zsírok, kiváló minőségű szappanok, tejtermékek) tartósítószereként, cserző tulajdonságokkal rendelkeznek, és jelentősek a bőrgyártásban és a marófestésben.
Mandulasav aromás zsírsavakra utal (C 6 H 5 – CH (OH) – COOH), megtalálható az amygdalinban, mustárban, bodzában stb.
Tanninok gyakran többértékű fenolok származékai. A növények részei, és kéreg-, fa-, levelek, gyökerek, gyümölcsök vagy növedékek (epe) kivonataiból nyerik.
A tanninok a legfontosabb tanninok. Különböző kémiai vegyületek keveréke, amelyek fő része gallusz- és digallusavak észterei, valamint glükóz vagy többértékű alkoholok.

Dg-digallic sav

m-digallinsav
A tannin fenolok és észterek tulajdonságait mutatja. Vas-klorid oldatával fekete komplex vegyületet képez. A tanninokat széles körben használják cserző-kivonatként, pamutszövetek festésére szolgáló maróanyagként, a gyógyászatban összehúzóként (baktericid és vérzéscsillapító tulajdonságokkal rendelkeznek), tartósítószerként.
A lipidek közé tartoznak a szerves anyagok, amelyek közül sok nagy molekulatömegű zsírsavak és többértékű alkoholok észterei – zsírok, foszfatidok, viaszok, szteroidok, nagy molekulatömegű zsírsavak stb.
A lipidek elsősorban a növényi magvakban, a diómagokban és az állati szervezetekben - a zsír- és idegszövetekben, különösen az állatok és az emberek agyában találhatók.
A természetes zsírok háromértékű alkohol-glicerin és magasabb szénatomszámú karbonsavak észtereinek keverékei, pl. e savak gliceridjeinek keverékei.
KÖRÜLBELÜL 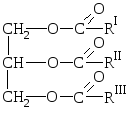 általános zsírképlet:
általános zsírképlet:
ahol R I R II R III magasabb rendű zsírsavak páros szénatomszámú szénhidrogéncsoportjai. A zsírok telített és telítetlen savak maradékait is tartalmazhatják.
Telített savak:
C 15 H 31 COOH – palmitinsav;
C 17 H 35 COOH – sztearinsav;
C 3 H 7 COOH – olaj (vajban található) stb.
Telítetlen savak:
C 17 H 33 COOH – olajsav;
C 17 H 31 COOH – linolsav;
C 17 H 29 COOH – linolén stb.
A zsírokat természetes állati és növényi eredetű forrásokból nyerik.
Fizikai tulajdonságok a zsírok savas összetételüknek köszönhetőek. A főként telített savak maradékait tartalmazó zsírok szilárd vagy pasztaszerű anyagok (bárány-, marhahús-zsír stb.) A zsírok, amelyek főként telítetlen savak maradékait tartalmazzák, szobahőmérsékleten folyékony állagúak, és olajoknak nevezzük. A zsírok nem oldódnak vízben, de jól oldódnak szerves oldószerekben: éterben, benzolban, kloroformban stb.
Kémiai tulajdonságok. Mint minden észter, a zsírok is hidrolízisen mennek keresztül. A hidrolízis savas, semleges vagy lúgos környezetben történhet.
1. Savas hidrolízis.

Kapcsolódó cikkek
-
A tömegszabályozás alapelvei és technológiái
Már a szociálpszichológia és a társadalmi tömegjelenségek szociálpszichológiai megközelítésének megalapítóinak munkáiban is megtalálhatóak az első próbálkozások a tömegek megfékezésének stratégiájának, taktikájának tudományos alátámasztására, az azt irányító technológiák fejlesztésére...
-
Mivel tálaljuk a sózott makrélát?
A makréla, vagy ahogy nyugaton szokás nevezni, makréla, egy olyan hal, amely nemcsak ízletes, hanem egészséges is. A mikro- és makroelemek, vitaminok és többszörösen telítetlen zsírsavak leggazdagabb készlete teszi ezt a halat szívesen látott vendég asztalunkon. Eszik,...
-
Hogyan készítsünk finom omlós mannát
A Mannik egyike azoknak a recepteknek, amelyekkel minden háziasszonynak rendelkeznie kell. Tejjel készült búzadarával egyszerűen és gyorsan elkészíthető. Ez a búzadara kiváló alternatívája a gyerekek örömmel fogyasztják. Mannát abszolút bárki elkészíthet...
-
Hitelügyintéző: Az önéletrajzzal kapcsolatos felelősség
Hagyományosan a pénzügyi dolgozók magas jövedelműek, így a banki és hitelezési állások napról napra egyre több jelentkezőt vonzanak. Speciális végzettség vagy...
-
Hogyan történik a részvényosztalék kifizetése és hogyan tudjuk felhasználni?
Bármely vállalkozás tevékenysége a nyereség termelésére irányul, amelyet utólag megfelelően el kell osztani. Általában ennek jelentős része a termelés továbbfejlesztésére megy, de arról beszélünk, hogy ez hogyan történik...
-
Miért álmodik kopaszságról (kopaszság) a fején?
Miért álmodik Kopaszról egy álomban az álomkönyv szerint? Miért álmodik kopaszságról az álomkönyv szerint? Ez az álom figyelmeztetés az alvó számára, hogy ne felejtse el ébernek lenni, még akkor sem, ha jó barátok társaságában van. Ismerősök között...
